применение кислорода в жизни
Кислород (O, Oxygenium)
История кислорода
Открытие кислорода произошло дважды, во второй половине XVIII столетия с разницей в несколько лет. В 1771 году кислород получил швед Карл Шееле, нагревая селитру и серную кислоту. Полученный газ был назван «огненным воздухом». В 1774 английский химик Джозеф Пристли проводил процесс разложения оксида ртути в полностью закрытом сосуде и открыл кислород, но принял его за ингредиент воздуха. Только после того, как Пристли поделился своей находкой с французом Антуаном Лавуазье, стало понятно, что открыт новый элемент (calorizator). Пальма первенства данного открытия принадлежит Пристли потому, что Шееле опубликовал свой научный труд с описанием открытия лишь в 1777 году.
Общая характеристика кислорода
Кислород является элементом XVI группы II периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 8 и атомную массу 15,9994. Принято обозначать кислород символом О (от латинского Oxygenium – порождающий кислоту). В русском языке название кислород стало производным от кислоты, термина, который был введён М.В. Ломоносовым.
Нахождение в природе
Кислород является самым распространённым элементом по нахождению в земной коре и Мировом океане. Соединения кислорода (в основном – силикаты) составляют не менее 47% массы земной коры, кислород вырабатывается в процессе фотосинтеза лесами и всеми зелёными растениями, большая часть приходится на фитопланктон морских и пресных вод. Кислород – обязательная составная часть любых живых клеток, также находится в большинстве веществ органического происхождения.
Физические и химические свойства
Кислород – лёгкий неметалл, состоит в группе халькогенов, имеет высокую химическую активность. Кислород, как простое вещество, представляет собой газ без цвета, запаха и вкуса, имеет жидкое состояние – светло-голубая прозрачная жидкость и твёрдое – светло-синие кристаллы. Состоит из двух атомов кислорода (обозначается формулой О₂).
Полезные свойства кислорода и его влияние на организм
Кислород участвует в окислительно-восстановительных реакциях. Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечнососудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном.
Биологическая роль кислорода
Кислород – основа основ жизнедеятельности всех живых организмов на Земле, является основным биогенным элементом. Находится в составе молекул всех важнейших веществ, которые отвечают за структуру и функции клеток (липиды, белки, углеводы, нуклеиновые кислоты). Каждый живой организм содержит гораздо больше кислорода, чем какого-либо элемента (до 70%). Для примера, организм взрослого среднестатического человека массой 70 кг содержит 43 кг кислорода.
Кислород поступает в живые организмы (растения, животные и человек) благодаря органам дыхания и поступлению воды. Помня о том, что в организме человека самый главный орган дыхания – это кожа, становится понятно, сколько кислорода может получать человек, особенно летом на берегу водоёма. Определить потребность человека в кислороде достаточно сложно, ведь она зависит от многих факторов – возраст, пол, масса и поверхность тела, система питания, внешняя среда и т.д.
Применение кислорода в жизни
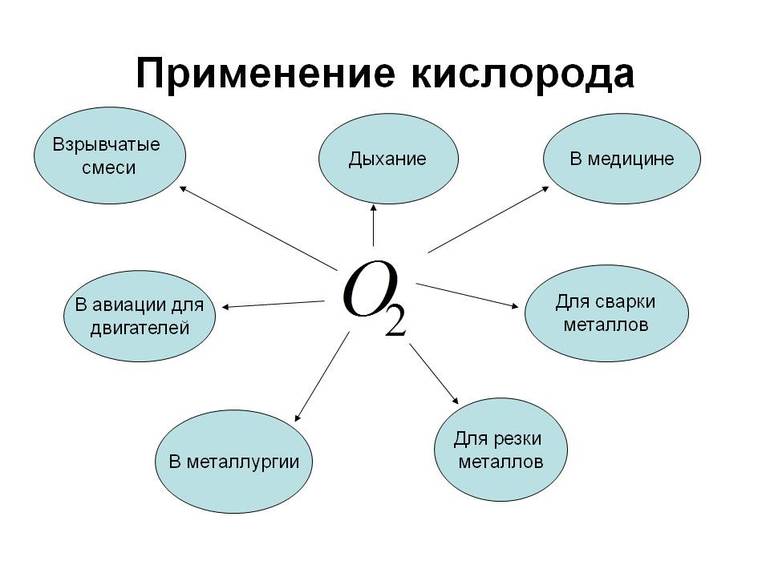
Кислород применяется практически повсеместно – от металлургии до производства ракетного топлива и взрывчатых веществ, применяемых для дорожных работах в горах; от медицины до пищевой промышленности.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E941, как пропеллент и упаковочный газ.
Применение кислорода

Всего получено оценок: 492.
Всего получено оценок: 492.
Кислород – химический элемент VI группы периодической системы Менделеева и самый распространенный элемент в земной коре (47% от ее массы). Кислород является жизненно важным элементом почти всех живых организмов. Более подробно о функциях и применении кислорода в этой статье.
Общие сведения
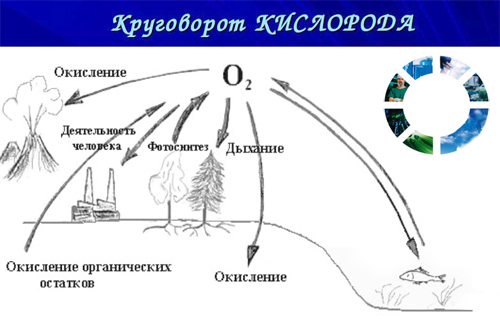
Кислород представляет собой бесцветный газ без вкуса и запаха, который плохо растворяется в воде. Он входит в состав воды, минералов, горных пород. Свободный кислород образуется благодаря процессам фотосинтеза. Кислород играет наиважнейшую роль в жизни человека. Прежде всего кислород необходим для дыхания живых организмов. Также он принимает участие в процессах разложения погибших животных и растений.
Воздух содержит около 20,95% по объему кислорода. В гидросфере содержится почти 86% по массе кислорода.
Кислород был получен одновременно двумя учеными, но сделали они это независимо друг от друга. Швед К. Шееле получил кислород при прокаливании селитры и других веществ, а англичанин Дж. Пристли – при нагревании оксида ртути.
Применение кислорода в промышленности
Области применения кислорода обширны.
В металлургии он необходим для производства стали, которую получают из металлолома и чугуна. Во многих металлургических агрегатах для лучшего сжигания топлива используют воздух, обогащенный кислородом.
В авиации кислород используется как окислитель топлива в ракетных двигателях. Также он необходим для полетов в космос и в условиях, где нет атмосферы.
В области машиностроения кислород очень важен для резки и сварки металлов. Чтобы расплавить металл нужна специальная горелка, состоящая из металлических труб. Эти две трубы вставляются друг в друга. Свободное пространство между ними заполняют ацетиленом и зажигают. Кислород же в это время пускают по внутренней трубке. И кислород и ацетилен подаются из баллона под давлением. Образуется пламя, температура в котором достигает 2000 градусов. При такой температуре плавится практически любой металл.
Применение кислорода в целлюлозно-бумажной промышленности очень важно. Он используется для отбеливания бумаги, при спиртовании, при вымывании лишних компонентов из целлюлозы (делигнификация).
В химической промышленности кислород используется в качестве реагента.
Для создания взрывчатых веществ необходим жидкий кислород. Жидкий кислород производится путем сжижения воздуха и последующего отделения кислорода от азота.
Применение кислорода в природе и жизни человека
Кислород играет наиважнейшую роль в жизни человека и животных. Свободный кислород существует на нашей планете благодаря фотосинтезу. Фотосинтез – это процесс образования органического вещества на свету с помощью углекислого газа и воды. В результате этого процесса образуется кислород, который необходим для жизнедеятельности животных и человека. Животные и человек потребляют кислород постоянно, растения же расходуют кислород только ночью, а днем производят его.
Применение кислорода в медицине
Кислород находит применение и в медицине. Особенно актуально его использование при затрудненном дыхании во время некоторых заболеваний. Он применяется для обогащения дыхательных путей при туберкулезе легких, а также используется в наркозной аппаратуре. Кислород в медицине используется для лечения бронхиальной астмы, болезней желудочно-кишечного тракта. Для этих целей используют кислородные коктейли.
Также большое значение имеют кислородные подушки – прорезиненная емкость, заполненная кислородом. Она служит для индивидуального применения медицинского кислорода.
Что мы узнали?
В данном сообщении, которое охватывает тему «Кислород» по химии 9 класса кратко даны общие сведения о свойствах и применении этого газа. Кислород крайне важен для машиностроения, медицины, металлургической области и т.д.
Распространённость и свойства
Прежде всего, элемент необходим для дыхания активных организмов. Он также принимает участие в разложении мёртвых животных и растений. Содержание кислорода в земной коре составляет почти 50%, содержится в различных минералах в виде оксидов и солей. В связанном виде кислород входит в химический состав воды — его процентное соотношение составляет около 89%, а также в клетки всех живых существ — растений и животных.
Компонент характеризуется высочайшей химической насыщенностью и образует гибридные субстанции, состоящие из связанных атомов двух и более компонентов вместе с почти всей периодической таблицей, за исключением только лишь инертных газов (криптон, аргон, неон, гелий и ксенон). В период изменения акцентируется огромное количество тепла, такая реакция является экзотермичной. Он весьма тяжело приготовить в воде.
С повышением температуры водорастворимость убавляется. При снижении температуры вплоть до — 218*с он становится твёрдым.
При соприкосновении сжатого кислородного газа с распылёнными жирными веществами, полученными из веществ растительного, животного или минерального происхождения, происходит их самовозгорание. Это частый источник пожаров. Во избежание несчастных случаев кислородное оборудование должно быть тщательно обезжирено.
Бесцветное вещество обладает способностью образовывать взрывоопасные смеси и легковоспламеняющиеся газы, где поблизости находится источник открытого огня.
Извлечение вещества
Элемент из атмосферы можно приобрести с помощью специализированных установок. В них воздушное пространство фильтруется, избавляется от водорода и азота, малейших сухих элементов, углекислого газа, а также высушивается от влаги. Рециркулированный воздух сокращается компрессионной машиной, а газ перед нажимом переходит в конденсатор для сжижения. Для перевоплощения жидкого воздуха в газ применяются криоцилиндры либо приспособления для откачки с теплообменником. Этот химический компонент можно приобрести как в лаборатории, так и на промышленном предприятии.
Существует несколько способов получения кислорода в лабораторных условиях:
Производство кислорода в промышленности осуществляется различными способами. Современное оборудование обеспечивает приготовление вещества любой степени чистоты.
Применение элемента
Химический элемент используется для жизнеобеспечения людей, страдающих затруднённым дыханием, а также для лечения некоторых недугов. Примечательно, что при нормальном давлении чистый кислород долго не, может быть, вдыхаем. Это небезопасно для здоровья в любой области. Бывает использование компонента в авиации.
Этот химический элемент используется в стекловаренных печах в качестве компонента, улучшающего горение в них. Кроме того, благодаря веществу промышленность сокращает выбросы оксидов азота до уровня, безопасного для жизни. Теплоэлектростанции, работающие на нефти, природном газе или угле, используют кислород для сжигания топлива. Без него все промышленные предприятия просто не работали бы.
Этот химический элемент используется в спиртовании, делигнификации и других процессах, таких как:
В природе существует круговорот кислорода: в процессе фотосинтеза растения на свету превращают углекислый газ и воду в органические соединения. Этот процесс можно назвать выделением. Подобно людям и животным, растения ночью потребляют кислород из атмосферы, а потом растения вырабатывают его днём и расходуют ночью. Применение кислорода по химии 9 класса кратко рассматривают, пишут реферат с рисунками и схемами по теме.
Кислород применение
КИСЛОРОД ПРИМЕНЕНИЕ И ЗНАЧЕНИЕ

Кислород применяется в лечебной практике не только при легочных и сердечных заболеваниях, когда затруднено дыхание. Подкожное введение кислорода оказалось эффективным средством лечения таких тяжелых заболеваний, как, например, гангрена, слоновость, трофические язвы.
Не менее важен элемент № 8 и для промышленности. Обогащение воздуха кислородом делает эффективнее, быстрее, экономичнее многие технологические процессы, в основе которых — окисление. А таких процессов — много. На них пока держится почти вся тепловая энергетика. Превращение чугуна в сталь тоже невозможно без кислорода. Именно кислород «изымает» из чугуна избыток углерода.
Применение в металлургии
Замена воздушного дутья «кислородным» (в мартеновскую печь или конвертор обычно подается не чистый кислород, а воздух, обогащенный кислородом) намного увеличивает производительность сталеплавильных агрегатов. Одновременно улучшается и качество стали.
При замене обычного воздуха смесью 35% кислорода и 65% азота расход кокса в процессе выплавки ферросплавов (ферромарганца, ферросилиция, феррофосфора) снижается почти в два раза, а производительность печи возрастает более чем вдвое.
Сейчас в нашей стране черная металлургия поглощает более 60% получаемого кислорода. Нужен кислород и в цветной металлургии. Так, при выплавке свинца на Усть-Каменогорском свинцово-цинковом комбинате дутье, обогащенное кислородом до 30—31%, в свое время помогло снизить расход топлива более чем на треть, а флюсов — вдвое, что дало многомиллионную экономию.
При сжигании водорода в токе кислорода образуется весьма обыкновенное вещество — Н2О. Конечно, ради получения этого вещества не следовало бы заниматься сжиганием водорода (который, кстати, часто именно из воды получают). Цель этого процесса иная, она будет ясна, если ту же реакцию записать полностью, учитывая не только химические продукты, но и энергию, выделяющуюся в ходе реакции:
Почти семьдесят больших калорий на грамм-молекулу! Так можно получить не только «море воды», но и «море энергии». Для этого и получают воду в реактивных двигателях, работающих на водороде и кислороде.
Получение ацетилена кислородом
Та же реакция используется для сварки и резки металлов. Правда, в этой области водород можно заменить ацетиленом. Кстати, ацетилен все в больших масштабах получат именно с помощью кислорода, в процессах термоокислительного крекинга:
Это только один пример использования кислорода в химической промышленности. Элемент № 8 нужен для производства многих веществ (достаточно вспомнить об азотной кислоте), для газификации углей и мазута… На нужды этой отрасли расходуется немало кислорода.
Любое пористое горючее вещество, например опилки, будучи пропитанными голубоватой холодной жидкостью — жидким кислородом, становится взрывчатым веществом. Такие вещества называются оксиликвитами и в случае необходимости могут заменить динамит при разработке рудных месторождений.
Методы получения кислорода
Ежегодное мировое производство (и потребление) кислорода измеряется миллионами тонн. Не считая кислорода, которым мы дышим. Попытки создать более или менее мощную кислородную промышленность предпринимались еще в прошлом веке во многих странах. Но от идеи до технического воплощения часто лежит «дистанция огромного размера»…
Особенно быстрое развитие кислородной промышленности началось в годы Великой Отечественной войны, после изобретения академиком П. Л. Капицей турбодетандера и создания мощных воздухра-зделительных установок.
Еще Карл Шееле получал кислород по меньшей мере пятью способами: из окиси ртути, сурика, селитры, азотной кислоты и пиролюзита. На подводных лодках и сейчас получают кислород, разлагая богатые этим элементом хлораты и перхлораты. В любой школьной лаборатории демонстрируют опыт — разложение воды на кислород и водород электролизом. Но ни один из этих способов не может удовлетворить потребности промышленности в кислороде.
Энергетически проще всего получить элемент № 8 из воздуху поскольку воздух — не соединение, и разделить воздух не так уж трудно. Температуры кипения азота и кислорода отличаются (при атмосферном давлении) на 12,8° С. Следовательно, жидкий воздух можно разделить на компоненты в ректификационных колоннах так же, как делят, например, нефть.
Но чтобы превратить воздух в жидкость, его нужно охладить до минус 196° С. Можно сказать, что проблема получения кислорода — это проблема получения холода.
Чтобы получать холод с помощью обыкновенного воздуха, последний нужно сжать, а затем дать ему расшириться при этом заставить его производить механическую работу. Тогда в соответствии с законами физики воздух обязан охлаждаться. Машины, в которых это происходит, называют детандерами.
До 1938 г. для получения жидкого воздуха пользовались только поршневыми детандерами. По существу, такой детандер — это аналог паровой машины, только работает в нем не пар, а сжатый воздух.
Чтобы получить жидкий воздух с помощью таких детандеров, нужны были давления порядка 200 атм, причем по неизбежным техническим причинам на разных стадиях процесса давление было не одинаковым: от 45 до 200 атм. К.п.д. установки был немногим выше,чему паровой машины. Установка получилась сложной, громоздкой, дорогой.
Получение кислорода из воздуха
В конце 30-х годов советский физик академик П. Л. Капица предложил использовать в качестве детандера турбину. Идея — не новая, ее еще в конце прошлого века высказывал Дж. Рэлей, но к.п.д. «докапицынских» турбин для ожижения воздуха был невысок. Поэтому небольшие турбодетандеры лишь выполняли кое-какую подсобную работу при поршневых детандерах.
Капица создал новую конструкцию, которая, по словам изобретателя, была «как бы компромиссом между водяной и паровой турбиной». Главная особенность турбодетандера Капицы в том, что воздух в ней расширяется не только в сопловом аппарате, но и на лопатках рабочего колеса. При этом газ движется от периферии колеса к центру, работая против центробежных сил.
Такая конструкция турбины позволила поднять к.п.д. установки с 0,5 до 0,8. И, кроме того, турбодетандер «делает» холод с помощью воздуха, сжатого всего лишь до нескольких атмосфер. Очевидно, что 6 атм получить намного проще и дешевле, чем 200. Немаловажно для экономики и то, что энергия, которую отдает расширяющийся воздух, не пропадает напрасно, она используется для вращения ротора генератора электрического тока.
Современные установки для разделения воздуха, в которых холод получают с помощью турбодетандеров, дают промышленности, прежде всего металлургии и химии, сотни тысяч кубометров газообразного кислорода. Они работают не только у вас, но и во всем мире.
Первый опытный образец турбодетандера был невелик. Его ротор восьми сантиметров в диаметре весил всего 250 г. Но, как писал П. Л. Капица в 1939 г., «экспериментальная эксплуатация этого турбодетандера показала, что он является надежный и очень простым механизмом. Технический к.п.д. получается 0,79—0,83», И этот турбодетандер стал «сердцем» первой установки для получения кислорода новым методом.
В 1942 г. построили подобную, но уже намного более мощную установку, которая производила до 200 кг жидкого кислорода в час. В конце 1944 г. вводится в строй самая мощная в мире турбокислородная установка, производящая в 6—7 раз больше жидкого кислорода, чем установка старого типа, и при этом занимающая в 3—4 раза меньшую площадь.
В наши дни быстро растет потребность в кислороде многих отраслей промышленности, в первую очередь металлургии. Соответственно растут мощности воздухоразделительных установок. А источник кислорода один — атмосфера.
Статья на тему Кислород применение
Похожие страницы:
Понравилась статья поделись ей
Применение кислорода в жизни
§6.5 Применение кислорода.
Кислород необходим практически всем живым существам. Дыхание – это окислительно-восстановительный процесс, где кислород является окислителем. С помощью дыхания живые существа вырабатывают энергию, необходимую для поддержания жизни. К счастью, атмосфера Земли пока не испытывает заметного недостатка кислорода, но такая опасность может возникнуть в будущем.
Вне земной атмосферы человек вынужден брать с собой запас кислорода. Мы уже говорили о его применении на подводных лодках. Точно так же полученный искусственно кислород используют для дыхания в любой чуждой среде, где приходится работать людям: в авиации при полетах на больших высотах, в пилотируемых космических аппаратах, при восхождении на высокие горные вершины, в экипировке пожарных, которым часто приходится действовать в задымленной и ядовитой атмосфере и т.д.
Во всех этих устройствах есть источники кислорода для автономного дыхания.
| Рис. 6-3. Работа в открытом космосе (фото с Международной космической станции) |
| Рис. 6-4. Снаряжение водолаза (фото с сайта www.tetis.ru) |
| Рис. 6-5. Пожарный с автономным дыхательным аппаратом (фото с сайта www.aha.ru) |
В медицине кислород используют для поддержания жизни больных с затрудненным дыханием и для лечения некоторых заболеваний. Однако чистым кислородом при нормальном давлении долго дышать нельзя – это опасно для здоровья.
| Рис. 6-6. Больной находится в специальном аппарате в кислородной атмосфере при пониженном давлении. Врач беседует с больным по телефону (фото автора) |
Но главными потребителями кислорода, конечно, являются энергетика, металлургия и химическая промышленность.
Электрические и тепловые станции, работающие на угле, нефти или природном газе используют атмосферный кислород для сжигания топлива. Если даже небольшой автомобиль является настоящим «пожирателем» кислорода (как мы выяснили в предыдущей главе), то гигантские тепловые и электрические станции расходуют кислорода неизмеримо больше. До сих пор они вырабатывают около 80 % всего электричества в нашей стране и только остальные 20 % электроэнергии дают гидростанции и атомные станции, не расходующие атмосферного кислорода.
Для металлургической и химической промышленности нужен уже не атмосферный, а чистый кислород. Ежегодно во всем мире получают свыше 80 млн. тонн кислорода. Для его производства требуется огромное количество электроэнергии, получение которой, как мы уже знаем, тоже связано с расходованием кислорода.
Чистый кислород расходуется главным образом на получение стали из чугуна и металлолома. С этим важным процессом вы познакомитесь в следующем классе.
В машиностроении, в строительстве кислород используют для сварки и резки металлов. Горючий газ ацетилен, сгорая в токе кислорода, позволяет получить температуру выше 3000 ° С! Это приблизительно вдвое больше температуры плавления железа.
Ацетиленовая горелка состоит из двух трубок, вставленных одна в другую. В одну трубку подается кислород, в другую – ацетилен, после чего смесь газов поджигается. Таким пламенем можно расплавить металлические детали в месте их соединения, то есть сварить их между собой.