pantoea calida что это
Postsurgical Pantoea calida meningitis: a case report
Abstract
Introduction
Pantoea calida, a recently described environmental Enterobacteriaceae organism, has not yet been associated with human infection.
Case presentation
We report a case of postoperative meningitis caused by P. calida. After pituitary adenoma resection, a 52-year-old Caucasian woman developed febrile meningitis confirmed by cerebrospinal fluid analysis. P. calida was grown in pure culture from this fluid and was firmly identified with partial rpoB gene sequencing. She was cured by a 14-day course of meropenem.
Conclusions
P. calida must be added to the list of opportunistic Enterobacteriaceae pathogens responsible for postsurgical meningitis. It is easily identified by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry.
Introduction
Pantoea calida has been recently described as a species of Enterobacteriaceae after its seminal isolation and culture from powdered infant formula [1]. It has not yet been associated with any infections and no clinical isolate has been reported. Here, we isolated one strain of P. calida from a cerebrospinal fluid (CSF) specimen and identified it as the cause of postsurgical meningitis.
Case presentation
A 52-year-old Caucasian woman had a medical history of hypertension, smoking and alcoholism. She presented with binocular diplopia. A computed tomography scan showed an intrasellar lesion with invasion of her right cavernous sinus that was further confirmed by brain magnetic resonance imaging. An endoscopic endonasal biopsy was performed and histopathology showed a nonspecific inflammation and subacute hemorrhagic alteration of her nasal mucosa. An antibiotic prophylaxis with cefazolin 2gr was given. A transnasal surgical excision was performed, and no leak of CSF was observed after the surgery. Histopathology confirmed a single prolactin pituitary adenoma. Five days after the surgery, she presented a fever (38.6°C) and a meningeal syndrome with consciousness disorder, neck stiffness and a Glasgow Coma Scale evaluated at 13 (E4V4M5) but without focal neurological deficits. The CSF collected by lumbar puncture showed hypoglycorrhachia (1.33mmol/L; CSF/serum glucose ratio=0.20), an elevated protein level (5.88g/L) and 4500 leukocytes/mL including 98% polymorphonuclear leukocytes. There was no detectable organism on direct microscopic examination after Gram staining. Treatment combining intravenous vancomycin 1gr twice a day and intravenous meropenem 2gr three times a day was started for presumptive postsurgical meningitis. Her clinical condition rapidly improved, with apyrexia and a net regression of the meningeal syndrome within 2 days. Five days after the onset of symptoms, vancomycin was stopped and meropenem 6gr per day was continued for a total of 14 days. At 90-day follow-up she was afebrile, healthy and without any sign of meningitis.
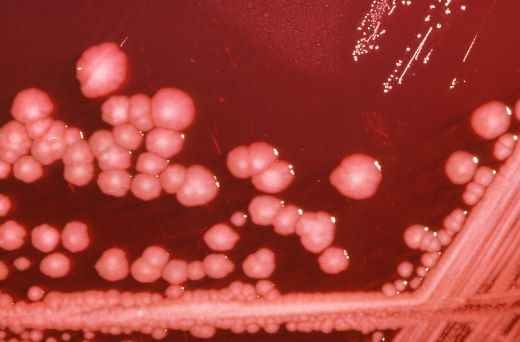
The CSF was inoculated on Polyvitex (bioMérieux, La Balme-les-Grottes, France) and Columbia agar with 5% sheep blood and incubated at 37°C under a 5% carbon dioxide atmosphere. After 48-hour incubation, small whitish round shiny domed colonies were observed on both culture media. Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS) performed as previously described [2, 3] yielded P. calida with identification score of 2.26, 2.17 and 2.17 for the three spots deposited on the MALDI-TOF-MS plate. Furthermore partial rpoB gene sequencing performed as previously reported [4] confirmed the identification of P. calida with 99.88% sequence similarity with the reference sequence (GenBank GQ892191). Antimicrobial susceptibility was performed by diffusion method in agar and incubated aerobically for 24 hours at 37°C. The isolate was resistant to ampicillin (minimal inhibitory concentration (MIC) >8mg/L), amoxicillin-clavulanate (MIC, 1mg/L), and cephalothin (MIC, 1mg/L). It was susceptible to ceftriaxone (MIC, 0.5mg/L), imipenem (MIC, 0.5mg/L), ciprofloxacin (MIC, 0.25mg/L), gentamicin (MIC
Discussion
Here, P. calida was isolated from the CSF of a patient with postoperative meningitis [5]. The isolate was firmly identified by using two different complementary approaches: MALDI-TOF-MS which is an advanced proteomics method [2, 3] relying on the analysis of unique peptidic signatures; and partial rpoB gene sequencing which relies on the analysis of unique nucleotidic signatures [6]. These two technical approaches yielded unambiguous, concordant identification. In particular, MALDI-TOF-MS proved to be efficient to identify this species, despite the fact that no clinical isolate was previously included in the database.
The absence of any bacteria other than P. calida on the culture of CSF, as well as the fact that it was the first identification of this microorganism in our laboratory, secure the conclusion that P. calida was responsible for this postoperative meningitis. Accordingly, the patient was rapidly cured after an effective antibiotic treatment was administrated. In this case, the source of infection remained unknown. Indeed, P. calida has been documented only in powdered infant formula [1] and our patient had no contact with such formula. Of interest, the Cronobacter species (formerly Enterobacter sakazakii) causing health-care-associated meningitis in neonates [7] is also contaminating powdered infant formula [8, 9].
Indeed, P. calida is closely related to members of the Enterobacteriaceae genus Erwinia, Tatumella, Kluyvera, Citrobacter and Cronobacter, which also comprise opportunistic pathogens causing meningitis, mainly in newborns [1]. Whereas Erwinia and Tatumella organisms have not been associated with central nervous system infection, Kluyvera meningitis has been reported in a newborn [10]. Also Citrobacter bacteria are opportunistic pathogens seldom reported as causing meningitis in neonates [11], children [12] and adults with cancer [13]. Recently, one case of Citrobacter koseri meningitis has been reported after free-diving [14]. Lastly, Cronobacter species along with Enterobacter species have been reported as causes of health-care-associated meningitis [15].
Conclusions
P. calida should be added to the list of Enterobacteriaceae pathogens responsible for infectious postoperative meningitis. Sources different from powdered infant formula should be investigated. P. calida meningitis can be cured by appropriate antibiotic treatment. This new pathogen can easily be identified by using MALDI-TOF-MS [2, 3].
Consent
Written informed consent was obtained from the patient for publication of this case report and accompanying images. A copy of the written consent is available for review by the Editor-in-Chief of this journal.
Abbreviations
Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry
Minimal inhibitory concentration.
References
Popp A, Cleenwerck I, Iversen C, De Vos P, Stephan R: Pantoea gaviniae sp. nov. and Pantoea calida sp. nov., isolated from infant formula and an infant formula production environment. Int J Syst Evol Microbiol. 2010, 60: 2786-2792. 10.1099/ijs.0.019430-0.
Seng P, Drancourt M, Gouriet F, La Scola B, Fournier PE, Rolain JM, Raoult D: Ongoing revolution in bacteriology: routine identification of bacteria by matrix-assisted laser desorption ionization time-of-flight mass spectrometry. Clin Infect Dis. 2009, 49: 543-551. 10.1086/600885.
Seng P, Abat C, Rolain JM, Colson P, Lagier JC, Gouriet F, Fournier PE, Drancourt M, La Scola B, Raoult D: Identification of rare pathogenic bacteria in a clinical microbiology laboratory: impact of matrix-assisted laser desorption ionization-time of flight mass spectrometry. J Clin Microbiol. 2013, 51: 2182-2194. 10.1128/JCM.00492-13.
Mollet C, Drancourt M, Raoult D: rpoB sequence analysis as a novel basis for bacterial identification. Mol Microbiol. 1997, 26: 1005-1011. 10.1046/j.1365-2958.1997.6382009.x.
Tavares WM, Machado AG, Matushita H, Plese JP: CSF markers for diagnosis of bacterial meningitis in postoperative neurosurgical patients. Arq Neuropsiquiatr. 2006, 64: 592-595. 10.1590/S0004-282X2006000400012.
Adékambi T, Drancourt M, Raoult D: The rpoB gene as a tool for clinical microbiologists. Trends Microbiol. 2009, 17: 37-45. 10.1016/j.tim.2008.09.008.
Hunter CJ, Bean JF: Cronobacter: an emerging opportunistic pathogen associated with neonatal meningitis, sepsis and necrotizing enterocolitis. J Perinatol. 2013, 33: 581-585. 10.1038/jp.2013.26.
Cai XQ, Yu HQ, Ruan ZX, Yang LL, Bai JS, Qiu DY, Jian ZH, Xiao YQ, Yang JY, Le TH, Zhu XQ: Rapid detection and simultaneous genotyping of Cronobacter spp. (formerly Enterobacter sakazakii) in powdered infant formula using real-time PCR and high resolution melting (HRM) analysis. PLoS One. 2013, 8 (6): e67082-10.1371/journal.pone.0067082.
Yan QQ, Condell O, Power K, Butler F, Tall BD, Fanning S: Cronobacter species (formerly known as Enterobacter sakazakii) in powdered infant formula: a review of our current understanding of the biology of this bacterium. J Appl Microbiol. 2012, 113: 1-15. 10.1111/j.1365-2672.2012.05281.x.
Rosso M, Rojas P, Garcia E, Marquez J, Losada A, Munoz M: Kluyvera meningitis in a newborn. Pediatr Infect Dis J. 2007, 26: 1070-1071. 10.1097/INF.0b013e31812e4b96.
Cuadros EN, Castilla CY, Algarra CM, Pérez DM, Lopez BR, Martin FJ, Cardona AU: Medical and neurosurgical management of Citrobacter koseri, a rare cause of neonatal meningitis. J Med Microbiol. 2014, 63: 144-147. 10.1099/jmm.0.063586-0.
Prais D, Nussinovitch M, Harel L, Amir J: Citrobacter koseri (diversus) meningitis in an otherwise healthy adolescent. Scand J Infect Dis. 2003, 35: 202-204. 10.1080/0036554021000027020.
Tan CK, Lai CC, Lin SH, Liao CH, Huang YT, Hsueh PR: Fatal Citrobacter farmeri meningitis in a patient with nasopharyngeal cancer. J Clin Microbiol. 2010, 48: 1499-1500. 10.1128/JCM.00282-10.
Россельхознадзор / Нормативные документы
федеральная служба по ветеринарному и фитосанитарному надзору
В данном разделе размещаются актуальные версии нормативно-правовых актов (законы, приказы, указы, решения Верховного суда РФ и др.), представляющие интерес для специалистов в области ветеринарии и фитосанитарии.
Дополнительную информацию Вы можете получить, задав вопрос в разделе «Электронная приемная».
Приказ от 26 декабря 2007 г. N 673
«Об утверждении перечня карантинных объектов»
(Зарегистрировано в Минюсте РФ 17 января 2008 г. N 10903)
Содержание
Приказ
Об утверждении перечня карантинных объектов
В соответствии со статьей 5 Федерального закона от 15 июля 2000 г. N 99-ФЗ «О карантине растений» (Собрание законодательства Российской Федерации, 2000, N 29, ст. 3008; 2002, N 30, ст. 3033; 2004, N 35, ст. 3607; 2005, N 19, ст. 1752; Российская газета, 2006, 31 декабря), пунктом 5.2.22 Положения о Министерстве сельского хозяйства Российской Федерации, утвержденного Постановлением Правительства Российской Федерации от 24 марта 2006 г. N 164 (Собрание законодательства Российской Федерации, 2006, N 14, ст. 1543; 2007, N 14, ст. 1702; N 46, ст. 5576), приказываю:
1. Утвердить Перечень карантинных объектов (вредителей растений, возбудителей болезней растений и растений (сорняков)) согласно приложению.
2. Контроль за выполнением Приказа возложить на заместителя Министра А.П. Козлова.
Приложение
к Приказу Минсельхоза России
от 26 декабря 2007 г. N 673
Перечень карантинных объектов (вредителей растений, возбудителей болезней растений и растений (сорняков))
Часть I
Карантинные объекты, отсутствующие на территории Российской Федерации
Вредители растений
Азиатский усач (Anoplophora glabripennis (Motschulsky))
Азиатская хлопковая совка (Spodoptera litura Fabr.)
Американский клеверный минер (Liriomyza trifolii Burg.)
Андийские картофельные долгоносики (Premnotrypes spp.)
Египетская хлопковая совка (Spodoptera littoralis Boisd.)
Зерновка рода калособрухус (Callosobruchus spp.)
Капровый жук (Trogoderma granarium Ev.)
Картофельный жук-блошка (Epitrix cucumeris (Harris))
Картофельный жук-блошка клубневая (Epitrix tuberis Gentner)
Кукурузный жук диабротика (Diabrotica virgifera Le Conte)
Пальмовый трипс (Thrips palmi Karny)
Плодовый долгоносик (Conotrachelus nenuphar Hb.)
Средиземноморская плодовая муха (Ceratitis capitata (Wied.))
Томатный листовой минер (Liriomyza sativae Blanch)
Тутовая щитовка (Pseudaulacaspis pentagona (Targ.-Toz.))
Южноамериканский листовой минер (Liriomyza huidobrensis Blanch.)
Яблонная муха (Rhagoletis pomonella Walsh.)
Японский жук (Popillia japonica Newm.)
Возбудители болезней растений грибные
Аскохитоз хризантем (Didymella ligulicola (K.F. Baker, Dimock & Davis) von Arx)
Белая ржавчина хризантем (Puccinia horiana Henn.)
Головня картофеля (клубней) (Thecaphora solani Thirum et O’Brien. (=Angiosorus solani Thirum et O’Brien.))
Диплодиоз кукурузы (Stenocarpella macrospore (Earle) Sutton (=Diplodia macrospora Earle))
Диплодиоз кукурузы (Stenocarpella maydis (Berkeley) Sutton (=D. maydis (Berkeley) Saccardo))
Индийская головня пшеницы (Neovossia indica (Mitra) Mundkur (=Tilletia indica Mitra))
Коричневый пятнистый ожог хвои сосны (Mycosphaerella dearnessii M.E. Bar.)
Рак стволов и ветвей сосны (Atropellis pinicola Zeller & Gooding)
Рак стволов и ветвей сосны (Atropellis piniphilla (Weir.) Lohman & Cash)
Техасская корневая гниль (Phymatotrichopsis omnivore (Duggar.) Henne-bert (Phymatotrichum omnivorum (Duggar))
Усыхание дуба (сосудистый микоз) (Ceratocystis fagacearum (Bretz.) Hunt.)
Возбудители болезней растений бактериальные
Бактериальный ожог риса (Xanthomonas oryzae pv. oryzae (Ishiyama) Swings et al.)
Бактериальная полосатость риса (Xanthomonas oryzae pv. oryzicola (Fang. et al.) Swings et al.)
Бактериальное увядание винограда (Xylophilus ampelinus (Panagopoulus) Willems et al. (=Xanthomonas ampelina Panagopoulos))
Бактериальное увядание (вилт) кукурузы (Pantoea stewartii subsp. stewartii (Smith) Mergaert et al. (=Erwinia stewartii (Smith) Dye)
Золотистое пожелтение винограда (Grapevine flavescence doree phytoplasma)
Ожог плодовых деревьев (Erwinia amylovora (Burill.) Winslow et al.)
Возбудители болезней растений вирусные
Андийский латентный тимовирус картофеля (Potato Andean latent tymovirus)
Андийская крапчатость картофеля (Potato Andean mottle comovirus)
Вирус T картофеля (Potato T trichovirus)
Латентная мозаика персика (американская) (Peach latent mosaic viroid)
Пожелтение картофеля (Potato yellowing alfamovirus)
Рашпилевидность листьев черешни (Cherry rasp leaf nepovirus)
Розеточная мозаика персика (Peach rosette mosaic nepovirus)
Возбудители болезней растений нематодные
Бледная картофельная нематода (Globodera pallida (Stone) Behrens)
Колумбийская галловая корневая нематода (Meloidogyne chitwoodi Golden et al.)
Сосновая стволовая нематода (Bursaphelenchus xylophilus (Steiner et Buhrer) Nickle)
Растения (сорняки)
Бузинник пазушный (ива многолетняя) (Iva axillaris Pursh.)
Ипомея плющевидная (Ipomoea hederacea L.)
Ипомея ямчатая (Ipomoea lacunosa L.)
Паслен каролинский (Solanum carolinense L.)
Паслен линейнолистный (Solanum elaeagnifolium Cav.)
Подсолнечник реснитчатый (Helianthus ciliaris DC.)
Стриги (все виды) (Striga spp.)
Ценхрус малоцветковый (Cenchrus pauciflorus Benth.)
Череда волосистая (Bidens pilosa L.)
Часть II
Карантинные объекты, ограниченно распространенные на территории Российской Федерации
Вредители растений
Американская белая бабочка (Hyphantria cunea Drury)
Большой еловый лубоед (Dendctonus micans Kug.)
Большой черный еловый усач (Monochamus urussovi Fisch.)
Восточная плодожорка (Grapholitha molesta Busck.)
Восточносибирский хвойный усач (Monochamus impulviatus Mot.)
Дальневосточный черный усач (Monochamus nitens Bates)
Западный (калифорнийский) цветочный трипс (Frankliniella occidentalis Perg.)
Картофельная моль (Phthorimaea operculella Zell.)
Калифорнийская щитовка (Quadraspidiotus perniciosus Comst.)
Малый черный еловый усач (Monochamus sutor L.)
Непарный шелкопряд (азиатская раса) (Lymantria dispar L. (asian race))
Персиковая плодожорка (Carposina niponensis Wlsgh.)
Сибирский шелкопряд (Dendrolimus sibiricus Tschetw.)
Табачная белокрылка (Bemisia tabaci Gen.)
Черный сосновый усач (Monochamus galloprovincialis Oliv.)
Черный хвойный усач (Monochamus saltuarius Gebl.)
Филлоксера (Viteus vitifoliae (Fitch.))
Возбудители болезней растений грибные
Рак картофеля (Synchytrium endobioticum (Schilb.) Percival)
Фитофтороз корней малины и земляники (Phytophthora Fragariae Hickman)
Фомопсис подсолнечника (серая пятнистость стебля) (Diaporthe helianthi Munt. Cvet. et al.(=Phomopsis helianthi Munt. Cvet. et al.))
Южный гельминтоспориоз кукурузы раса T (Cochliobolus heterostrophus Drechsler (=Bipolaris maydis (Nisikado) Shoem) (race T))
Возбудители болезней растений бактериальные
Бурая гниль картофеля (Ralstonia solanacearum (Smith) Yabuuchi et al. (=Pseudomonas solanacearum (Smith) Smith)
Возбудители болезней растений вирусные
Шарка (оспа) сливы (Plum pox potyvirus)
Возбудители болезней растений нематодные
Золотистая картофельная нематода (Globodera rostochiensis (Woll.) Behrens.)
Растения (сорняки)
Амброзия многолетняя (Ambrosia psilostachya DC.)
Амброзия полыннолистная (Ambrosia artemisiifolia L.)
Амброзия трехраздельная (Ambrosia trifida L.)
Горчак ползучий (Acroptilon repens DC.)
Паслен колючий (Solanum rostratum Dun.)
Паслен трехцветковый (Solanum triflorum Nutt.)
Семейство Enterobacteriaceae. Часть 1
Автор: врач – клинический фармаколог Трубачева Е.С.
.jpg)
Автор: врач – клинический фармаколог Трубачева Е.С.
Morganella spp. и Proteus spp.
Особо выдающихся представителей семейства Enterobacteriaceae мы уже разбирали в отдельных статьях, а именно представительницу рода Esherichia — кишечную палочку E.coli, а также одну из представительниц клебсиелл — Klebsiella pneumonia. В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых — как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Микробиологические аспекты
Основными клинически значимыми представителями родов семейства Enterobacteriaceae, вызывающими заболевания у человека, являются:
Естественно совсем уж экзотику мы рассматривать не станем, но по наиболее часто встречающимся представителям обязательно пробежимся.
Клинические аспекты
Почему данное семейство так актуально? Наверное, потому, что почти ни одна нозология не обходится без его представителей. В самом широком смысле семейство Enterobacteriaceae является причиной следующих заболеваний:
Как мы видим, наши знакомые отметились практически везде. Но надо обязательно помнить, что выявление вышеуказанных представителей у здоровых людей из респираторного тракта, урогенитального и уж тем более желудочно-кишечного ни в коем случае не говорит о том, что человек чем-то болен, так как в большинстве своем эти микробы являются представителями нормальной микрофлоры, а не все люди умеют мыть руки, особенно летом.
Когда можно думать о наличии бактериальной патологии? Во-первых, когда имеется четкая клиника, во-вторых, когда микробы выделены из стерильных в норме сред, таких как кровь и ликвор, брюшная или плевральная полость, точнее, экссудат оттуда и, в-третьих, когда микроорганизмы выделены в клинически значимых концентрациях (тут в помощь будет ваша бак. лаборатория).
Стоит отметить еще один немаловажный момент — не все представители семейства Enterobacteriaceae умеют жить вне организма человека, и поэтому не размножаются во внешней среде, а потому обнаружение оных на пищевых продуктах и всевозможных поверхностях в лечебных учреждениях говорит о фекальном загрязнении, проще говоря, о неумении обрабатывать руки после посещения туалетной комнаты. Одним из таких микробов-детекторов является кишечная палочка, и стоит ее поймать даже не на руках персонала, а, например, на компьютерной мышке, как дальше можно уже ничего не искать, а начинать очередной этап избиения младенцев, пардон, обучения правилам асептики и антисептики, в частности, обработки рук.
Но давайте перейдем к частностям — и первым микроорганизмом, который будем сегодня рассматривать, станет:
Morganella spp.
Зверюшка названа так в честь своего первооткрывателя Гарри Р. Моргана.
Начнем традиционно с микробиологических аспектов
Семейство морганелл включает единственный вид M. morganii, включающий два подвида M. morganii и M. sibonii, которые различаются только ферментацией трегалозы.
Морганеллы являются представителями нормальной микрофлоры как человека, так и животных, а потому могут присутствовать в качестве сапрофитов в окружающей (внебольничной!) среде.
Морганеллы имеют довольно сложные отношения с антибактериальными препаратами и обладают природной резистентностью к:
Проявляют высокую чувствительность к:
Клинические аспекты
Как говорилось выше, морганеллы являются частью нормальной микрофлоры человека, крайне редко вызывая инфекционные заболевания. Чаще всего они являются возбудителями осложненных инфекций мочевыводящих путей.
Факторами риска развития инфекции являются:
В качестве механизмов резистентности морганеллы способны продуцировать бета-лактамазы, чем и объясняется их природная устойчивость к пенициллинам и цефалоспоринам 1-2 поколений. При нерациональном использовании антибиотиков они начинают вырабатывать бета-лактамазы расширенного спектра и факторы устойчивости к фторхинолонам, которыми довольно бодро делятся с соседями по семейству Enterobacteriaceae. Отдельно стоит отметить способность отдельных штаммов морганелл к резистентности к имипенему.
Какие заболевания вызывают чаще всего:
Терапевтические аспекты
Антибактериальная терапия будет полностью зависеть от результата из микробиологической лаборатории. Повторимся еще раз, микроб изначально умеет вырабатывать бета-лактамазы, а потому в случае развития осложненных инфекции мочевыводящих путей, которые чаще всего уже не связанны с кишечной палочкой, препаратами выбора становятся карбопенемы (имипенем, если штамм к нему чувствителен, или меропенем), дозирование которых проводится с учетом клиренса креатинина. Длительность лечения должна быть не менее 7 дней. В качестве альтернативы можно использовать цефалоспорин 4-го поколения Цефипим каждые 8 часов или фторхинолоны.
Аминогликозиды, несмотря на чувствительность к оным, при лечении заболеваний мочевыводящих путей лучше не применять в виду их нефро- и отоксичности, и по этой же причине их невозможно будет использовать около трех месяцев после проведенной терапии, например, в лечении синегнойной инфекции. Цефалоспорины третьего поколения тоже применять не стоит, так как морганеллы довольно быстро обзаводятся бета-лактамазами расширенного спектра, которые, как мы помним, эту генерацию препаратов быстро инактивируют.
Proteus spp.
Микробиологические аспекты
Протей долгое время был практически родным отцом морганеллы, так как последняя рассматривалась как один из видов рода протей. Этот род примечателен тем, что занимает почетное второе место по выявляемости после кишечной палочки в семействе Enterobacteriaceae.
В данный момент представителями рода протей являются P. mirabilis, вызывающий порядка 90% инфекционных заболеваний, а также P. vulgaris и P. penneri.
Клинические аспекты
Протеи выступают возбудителями порядка 10% неосложненных инфекций мочевыводящих путей, с чем могут быть связаны неудачи в лечении последних с использованием аминопенициллинов.
Как и все клинически значимые возбудители семейства Enterobacteriaceae, протей является возбудителем нозокомиальных инфекций, таких как пневмония, вплоть до сепсиса. Кроме того выступает возбудителем интраабдоминальных, а также хирургических инфекций кожи и мягких тканей, сепсиса, связанного с медицинскими вмешательствами как последствий нозокомиальной пневмонии в результате недостаточной дезинфекции, например, бронхоскопов.
Таким образом, мы видим, что, как и в предыдущем случае, проще правильно помыть руки и обработать инструменты, чем лечить это все с учетом природной и приобретенной резистентности.
Терапевтические аспекты
Как и в случае с морганеллой, нам просто необходим результат микробиологического исследования с определением чувствительности по МПК возбудителя либо результаты микробиологического мониторинга, которые помогут предположить зверей в случае неудачи ранее проводимого лечения.
В случае ампициллин-чувствительного P.mirabilis именно ампициллин может выступать препаратом первой линии. Кроме того, возможно использование цефуроксима и фторхинолонов. Обязательным аспектом лечения является его длительность. В случае неосложненных инфекций мочевыводящих путей (цистита) — не менее 3 дней, пиелонефрита — 10–14 дней, осложненных инфекций — 10–21 день. Сепсис является состоянием, требующим индивидуального подхода, но лечим не менее 14 дней.
На этом на сегодня мы закончим, но повторим одну базовую и, чего уж, наиважнейшую истину: в лечении инфекций, связанных с любым представителем семейства Enterobacteriaceae, самым главным будет являться профилактика. А именно правильное и тщательное мытье рук. Обеспечим мытье рук, не будет большинства проблем с инфекциями, вызванными указанным семейством.