Что вырабатывают в лимфоциты
Иммунная система Часть 4 Лимфоциты
Иммунная система Часть 4 Лимфоциты
В-лимфоциты
Развитие В-лимфоцитов происходит в костном мозге, после чего они покидают его и перемещаются в лимфатические узлы.
Зрелый В-лимфоцит выполняет роль антиген-презентирующей клетки и быть источником особых молекулярных веществ для регуляции иммунного ответа. Однако его основная задача вырабатывать антитела.
Для этого необходим контакт с антигеном и несколько дней для превращения В-лимфоцита в плазматическую клетку. В начале образующие антитела представлены иммуноглобулинами класса М IgM. После воздействия особых молекул из Т-лимфoцитов в плазматических клетках синтез антител переключается на классы IgG, IgA или IgE. Помня о встрече с антигеном, В-лимфоциты превращаются в клетки памяти.
При повторной встрече с антигеном, клетки памяти быстро преобразуются в плазматические клетки и сразу секретируют большое количество АТ. А Т-лимфоциты, сохранившие свою память, переключают В-клетки на образование более сильных IgG. Повторная встреча с антигеном нередко протекает незаметно для организма, так быстро и эффективно развивается иммунный ответ.
Т-лимфоциты
Родившись из стволовой клетки костного мозга, предшественники Т-лимфоцитов переходят в тимус, где подвергаются строгому отбору и сортировке. Существует несколько типов Т-лимфоцитов, выполняющих разные функции. Им принадлежит ключевая роль в формировании клеточного или гуморального ответа. Направление иммунитета во многом зависит от особых молекул, которые выделяют антиген-презентирующие клетки.
Тип и подтип Т-лимфоцитов
Способствуют формированию приобретенного иммунитета.
Th1-клетки (Т-хелперы 1 типа)
Активируют фагоцитирующие клетки и клетки-киллеры, выделяют ИФН-гамма, ИЛ-2, ФНО-альфа. Обуславливают приобретенный клеточный иммунный ответ, направленный на внутриклеточные патогены (вирусы), способствуют воспалительной реакции.
Th2-клетки (Т-хелперы 2 типа)
Активно участвуют в выработке антител В-лимфоцитами, выделяют ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13. Обуславливают формирование приобретенного гуморального иммунного ответа, участвуют в противопаразитарном и аллергическом иммунном ответе.
Th17-клетки (Т-хелперы 17 типа)
Производят ИЛ-17, ИЛ-21, ИЛ-22, участвуют в аутоиммунных процессах, в борьбе с внеклеточными бактериями и грибами.
Th0-клетки (Нулевые Т-хелперы)
Наивные клетки, которые должны определиться с выбором. Под действием ИЛ-4, ИЛ-2 превращаются в Th2-клетки; Под действием ИЛ-12, ИФН-гамма в Th1-клетки; Под действием ИЛ-6, ТФР-бета в Th17-клетки.
Т- лимфоциты регуляторные супрессорные
Способствуют завершению иммунного ответа благодаря особым молекулам ТФР-бета, ИЛ-10, ИЛ-13 и другим, подавляющим иммунную реакцию.
Т-лимфоциты цитотоксические и Естественные Т-клетки-киллеры
Необходимы для уничтожения внутриклеточных патогенов, в частности, вирусов. Секретируют ИЛ-4 и ИФН-гамма, регулируют иммунный ответ.
Иммунных клеток гораздо больше, чем мы рассмотрели, они все несут разную функцию, их работа тесно переплетена. Многие иммунные клетки способны вырабатывать особые молекулы, которые регулируют острое воспаление и иммунный ответ.
Выберите город
Годовой абонемент
Годовой абонемент входит в состав первого заказа и дает возможность год Вам и членам Вашей семьи сдавать анализы в два раза дешевле. Результаты всех анализов бессрочно будут храниться в личном кабинете. Подробнее
Что вырабатывают в лимфоциты
Оба типа лимфоцитов образуются у эмбриона из полипотентных гемопоэтических стволовых клеток, формирующих лимфоциты как один из наиболее важных результатов их дифференцировки. Почти все сформированные лимфоциты в результате заселяют лимфоидную ткань, однако прежде чем это произойдет, они дополнительно дифференцируются или проходят предварительную обработку.
Лимфоциты, которые в итоге станут активированными Т-лимфоцитами, сначала мигрируют к тимусу, где подвергаются предварительной обработке. Эти ответственные за клеточно-опо-средованный иммунитет лимфоциты называют Т-лимфоцитами, что подчеркивает роль тимуса.
Другая популяция лимфоцитов, В-лимфоциты, предназначенные для формирования антител, проходят предварительную обработку в печени плода в середине периода внутриутробной жизни, а также в костном мозге в конце внутриутробной жизни плода и после рождения. Эта популяция клеток впервые была открыта у птиц, имеющих специальный орган для их предварительной обработки, который называют бурсой Фабриция (фабрициевой сумкой). Ответственные за гуморальный иммунитет лимфоциты называют В-лимфоцитами, что подчеркивает роль бурсы.
На рисунке ниже показаны две лимфоцитарные системы для формирования: (1) активированных Т-лимфоцитов; (2) антител.
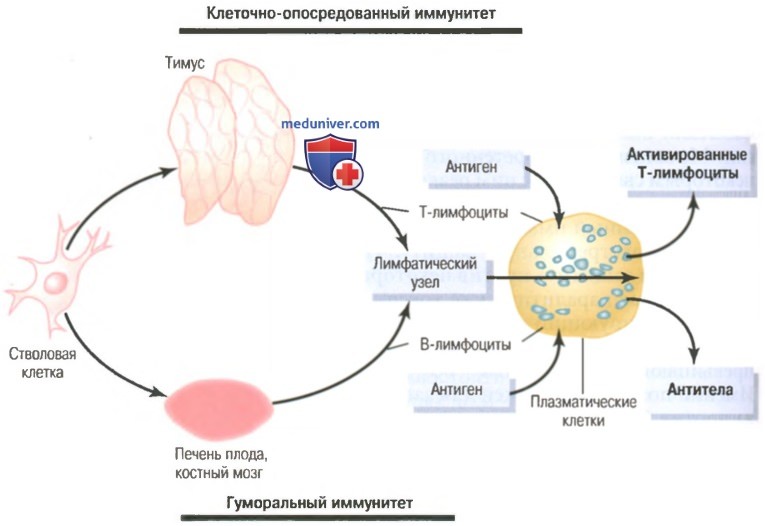
Этот рисунок также демонстрирует происхождение лимфоцитов тимуса (Т-лимфоцитов) и бурсы (В-лимфоцитов), ответственных за клеточно-опосредованные и гуморальные иммунные процессы, соответственно
Предварительная обработка Т- и В-лимфоцитов
Все лимфоциты организма происходят от коммитированных в лимфоцитарном направлении стволовых клеток эмбриона, но эти клетки не могут непосредственно превратиться в активированные Т-лимфоциты или антитела. Прежде чем это станет возможным, клетки должны подвергнуться дальнейшей дифференцировке в соответствующих областях, где они проходят специфическую обработку.
а) Т-лимфоциты проходят предварительную обработку в тимусе (вилочковой железе). После образования в костном мозге Т-лимфоциты сначала мигрируют к вилочковой железе. Здесь они быстро делятся, одновременно становясь чрезвычайно разнообразными, т.е. предназначенными для реакции против разных специфических антигенов. Это значит, что один лимфоцит, обработанный в тимусе, проявляет специфическую реактивность в отношении одного антигена. Следующий лимфоцит специфически реагирует на другой антиген. Это продолжается до тех пор, пока в тимусе не появятся тысячи разных типов лимфоцитов со специфической реактивностью в отношении тысяч разных антигенов. Эти разные типы предварительно обработанных Т-лимфоцитов оставляют тимус и распространяются кровью по всему телу, временно оседая в лимфоидной ткани.
Кроме того, благодаря обработке в тимусе любой оставляющий его Т-лимфоцит не реагирует с белками или другими антигенами собственных тканей организма (иначе Т-лимфоциты погубили бы собственное тело человека в течение всего нескольких дней). Тимус выбирает, какие Т-лимфоциты могут его покинуть, сначала смешивая их практически со всеми специфическими аутоантигенами собственных тканей тела. Если Т-лимфоцит реагирует, он разрушается и фагоцитируется, вместо того, чтобы выделяться. Это происходит с основной частью клеток (вплоть до 90%). Таким образом, клетки, выделяющиеся из тимуса, не реагируют против собственных антигенов тела; они реагируют лишь на антигены внешних источников, например бактерий, токсинов или тканей, пересаженных от другого человека.
Основная часть предобработки Т-лимфоцитов в тимусе происходит перед рождением ребенка и в течение нескольких месяцев после рождения. Удаление вилочковой железы после этого периода ослабляет (но не исключает) Т-лимфоцитарную иммунную систему. Однако удаление тимуса за несколько месяцев до рождения может нарушить развитие всего клеточно-опосредован-ного иммунитета. Поскольку именно клеточный тип иммунитета в основном отвечает за отторжение трансплантированных органов, например сердца или почек, органы можно пересаживать с меньшей вероятностью отторжения, если у животного в соответствующее время до его рождения удалить тимус.
б) В-лимфоциты проходят предварительную обработку в печени и костном мозге. О деталях предварительной обработки В-лимфоцитов известно гораздо меньше, чем о предобработке Т-лимфоцитов. Известно, что у человека предварительная обработка В-лимфоцитов осуществляется в печени в середине внутриутробного периода развития, а также в костном мозге в конце внутриутробного периода и после рождения.
Существуют два важных различия между В- и Т-лимфоцитами. Во-первых, В-лимфоциты активно секретируют реактивные агенты, называемые антителами, в отличие от Т-лимфоцитов, реагирующих с антигеном непосредственно. Антитела — это крупные белковые молекулы, способные соединяться с антигенной субстанцией и разрушать ее. Во-вторых, разнообразие В-лимфоцитов выражено больше, чем у Т-лимфоцитов, т.е. формируются миллионы типов В-лимфоцитарных антител с разными специфическими реактивностями. После предобработки В-лимфоциты, как и Т-лимфоциты, мигрируют к лимфоидной ткани по всему телу, где временно располагаются рядом, но несколько обособленно от областей локализации Т-лимфоцитов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Т и В лимфоциты ( по материалам статьи R Luz Elena Cano and H. Damaris E. Lopera.)
Лимфоциты Т и В (клетки Т и В) участвуют в приобретенном или антиген-специфическом иммунном ответе, учитывая, что они являются единственными клетками в организме, способными распознавать и реагировать специфически на каждый антигенный эпитоп. Клетки В обладают способностью превращаться в плазматические клетки и отвечают за выработку антител (Abs). Таким образом, гуморальный иммунитет зависит от B-клеток, а клеточный иммунитет зависит от T-клеток. В настоящей заметке процессы онтогенеза суммированы для каждого типа лимфоцитов вместе с их основными характеристиками, различными субпопуляциями, описанными до настоящего времени, механизмами сигнализации, используемыми для их активации, и их основными функциями на основе иммунологического профиля, который они представляют.
Онтогенез
Процесс развития и созревания Т-клеток у млекопитающих начинается с гемопоэтических стволовых клеток (HSC) в печени плода, а затем в костном мозге, где HSC дифференцируются в мультипотентные предшественники. Подмножество мультипотентных предшественников инициирует транскрипцию генов 1 и 2, активирующих рекомбинацию (RAG 1 и RAG2), и становится мультипотентными предшественниками с лимфоидным праймером, а затем общими лимфоидными предшественниками (CLP). Лишь небольшое подмножество плюрипотентных клеток мигрирует в тимус и дифференцируется в ранние предшественники тимуса (ETP). Тимус не содержит самообновляющихся предшественников; и, следовательно, длительный тимопоэз зависит от набора предшественников, оседающих тимусом, на протяжении всей жизни человека. Эти предшественники должны войти в тимус, чтобы постепенно перепрограммироваться в полностью зрелые и функциональные Т-клетки. Различные этапы развития Т-клеток, координируются с миграцией развивающихся тимоцитов к специфическим нишам в тимусе, которые обеспечивают необходимые специфичные для стадии факторы, необходимые для дальнейшей дифференцировки.
CD4+ Т клетки
Если Т-клетка экспрессирует CD4, она превращается в Т-хелперную клетку (Th), которая выполняет двойную функцию: продуцирует цитокины и стимулирует В-клетки для генерации Abs. До недавнего времени были идентифицированы только четыре различных фенотипа: Th1, Th2, Th17 и T-регуляторные клетки (Treg), каждая из которых секретирует свой профиль цитокинов. Однако в последние несколько лет были обнаружены новые подмножества T-хелперов, такие как Th9, Th22 и фолликулярные хелперы (Tfh).
Среди всех подмножеств T-хелперных клеток Tfh экспрессирует TCR с наибольшим сродством к Ag и наибольшему количеству костимулирующих молекул, таких как ICOS и CD40L. Кроме того, они экспрессируют фактор транскрипции BCL-6 и цитокины, такие как IL-21, IL-4 и IL-10, которые индуцируют дифференцировку B-клеток и продукцию Ab.
Клиническая значимость этих клеток показана у пациентов с мутациями гена FOXP3, у которых развивается иммунодефицит, связанный с хромосомой X, которая проявляется плюриландландриальными и кишечными проявлениями, известными как IPEX. Эта аутоиммунная полиорганная болезнь требует трансплантации костного мозга в раннем детстве/
Цитотоксические T-клетки также высвобождают IFN-γ и TNF-α, которые важны для защиты от вирусных инфекций и для контроля пролиферации опухолевых клеток
Первые стадии развития B-клеток происходят в сложных микроокружениях, созданных стромальными клетками костного мозга, известными как «ниши», из которых происходят стимулы и факторы, необходимые для запуска ряда клеточных сигналов. Они, в свою очередь, активируют факторы транскрипции, которые индуцируют или репрессируют экспрессию различных генов-мишеней, которые модулируют выживание, пролиферацию и дифференцировку клеток. IL-7 имеет решающее значение для развития B-клеток и вырабатывается клетками стромы.
Во время дифференцировки В-клеток изначально происходит процесс рекомбинации генов, который кодирует сегменты V ( переменная ), D ( разнообразие ) и J ( соединение ) тяжелой цепи (цепь H) вместе с генами для сегменты V и J легкой цепи (цепь L) мембраносвязанного иммуноглобулина (mIg). Этот процесс рекомбинации инициируется комплексом белков RAG1-RAG2, которые генерируют разрыв двойной цепи ДНК между сегментами генов и специфическими сайтами узнавания, которые также известны как « сигнальные последовательности рекомбинации ». Этот процесс приводит к генерации B-клеток, которые экспрессируют широкий репертуар mIg. Это формирует B-клеточный рецептор (BCR), который способен распознавать более 5 × 1013 разных Аг.
Сигнальные механизмы
Передача сигналов, создаваемая сигналосомой, активирует множество сигнальных каскадов, которые участвуют в других киназах, GTPases и факторах транскрипции, таких как NF-kB, Bcl6, NF-AT, FoxO, Jun и ATF-2 и т. д.
Активация всех этих механизмов приводит к изменениям клеточного метаболизма, экспрессии генов и организации цитоскелета клетки. Результат ответа определяется различными факторами или условиями, такими как: состояние созревания B-клеток, природа Ag, величина и длительность передачи сигналов через BCR и сигналы других рецепторов, таких как CD40, рецептор IL-21 и BAFF-R. Таким образом, многие другие трансмембранные белки, такие как CD45, CD19, CD22, PIR-B и Fc γRIIB1 (CD32), модулируют специфические элементы сигнальной BCR. Во время естественныхпроцессы, B-клетки также активируются APC, которые захватывают и представляют антигенные фракции на своих клеточных поверхностях. Этот тип активации B-клеток такими Ags, ассоциированными с клеточной мембраной, также требует реорганизации цитоскелета B-клеток. Таким образом, следует ожидать, что сложность передачи сигналов, опосредованной BCR, позволяет осуществлять разнообразные биологические эффекты, включая выживание, толерантность или апоптоз клеток, а также пролиферацию и дифференцировку в продуцирующих Ab клетках или B-клетках памяти.
Ко-рецепторы BCR
Костимулирующие молекулы
Другим важным аспектом в активации B-клеток является присутствие молекул, которые положительно или отрицательно регулируют процесс. Вместе они известны как костимулирующие молекулы, и некоторые из них описаны следующим образом.
Молекулы адгезии
Зрелые B-клетки можно разделить на несколько подмножеств в зависимости от их местоположения, фенотипа клеточной поверхности, Ag-специфичности и путей активации.
Фолликулярные B-клетки (FoB) или B-2. Они генерируются непосредственно в костном мозге и достигают фолликулы вторичных лимфоидных органов и кровообращения. Они считаются покоящимися (наивными) клетками и составляют наибольшую субпопуляцию В-клеток. На их дифференциацию влияют самые разные факторы, включая хемокины, передачу сигналов BCR и некоторые Ags. Они участвуют в T-зависимых (TD) иммунных реакциях, поскольку они могут использовать BCR для поглощения Ag, обработки его и представления его специфичным для Ag T-клеткам).
B1 B Клетки. Это первые B-клетки, которые сформировались в печени плода. Они подразделяются на B1a и B1b с первым, экспрессирующим гликопротеин мембраны CD5, который отсутствует во втором. Оба экспрессирующих маркера CD9 и CD45RA участвуют в иммунных реакциях типа TI, обнаруживаются в брюшной и плевральной полостях и являются основным источником циркулирующего Abs. Как и в случае с MZB, B-1 быстро реагирует на специфические для Ag стимулы и трансформируется в плазматические клетки. Наблюдалось увеличение их числа в экспериментальных исследованиях и у людей с аутоиммунными заболеваниями.
Плазматические или Ab-секреторные клетки. Они отличаются от активированной B-клетки, которая в присутствии IL-2 и IL-10 перестает экспрессировать поверхностные молекулы, такие как молекулы CD19, CD20, CD22, HLA класса II и их BCR. Эти клетки также теряют способность делиться. В то же время они претерпевают ряд клеточных модификаций, например, увеличение их цитоплазмы из-за усиленного роста эндоплазматического ретикулума, который необходим для того, чтобы содержать большое количество рибосом для надежной продукции Abs. Они также перестают экспрессировать CXCR5 и CXCR7 и увеличивают CXCR4, что приводит к потере контакта с DC и заставляет клетки T FH мигрировать из GC в медуллярные шнуры ганглиев.
В целом, мы можем сказать, что эти врожденные иммунные клетки могут стимулировать и помогать ответу Abs на процессы как TD, так и TI. Для первых, эти клетки используют вспомогательные сигналы для B-клеток в GC и в центральных лимфоидных участках, таких как костный мозг. Вдобавок к этому ответы типа TTI имеют место на поверхности слизистых оболочек и в краевой зоне селезенки, вызывая быстрый ответ от естественного Abs.
Традиционно, гуморальный иммунный ответ, опосредованный Abs, классифицируется на основании того, получают ли B-клетки помощь от T-клеток, т. е. являются ли они ответами TD или TI тимуса.
Терапия
Учитывая ускоренные темпы новых открытий в биологии В-клеток, лучшее понимание клеточных и молекулярных механизмов, вовлеченных в развитие, дифференцировку и функционирование этих клеток, выявит потенциальные терапевтические мишени и позволит разработать методы лечения анти-В-клеток, которые может разрешить клеточные изменения, ответственные за различные патологии.
Уже известно, что B-клетки играют фундаментальную роль в патогенезе RA путем продуцирования аутоантител и секреции хемокинов / цитокинов, и что они могут служить в качестве Ag-презентирующих клеток. Таким образом, некоторые рецепторы, костимулирующие молекулы, части сигнального каскада и провоспалительные медиаторы B-клеток считаются перспективными молекулами-мишенями для лечения RA, SLE, множественной миеломы и других заболеваний
Литература
Anderson G, Takahama Y. Thymic epithelial cells: working class heroes for T cell development and repertoire selection. Trends Immunol. 2012;33:256–63.
Bhandoola A, Sambandam A. From stem cell to T cell: one route or many? Nat Rev Immunol. 2006;6:117–26
Bousso P. T Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat Rev Immunol. 2008;8:675–84.
Cyster JG. Homing of antibody secreting cells. Immunol Rev. 2003;194:48–60
Lloyd CM, Hessel EM. Functions of T cells in asthma: more than just T(H)2 cells. Nat Rev Immunol. 2010;10:838–48
Kato A, Hulse KE, Tan BK, Schleimer RP. B-lymphocyte lineage cells and the respiratory system. J Allergy Clin Immunol. 2013;131:933–57
. King C. New insights into the differentiation and function of T follicular helper cells. Nat Rev Immunol. 2009;9:757–66.
Kurosaki T. B-lymphocyte biology. Immunol Rev. 2010;237:5–9.
Mauri C, Bosma A. Immune regulatory function of B cells. Annu Rev Immunol. 2012;30:221–41
Pieper K, Grimbacher B, Eibel H. B Cell biology and development. J Allergy Clin Immunol. 2013;131:959–71.
Townsend MJ, Monroe JG, Chan AC. B Cell targeted therapies in human autoimmune diseases: an updated perspective. Im-munol Rev. 2010;237:264–83.
Turner SJ, Doherty PC, McCluskey J, Rossjohn J. Structural determinants of T Cell receptor bias in immunity. Nat Rev Immu-nol. 2006;6:883–94.
von Boehmer H, Melchers F. Checkpoints in lymphocyte development and autoimmune disease. Nat Immunol. 2010;11:14–20.
Cox MA, Kahan SM, Zajac AJ. Anti-viral CD8 T cells and the cytokines that they love. Virology. 2013;435:157–69
Girard JP, Moussion C, Forster R. HEVs, lymphatics and homeostatic immune cell trafficking in lymph nodes. Nat Rev Immunol. 2012;12:762–73.
Vinuesa CG, Chang PP. Innate B cell helpers reveal novel types of antibody responses. Nat Immunol. 2013;14:119–26
Активация иммунитета, дендритные клетки и лимфоциты
Дендритные клетки и лимфоциты
«Боевая» и «самоконтролирующая» функции иммунной системы
Примечание. На данной странице кратко рассмотрены функции и характеристики основных иммунокомпетентных клеток: Т- и В-лимфоцитов и дендритных клеток ( DCs ). Но в начале дана характеристика особому двойному функционалу иммунной системы, в которой основную роль играют лимфоциты. Поэтому стоит напомнить, что же из себя предсталяют эти клетки.
Те или иные механизмы иммунной защиты есть практически у всех животных. Эти механизмы сильно различаются по своей структуре, сложности, эффективности и, главное, по соотношению врожденных и приобретенных компонентов. У беспозвоночных преобладает врожденный иммунитет, хотя это далеко не абсолютное правило. У позвоночных вдобавок к врожденным защитным механизмам развилась необычайно сложная адаптивная иммунная система, способная приспосабливаться (адаптироваться) к всевозможным новым инфекциям, вырабатывать новые средства борьбы с ними и обладающая к тому же хорошей памятью (именно благодаря иммунной памяти мы получаем стойкий иммунитет ко многим болезням, однажды переболев ими).
У всех «высших» позвоночных основными компонентами адаптивной иммунной системы являются лимфоциты двух типов: B и T (см.: B cell, T cell). Каждый зрелый лимфоцит производит один (и только один) тип рецепторов, причем каждый рецептор способен распознавать чужеродные молекулы (антигены) строго определенного типа. Рецепторы B-лимфоцитов называются антителами, они могут отделяться от поверхности лимфоцита и самостоятельно атаковать «врагов» (например, бактерий). Рецепторы Т-лимфоцитов (Т-клеточные рецепторы) по своей структуре похожи на антитела, но они прочно приделаны к поверхности Т-лимфоцита и не расплываются свободно в окружающей среде, подобно антителам.
В ходе развития (созревания) лимфоцитов происходит сложная перестройка их генома. Суть ее состоит в том, что из имеющегося в геноме набора «заготовок» комбинаторным путем формируются зрелые, готовые к использованию гены антител или Т-клеточных рецепторов. Возникает огромное разнообразие лимфоцитов, производящих сотни тысяч и миллионы разных иммунных рецепторов. Среди этих рецепторов неизбежно появляются и опасные для организма, готовые наброситься на свои собственные антигены. Лимфоциты, производящие такие рецепторы, отбраковываются; остальные сохраняются. В результате организм получает огромный набор лимфоцитов, способных распознавать чуть ли не любые чужеродные белки и углеводы. Когда в организм проникает инфекция (например, бактерии), те B-лимфоциты, чьи антитела проявляют наибольшее сродство к поверхностным веществам (антигенам) данной бактерии, дополнительно «подгоняют» гены своих антител к этим антигенам путем соматического гипермутирования.
T- и B-лимфоциты высших позвоночных обмениваются между собой разнообразными химическими сигналами (см. ниже интерлейкины). В соответствии с этим у разных типов лимфоцитов активны строго определенные гены, ответственные за прием и передачу этих сигналов.
Более подробно о цитокинах см. в отдельном разделе:
Одно из главных функциональных различий В- и Т-лимфоцитов состоит в том, что первые специализируются в первую очередь на борьбе с инфекциями путем массового производства антител, а вторые — в большей степени «разведчики» и специалисты по тонкому различению «своих» и «чужих» антигенов; в частности, они внимательно следят за тем, чтобы B-лимфоциты по ошибке не начали производить аутоиммунные антитела, атакующие собственные клетки организма.
Разделение труда между лимфоцитами неизбежно вытекает из самой «идеи» производства огромного количества разнообразных иммунных рецепторов комбинаторным путем. С одной стороны, благодаря этой технологии позвоночные успешнее, чем любые другие животные, противостоят разнообразным инфекциям. Вряд ли без этого наши предки смогли бы стать теплокровными, то есть превратиться в ходячий термостат с питательной средой для микробов. С другой, такая иммунная система должна находиться под строжайшим контролем, иначе она мгновенно убьет свой собственный организм. Кто же может проконтролировать, какой антиген распознал тот или иной лимфоцит, точно ли этот антиген чужой и не будет ли для организма вреда, если данный лимфоцит начнет размножаться? Кроме другого лимфоцита, никто в этом не разберется. Иммунная система должна контролировать себя сама.
Активация иммунитета и Дендритные клетки
Источник: «Наука и жизнь» №11, 2011
Автор: Ольга Белоконева, кандидат химических наук
В 2011 году Нобелевская премия по физиологии и медицине присуждена Брюсу Бойтлеру и Жюлю Хоффманну за открытие механизмов активации врождённого иммунитета, и Ральфу Штайнману за открытие дендритных клеток и их роли в активации адаптивного иммунитета. Эти исследования называют революционными, поскольку открытие врождённого иммунитета в корне изменило представление о функционировании иммунной системы.
В природе существуют две линии защиты, два вида иммунитета.
Процесс выработки антител запускается не сразу, у него есть определённый инкубационный период, зависящий от типа патогена. Зато, если уж процесс активации пошёл, как только та же самая инфекция попытается проникнуть в организм ещё раз, B-клетки моментально отреагируют выработкой антител, и инфекция будет уничтожена немедленно, не причинив никакого вреда. Именно поэтому на некоторые виды инфекций у человека вырабатывается иммунитет на всю оставшуюся жизнь.
А вот система врождённого иммунитета неспецифична и не обладает «долгосрочной памятью», поскольку реагирует на некие молекулярные структуры, присущие всем патогенным микроорганизмам. Эти структуры получили название «патоген-ассоциированные молекулярные образы» (pathogen-associated molecular patterns — PAMP ). Такими PAMP служат молекулы, входящие в состав клеточной мембраны бактерий. Несмотря на химические различия, все эти структуры обладают следующими свойствами: они синтезируются только микроорганизмами (в клетках животных их нет, поэтому распознавание PAMP расценивается иммунной системой как сигнал к началу борьбы с чужаком); они характерны для целого ряда патогенов, а не только для одного; эти структуры являются важными для жизнедеятельности бактерии, поэтому в процессе эволюции они меняются очень медленно (иначе иммунная система просто не успевала бы настраивать распознавание). Если бактерии удаётся прорвать «первую линию обороны» и избежать уничтожения макрофагами или гранулоцитами, то в борьбу должна включиться система приобретённого иммунитета.
Каким образом система врождённого иммунитета подаёт знак системе приобретённого иммунитета на выработку специфических антител? Вот за решение этого ключевого вопроса иммунологии и присуждена Нобелевская премия 2011 года.
В 1973 году Ральф Штайнман открыл новый вид клеток, которые назвал дендритными, поскольку внешне они напоминали дендриты нейронов. Клетки обнаружились во всех тканях организма, которые соприкасались с внешней средой: в коже, лёгких, слизистой оболочке желудочно-кишечного тракта. Сначала исследователь предположил (в ту пору это вызвало скептицизм многих учёных), а затем и доказал, что дендритные клетки служат посредниками между врождённым и приобретённым иммунитетом. То есть «первая линия обороны» подаёт через них сигнал, который активирует T-клетки и запускает каскад выработки антител B-клетками (дополнительно о врожденном иммунитет см. здесь → ).
Дендритные клетки (англ. Dendritic cells, DC) – это популяция особых клеток иммунной системы костно-мозгового происхождения, функция которых заключается в презентации «вражеских» антигенов другим клеткам иммунной системы. Таким способом они активируют адаптивный иммунитет. По научному, такие клетки-посредники называются антигенпрезентирующими (АПК). См. механизм действия на рис. 1 и рис. 2 ).
Как оказалось позже, дендритные клетки (так же как и макрофаги и эпителиальные клетки) имеют на клеточной поверхности специальные белковые комплексы — рецепторы. Гены, кодирующие эти рецепторы, аналогичны Toll-генам плодовой мушки дрозофилы (от нем. toll — сногсшибательный, безумный), играющим ключевую роль в эмбриогенезе. В 1996 году Жюль Хоффманн обнаружил, что у мушек с «выключенным» Toll-геном полностью отсутствовал иммунитет и они погибали от любой грибковой инфекции. Хоффманн предположил, что ген Tollважен не только для развития эмбриона, он ещё играет ключевую роль в иммунной системе. Как оказалось, этот ген кодирует специальные рецепторы, распознающие молекулы в структуре мембран бактериальных патогенов (PAMP), посылая биохимический сигнал на устранение «чужака». Их назвали « Toll-подобные рецепторы » (англ. Toll-like).
При взаимодействии РАМР с Toll-подобным рецептором на поверхности дендритной клетки появляются белки-антигены, которые и запускают адаптивный иммунный ответ T-клеток. У человека обнаружен десяток таких Toll-подобных рецепторов. Некоторые из них находятся на поверхности клеток, другие «плавают» в клеточной цитоплазме. Конечным результатом взаимодействия PAMP с этими рецепторами является активация T-клеток. На клеточном уровне происходит активация фагоцитов: они начинают продуцировать активные формы кислорода, а следовательно, более интенсивно переваривать «обрывки» клеточных стенок чужеродных бактерий.
Таким образом, открытие врождённого иммунитета привело к появлению новых подходов в профилактике и лечении заболеваний, в разработке новых вакцин и противоопухолевых препаратов.
Активация адаптивной иммунной системы
Небольшая доля активированной B-клетки (и активированной TH-клетки) будет развиваться в клетки памяти, чтобы обеспечить длительный иммунитет.
См. дополнительно:
B- и T-лимфоциты. Общая характеристика
1. Общая характеристика B-лимфоцитов
После связывания антигена с рецепторами B-клетки клетка активируется. Активация B-клеток состоит из двух фаз: пролиферации и дифференцировки; все процессы индуцируются контактом с антигеном и T- хелперами.
В результате пролиферации увеличивается число клеток, способных реагировать с введенным в организм антигеном. Значение пролиферации велико, поскольку в неиммунизированном организме очень мало B-клеток, специфичных для определенных антигенов.
Каждый лимфоцит, относящийся к B-лимфоцитам и дифференцирующийся в костном мозге, запрограмирован на образование антител только одной специфичности.
Молекулы антител не синтезируются никакими другими клетками организма, и все их многообразие обусловлено образованием нескольких миллионов клонов B-клеток. Они (молекулы антител) экспрессируются на поверхностной мембране лимфоцита и функционируют как рецепторы. При этом на поверхности каждого лимфоцита экспрессируется около ста тысяч молекул антител. Кроме того, B-лимфоциты секретируют в кровоток продуцированные ими молекулы антител, являющиеся измененными формами поверхностных рецепторов этих лимфоцитов.
Антитела формируются до появления антигена, и антиген сам отбирает для себя антитела. Как только антиген проникает в организм человека, он встречается буквально с войском лимфоцитов, несущих различные антитела, причем у каждого есть свой индивидуальный распознающий участок. Антиген соединяется только с теми рецепторами, которые в точности ему соответствуют. Лимфоциты, связавшие антиген, получают пусковой сигнал и дифференцируются в плазматические клетки, продуцирующие антитела. Поскольку лимфоцит запрограммирован на синтез антител только одной специфичности, антитела, секретируемые плазматической клеткой, будут идентичны своему оригиналу, т.е. поверхностному рецептору лимфоцита и, следовательно, будут хорошо связываться с антигеном. Так антиген сам отбирает антитела, распознающие его с высокой эффективностью.
2. Общая характеристика T-лимфоцитов
Дополнительно см.:
T-лимфоциты подразделяются на ряд подклассов. Главные из них это две различные, неперекрывающиеся субпопуляции: клетки одной из них несут маркер CD4 и в основном «помогают» в осуществлении иммунного ответа или индуцируют его ( T-хелперы ), клетки другой несут маркер CD8 и обладают преимущественно цитотоксической активностью (цитотоксические T-лимфоциты ( T-киллеры )). При этом, Т-хелперы стимулируют выработку антител, а Т-супрессоры тормозят её.
Отдельно стоит отметить т.н. NK-клетки (естественные киллеры или натуральные киллеры)
Дополнительно о Т- и В-лимфоцитах см. здесь →
Дополнительно см.:
К разделам:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ


















