сколько дней можно пить таблетки нимесулид
Длительное применение нимесулида в реальной клинической практике: вопросы безопасности
К.м.н. И.З. Гайдукова, профессор А.П. Ребров, О.Л. Полянская, М.Ю. Спицина
ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» МЗ РФ
Достоинства и недостатки нестероидных противовоспалительных препаратов, особенности нимесулида
Нестероидные противовоспалительные препараты (НПВП) являются наиболее часто применяемыми в реальной клинической практике лекарственными средствами. Сочетание анальгетического, противовоспалительного и жаропонижающего действий обусловили востребованность указанных препаратов при лечении большого числа заболеваний. При этом в лечении разных нозологических форм НПВП занимают различное место. При ряде заболеваний НПВП являются в первую очередь симптоматическими средствами (например, при онкологических заболеваниях), хотя справедливости ради следует отметить, что у ряда НПВП (например, нимесулида и целекоксиба) имеется способность замедлять неоангиогенез и тормозить рост опухоли [1]. При острой боли в позвоночнике противовоспалительные препараты наряду с анальгетиками применяются короткими курсами до уменьшения болевого синдрома и локального воспаления.
По данным некоторых исследований, НПВП являются препаратами, применение которых тормозит прогрессирование формирования синдесмофитов у пациентов со СпА, причем указанный положительный эффект напрямую связан с индексом потребления НПВП, отражающим кратность и длительность приема того или иного препарата данной группы [4].
Нежелательные явления, ассоциирующиеся с приемом НПВП, из которых наиболее значимыми являются ульцерогенный, гепато- и нефротоксические эффекты, неблагоприятное влияние препаратов на сердечно-сосудистую систему, существенно ограничивают их длительное применение [6, 7].
Какие требования предъявляются к оптимальному противовоспалительному препарату для лечения СпА? Во-первых, необходим быстрый противовоспалительный и обезболивающий эффект, сохраняющийся длительно. Во-вторых, препарат должен применяться внутрь и обладать высокой безопасностью. В популяции пациентов со СпА риск быстрого обострения сердечнососудистых заболеваний (в частности, сердечной недостаточности) меньше, чем при других заболеваниях суставов (пациенты в основном моложе 50 лет). В то же время при длительном приеме НПВП этот риск может повышаться [8], что потребует для терапии при наличии сердечно-сосудистой патологии поиска наиболее безопасного средства, а также мониторинга состояния сердечно-сосудистой системы. При длительном приеме НПВП риск желудочно-кишечных осложнений возрастает. Его можно уменьшить путем применения препаратов селективных или частично селективных в отношении циклооксигеназы-2 (ЦОГ-2). При высоком риске осложнений следует принимать комбинацию таких препаратов с ингибитором протонной помпы. Профилактика гепато- и нефротоксических эффектов при длительном применении НПВП представляется наиболее трудной задачей, т.к. эти побочные эффекты труднопредсказуемы и могут возникать у лиц с отсутствием факторов риска в анамнезе 12.
По данным фармацевтической компании Helsinn Healthcare SA, к 2005 г в мире было проведено около 450 млн терапевтических курсов нимесулида 15. Группой по изучению эффективности нимесулида (Consensus Report Group on Nimesulid, 2006) были обозначены основные достоинства препарата, позволяющие применять его в клинической практике: высокий профиль безопасности относительно осложнений со стороны желудочно-кишечного тракта (ЖКТ), высокая кардиоваскулярная безопасность, выраженный противовоспалительный и анальгетический эффект при наличии быстрого начала действия (через 30 мин. после приема) [15].
Вместе с тем известно, что часть врачей и пациентов отказываются от применения нимесулида из-за имеющихся сообщений о его негативном влиянии на функцию печени и почек [9, 22-24]. Всего описано около 200 случаев гепатотоксических эффектов нимесулида, из которых тяжелым был 81 случай. Из этого следует, что острая печеночная недостаточность при приеме нимесулида является непредсказуемым эффектом препарата и может развиться как при его длительном применении, так и после нескольких приемов. При этом общая частота развития нежелательных явлений со стороны печени является низкой.
При применении нимесулида в литературе описаны снижение скорости клубочковой фильтрации (СКФ) и развитие тубуло-интерстициального нефрита 10. При наличии отдельных клинических случаев острого почечного повреждения [9, 23] общая частота встречаемости нарушения функции почек при длительном лечении нимесулидом неизвестна.
Наиболее опасным нежелательным явлением, которое определяет летальность пациентов, применяющих НПВП, остаются желудочно-кишечные кровотечения. Несмотря на принимаемые меры профилактики, ежегодно регистрируются тысячи случаев новых желудочно-кишечных кровотечений, ассоциирующихся с приемом НПВП [26].
Материалы и методы
В исследование включено 96 пациентов (18-50 лет), находившихся на лечении в ревматологическом отделении областной клинической больницы г Саратова в 2010-2013 гг. Диагноз аксиального СпА устанавливали на основании соответствия пациента классификационным критериям ASAS (the Assessment of Spondyloarthritis International Society) [30, 31]. Пациентам проводили общеклиническое обследование, исследовали общий анализ крови (ОАК), общий анализ мочи (ОАМ), С-РБ высокочувствительным методом c применением реактивов фирмы Diasis; общий белок, альбумины, мочевину, креатинин, глюкозу, билирубин, аспартат- и аланинамино-трансферазу сыворотки крови. У части больных исследовали суточную протеинурию, выполняли УЗИ почек, дуплексное исследование почечных артерий. Наличие гипостенурии констатировали в случае снижения удельного веса утренней мочи менее 1018 у.е. на фоне сухоядения. СКФ рассчитывали по формуле MDRD (Modification of Renal Disease Study) [32]. Активность СпА определяли путем расчета индекса BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) [29].
Были проанализированы терапия, которую пациенты получали на амбулаторном этапе до момента госпитализации, и рекомендации их лечащих врачей при выписке. Наличие хронической болезни почек (ХБП) констатировали на основании рекомендаций K/DOQI (2002) [33]. Пациентам, принимавшим нимесулид (Найз ® ), предоставляли вопросник, уточняющий длительность, кратность приема и применяемые дозировки препарата.
Протокол исследования одобрен этическим комитетом ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» МЗ РФ.
Результаты и обсуждение
Все пациенты отмечали наличие боли воспалительного характера в спине (ежедневно) и применяли для лечения НПВП.
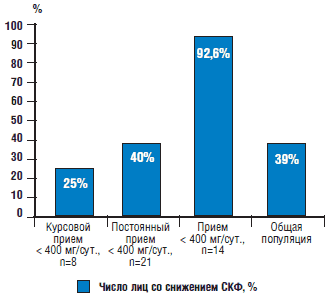
Рис. 1. Число лиц со снижением СКФ у пациентов с различными режимами дозирования нимесулида
Примечание:
• Частота встречаемости ХБП в общей популяции – данные Clase C.M., Garg A.X. Kiberd B.A. Prevalence of low glomerular filtration rate in nondiabetic Americans: NHANES III // J Am Soc Nephrol. 2002. Vol. 13. Р. 1338–1349 [35].
• Различия между частотой снижения СКФ у пациентов, принимающих нимесулид более 400 мг/сут., и у пациентов из других групп достоверны (p
Список использованной литературы
Нимесулид в лечении хронических заболеваний суставов
Заболевания суставов различной локализации являются одной из самых частых причин обращения к врачу наряду с артериальной гипертензией. Заболевания суставов являются социально значимыми болезнями.
Заболевания суставов различной локализации являются одной из самых частых причин обращения к врачу наряду с артериальной гипертензией. Заболевания суставов являются социально значимыми болезнями.
Во-первых, эти заболевания поражают значительную часть населения. Наиболее распространенным заболеванием суставов является деформирующий остеоартроз (ОА), особенно у лиц старше 65 лет, когда его распространенность достигает 97% населения. Среди хронических воспалительных заболеваний суставов наиболее частым является ревматоидный артрит (РА) — заболевание, практически облигатно приводящее к инвалидизации больных уже через 3–5 лет от дебюта болезни.
Во-вторых, эти заболевания характеризуют развитие стойкого болевого синдрома, который может быть связан с различными причинами. Наиболее частая причина боли при патологии суставов — развитие синовиита. Однако при ОА развитие боли может быть связано и с другими патогенетическими звеньями болезни. В норме болевые окончания имеют все структуры сустава, за исключением хряща. Но при ОА происходит частичная васкуляризация и иннервация хряща. Истончение и повреждение хряща снижает его амортизационные свойства, увеличивается нагрузка на субхондральную кость с развитием ее отека и боли. Кроме того, фибрилляция хряща также индуцирует боль и воспаления.
Данные, полученные при изучении влияния боли на прогноз при ОА, свидетельствуют:
Нестероидные противовоспалительные препараты (НПВП) обладают анальгетическим, противовоспалительным и жаропонижающим эффектами. Поэтому они являются незаменимыми в лечении артрологических заболеваний. Быстрое развитие обезболивающего эффекта и определяет облигатность их применения в лечении суставной патологии. Позитивный лечебный эффект НПВП связан с ингибицией ЦОГ-2. Этот фермент, участвующий в каскаде распада поврежденных при воспалении и других поражениях клеточных мембран, отвечает за выделение провоспалительных простагландинов и других медиаторов воспаления не только в суставах, но и в других органах и тканях, в первую очередь в стенках сосудов. Исходя из вышесказанного, становится ясно, что использование селективных ингибиторов ЦОГ-2 имеет важное клиническое и социальное значение.
В клинической практике селективные ингибиторы ЦОГ-2 заняли прочное место, хотя до сих пор не весь потенциал их возможностей используется практическими врачами. Нередко возникают «мифы» об их потенциальной токсичности, в первую очередь в отношении сердечно-сосудистой системы. В западной литературе была опубликована информация о гепатотоксичности нимесулидов, основанная на единичных и плохо документированных клинических случаях. Эти аспекты хотелось особо обсудить в данном сообщении, взяв в качестве примера препарат «Найз».
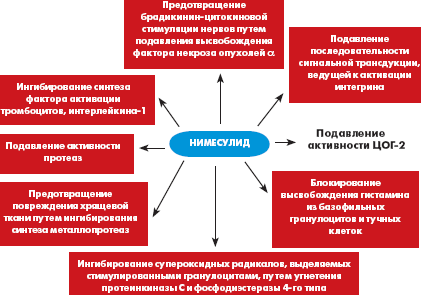
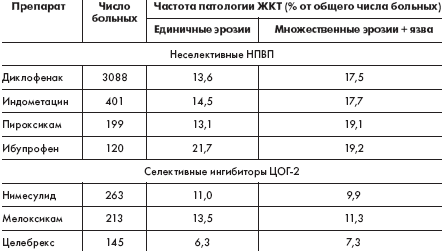
Препарат «Найз» относится к селективным ингибиторам ЦОГ-2, что доказано в исследованиях in vivo [7] и in vitro на молекулярных моделях [6]. Кроме того, препарат обладает еще несколькими важными механизмами действия (рис.). Наибольший опыт применения препарата «Найз» в ревматологической практике в Российской Федерации накоплен в лечении больных с ОА. Больные ОА, как правило, имеют высокий риск развития желудочно-кишечных осложнений в связи с возрастом, частым наличием сопутствующей сосудистой, кардиальной, ренальной патологии и необходимостью использовать сопутствующую терапию. Найз обычно используется этой категорией больных в суточной дозе 200 мг/сутки. Это обеспечивает достижение клинического эффекта у 87% [8] — 93% [9] больных при хорошей переносимости Найза в отношении желудочно-кишечного тракта, как по отечественным данным (табл. 1), так и по данным зарубежных контролируемых исследований, постмаркетингового изучения переносимости нимесулида в 17 странах у 118 831 385 больных [10–13].
В нашем исследовании участвовало 40 больных с ОА (32 больных) и с РА (8 больных), в возрасте от 49 до 79 лет (58,8 ± 18,3 года), страдающих артериальной гипертензией более чем 5 лет, получающих стабильную дозу антигипертензивных препаратов в течение не менее 6 месяцев, без явных проявлений сердечной недостаточности. Большинство больных получали ингибиторы АПФ (эналаприл 10–30 мг/сутки) — 28 больных, β-адреноблокаторы (пропранолол 20–40 мг/сутки) — 12 больных. Всем больным после 3-дневного периода перерыва в приеме НПВП (ибупрофен, мелоксикам, кетопрофен, диклофенак) назначался рандомизировано либо диклофенак в дозе 100–150 мг/сутки, либо Найз в дозе 200–400 мг/сутки на 20 дней. АД регистрировалось 6 раз в сутки: после пробуждения, перед первым приемом антигипертензивных или нитратных препаратов, через 2 часа после их приема и далее еще 3 раза с равными промежутками в течение всего периода «отмывки», первую и последнюю неделю приема НПВП, в остальное время исследования АД регистрировалось 4 раза в сутки каждые 3 часа с момента пробуждения. Пациенты в течение периода исследования вели дневник с указанием АД, приема антигипертензивных препаратов и нежелательных реакций. Статистическая обработка проводилась методом сопряженных пар.
Практически у всех больных обеих групп к концу периода «отмывки» отмечалось увеличение среднесуточного АД (табл. 2). Тем не менее, в течение 1-й недели лечения (табл. 2), различия в среднем систолическом давлении были достоверно больше при приеме диклофенака, а на фоне Найза практически не отличались от исходного (p 0,05). Известно, что изменение систолического АД (САД) является более важным фактором риска кардиоваскулярной патологии, чем изменение ДАД [19]. Уменьшение уровня САД на 12 мм рт. ст. снижает риск развития инфаркта миокарда на 27%, усугубления застойной сердечной недостаточности на 55% и инсульта на 56% [19, 20].
Аналогичные результаты продемонстрированы в исследовании В. И. Мазурова и соавт. [21], сравнивших гемодинамические показатели у больных ОА (n = 40), имеющих (23 пациента) или не имеющих (17 пациентов) сопутствующую артериальную гипертензию (АГ), при назначении Найза или диклофенака на 1 месяц. Пациенты всех подгрупп были сопоставимы по локализации ОА, рентгенологической стадии. Пациенты, имевшие ОА в сочетании с АГ, были примерно на 10 лет старше больных с нормальным уровнем АД. Доза Найза составляла 200 мг/сутки и диклофенака — 100 мг/сутки. Для лечения АГ всем больным второй подгруппы был назначен Ренитек (эналаприл) по 5–10 мг 2 раза в сутки. Всем больным до назначения НПВП и через 1 месяц помимо клинического осмотра и оценки боли (по шкале ВАШ) проводились ЭКГ, суточное мониторирование АД, импедансометрическая кардиография (ИМК), определение уровня десквамированных эндотелиоцитов в периферической крови по методике Hladovec J. и соавт. (1978), определение состояния эндотелий-зависимой и эндотелий-независимой (проба с нитроглицерином) вазодилятации (ЭЗВД, ЭНВД соответственно) плечевой артерии с помощью ультразвука высокого разрешения.
Через один месяц лечения статистически значимых различий в уменьшении боли по ВАШ на фоне приема Найза или диклофенака не отмечено (p > 0,05). Данные средних параметров суточного мониторирования АД представлены в табл. 3 и 4. При назначении Найза больным ОА без АГ (группа 1А) среднее суточное САД и среднее дневное САД и ДАД повышались в пределах нормальных значений без субъективных ощущений. В группе 1Б, получавшей диклофенак, отмечено более значимое увеличение систолического и ДАД, как среднесуточного, так и среднедневного (p
Н. В. Чичасова, доктор медицинских наук, профессор
Г. Р. Имаметдинова
Е. Л. Насонов, доктор медицинских наук, профессор, академик РАМН
ММА им. И. М. Сеченова, Москва
Применение нимесулидов в педиатрической практике: за и против
Нимесулид является одним из широко распространенных нестероидных противовоспалительных препаратов (НПВП), применяемых в клинической, в том числе педиатрической, практике во многих странах мира. Принадлежность нимесулида к группе селективных ингибиторов ц
Нимесулид является одним из широко распространенных нестероидных противовоспалительных препаратов (НПВП), применяемых в клинической, в том числе педиатрической, практике во многих странах мира. Принадлежность нимесулида к группе селективных ингибиторов циклооксигеназы-2 (ЦОГ-2), обусловливающая хорошую гастроэнтерологическую переносимость, обеспечивает ему явные преимущества перед другими НПВП и объясняет растущую популярность препарата среди врачей и пациентов. При этом более высокая эффективность нимесулидов как жаропонижающего средства по сравнению с традиционно применяющимися при гипертермии парацетамолом и ибупрофеном, доказанная в ходе многочисленных контролируемых клинических испытаний, а также опыт практического использования препаратов этой группы, накопившийся за последние годы, привели к тому, что многие практикующие врачи стали отдавать предпочтение нимесулидам по сравнению с другими НПВП. Стремительно возрастающая доля нимесулидов на фармацевтическом рынке НПВП не могла не вызвать обеспокоенности среди конкурирующих за этот рынок фармацевтических компаний. Таким образом, к 2000 г., т. е. спустя 15 лет (!) после разработки и появления нимесулида в аптечной сети и после продажи швейцарской компанией-разработчиком Helsinn Healthcare лицензии на производство нимесулида крупнейшим фармацевтическим компаниям мира, среди врачей и организаторов здравоохранения развернулись активные дискуссии по поводу целесообразности применения нимесулида из-за его потенциальной гепатотоксичности. Ареной для этих дискуссий стали популярные медицинские издания, сначала зарубежные, а теперь и российские, причем анализ публикуемой в них информации не всегда можно признать объективным. Сторонники ограничения использования нимесулидов в педиатрической практике в качестве аргумента нередко приводят ссылки на литературные источники, в названиях которых фигурируют ключевые слова «гепатотоксичность нимесулидов», хотя содержание работ свидетельствует об обратном. В качестве примера можно привести масштабное исследование, выполненное в Италии G. Traversa с соавторами и опубликованное в печатном варианте и на интернет-сайте BMJ в 2003 г. под названием «Cohort study of hepatotoxity associated with nimesulide and other nonsteroidal anti-inflammatory drugs». Исследование было посвящено изучению популяционной частоты гепатотоксических реакций, связанных с приемом нимесулида и других НПВП, и охватило 397 537 больных, применявших НПВП, а всего было проанализировано 2 млн назначений — за период с 1997 по 2001 г. Суммарная частота гепатопатий составила 29,8 на 100 000 пациентов-лет и ассоциировалась в большей степени с другими НПВП (диклофенаком — 39,2 на 100 000 пациентов-лет; кеторолаком — 66,8 и ибупрофеном — 44,6), нежели с нимесулидом (35,3 на 100 000 пациентов-лет).
Весьма примечательно, что за период с 1985 по 2001 г. была собрана информация только о 195 случаях (из них 123 — серьезных) развития неблагоприятных реакций после применения нимесулида, при том что этот препарат получали около 304 млн пациентов, а частота гепатопатий, возникших на фоне лечения нимесулидом, составила 0,1 на 100 000. Еще более удивляет тот факт, что с 1985 до 1997 г. отмечено только 25 случаев гепатопатий, ассоциированных с приемом нимесулида, а в последующие 3 года этот показатель возрос до 170. Такая статистика может объясняться либо обостренным вниманием к данной проблеме, либо какими-то иными причинами. В связи с этим следует отметить, что последние годы ознаменовались бурным всплеском заболеваемости вирусными гепатитами, причем все более многочисленным и разнообразным становится спектр гепатотропных вирусных агентов, а их массовая диагностика далека от должного уровня.
О явном преувеличении масштабов проблемы НПВП-индуцированных гепатопатий свидетельствуют объективные данные ведущих специалистов-гепатологов, по мнению которых НПВП фактически находятся на последнем месте в ряду причин лекарственных поражений печени и во много раз уступают в том, что касается частоты развития гепатопатий, таким распространенным лекарственным средствам, как антибиотики. Кроме того, известно, что НПВП-индуцированные гепатопатии относятся к редким непредсказуемым идиосинкразическим побочным эффектам и в значительно большей степени зависят от других факторов (в том числе генетических, инфекционных, алиментарных, полипрагмазии, употребления алкоголя и т. д.), нежели от собственно механизма действия НПВП. По сравнению с риском развития НПВП-индуцированных гастропатий, которые, как стало известно в последние годы, актуальны не только для взрослых ревматологических больных, но и для детей, риск НПВП-ассоциированного поражения печени минимален. Из этого соотношения следует, что при выборе НПВП предпочтение следует отдавать селективным ингибиторам ЦОГ-2, в том числе нимесулидам.
Вопрос о вероятности того, что нимесулиды способны оказывать на организм гепатоксическое воздействие (в частности, несколько примеров острого гепатита у взрослых пациентов, получавших нимесулид, были описаны в литературе), оказался в центре внимания специалистов-педиатров благодаря серии статей, размещенной на интернет-сайте BMJ. Отдельные материалы этой серии, касающиеся применения нимесулида у детей, представляются достаточно тенденциозными, неубедительными и излишне эмоциональными. Так, например, в публикации K. Saha из Университетского медицинского центра в Огайо (США) звучит призыв прекратить применение нимесулидов у детей, хотя предлагаемый в качестве альтернативы ацетаминофен (парацетамол) вполне сопоставим с нимесулидом по частоте упоминаемых в литературе гепатологических побочных реакций. В России сторонники ограничения применения нимесулида в педиатрической практике ссылаются на то, что нимесулид не зарегистрирован как препарат, применяемый у детей, в США и многих странах Европы, что нельзя считать достаточно весомым аргументом. Следует подчеркнуть, что самый распространенный в России НПВП — диклофенак натрия — также практически не используется у детей с ревматическими заболеваниями в большинстве стран Европы и Северной Америки. В Европе самым используемым НПВП является напроксен — препарат, который российские педиатры не имеют возможность назначать, поскольку имеющиеся на отечественном фармацевтическом рынке в настоящее время дженерики напроксена ограничены в применении у детей до 16 лет, не имеют «детских» лекарственных форм, а их качество вызывает нарекания у практикующих врачей. Относительно НПВП в педиатрической практике в США уместно заметить, что в ходе дискуссии на Конгрессе педиатров, прошедшем в России в феврале 2005 г., известнейший американский профессор педиатр и детский ревматолог из Нью-Йорка T. Lehman признал, что из НПВП чаще всего использует индометацин, хотя именно этот препарат зарекомендовал себя как наиболее агрессивное в плане развития побочных реакций средство. Кроме того, известно, что наиболее популярным из этой группы препаратов для применения у детей в США до сих пор является аспирин, гепатотоксичность которого не вызывает сомнений. Причем, если в отношении нимесулида неблагоприятные гепатологические реакции зафиксированы у взрослых, то развитие синдрома Рея (тяжелого нарушения функции печени, сопровождающегося ацидозом и энцефалопатией на фоне приема аспирина) наблюдается практически исключительно у детей. Следует также отметить, что в той же серии статей-откликов на сайте BMJ фигурируют и заметки прямо противоположного содержания под названиями «Defending Nimesulide Use!» («Защитим использование нимесулида!») и «Science or Commerce?» («Наука или коммерция?») и приводятся данные как минимум о 50 случаях развития синдрома Рея в результате применения не аспирина, а других лекарственных средств, чаще всего парацетамола. По-видимому, в патогенезе синдрома Рея, как и других серьезных побочных реакций, немаловажную роль играют процессы, связанные с лекарственными взаимодействиями и ответом организма на активную репликацию определенных вирусов. Эти данные подтверждают, что практически любой лекарственный препарат, даже самый безопасный, может выступить в роли последнего (но не самого главного) звена в сложной патогенетической цепи, приводящей к неблагоприятным последствиям. Именно поэтому решение о выборе лекарственного препарата в конкретной клинической ситуации должен принимать только грамотный, информированный обо всех возможных побочных эффектах и рисках врач, а безрецептурный прием НПВП возможен только в течение очень ограниченного периода времени и лишь с использованием препаратов и тех невысоких доз (ацетаминофен —10 мг/кг, ибупрофен — 5–10 мг/кг), которые признаны безопасными ВОЗ. При этом каждый практикующий врач должен понимать, что достоинства препарата всегда являются продолжением недостатков и наоборот. Так, ацетаминофен и ибупрофен являются самыми короткодействующими из жаропонижающих и противовоспалительных средств, что обусловливает, с одной стороны, их относительную безопасность, а с другой — в ряде ситуаций недостаточную эффективность в плане продолжительности действия.
В амбулаторных условиях при обеспечении адекватного врачебного контроля и в стационаре нет оснований ограничивать врача в праве выбора эффективного лекарственного средства, если препарат допущен к применению у детей и если имеются показания к его применению. Врачам случается сталкиваться в госпитальной педиатрической практике с ограничениями по использованию нимесулида, причем проводившимися без достаточного обоснования на административном уровне. В том числе это касается стационаров в Москве и некоторых регионах России, в которых накоплен многолетний успешный опыт применения «детских» лекарственных форм нимесулида. Одновременно в нашей стране существует достаточно терпимое отношение к использованию незарегистрированных лекарственных средств в педиатрической практике. Следует подчеркнуть, что в перечень НПВП, разрешенных к применению у детей, при незначительных возрастных ограничениях, входят ибупрофен, индометацин и только два дженерика нимесулида, выпускаемых под торговыми названиями найз® и нимулид®. Отдельные лекарственные формы диклофенака натрия, в зависимости от конкретного торгового названия, разрешены к применению у детей старше 6, либо 12, либо 15 лет. Мелоксикам разрешен к применению у детей старше 15 лет, многие новые НПВП — только после 18 лет. Каждый врач должен понимать, что побочная реакция, развившаяся на назначенный им препарат в зависимости от того, зарегистрирован ли он для применения в соответствующей возрастной группе, может иметь различные последствия, в том числе юридические. В связи с этим уместно отметить, что найз, разрешенный к применению с 2-летнего возраста, в 2004 г. успешно прошел процедуру перерегистрации отчасти и потому, что за 5 лет его использования на отечественном фармацевтическом рынке не было зарегистрировано серьезных неблагоприятных побочных реакций, индуцированных этим препаратом.
Большой опыт применения найза накоплен в детской клинике Института ревматологии. За 5 лет использования препарата в нашей клинике у 385 пациентов в возрасте от 1 года 2 мес до 18 лет, страдающих различными ревматическими заболеваниями, было отмечено только 16 случаев неблагоприятных побочных реакций. Спектр побочных реакций включал: умеренные диспептические явления, возникавшие преимущественно после приема суспензии, — у 9 детей, небольшое (в 1,5–2,5 раза) повышение трансаминаз — у 2 детей, минимальный отечный синдром с тенденцией к олигурии — у 4 детей, а также гематологическую реакцию в виде тенденции к лейкопении и изменения формулы крови — у 1 больного. Все неблагоприятные реакции легко устранялись отменой препарата и не требовали применения дополнительных средств. Следует подчеркнуть, что у 369 детей длительный непрерывный прием препарата (от 1,5 мес до 5,2 лет) в высоких дозах 4–5 мг/кг не сопровождался побочными реакциями, в том числе у 113 пациентов, одновременно получавших такие гепатотоксичные лекарственные средства, как метотрексат, циклоспорин А или сульфасалазин, а также имевших в анамнезе гиперферментемию на фоне приема диклофенака и других НПВП.
Увеличение доли стационарных и амбулаторных пациентов с ювенильным артритом, длительно принимающих найз в виде монотерапии или в составе комплексной терапии, с 5–10% в 2000–2001 гг. до 55–64% в 2003–2005 гг. свидетельствует о сформированной за последнее время приверженности врачей и пациентов к применению этого препарата.
Анализ данных литературы и большой клинический опыт позволяют на сегодняшний день рассматривать найз как препарат выбора в ряду НПВП, когда речь идет о его применении у детей.
Аргументы в пользу использования найза у детей:
Безусловно, необходим взвешенный и осторожный подход к назначению нимесулидов в педиатрической практике из-за потенциального риска возникновения побочных реакций, особенно при полипрагмазии, и развития коморбидных состояний; во всех случаях следует соблюдать надлежащую процедуру врачебного мониторирования безопасности терапии.
По вопросам литературы обращайтесь в редакцию.
И. П. Никишина, кандидат медицинских наук
Институт ревматологии, Москва