sars cov 2 что это такое как лечить
Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы помним, как с начала декабря 2019 года в китайском городе Ухань был выявлен ряд случаев пневмонии, связанных с коронавирусной инфекцией COVID-19 c серьезными симптомами, такими как респираторные проблемы (кашель, одышка, поражение легких) и лихорадка. Но вы когда-нибудь задумывались о том, что же происходит с остальными органами нашего тела? Так давайте разберём, как крошечный вирус может поражать не только дыхательную систему, но и вызвать повреждение других систем человеческого организма.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Партнеры номинации — медико-биологическая школа «Вита» и «Новая школа».
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
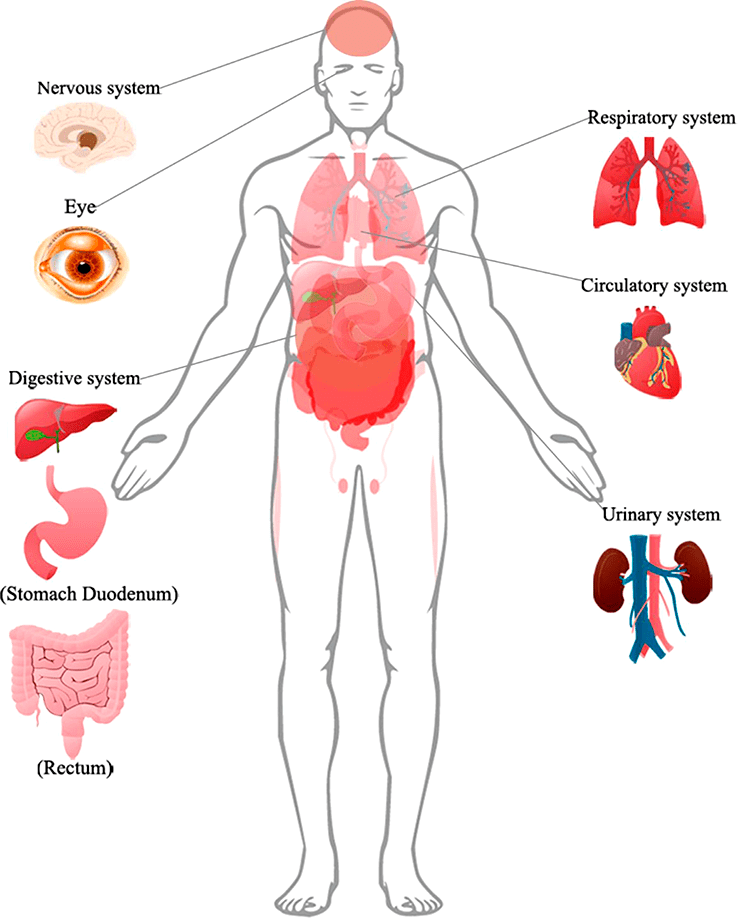
Согласно исследованиям немецких ученых, SARS-CoV-2 проникает внутрь организма с помощью клеточного рецептора — ангиотензинпревращающего фермента 2 (АПФ2; ACE2 — англ.), который специфически синтезируется в определенных органах и тканях. Соответственно, ACE2 играет важную роль в регуляции сердечно-сосудистой, кишечной, почечной и репродуктивной функций [1]. Попав в систему кровообращения, коронавирус, вероятнее всего, распространяется через кровоток [2]. Следуя этим данным, мы можем понять, как SARS-CoV-2 заражает не только дыхательную систему, но и представляет потенциальную угрозу для пищеварительной и мочеполовой систем, ЦНС и системы кровообращения.
Рисунок 1. Поражения органов, подтвержденные клиническими признаками или биопсией, у пациентов с COVID-19
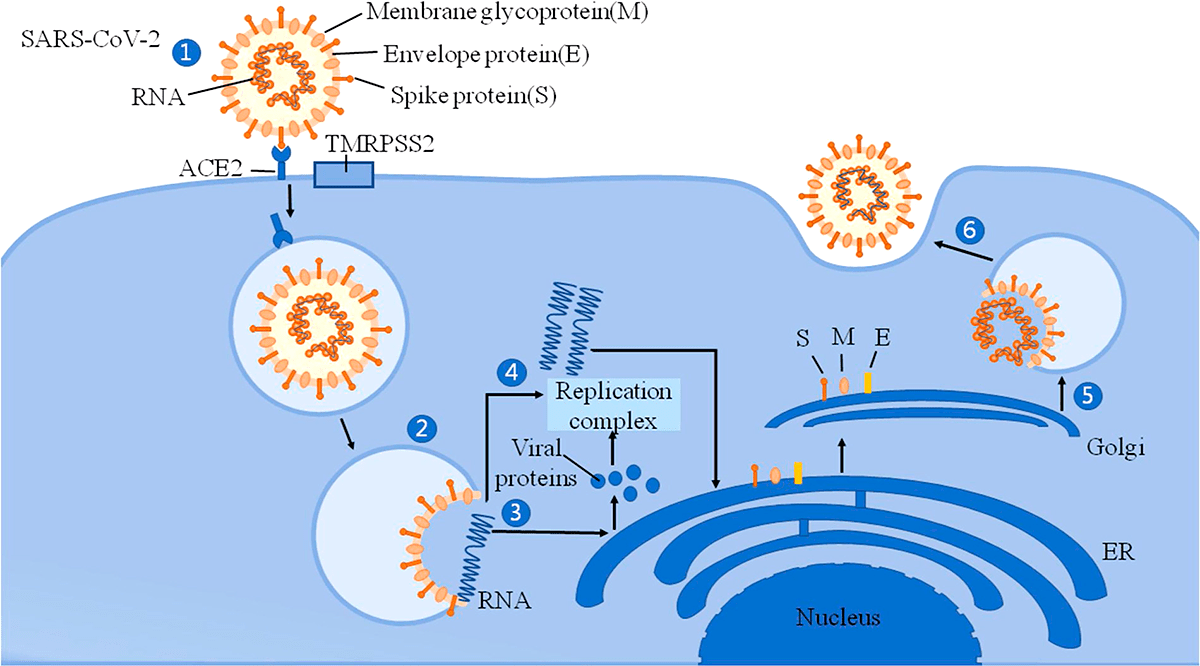
Рисунок 2. Механизм вторжения SARS-CoV-2 в клетку
SARS-CoV-2 и пищеварительная система
Помимо главного рецептора ACE2, SARS-CoV-2 использует трансмембранную сериновую протеазу 2 (TMRPSS2), фермент, который также экспонируется на эпителиальных клетках тонкой кишки. Он способствует проникновению вируса в клетки [3]. Активность SARS-CoV-2 может вызывать модификации ACE2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. ACE2 оказывает значительное влияние на состав кишечной микробиоты [4]. Первичные воспалительные стимулы вызывают высвобождение в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию.
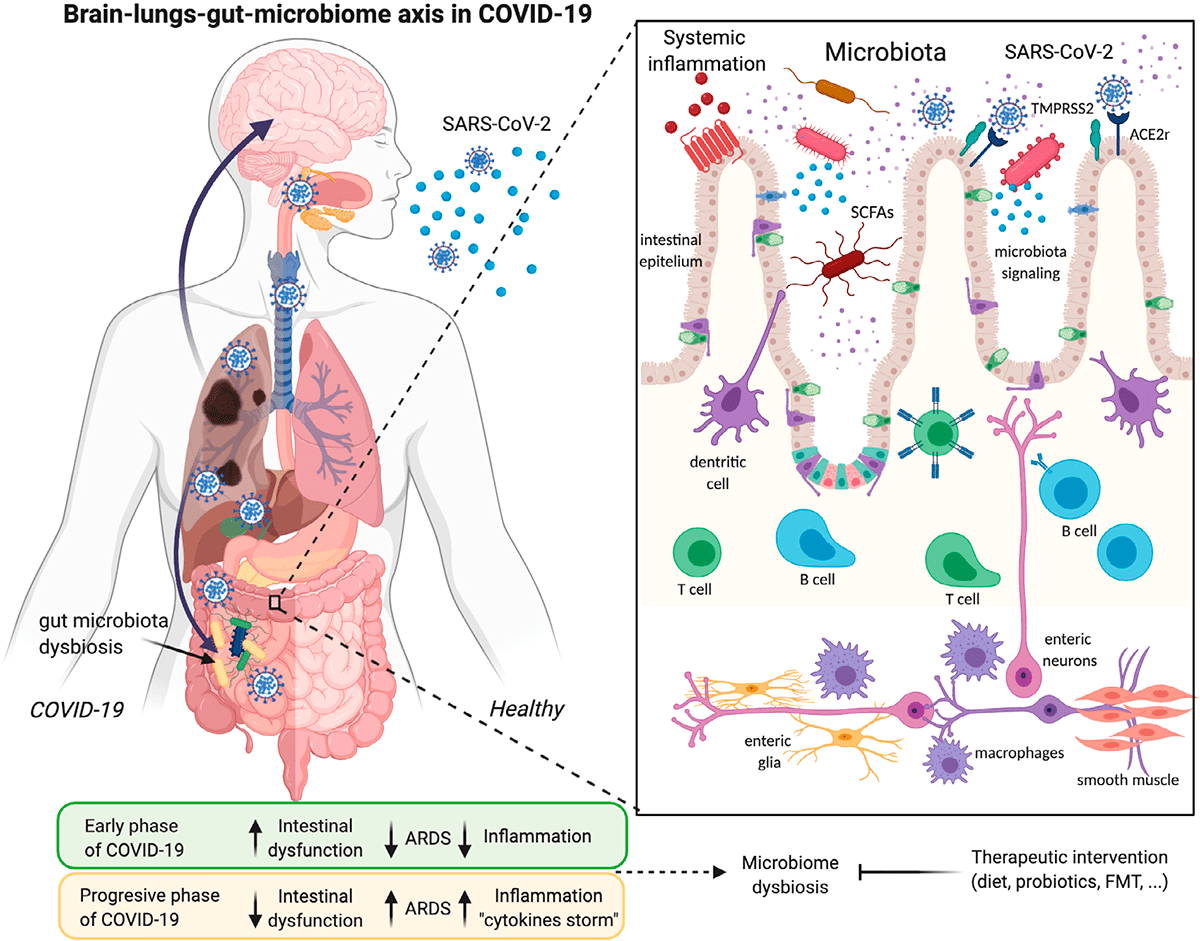
Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Наш микробиом меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна [5], [6]; во взрослом возрасте стабильна и разнообразна, а к пожилому возрасту разнообразие микробиоты уменьшается, а дисбиоз увеличивается, что связывают с когнитивным дефицитом, депрессией и воспалением [7]. Сниженное разнообразие микробиоты — еще один фактор риска заражения COVID-19 для пожилых людей.
Рисунок 3. Инфекция SARS-CoV-2 и ее связи с осью легких—кишечника—мозга и дисбиозом микробиома
Изменение кишечной флоры также связано с ожирением, еще одним фактором риска для тяжелого течения COVID-19 [8], [9]. Жировая ткань может служить резервуаром для распространения SARS-CoV-2 и активации системного иммунитета [10]. Коронавирусная инфекция вызывает изменения в кишечной бактериальной флоре, которые могут повлиять на ось «кишечник—мозг». Таким образом, кишечная флора играет решающую роль в регуляции неврологических функций, таких как депрессия или тревога [11].
Следовательно, режим питания играет значительную роль во время заражения вирусом SARS-CoV-2. Из-за вирусной инфекции иногда начинается дисбиоз, который может быть скомпенсирован компонентами диеты и пробиотиками [12]. Несколько исследований показывают, что оптимальный иммунный ответ зависит от правильного питания [13], [14]. Недоедание может поставить под угрозу иммунитет, тем самым влияя на уязвимость ответа на COVID-19. Потребление достаточного количества белка имеет решающее значение для выработки антител, поддержания ворсинчатой морфологии кишечника и уровня кишечного иммуноглобулина, что улучшает кишечный барьер [15–17]. Таким образом, высококачественные белки являются важным компонентом противовоспалительной диеты, которая включает омега-3 жирные кислоты, витамины С и Е, фитохимические вещества, которые широко присутствуют в продуктах растительного происхождения (фруктах, овощах, орехах, злаках и т.д.) [18–21]. Правильная диета укрепляет иммунную систему и способствует защите организма от тяжелого течения COVID-19.
SARS-CoV-2 и центральная нервная система (ЦНС)
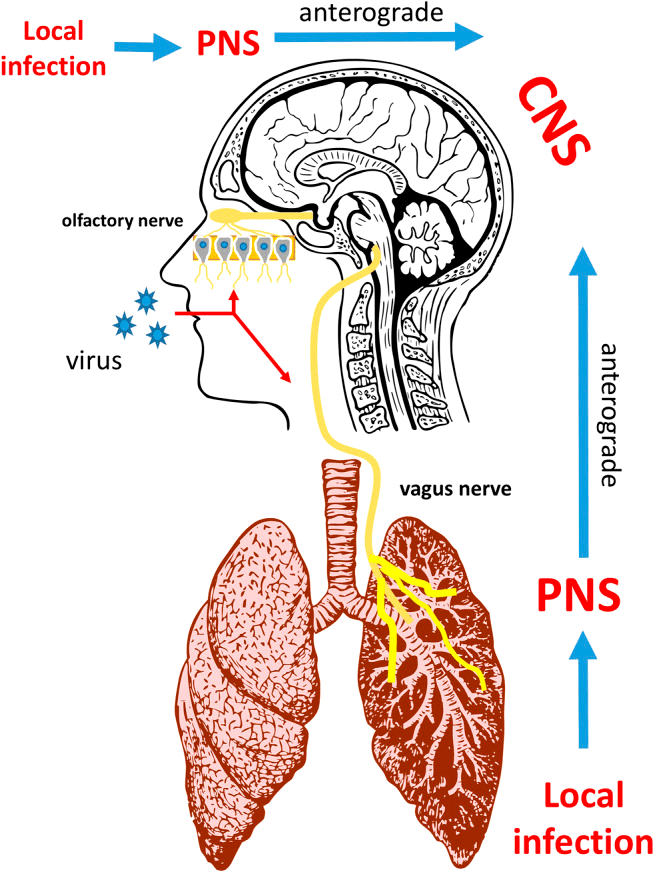
Кроме пищеварительной системы, коронавирусная инфекция (COVID-19) также затрагивает центральную и периферическую нервную систему. Неврологические проявления могут возникать по разным причинам, включая прямое вирусное поражение центральной нервной системы (ЦНС) и иммунноопосредованные процессы. Примеры заболеваний ЦНС при COVID-19 могут включать энцефалит (воспаление головного мозга), менингит и инсульт. В периферической нервной системе COVID-19 ассоциируется с дисфункцией обоняния и вкуса, повреждением мышц и синдромом Гийена—Барре, при котором иммунная система человека поражает собственные периферические нервы.
Рисунок 4. Коронавирусная инфекция и нервная система
Ученые Университета Гонконга отметили, что механизмы инфекции SARS-CoV-2 могут быть аналогичны механизмам инфекции SARS-CoV из-за 79,5% сходства последовательностей РНК этих двух коронавирусов [22]. Однако SARS-CoV-2 обладает более мощной способностью к распространению, чем SARS-CoV и MERS-CoV. Причина в том, что SARS-CoV-2 и ACE2 обладают более сильной связывающей способностью [23]. S-белок (спайк-белок) на поверхности коронавируса связывается с ACE2 и прикрепляется к поверхности клетки; затем сериновая протеаза (TMPRSS2) активирует S-белок, что помогает вирусу проникать в нейрон [1]. Так как клетки кровеносных сосудов экспонируют ACE2 в большом количестве, SARS-CoV-2 может атаковать эндотелиальные клетки в кровеносных сосудах головного мозга через этот рецептор и нарушить гематоэнцефалический барьер (ГЭБ — барьер между кровеносной системой и центральной нервной системой). Нарушенный ГЭБ может способствовать вторжению вируса в ткани мозга и нейроны и привести к серьезным неврологическим осложнениям [24].
SARS-CoV-2 и система кровообращения
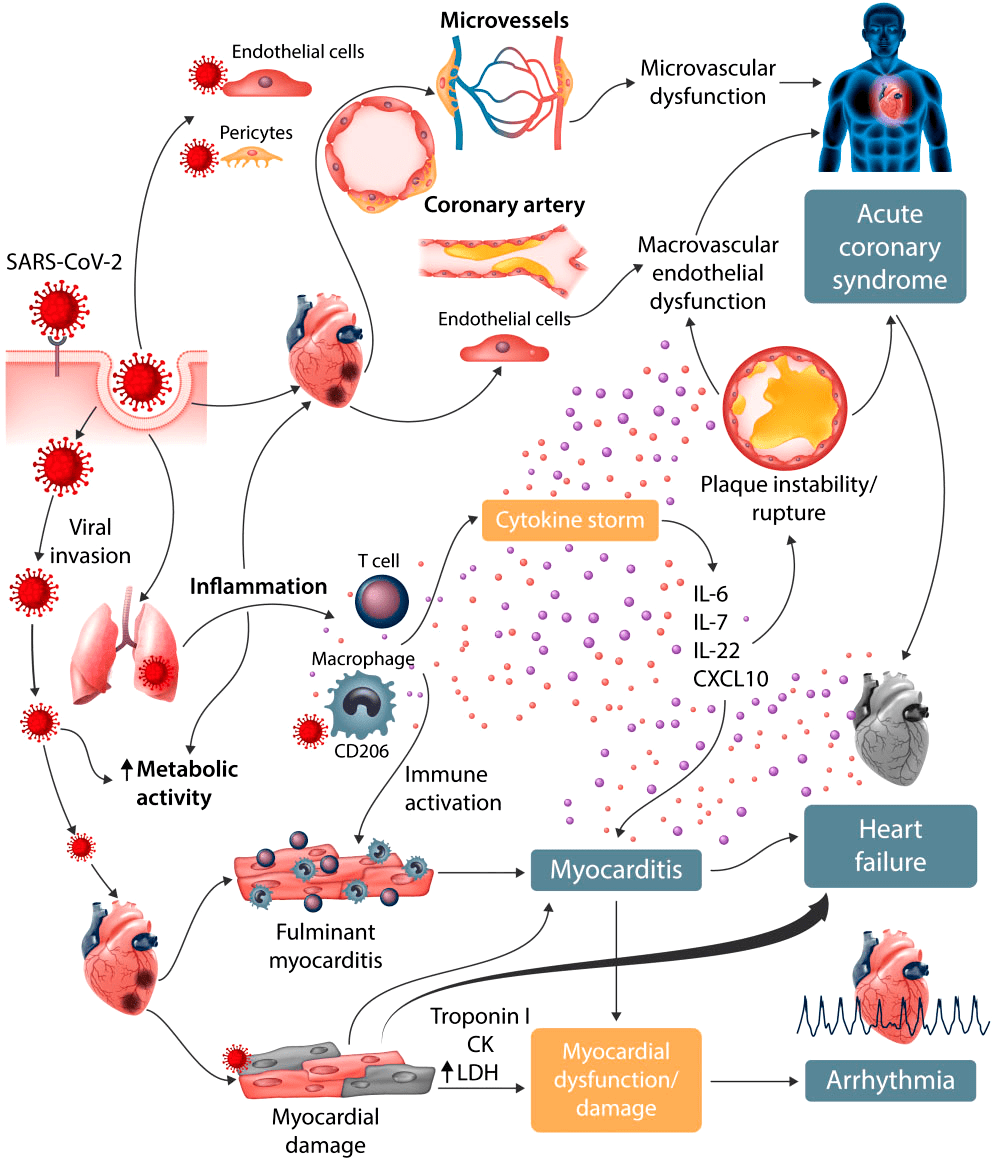
Помимо дыхательных путей, SARS-CoV-2 поражает сердечно-сосудистую систему. Это приводит к высвобождению высокочувствительных сердечных тропонинов (hs-cTnl) — белков, содержащихся в сердце и скелетных мышцах человека. В процессе заражения мембраносвязанный белок ACE2 может расщепляться трансмембранным дезинтегрином ADAM17, высвобождая ACE2 в кровоток. Таким образом, вирус циркулирует в крови зараженного организма. Воспаление сосудистой системы и миокарда может привести к миокардиту, сердечной недостаточности и быстрому ухудшению состояния больного [25].
Рисунок 5. Сердечно-сосудистое поражение при COVID-19
SARS-CoV-2 и мочеполовая система
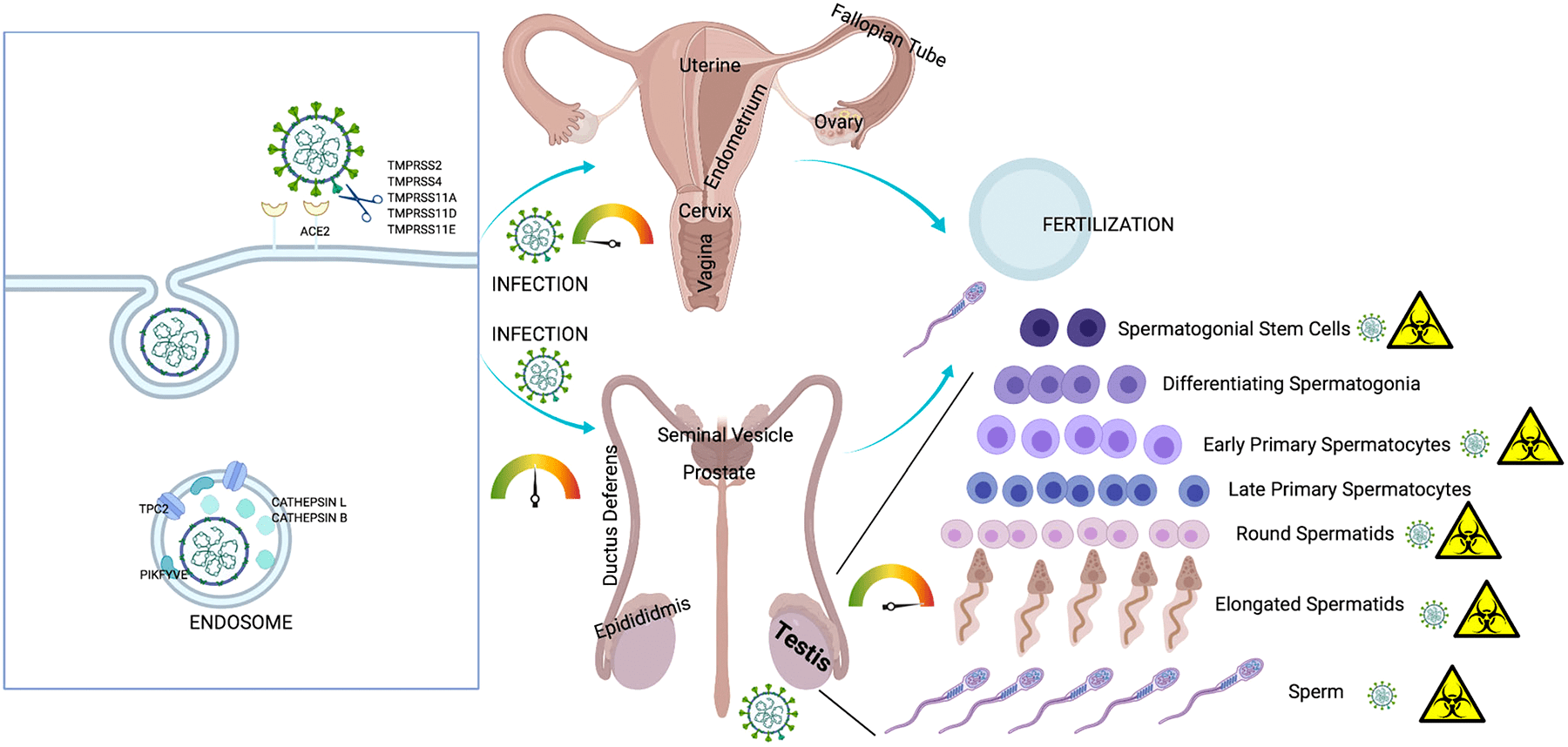
Инфекция репродуктивной системы требует большего внимания, потому что она не только влияет на нынешнее поколение, но также может распространяться на потомство через поврежденные гаметы. На сегодняшний день несколько исследований подтвердили влияние SARS-CoV-2 как на мужскую, так и на женскую репродуктивную систему [26], [27]. В настоящее время хорошо известен факт, что мужчины более восприимчивы к инфекции SARS-CoV-2 и у них выше уровень смертности, чем у женщин. Это объясняется тем, что клетки семенного протока и сперматогонии синтезируют много ACE2 [28–30].
По мнению ученых, SARS-CoV-2 нарушает репродуктивные функции мужчин через несколько механизмов, таких как воспалительные реакции, окислительный стресс и апоптоз [31–33]. Инфекция SARS-CoV-2 приводит к перепроизводству активных форм кислорода, которые могут усиливать внутриклеточные сигнальные пути (NF-κB-TLR). Это приводит к высвобождению цитокинов, что еще больше усиливает воспалительный ответ. К примеру, орхит, вызванный инфекцией SARS-CoV-2, может привести к окислительному стрессу в тканях яичка. Окислительный стресс может вызвать внутриклеточное окислительное повреждение сперматозоидов, что приводит к ухудшению их качества и мужскому бесплодию.
Рисунок 6. Инфекция SARS-CoV-2 и репродуктивная система
Рецепторы ACE2 были также обнаружены в женских яичниках [34], [35]. Можно предположить, что SARS-CoV-2 поражает ткань яичников и клетки гранулезы и таким образом ухудшает функцию яичников и жизнеспособность ооцитов, что может привести к бесплодию или невынашиванию [33]. Недавно ученые (Виванти и др.) сообщили о трансплацентарной передаче вируса от матери, инфицированной COVID-19, новорожденному. Мать была инфицирована в последнем триместре беременности, и гены SARS-CoV-2 были обнаружены в ткани плаценты. Согласно этому отчету, трансплацентарная передача может привести к воспалению плаценты [36]. Однако стоит отметить, что плацента имеет плацентарный барьер, который не смешивает кровь матери и плода, тем самым защищая плод от всех видов материнской инфекции. Невосприимчивые клетки плаценты обладают противовирусными свойствами, которые дополнительно предотвращают проникновение SARS-CoV-2 в клетки ребенка [37].
Вывод
Прочитав эту статью, мы с вами узнали, как вирус поражает не только дыхательную систему, но и другие системы человека. Это осложняет потенциальные клинические проявления и затрудняет лечение случаев COVID-19. Однако биомедицинские исследования могут помочь нам больше узнать о способностях нового коронавируса и о том, как с ним бороться, чтобы определить важные ориентиры для дальнейших исследований, диагностики и лечения. Также стоит всегда помнить, что соблюдая правильную диету и карантинные меры, мы снижаем риски заражения и ухудшения состояния здоровья во время COVID-19. Ведь вирус не всегда может вызвать вышеуказанные осложнения, если мы будем правильно заботиться о своем здоровье.
Чем лечить коронавирус? Новые ответы вирусолога
Ника Воюцкая
Почему одни вирусы остаются локальными, а другие — становятся причиной пандемии? Можно ли предсказать пандемию? Когда мы получим вакцину и лекарство — и как они будут работать? Корреспондент «СПИД.ЦЕНТРа» Ника Воюцкая узнала ответы на эти вопросы у петербургского вирусолога и исполняющего обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого Андрея Васина.
— Давайте повторим для читателя еще раз, что вообще из себя представляет новый коронавирус?
— Новый коронавирус — SARS-Cov-2 — представитель одного из многочисленных семейств РНК-содержащих вирусов человека и животных. Вирус — это упакованная молекула нуклеиновой кислоты (ДНК или РНК). Для размножения вирус должен попасть в клетки хозяина, а он, в свою очередь, сопротивляется и вырабатывает механизм защиты, который вирус пытается обойти.
— Причем вирусы эволюционируют быстрее, чем клеточные организмы.
— Да. В этом их преимущество. Организм хозяина (например, человека) так быстро эволюционировать не может, потому что устроен сложнее. Каждый раз, когда появляется новый вирус или новая разновидность уже известного вируса, организму нужно время, чтобы выработать защиту.
Вирус заразил клетку — клетка выработала защиту против вируса — вирус накопил определенное количество ошибок в геноме, и какие-то из них позволили вирусу обойти защиту клетки — вирус размножается дальше. Эволюция, с точки зрения вирусологии, — это история войны клеточных организмов с вирусами, в результате которой и те и другие меняются и приспосабливаются друг к другу.
— Если вирусы такие классные, почему мы, люди, до сих пор живы?
— Вирусу выгодно инфицировать клетку, но не убивать ее. Где он будет дальше размножаться? 1918 год. «Испанка», новый вирус, к которому не было популяционного иммунитета. 50 млн человек умерли за один эпидемический сезон. Кто-то выжил — и приобрел иммунитет к «испанке». На следующий год заболевание у переболевших прошло в гораздо более легкой форме — потому что появился иммунитет к вирусу. Резюме: когда новый вирус попадает в популяцию, смертность от него высокая (но для разных вирусов разная: может быть 1–2 %, может — 50 %). Проходит время, вирус и организм адаптируются друг к другу, что приводит к снижению тяжести заболевания и летальности.
— Спрошу сразу: когда нам ожидать лекарство от нового коронавируса?
— Разрабатывать новое лекарство очень сложно и долго. Если не говорить о препаратах, созданных методами генной инженерии, а о традиционных низкомолекулярных лекарствах — на это может уйти около десяти лет и несколько миллиардов долларов.
Поэтому вместо изобретения нового лекарства от COVID-19 исследователи делают repurposing of the drugs — испытывают против нового коронавируса уже известные препараты. На первых этапах проводят скрининг с помощью биоинформатики и компьютерного моделирования. Дальше — экспериментальная проверка.
Так можно пропустить целый этап проверки безопасности и токсичности. Ученым остается лишь доказать, что препарат эффективен при этом заболевании и именно при этом заболевании не вызовет побочных эффектов.
Сейчас испытывается множество таких лекарств — четыре наиболее перспективных выбрала ВОЗ, но, вообще, их гораздо больше. Китай испытывает все подряд, от новейших разработок до традиционной китайской медицины, — вдруг сработает? У них есть такая возможность.
— А как вообще лекарство от одного вируса может победить другой вирус?
— Возьмем «Калетру» (Лопинавир + Ритонавир) — ингибитор протеазы ВИЧ — и один из препаратов, исследуемых сейчас ВОЗ для лечения коронавируса. Идея вот в чем: у коронавируса тоже есть фермент протеаза. Вдруг ингибитор протеазы ВИЧ проингибирует и протеазу нового вируса? То же касается и ингибиторов полимеразы (Ремдезивир, Фавипиравир) — фермента, который позволяет вирусам реплицировать свой геном.
— «Калетра» в китайском рандомизированном контролируемом исследовании показала себя неэффективной. Пациентов было 199. Это окончательный результат?
— Пациенты — неоднородная масса людей, и у всех заболевание протекает по-разному. Опасность исследования с маленькой выборкой в том, что в него теоретически могли попасть именно те люди, для которых препарат оказался малоэффективным. Или наоборот. А большая выборка может показать, что для другой группы пациентов препарат сработает. Поэтому нужно больше исследований.
— Как работает Ремдезивир — еще одно потенциальное лекарство от коронавируса? Читаю, что это ингибитор РНК-зависимой РНК-полимеразы, но не понимаю, что это значит.
— Цепочка РНК вируса состоит из нуклеотидов: A, C, U и G. РНК-полимераза — вирусный фермент, который эту цепочку распознает и копирует. Если мы добавляем модифицированное основание, оно распознается полимеразой и автоматически добавляется к цепочке как обычный нуклеотид. Но новый нуклеотид к этой цепочке присоединиться уже не может. Или свойства этой цепочки нарушаются. Так мы блокируем РНК-полимеразу, и вирус больше не реплицируется.
— Пока самые обнадеживающие новости — о Хлорохине и Гидроксихлорохине. Французские ученые успешно провели клиническое исследование Гидроксихлорохина в лечении COVID-19. Можно говорить о победе?
— Это дает надежду, но выводы делать рано. Нужны исследования с большей выборкой. Разница между эффективностью плацебо и препарата оказалась достоверной, но в исследовании участвовали всего 36 человек. Эти препараты успешно лечат малярию, но как они себя поведут и какие побочные действия дадут при лечении коронавируса — пока неизвестно.
— Есть еще терапия антителами. Как она работает и когда ее ждать?
— Что такое антитело? Это молекула, которая вырабатывается клетками иммунной системы и нейтрализует вирус. Можно сделать его искусственно и ввести человеку, остановив тем самым распространение вируса. Подход старый: на заре вирусологии брали кровь переболевшего человека и вводили больному — иногда помогало, но давало много побочных эффектов. Сейчас антитела находят, выделяют, очищают и делают из них препарат.
Антитело, которые мы получаем в лаборатории, может эффективно нейтрализовать вирус. Но это большая белковая молекула, и она может быть токсичной, дать серьезные побочные эффекты или просто потерять активность. Можно не синтезировать антитело в лаборатории, а сделать так, чтобы сам организм его синтезировал.
Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Но можно предположить, что пожизненного иммунитета к нему не будет.
Для этого определяем генетическую последовательность, кодирующую антитело, и «записываем» ее в молекулу мРНК. Эту молекулу вводим в организм. Там уже внутри клетки происходит трансляция молекулы мРНК, и антитело синтезируется в «естественных» условиях.
То есть мы делаем молекулу «кода», вводим в организм — и организм расшифровывает «код» и сам производит антитела. Молекулы РНК меньше размером, чем молекулы белка, стабильнее, гомогеннее по структуре и проще в производстве, чем молекулы антитела, — в этом их преимущество.
До конца пандемии разработать эффективную антительную терапию от COVID-19, а тем более на основе мРНК точно не получится. Но есть надежда, что пандемия SARS-CoV-2 ускорит развитие противовирусных иммунобиотехнологий и произойдет технологический рывок. И это позволит человечеству подойти к новой пандемии более подготовленным, чем к пандемии SARS-CoV-2.
—Насколько, вообще, часто появляются новые вирусы?
— Глобальные, как SARS-CoV-2, — не так уж часто. Ближайшая к нам сходная пандемия — та самая «испанка» 1918 года. Новый коронавирус — вторая крупная пандемия современного мира, потенциально сравнимая с «испанкой» по масштабу и скорости распространения (но не по смертности). Есть пандемия ВИЧ — но она растянута во времени. Была пандемия свиного гриппа 2009 года, но не столь опасная: вызвана новым вариантом вируса гриппа, но все же гриппом, против которого уже были препараты и технологии производства вакцин.
— Почему одни вирусы остаются локальными, а другие вызывают пандемию? Коронавирусы SARS или MERS не привели к пандемии. А ведь это относительно недалекое прошлое, когда было и авиасообщение, и высокая плотность населения в городах.
— Дело, скорее, в биологических свойствах конкретного вируса, а не в свойствах популяции. Чтобы вирус широко распространился, у него должно одновременно совпасть несколько характеристик: специфичность к рецептору на клетке, распространенность этого рецептора, эффективность репликации в данном типе клеток и многое другое.
При этом быстро распространиться могут только те вирусы, которые передаются воздушно-капельным и контактным путем. Вирус Эбола передавался с инфицированными биологическими жидкостями — поэтому его получилось локализовать. SARS и MERS также не обладали набором свойств для быстрого глобального распространения. А в новом коронавирусе «удачные» для распространения свойства совпали.
— Можно ли предсказать пандемию?
— Какой из вирусов станет пандемическим и как он будет распространяться — нет, это процесс стохастический. Вирус быстро накапливает мутации, происходит изменение его характеристик и свойств. Это абсолютно случайный процесс, хотя и подверженный действию отбора. При этом было известно, что коронавирусы обладают пандемическим потенциалом, можно было ожидать, что один из них приведет к пандемии. Но невозможно было предсказать, когда это случится.
— Как определить, что вирус обладает пандемическим потенциалом?
— Новые вирусы человека не возникают ниоткуда — это зоонозный тип передачи: от летучих мышей, обезьян и кого угодно из животных, с кем у человека есть контакт. Если изучать вирусы, которые циркулируют среди животных, можно предположить, какие из них потенциально могут преодолеть межвидовой барьер и «перепрыгнуть» на человека. А они могут, если животное эволюционно близкое человеку (обезьяны) или у него есть общие гомологичные рецепторы (летучие мыши — панголины — человек).
Возьмем птичий грипп: высокопатогенный вирус гриппа птиц H5N1 преодолел межвидовой барьер. Но, к счастью, от человека к человеку не передавался. Вот если бы он мутировал так, что смог бы передаваться от человека к человеку, мы получили бы пандемию с очень высокой степенью летальности. Поэтому изучению гриппа птиц уделяют много внимания.
Так что есть постоянная угроза пандемии. Мы не можем предсказать ни время начала, ни источник, ни летальность. Это как с землетрясениями: может быть? Да. Повлиять или предсказать можем? Нет. Пандемия с высокой летальностью может случиться раз в сто лет, а может — раз в шестьсот. Или, может, через год будет новая.
— Будет ли иммунитет у тех, кто переболел новым коронавирусом?
— Коронавирусы человека не очень хорошо изучены: среди людей до настоящего времени встречались всего шесть представителей семейства. Четыре (OC43, HKU1, NL63 и 229E) вызывают обычные легкие респираторные инфекции и не были особо интересны исследователям. Еще два, SARS и MERS — вирусы атипичной пневмонии и ближневосточного респираторного синдрома, — изучались, но инфекции были ограниченными. Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Можно предположить, что раз этот вирус РНК-содержащий, то он является вариабельным, то есть быстро изменяющимся, — и пожизненного иммунитета к нему не будет. Скорее, длительность иммунитета будет как к гриппу, относительно короткой.
— Что будет, если те, кто переболел и выздоровел, заболеют снова? Статистика смертности от нового коронавируса значительно выше, чем от гриппа.
— Есть вероятность, что новый коронавирус станет сезонным и будет, как грипп, циркулировать и создавать ежегодные эпидемические вспышки. При этом чем дольше вирус будет циркулировать в популяции, чем больше людей переболеют им в первый раз, тем легче он будет переноситься. И тем ниже будет вероятность осложнений и смерти в результате заражения. Тогда уже можно будет сравнивать смертность от сезонного гриппа и сезонного коронавируса SARS-CoV-2.
Разработать вакцину быстро невозможно. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
«Пра-пра-прадедушкой» всех современных вирусов гриппа можно считать тот самый вирус «испанки» 1918 года. Со временем в результате мутаций и замен некоторых генов из него образовались циркулирующие в настоящее время вирусы гриппа А. Сначала «испанка» унесла жизни 50 млн человек, сейчас же смертность от гриппа относительно невысокая. Вирус «привык» к людям, иммунная система людей «привыкла» к вирусу. (Не стоит забывать и о вакцинации против гриппа!) Наше идеальное сосуществование с новым вирусом будет тогда, когда летальных случаев не будет, а еще лучше — не будет тяжелых случаев.
— Как быстро появится вакцина от SARS-CoV-2?
— Разработать вакцину быстро невозможно. Сейчас часто пишут, что с современными технологиями сделать новую вакцину можно быстро. Это не так. Что такое «разработать»? Сделать в лаборатории некую биологическую конструкцию, которая потенциально может защищать организм, — требует месяца-двух.
Но то, что создано in silico и получено в лаборатории, нужно испытать на животных. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
На этом этапе вакцину испытывают по двум направлениям. Первое — безопасность. Второе — насколько она защищает от вируса. Для этого нужно использовать релевантную животную модель вирусной инфекции — то есть сначала адаптировать новый вирус к организму подопытного животного. Иногда адаптировать вирус получается быстро и легко, иногда нет. При этом развитие инфекции в животном должно имитировать человеческое. Если вирус респираторный — то и у лабораторного животного болезнь должна поражать органы дыхания.
— Как разрабатывается сама вакцина, ее формула? Тот самый первый этап, который теперь можно сделать за месяц.
— Можно ослабить или инактивировать вирус — это традиционный подход, но сейчас мало кто так делает — все делают генно-инженерные вакцины (векторные, рекомбинантные, ДНК, РНК). Для этого нужна только последовательность генома вируса. Имея ее, мы понимаем, какие белки этот геном кодирует, что вот этот белок, например, — поверхностный, и на него должны образовываться антитела, и т.д. Берем фрагмент гена/ген целиком/несколько генов вируса, синтезируем и вставляем в генетическую конструкцию. Она будет кодировать вакцинный антиген и/или саму вакцину. Дальше — испытываем на животных.
— Хорошо, мы создали вакцину в пробирке. Потом адаптировали вирус под животное, ввели ему вакцину, заразили, вакцина подействовала. Это заняло 7 месяцев. Что дальше? Уже можно вакцинировать людей?
— Пока нет. Следующая стадия — проверка безопасности на людях: находим здоровых добровольцев и вводим им вакцину. Если побочных реакций нет, испытываем вакцину на людях, которые могут заразиться этим вирусом. Стадия клинических исследований может длиться год, два, три… Но и это не все.
Если клинические исследования прошли успешно, нужно зарегистрировать вакцину и привить, скажем, 40 млн человек. Для этого нужно произвести 40 миллионов доз. Что может оказаться даже более сложной задачей, чем разработка самой вакцины. И только когда мы прошли путь от идеи до миллионов привитых, можно сказать: «Мы создали вакцину». В случае пандемии, когда все что можно упрощается и есть готовые производственные мощности, этот путь может занять полтора-два года. И это самый оптимистичный прогноз.