rass 4 балла что такое
NSICU.RU neurosurgical intensive care unit
сайт отделения реанимации НИИ им Н.Н. Бурденко
Курсы повышения квалификации
Внутричерепная гипертензия
Асинхронии и графика ИВЛ
Водно-электролитные
нарушения
в нейрореанимации
Книга «Основы ИВЛ»
Рекомендации
по интенсивной терапии
у пациентов
с нейрохирургической патологией
Статьи → Шкала оценки тяжести дыхательной недостаточности у нейрохирургических пациентов.
Абстракт
Введение
Абсолютными показаниями для начала ИВЛ у нейрохирургических пациентов являются: коматозное состояние, эпилептический статус, гипоксемия, гиперкапния или гипокапния. В клинической практике нередко ИВЛ начинается до формирования абсолютных показаний на основании экспертной оценки лечащих врачей. Для объективизации показаний к ИВЛ была создана шкала оценки тяжести дыхательной недостаточности (ДН). Шкала состоит из трех блоков, оценивающих уровень сознания, выраженность нарушений глотания, кашля, проходимости дыхательных путей и степень паренхиматозного повреждения легких. По созданной шкале 4 и более баллов является показанием к ИВЛ. Разработанная шкала была апробирована в клинических условиях.
Материалы и методы
Апробация шкалы проводилась в период с декабря 2009 по март 2010 года. При тотальной выборке пациентов в соответствии с выбранными критериями включения и исключения в исследование вошло 15 пациентов. Из них было 8 женщин (53%) и 7 мужчин (47%). Возраст пациентов 25 – 68 лет, медиана 42 года. В 7 наблюдениях были аневризмы сосудов головного мозга, у 8 пациентов – опухоли головного мозга различной локализации и гистологии. Эти пациенты оценивались по шкале, но показания к ИВЛ определяли лечащие врачи, не владевщие шкалой.
Результаты
Выводы
Введение
По данным современной литературы, абсолютными показаниями к началу ИВЛ являются [2,3,10,19,28,31]:
Шкала создана для прикроватной оценки тяжести ДН и принятия решения о необходимости начала ИВЛ. Шкала состоит из трех блоков.
Первый блок включает в себя оценку нарушений сознания. Для оценки степени психомоторного возбуждения и уровня седации мы использовали шкалу RASS (Ричмондская шкала оценки ажитации и седации), которая специально была создана для этих целей 15.
Таблица 2
RASS: Ричмондская шкала оценки ажитации и седации.
| +4 | Пациент агрессивен | Пациент агрессивен, возникают эпизоды выраженного психомоторного возбуждения, возможно нанесение физического ущерба медицинскому персоналу |
| +3 | Выраженная ажитация | Пациент агрессивен, удаляет катетеры, зонды, дренажи, трубки |
| +2 | Ажитация | Частая нецеленаправленная двигательная активность, «борьба» с респиратором при проведении ИВЛ |
| +1 | Беспокойство | Пациент беспокоен, иногда испуган, но неагрессивен, а двигательная активность не имеет деструктивной направленности |
| 0 | Спокойствие и внимательность | |
| -1 | Сонливость | Не достаточно внимателен, пробуждается на оклик отсроченно: открывает глаза, фиксирует взор более 10 секунд |
| -2 | Легкая седация | Пробудим на оклик (открывает глаза, но фиксирует взор менее 10 секунд) |
| -3 | Умеренная седация | Двигательная активность или открывание глаз в ответ на оклик без фиксации взора |
| -4 | Глубокая седация | Нет реакции на оклик, но двигательная активность или открывание глаз на проприоцептивные и ноцицептивные раздражители |
| -5 | Отсутствие пробуждения | Нет реакции ни на оклик, ни на проприоцептивные и ноцицептивные раздражители |
Для оценки уровня угнетения сознания мы использовали критерии, описанные в литературе [35]:
Второй блок содержит в себе критерии оценки нарушений глотания, кашля и проходимости дыхательных путей. Оценка критериев выполняется в упрощённом виде по принципу нарушен/сохранен:
Особую группу составляют пациенты, набравшие 4 балла только за счет второго блока шкалы (нарушнений глотания, кашля и проходимости дыхательных путей), но не имеющие нарушений сознания, снижения индекса рО2/FiО2 и изменения механики дыхания. Такие пациенты могут быть переведены на спонтанное дыхание после обеспечения надёжной проходимости дыхательных путей и защиты от аспирации (трахеостомия с использованием трубки с герметизирующей манжеткой). Для выделения этой группы с 2006 года в Институте успешно применяется шкала бульбарных нарушений [1]. Этим пациентам выполняется трахеостомия, после чего они проходят реабилитацию на спонтанном дыхании с использованием трахеостомических трубок с герметизирующими манжетками.
Шкала составлена таким образом, что каждый из 3 блоков начинается критериями нормы: ясное сознание, сохраненные глотание, кашель и проходимость дыхательных путей, индекс рО2/FiО2 более 300. Здоровый человек по этой шкале будет иметь 0 баллов. Заканчиваются блоки критериями, характеризующими крайнюю выраженность патологического состояния: коматозное состояние или глубокая седация, отсутствие проходимости дыхательных путей и индекс рО2/FiО2 менее 200. Изолированно каждое из этих состояний является абсолютным показанием для начала ИВЛ [2,3,10,19,28,31]. Однако между нормой и абсолютными показаниями для начала ИВЛ существует множество промежуточных клинических состояний, когда у пациента развивается сочетание различной выраженности нарушений сознания, глотания, кашля, проходимости дыхательных путей и паренхиматозного повреждения легких. У таких пациентов показания для начала ИВЛ устанавливаются лечащим доктором на основании его личного опыта. Созданная нами шкала разработана для объективизации показаний к началу ИВЛ. Так, если пациент имеет суммарную оценку по шкале 4 и более баллов, то он нуждается в проведении ИВЛ. При ожирении пациента ухудшается функция дыхания [18], поэтому при индексе массы тела более 30 общая сумма баллов по шкальной оценке увеличивается на 1 балл.
Шкала оценки тяжести ДН у нейрохирургических больных создана для динамической оценки выраженности ДН у этих пациентов, последовательности развития нарушения сознания, глотания, кашля, проходимости дыхательных путей и паренхиматозного повреждения легких, а также для возможности оценки эффективности проводимой терапии
Целью второго, проспективного, этапа проведенного исследования явилась апробация созданной шкалы. Этот этап соответствовал критериям обсервационного исследования. Набор пациентов производился в период с декабря 2009 года по март 2010 года в соответствии с критериями включения и исключения пациентов. Критериями включения были:
Критериями исключения были:
После прекращения респираторной поддержки все эти пациенты были оценены лечащими врачами как «пациенты, требующие наблюдения в отделении реанимации и/или проведения интенсивной терапии». По газовому составу артериальной крови все пациенты после экстубации были компенсированы: pO2>60 мм.рт.ст, pCO2 30–50 мм.рт.ст, индекс рО2/FiО2>200.
Оценка по созданной шкале всех включенных в исследование пациентов после экстубации была более 1 балла (Таблица 3). При помощи КТ-исследования головного мозга была исключена нейрохирургическая патология, требующая экстренных вмешательств. Решения о реинтубации и возобновлении ИВЛ принимались лечащими врачами отделения, которые не участвовали в создании этой шкалы и которые не знали результатов балльной оценки состояния пациентов. Это позволило минимизировать влияние получаемых результатов оценки пациентов по созданной шкале на определение дальнейшей терапевтической тактики. Оценка по шкале производилась каждые 6 часов и каждый раз при ухудшении состояния. Однако для облегчения восприятия материала в таблицах 3,4 приведена сумма баллов приведена на этапах изменения лечебной тактики. Значение А: при пролонгировании наблюдения пациента в отделении реанимации в связи с нестабильным состоянием (оценка по шкале > 1 балла), но при отсутствии абсолютных показаний для экстренной реинтубации и возобновления ИВЛ; значение В – перед реинтубацией в случае развития абсолютных показаний или экспертного мнения лечащего доктора при отсутствии абсолютных показаний для начала ИВЛ; или при переводе пациента из отделения реанимации в нейрохирургическое отделение; значение С (у пациентов с реинтубацией) – после повторной экстубации; значение D – перед повторной реинтубацией или при переводе в нейрохирургическое отделение.
Таблица 3
Характеристика проспективной группы: демографические данные, диагноз, количество экстубаций и реинтубаций, длительность ИВЛ, осложнения и исходы.
Примечания. 1 – Приведена сумма баллов по шкале. Оценка производилась в динамике несколько раз. Значение А: сумма баллов при пролонгировании наблюдения пациента в отделении реанимации в связи с нестабильным состоянием (оценка по шкале > 1 балла), но при отсутствии абсолютных показаний для экстренной реинтубации и возобновления ИВЛ; Значение В – перед реинтубацией в случае развития абсолютных показаний или экспертного мнения лечащего доктора при отсутствии абсолютных показаний для начала ИВЛ; или при переводе пациента из отделения реанимации в нейрохирургическое отделение; Значение С (у пациентов с реинтубацией) – после повторной экстубации; Значение D – перед повторной реинтубацией или при переводе в нейрохирургическое отделение.
П/о – после операции. ПМА – передняя мозговая артерия. ПСА – передняя соединительная артерия. ЗМА – задняя мозговая артерия.
ХОБЛ – хроническая обструктивная болезнь легких.
Таблица 4
Динамика балльной оценки пациентов по шкале тяжести дыхательной недостаточности.
| Пациенты | Оценка тяжести ДН в динамике. | Нарушения глотания | Индекс рО2/FiО2 | Шкала RASS | Ожирение | Общая оценка |
| 1 | A | 2 | 0 | 1 | 0 | 3 |
| B | 3 | 2 | 3 | 0 | 8 | |
| 2 | A | 2 | 1 | 1 | 1 | 5 |
| B | 3 | 2 | 1 | 1 | 7 | |
| 3 | A | 0 | 3 | 0 | 0 | 3 |
| B | 0 | 2 | 0 | 0 | 2 | |
| 4 | A | 2 | 2 | 1 | 0 | 5 |
| B | 2 | 3 | 3 | 0 | 8 | |
| C | 2 | 0 | 0 | 0 | 2 | |
| 5 | A | 0 | 2 | 1 | 0 | 3 |
| B | 0 | 0 | 1 | 0 | 1 | |
| 6 | A | 0 | 2 | 0 | 1 | 3 |
| B | 0 | 1 | 0 | 1 | 2 | |
| 7 | A | 0 | 1 | 2 | 0 | 3 |
| B | 0 | 1 | 0 | 0 | 1 | |
| 8 | A | 0 | 1 | 2 | 0 | 3 |
| B | 0 | 0 | 2 | 0 | 2 | |
| 9 | A | 0 | 2 | 1 | 0 | 3 |
| B | 0 | 1 | 1 | 0 | 2 | |
| 10 | A | 0 | 1 | 2 | 0 | 3 |
| B | 3 | 3 | 3 | 0 | 9 | |
| 11 | A | 3 | 1 | 0 | 0 | 4 |
| B | 3 | 1 | 2 | 0 | 6 | |
| C | 2 | 1 | 0 | 0 | 3 | |
| 12 | A | 0 | 3 | 1 | 0 | 4 |
| B | 0 | 4 | 2 | 0 | 6 | |
| C | 0 | 3 | 2 | 0 | 5 | |
| D | 0 | 4 | 3 | 0 | 7 | |
| 13 | A | 0 | 0 | 2 | 0 | 2 |
| B | 0 | 0 | 1 | 0 | 1 | |
| 14 | A | 3 | 4 | 3 | 0 | 10 |
| B | 3 | 4 | 3 | 0 | 10 | |
| C | 3 | 2 | 3 | 0 | 8 | |
| D | 3 | 4 | 3 | 0 | 10 | |
| 15 | A | 3 | 0 | 0 | 0 | 3 |
| B | 3 | 0 | 0 | 0 | 3 |
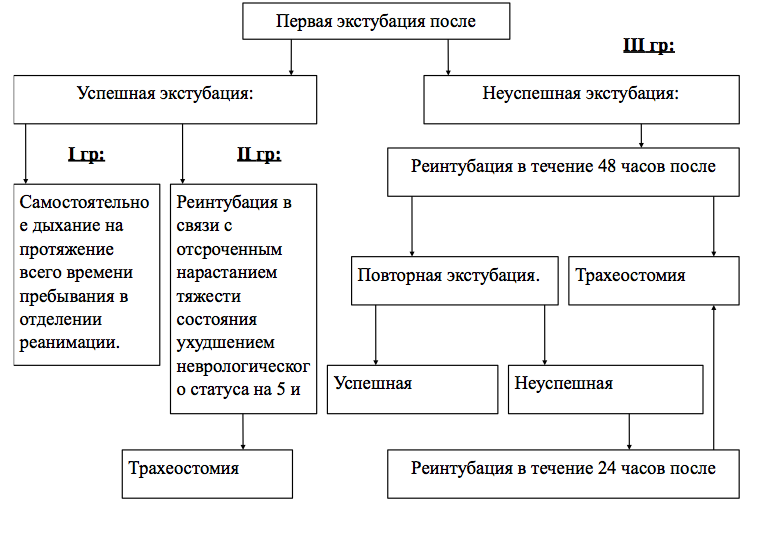
Результаты исследования и их обсуждение
Распределение пациентов на втором, проспективном, этапе исследования.
I группа
Пациенты I группы находились в отделении реанимации в течение 8,4±4,6 суток (m±sd), у них не развивалось пневмонии. По шкале исходов Глазго (ШИГ) при выписке из Института 5 баллов было у трех пациентов (наблюдения 3,6,7), 4 балла – у 4 пациентов (наблюдения 5,8,9,13) и 3 балла – в наблюдении 15.
Таким образом, пациенты, у которых в течение всего времени пребывания в отделении реанимации сумма баллов по созданной шкале не превышает 3 баллов, не нуждаются в реинтубации трахеи и возобновлении ИВЛ и имеют благопрятные исходы. Тяжесть ДН у них определяется преимущественно изменением уровня сознания и снижением индекса рО2/FiО2. У подавляющего большинства этих пациентов не выявлялось нарушений глотания, кашля, проходимости дыхательных путей.
Наиболее тяжелым наблюдением этой группы было 15 наблюдение.
Пациентка Б, 29 лет, поступила в Институт с диагнозом: Нейрофиброматоз II типа, двусторонние невриномы слуховых нервов и состояние после удаления опухолей в 2003, 2004, 2009 годах. До операции пациентка была в ясном сознании. Выявлялась глухота с двух сторон, онемение лица и снижение роговичных рефлексов с двух сторон, парез лицевого нерва, больше справа, множественный нистагм и шаткость походки, бульбарные нарушения. Сопутствующей соматической патологии выявлено не было. Во время операции произведено удаление невриномы VIII нерва слева без осложнений. В связи с нарастанием стволовой симптоматики в виде отсутствия глоточного и угнетения кашлевого рефлексов (нет реакции на интубационную трубку) ИВЛ проводилась в течение последующих 6 суток. Обращало на себя внимание отсутствие скопления слюны в полости рта. Затем пациентка была удачно экстубирована. Она не могла проглотить тестовый болюс в виде 5 мл воды, у нее не было кашля (3 балла по шкале), но в полости рта не было скопления слюны, то есть пациентка сглатывала слюну. Мы предполагаем, что это связано с развитием компенсаторных механизмов защиты верхних дыхательных путей у пациентов с длительно существующим воздействием на бульбарную группу черепно-мозговых нервов. Кроме этого, у пациентки не было паренхиматозного повреждения легких, и выявлялся высокий уровень бодрствования, адекватное сотрудничество с медицинским персоналом.
Пациентка оставалась в отделении реанимации в течение 6 суток для интенсивного наблюдения за ней. На 22 сутки после операции она была выписана из Института в ясном сознании, без двигательного дефицита, но требовала постоянного ухода за собой в связи с общей тяжестью своего состояния.
II группа
Эту группу составили два пациента. Они были успешно экстубированы, но в дальнейшем, на 5 – 7 сутки, потребовали возобновления ИВЛ (наблюдения 1,10). Причина заключалась в ухудшении состояния, стремительном угнетении сознания до сопора и нарастании бульбарных нарушений. Оба пациента были трахеостомированы. Сумма баллов до ухудшения состояния составляла 3 балла (Таблица 3,4). Тяжесть ДН в этих наблюдениях была обусловлена двумя составляющими шкалы (Таблица 4). Из этого следует, что эти пациенты до ухудшения их состояния находились на грани компенсации своих дыхательных функций. При стремительном ухудшении состояния сумма баллов по шкале быстро достигла 8 и 9 баллов, соответственно. На этом этапе лечащие врачи незамедлительно возобновляли ИВЛ.
Пациенты II группы находились в отделении реанимации в течение 62 и 78 суток. В наблюдении 10 развилась пневмония вследствие аспирации, произошедшей во время ухудшения состояния. По шкале исходов Глазго (ШИГ) она при выписке имела 3 балла В наблюдении 1 пациентка скончалась на фоне менингоэнцефалита (Таблица 3).
Пациентка С (наблюдение 10), 25 лет, поступила в Институт с диагнозом интра-экстра-вентрикулярная краниофарингиома. При поступлении выявлялся хиазмальный синдром и гипопитуитаризм. Через 5 часов после операции пациентка была экстубирована. Она оставалась в сознании, повторялись эпизоды психомоторного возбуждения, требовавшие использования седативных препаратов. Выявлялись гормональные и гомеостатические нарушения, которые удавалось корригировать методами интенсивной терапии. По нашей шкале суммарная оценка составила 3 балла – RASS +2/-2 и индекс рО2/FiО2=272. Состояние оставалось стабильным в течение последующих 6 суток. На 7 сутки состояние ухудшилось. Развилось сопорозное состояние, появились нарушения глотания и кашля, возникла аспирация, приведшая к снижению индекса рО2/FiО2. Оценка по шкале составила 9 баллов. Пациентка была незамедлительно реинтубирована и на 2 сутки трахеостомирована. Ухудшение состояния было связано с ишемическим повреждением диэнцефальной области, поскольку ведущим при ухудшении был диэнцефальный синдром. На фоне проводимой интенсивной терапии состояние было стабилизирована. Пациентка была переведена из отделения реанимации на 39 сутки, деканулирована – на 47 сутки после трахеостомии, а ваписана из Института – на 78 сутки после операции. По ШИГ у пациентки было 3 балла.
III группа
Эту группу составили 5 пациентов (33%) (наблюдения 2,4,11,12,14). Это пациенты с неуспешной экстубацией, то есть те наблюдения, в которых реинтубация и возобновление ИВЛ были произведены в течение 48 часов после экстубации. У всех пациентов этой группы сразу после экстубации сумма баллов по нашей шкале составила 4 и более баллов. В отличие от пациентов, которые не требовали начала ИВЛ во время нахождения в отделении реанимации, у этих пациентов тяжесть была обусловлена двумя (наблюдения 11,12) или тремя (наблюдения 2,4,14) составляющими нашей шкалы. У 4 из 5 пациентов выявлялись нарушения глотания и кашля. Это говорит о том, что эти нарушения являются более тяжелыми и, вероятно, прогностически более неблагоприятными, чем изменения уровня сознания и снижение индекс рО2/FiО2 [11,14,21,22,23,24,29,30,32,33]. Однако лечащими врачами осуществлялась выжидательная тактика. В результате до реинтубации пациенты дышали самостоятельно в течение 9,8±8,6 часов (Таблица 3).
4 пациентов были экстубированы во второй раз (наблюдения: 4,11,12,14). Успешной была повторная экстубация у двух пациентов (наблюдения 4,11). В этих наблюдениях суммарная оценка по шкале составила 2 и 3 балла, соответственно. Пациенты были переведены в нейрохирургическое отделение на самостоятельном дыхании. У оставшихся двух пациентов и повторная экстубация оказалась неуспешной (наблюдения 12,14). При этом оценка по шкале составила 5 и 8 баллов, соответственно. Первый пациент был реинтубирован через 1,5 часа после экстубации, а второй – через 48 часов. Оба эти пациента были трахеостомированы.
Длительность нахождения в отделении реанимации пациентов III группы составила 30,6±25,1 суток (m±sd). У 3 из 5 (60%) пациентов развивалась пневмония, а у 1 – сепсис. По шкале исходов Глазго (ШИГ) 4 балла было у 2 пациентов (наблюдение 4,11), 3 балла – у 2 пациентов (наблюдение 12,14), по ШИГ 1 балл – в 1 случае (наблюдение 2). Вероятно, исходы в III группы могли бы быть улучшены при своевременной реинтубации трахеи, что позволило бы избежать тяжелых инфекционно-воспалительных и септических осложнений. По данным литературы, нозокомиальная пневмония развивается вследствие аспирации при несвоевременной реинтубации трахеи у неуспешно эсктубированных пациентов [11,12,13,14,16,32].
Типичным пациентом этой группы является наблюдение 12.
Пациент Г, 31 год, поступил в Институт с диагнозом аневризма ПМА-ПСА справа, спонтанное субарахноидальное кровоизлияние с прорывом в желудочковую систему. При поступлении тяжесть состояния по шкале Хант-Хесс – III. Аневризма клипирована на 2 сутки после кровоизлияния. Послеоперационный период осложнился развитием ангиоспазма. В связи с этим проводилась пролонгированная седация и ИВЛ в течение 8 суток. Затем пациент экстубирован. По нашей шкале суммарная оценка составила 4 балла за счет снижения индекса рО2/FiО2 и умеренного беспокойства. Пациент был оставлен на самостоятельном дыхании. Постепенно нарастала тяжесть ДН, и через 3 часа пациент стал ажитированным, а индекс рО2/FiО2 снизился менее 200. Пациент был реинтубирован. Далее в течение последующих 6 суток проводилась ИВЛ через оротрахеальную трубку. Рентгенологически выявлялись прикорневые инфильтративные изменения, более выраженные справа. Пациент вновь был экстубирован на 7 сутки, суммарная оценка по шкале составила 5 баллов. Однако и в этот раз пациент был реинтубирован только через 1,5 часа, когда индекс рО2/FiО2 вновь снизился ниже 200 и появилась выраженная ажитация с агрессией (суммарная оценка – 7 баллов). ИВЛ через оротрахеальную трубку продолжалась еще 2 суток. Затем была выполнена трахеостомия. В дальнейшем у пациента развилась тяжелая ацинетобактерная пневмония и сепсис. В гемокультурах был также веделен ацинетобактер. На фоне проводимой интенсивной терапии удалось стабилизировать состояние. Пациент был переведен из отделения реанимации на 51 сутки, деканулирован на 53 сутки после трахеостомии, выписан из Института – на 65 сутки. По ШИГ – 3 балла.
Ранняя диагностика и интенсивная терапия острого респираторного дистресс-синдрома у пациентов с тяжелыми пневмониями вирусно-бактериальной этиологии
Общая информация
Краткое описание
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
01.06.2017 № 48
КЛИНИЧЕСКИЙ ПРОТОКОЛ
«Ранняя диагностика и интенсивная терапия острого респираторного дистресс-синдрома у пациентов с тяжелыми пневмониями вирусно-бактериальной этиологии»
1. Настоящий Клинический протокол устанавливает общие требования к ранней диагностике и интенсивной терапии острого респираторного дистресс-синдрома у пациентов старше 18 лет (далее – пациенты) с тяжелыми пневмониями вирусно-бактериальной этиологии в стационарных условиях:
синдром респираторного расстройства (дистресса) у взрослого (шифр по Международной статистической классификации болезней и проблем, связанных со со здоровьем, десятого пересмотра (далее – МКБ-10) – J80).
2. Требования настоящего Клинического протокола являются обязательными для юридических лиц, осуществляющих медицинскую деятельность в порядке, установленном законодательством Республики Беларусь.
3. Для целей настоящего Клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь от 18 июня 1993 года «О здравоохранении» (Ведамасці Вярхоўнага Савета Рэспублікі Беларусь, 1993 г., № 24, ст. 290; Национальный реестр правовых актов Республики Беларусь, 2008 г., № 159, 2/1460) а также следующие термины и их определения:
искусственная вентиляция легких (далее – ИВЛ) – способы обеспечения газообмена между легкими и окружающим воздухом (или специально подобранной смесью газов);
кинетическая терапия – регулярное изменение положения тела пациента, а именно: поворачивание пациента на левый, правый бок, на живот, что обеспечивает перемещение легочного кровотока и улучшение вентиляции тех зон легких, которые остаются гиповентилируемыми в положении пациента на спине;
маневр открытия альвеол (рекрутмент) – временное повышение давления и (или) объема в дыхательных путях в целях открытия коллабированных альвеол с дальнейшим поддержанием их в раскрытом состоянии в течение всего дыхательного цикла с помощью положительного давления в конце выдоха (далее – ПДКВ);
нутритивная поддержка – комплекс мероприятий, направленный на обеспечение относительно устойчивого трофического гомеостаза у пациента с помощью ряда методов, отличных от обычного приема пищи, включающих в себя энтеральное и парентеральное питание или их комбинацию;
острая дыхательная недостаточность (далее – ОДН) – остро развившееся несоответствие уровня газообмена (внешнего дыхания) метаболическим потребностям организма пациента;
острый респираторный дистресс-синдром (далее – ОРДС) – острое, диффузное, воспалительное поражение легких, ведущее к повышению проницаемости сосудов легких, повышению массы легких и уменьшению аэрации легочной ткани;
отлучение от искусственной вентиляции легких – процесс постепенного отключения пациента от аппарата, осуществляющего искусственную вентиляцию легких и переход на полностью спонтанное дыхание;
пневмония – острое инфекционное заболевание легких, характеризующееся очаговым поражением респираторных отделов с внутриальвеолярной экссудацией;
пневмония тяжелого течения – особая форма острого инфекционного заболевания легких, которая проявляется тяжелым интоксикационным синдромом, гемодинамическими изменениями, выраженной дыхательной недостаточностью и (или) признаками тяжелого сепсиса, септического шока, характеризуется неблагоприятным прогнозом и требует лечения в условиях отделений анестезиологии и реанимации (далее – ОАР), включая палаты интенсивной терапии, больничных организаций, осуществляющих реанимацию и интенсивную терапию;
продленная заместительная почечная терапия (далее – ПЗПТ) – метод экстракорпоральной детоксикации, направленный на удаление водорастворимых соединений, накапливающихся в организме при нарушении функции почек, при котором технические средства для элиминации токсинов подключаются на срок, превышающий стандартные режимы (свыше 6–8 часов);
прон-позиция – укладывание пациента, находящегося на ИВЛ, на живот, что обеспечивает перемещение легочного кровотока и улучшение вентиляции тех зон легких, которые остаются гиповентилируемыми в положении пациента на спине;
респираторная поддержка – совокупность методов, позволяющих обеспечить полноценную ИВЛ, когда самостоятельное дыхание у пациента выключено, утрачено или резко нарушено;
экстракорпоральная мембранная оксигенация (далее – ЭКМО) – инвазивный экстракорпоральный метод насыщения крови кислородом (оксигенации) при развитии тяжелой острой дыхательной недостаточности.
Уровень оказания медицинской помощи (далее – уровень):
уровень 1 – районные организации здравоохранения с наличием отделения анестезиологии и реанимации на 4–6 коек;
уровень 2 – межрайонные организации здравоохранения, оснащенные компьютерным томографом (далее – КТ);
уровень 3 – организации здравоохранения городского подчинения;
уровень 4 – областные и республиканские организации здравоохранения.
Диагностика
4. Выделяют следующие критерии тяжелого течения пневмонии у пациента:
4.1. малые критерии тяжелого течения пневмонии (далее – малый критерий), к которым относятся:
частота дыхания (далее – ЧД) > 25/мин;
нарушение сознания;
SрO2 (Oxygen saturation) – насыщение артериальной крови кислородом (сатурация), измеренное неинвазивным методом (пульсоксиметрия) – менее 90 % (менее 95 % для пациентов с ожирением);
PаO2 (Partial arterial oxygen pressure) – парциальное напряжение кислорода в артериальной крови – ниже 60 мм рт. ст. (по данным анализа кислотно-основного состояния (далее – КОС));
систолическое артериальное давление ниже 90 мм рт. ст.;
двустороннее или многоочаговое поражение легких, наличие полости распада, плевральный выпот;
4.2. большие критерии тяжелого течения пневмонии (далее – большой критерий), к которым относятся:
необходимость в проведении ИВЛ;
быстрое прогрессирование очагово-инфильтративных изменений в легких – увеличение размеров инфильтрации более чем на 50 % на протяжении ближайших 2 суток;
септический шок, необходимость введения вазопрессорных и инотропных лекарственных средств на протяжении 4 часов и более;
острое почечное повреждение – острое состояние, которое характеризуется внезапным и продолжительным снижением скорости клубочковой фильтрации (далее – СКФ), сопровождающееся накоплением в организме продуктов метаболизма и жидкости (повышение концентрации креатинина в сыворотке на 26,5 мкмоль/л и более в течение 48 часов или повышение уровня креатинина в 1,5 раза и более по сравнению с исходным, или диурез менее 0,5 мл/кг/ч в течение 6 часов).
5. При наличии у пациента не менее двух малых критериев или одного большого критерия, а также при SрO2 менее 90 % (менее 95 % для пациентов с ожирением) по данным пульсоксиметрии врачом-специалистом констатируется тяжелое течение пневмонии и в порядке, установленном законодательством Республики Беларусь, осуществляется неотложная госпитализация (перевод) пациента в ОАР больничной организации.
6. К группе риска развития ОРДС при вирусно-бактериальной пневмонии относятся пациенты со следующими сопутствующими патологиями:
первичным или вторичным иммунодефицитом;
избыточной массой тела и ожирением I–III степени;
сахарным диабетом I, II типа;
гепатитом и циррозами различной этиологии.
Пациенты с сопутствующей патологией, указанной в части первой настоящего пункта при наличии двусторонней инфильтрации на рентгенограмме требуют медицинского наблюдения и лечения в ОАР в течение 1–3 суток независимо от того, выявлены у них два малых или один большой критерий тяжелого течения пневмонии.
7. Диагностическими критериями ОРДС являются:
временной интервал: возникновение синдрома (новые симптомы или усугубление симптомов поражения легких) у пациента в пределах одной недели от момента действия известного причинного фактора;
визуализация органов грудной полости у пациента (рентгенография органов грудной клетки и (или) КТ органов грудной клетки): двусторонние затемнения, которые нельзя объяснить выпотом, ателектазом, узлами;
механизм отека: дыхательную недостаточность у пациента нельзя объяснить сердечной недостаточностью или перегрузкой жидкостью.
8. Диагностика ОРДС у пациентов с тяжелыми пневмониями вирусно-бактериальной этиологии:
выполняется исследование газов артериальной крови;
степень повреждения легких (наличие ОРДС) рассчитывается по респираторному индексу (respiratory index, далее – RI):
где PаO2 (partial arterial oxygen pressure) – парциальное напряжение кислорода в артериальной крови;
FiO2 (fraction of inspiratory oxygen) – концентрация кислорода во вдыхаемой воздушной смеси, выраженная в десятых долях.
9. Формы ОРДС определяются в зависимости от степени повреждения легких (RI) и уровня используемого ПДКВ (positive end-expiratory pressure, далее – PEEP) или постоянного положительного давления в дыхательных путях (continuous positive airway pressure, далее – CPAP):
легкая: RI > 200 мм рт. ст. и 5 см вод. ст.;
умеренная: RI > 100 мм рт. ст. и 5 см вод. ст.;
тяжелая: RI 5 см вод. ст.
Лечение
10. Основные задачи респираторной поддержки пациентов с ОРДС: обеспечение адекватной оксигенации; поддержание оптимального транспорта газов кровью; предупреждение утомляемости дыхательных мышц.
11. Решение о начале респираторной поддержки принимается врачом анестезиологом-реаниматологом. Предпочтительно раннее начало респираторной поддержки.
12. Показания к применению ИВЛ:
12.1. клинические:
апноэ или брадипноэ (ЧД 35/мин), если это не связано с гипертермией (температура выше 38 °С) или выраженной не устраненной гиповолемией;
угнетение сознания, психомоторное возбуждение;
прогрессирующий цианоз;
избыточная работа дыхания, участие вспомогательных дыхательных мышц;
кома;
прогрессирующая сердечно-сосудистая недостаточность;
12.2. лабораторные:
прогрессирующая гипоксемия, рефрактерная к кислородотерапии со снижением РаО2 55 мм рт. ст. (у пациентов с сопутствующей хронической обструктивной болезнью легких при РаСО2 > 65 мм рт. ст.);
RI 2, тромбоциты 60 % и/или PEEP > 12 см вод. ст.
14.3. Сроки выполнения:
оценка необходимости выполнения трахеостомии производится с момента интубации трахеи и перевода пациента на ИВЛ;
трахеостомия показана, если предполагаемая длительность ИВЛ превышает 7 суток.
14.4. Письменное согласие на выполнение трахеостомии:
Предоставить информацию о сути процедуры, предполагаемых преимуществах, потенциальных опасностях, альтернативных методиках.
Письменное согласие на трахеостомию дает сам пациент; в отношении лиц, признанных в установленном порядке недееспособными, трахеостомия выполняется с письменного согласия их опекунов; лиц, не способных по состоянию здоровья к принятию осознанного решения, – с письменного согласия супруга (супруги) или других законных представителей.
При отсутствии лиц, указанных в части второй настоящего пункта, или невозможности в обоснованно короткий срок (исходя из состояния здоровья пациента) установить их местонахождение, решение о трахеостомии принимается врачебным консилиумом.
14.5. Техника выполнения:
предпочтение следует отдавать чрескожной пункционной методике;
обязателен фиброоптический контроль при проведении чрескожной пункционной трахеостомии.
15. Нутритивная поддержка:
15.1. Энергетическая потребность у пациента с ОРДС в среднем составляет 25–35 ккал/кг идеальной массы тела в острой фазе заболевания и 35–50 ккал/кг идеальной массы тела – в фазе стабильного гиперметаболизма.
15.2. Выбор метода введения фармаконутриентов (парентеральное, энтеральное или смешанное питание) у пациентов с ОРДС осуществляется в зависимости от степени сохранности функции желудочно-кишечного тракта (далее – ЖКТ):
15.2.1. При сохраненной функции ЖКТ осуществляется энтеральное питание. Предпочтение – энтеральным смесям, содержащим Омега-3-ненасыщенные жирные кислоты.
15.2.2. При сохраняющейся белково-энергетической недостаточности на фоне выраженного катаболизма осуществляется перевод пациента на смешанное питание (частичное парентеральное питание и энтеральное питание).
15.2.3. Если функции ЖКТ нарушены – полное парентеральное питание.
15.2.4. Если функции ЖКТ нарушены частично – осуществляется частичное парентеральное питание с энтеральным питанием.
20. Оказание медицинской помощи пациентам с ОРДС в стационарных условиях осуществляется в соответствии с приложениями 1, 2 к настоящему Клиническому протоколу.
Приложение 2
к Клиническому протоколу
«Ранняя диагностика и интенсивная
терапия острого респираторного
дистресс-синдрома у пациентов
с тяжелыми пневмониями
вирусно-бактериальной этиологии»
| Клиническая ситуация | Лекарственные средства |
| Пневмония, развившаяся до 5 суток от момента госпитализации, средней тяжести | Амоксициллин/клавулановая кислота или цефтриаксон, или цефотаксим при недостаточной эффективности (через 36–48 часов) в комбинации с макролидами (кларитромицин, азитромицин), или респираторные фторхинолоны (левофлоксацин, моксифлоксацин) |
| Пневмония, развившаяся до 5 суток от момента госпитализации, тяжелое течение | Карбапенем без антисинегнойной активности (эртапенем) или респираторные фторхинолоны (левофлоксацин, моксифлоксацин) |
| Пневмония, развившаяся спустя 5 суток и более от момента госпитализации, в том числе, у пациентов на искусственной вентиляции легких (далее – ИВЛ) | Цефтазидим или цефепим или пиперациллин/тазобактам или цефоперазон/сульбактам или карбапенемы с антисинегнойной активностью (имипенем/циластатин, меропенем, дорипенем) в комбинации с респираторными фторхинолонами (левофлоксацин). При наличии высокой частоты встречаемости инфекций, вызванных метициллин-резистентным Staphylococcus aureus (MRSA) – вместо респираторных фторхинолонов или макролидов – линезолид или гликопептиды (тейкопланин, ванкомицин) |
Примечание.
Небулайзерное введение антибактериальных лекарственных средств во время проведении ИВЛ при положительной микробиологической культуре мокроты: гентамицин 80 мг 3 раза в день, амикацин 400 мг 2–3 раза в день, колистин 500 ЕД 3–4 раза в день, ванкомицин 125 мг 3 раза в день.
Для первичной профилактики инвазивного кандидоза назначение противогрибковых лекарственных средств требуется только иммунокомпромитированным пациентам.
| FiO2 | 0.3 | 0.4 | 0.4 | 0.5 | 0.5 | 0.6 | 0.7 | 0.7 | 0.7 | 0.8 | 0.9 | 0.9 | 0.9 | 1.0 | 1.0 |
| PEEP | 5 | 5 | 8 | 8 | 10 | 10 | 10 | 12 | 14 | 14 | 14 | 16 | 18 | 18 | 20–24 |
Примечания:
1. Допустимы отклонения в обе стороны в диапазоне 0.1 для FiO2 и 2 см вод. ст. для PEEP.
2. Исключения из шкалы оксигенации:
– короткие периоды (до 5 минут) снижения SpO2 95 % не требуют коррекции PEEP;
– FiO2 1.0 может применяться на короткие интервалы времени (до 10 минут) при транзиторной десатурации или для предотвращения десатурации во время лечения (санация трахеи, подключение небулайзера и другое).
| Условия введения | Атракурий | Фентанил | Мидазолам | Пропофол | Морфин |
| Болюс | 1 мг/кг в течение 3 минут | 1 мкг/кг в течение 3 минут | болюсы 0,02–0,08 мкг/кг каждые 5–15 минут до достижения требуемого уровня седации | начальная инфузия 0,3 мг/кг·час, повышение скорости на 0,3–0,6 мг/кг·час до достижения требуемого уровня седации | Болюсы 2–4 мг каждые 5 минут до достижения требуемого уровня седации |
| Поддержание | инфузия 1 мг/кг·час | инфузия 1–3 мкг/кг·час | инфузия 0,04–0,2 мкг/кг·час | инфузия 0,3–3 мг/кг·час | инфузия 0–2 мг/час |
| Снижение дозы на 20–30 % | у пациентов с ХПН | у пожилых пациентов | у пожилых пациентов, пациентов с ХОБЛ, или при комбинации с опиоидами | у пожилых пациентов | |
| Мониторинг нейромышечной проводимости | при наличии соответствующего оборудования |
Лечение (стационар)
Приложение 1
к Клиническому протоколу
«Ранняя диагностика и интенсивная
терапия острого респираторного
дистресс-синдрома у пациентов
с тяжелыми пневмониями
вирусно-бактериальной этиологии»
| № п/п | Наименование нозологических форм заболеваний (шифр по МКБ-10). Уровень оказания медицинской помощи (далее – уровень) | Оказание медицинской помощи в стационарных условиях | Примечания | ||
| Диагностика | Мониторинг | Лечение | |||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1 | Острый респираторный дистресс-синдром (далее – ОРДС). Синдром респираторного расстройства (дистресса) у взрослого (J80). Районные организации здравоохранения с наличием отделения анестезиологии и реанимации на 4–6 коек (далее – уровень 1) | Осмотр врача-анестезиолога-реаниматолога. Пульсоксиметрия. Рентгенография органов грудной клетки. Исследование кислотно-основного состояния (далее – КОС) и газов артериальной крови. Расчет респираторного индекса (respiratory index, далее – RI). Измерение артериального давления (далее – АД) на периферических артериях, электрокардиография (далее – ЭКГ) в стандартных отведениях, насыщение артериальной крови кислородом (сатурация, Oxygen saturation – далее – SpO2). Термометрия общая. Определение группы крови по системам АВ0 и резус. Общий анализ крови с подсчетом формулы крови, тромбоцитов, уровня гемоглобина, гематокрита. Общий анализ мочи с определением относительной плотности, кислотности, наличия белка, глюкозы, микроскопия осадка. Биохимическое исследование крови с определением уровня билирубина, мочевины, креатинина, общего белка, аспартатаминотрансферазы (далее – АсТ), аланинаминотрансферазы (далее – АлТ), электролитов (калий, кальций, натрий, хлор), глюкозы, С-реактивного белка (далее – СРБ). Исследование показателей гемостаза с определением активированного частичного (парциального) тромбопластинового времени (далее – АЧТВ), протромбинового времени (далее – ПВ), международного нормализованного отношения (далее – МНО), уровня фибриногена. Микробиологические исследования крови, мокроты. По показаниям консультация врача-пульмонолога | Респираторный: пиковое давление в дыхательных путях (peak airway pressure, далее – Ppeak), давление плато (plateau airway pressure, далее – Pplat), среднее давление в дыхательных путях (pressure mean, далее – Pmean), положительное давление в конце выдоха (positive end-expiratory pressure, далее – PEEP); дыхательный объем выдоха (expiratory tidal volume, далее – VTE), минутная вентиляция (minute ventilation, далее – VE), объем утечки из контура, минутная вентиляция при самостоятельном дыхании (далее – VESPONT); частота дыханий (далее – ЧД), частота спонтанных (самостоятельных) дыханий (далее – ЧДспонт), соотношение времени вдоха (time of inspiration, далее – Ti) и выдоха (time of expiration, далее – Te) (далее – Ti :Te или I : E); концентрация кислорода на вдохе (fraction of inspiratory oxygen, далее – FiO2). Нереспираторный: неинвазивное АД, ЭКГ, SpO2 – непрерывное суточное мониторирование, температура тела; центральное венозное давление (далее – ЦВД). Лабораторный: общий анализ крови, подсчет лейкоцитарной формулы, биохимическое исследование крови, СРБ, коагулограмма. Исследование КОС и газового состава артериальной крови по показаниям, но не реже 2 раз в сутки. Микробиологические исследования крови, мокроты. Инструментальный: рентгенография органов грудной клетки. Мониторинг седации по Ричмондской шкале ажитации и седации (Richmond Agitation Sedation Scale, далее – RASS) – каждые 6–8 часов. Шкала RASS приведена в таблице 3 приложения 2 к настоящему Клиническому протоколу | Противовирусные лекарственные средства назначаются в первые 48–72 часа от начала заболевания, при тяжелом течении гриппа с развитием ОРДС – в любом сроке от момента заболевания. Озельтамивир* – 75 мг 2 раза в сутки, Занамивир (в блистере для ингаляции, 1 ингаляция – 5 мг занамивира)** – 2 ингаляции 2 раза в сутки. Длительность курса – 5 суток (при тяжелом течении, сохранении выделения вируса гриппа в секрете верхних дыхательных путей возможно до 10 дней). Антибактериальные лекарственные средства назначаются в зависимости от тяжести, сроков заболевания и применяются в сочетании с противовирусными лекарственными средствами. Режимы антибактериальной терапии приведены в таблице 1 приложения 2 к настоящему Клиническому протоколу. Режимы искусственной вентиляции легких (далее – ИВЛ): вентиляция с контролем по давлению: вентиляция с управляемым давлением (Pressure control ventilation, далее – P-CMV); синхронизированная перемежающаяся принудительная вентиляция с управляемым давлением (Pressure synchronized intermittent mandatory ventilation, далее – P-SIMV). Целевые показатели: начальный дыхательный объем (далее – ДО) 6 мл/кг идеальной массы тела (далее – ИМТ); давление плато в дыхательных путях (plateau airway pressure – Pplat) 30 см вод. ст., уменьшают ДО на 1 мл/кг ИМТ каждые 2–3 часа, поддерживая pH более 7,2. Минимальный ДО – 4 мл/кг ИМТ. Для поддержания VE постоянной регулировать ЧД и соотношение I:E. При 25 см вод. ст. 10 см вод. ст. использование закрытых аспирационных систем. При проведении ИВЛ обязательно использование увлажнителя, антибактериальных фильтров. Обеспечение минимально возможного уровня седации, необходимого для синхронизации пациента с аппаратом ИВЛ. Дозы седативных лекарственных средств приведены в таблице 4 приложения 2 к настоящему Клиническому протоколу. Инфузионная терапия для поддержания нормоволемии: предпочтителен энтеральный путь введения жидкости; подсчет баланса жидкости каждые 8–12 часов интенсивной терапии. При нестабильном состоянии пациента, необходимости инфузионной терапии шока, RI 30 см вод. ст. уменьшают ДО на 1 мл/кг ИМТ каждые 2–3 часа, поддерживая pH более 7,2. Минимальный ДО – 4 мл/кг ИМТ. Для поддержания VE постоянной регулировать ЧД и соотношение I:E. При 25 см вод. ст. 10 см вод. ст. использование закрытых аспирационных систем. При проведении ИВЛ обязательно использование увлажнителя, антибактериальных фильтров. Обеспечение минимально возможного уровня седации, необходимого для синхронизации пациента с аппаратом ИВЛ. Дозы седативных лекарственных средств приведены в таблице 4 приложения 2 к настоящему Клиническому протоколу. Инфузионная терапия для поддержания нормоволемии: предпочтителен энтеральный путь введения жидкости; подсчет баланса жидкости каждые 8–12 часов интенсивной терапии. При нестабильном состоянии пациента, необходимости инфузионной терапии шока, RI 30 см вод. ст. уменьшают ДО на 1 мл/кг ИМТ каждые 2–3 часа, поддерживая pH более 7,2. Минимальный ДО – 4 мл/кг ИМТ. Для поддержания VE постоянной регулировать ЧД и соотношение I:E. При 25 см вод. ст. 10 см вод. ст. использование закрытых аспирационных систем. При проведении ИВЛ обязательно использование увлажнителя, антибактериальных фильтров. Обеспечение минимально возможного уровня седации, необходимого для синхронизации пациента с аппаратом ИВЛ. Дозы седативных препаратов приведены в таблице 4 приложения 2 к настоящему Клиническому протоколу. Инфузионная терапия для поддержания нормоволемии: предпочтителен энтеральный путь введения жидкости; подсчет баланса жидкости каждые 8–12 часов интенсивной терапии. При нестабильном состоянии пациента, необходимости инфузионной терапии шока, RI 30 см вод. ст., уменьшают ДО на 1 мл/кг ИМТ каждые 2–3 часа, поддерживая pH более 7,2. Минимальный ДО – 4 мл/кг ИМТ. Для поддержания VE постоянной регулировать ЧД и соотношение I:E. При 25 см вод. ст. 10 см вод. ст. использование закрытых аспирационных систем. При проведении ИВЛ обязательно использование увлажнителя, антибактериальных фильтров. Обеспечение минимально возможного уровня седации, необходимого для синхронизации пациента с аппаратом ИВЛ. Дозы седативных препаратов приведены в таблице 4 приложения 2 к настоящему Клиническому протоколу. Инфузионная терапия для поддержания нормоволемии: предпочтителен энтеральный путь введения жидкости; подсчет баланса жидкости каждые 8–12 часов интенсивной терапии. При нестабильном состоянии пациента, необходимости инфузионной терапии шока, RI | |
Информация
Источники и литература
Информация
ПОСТАНОВЛЕНИЕ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
1 июня 2017 г. № 48
Об утверждении клинического протокола «Ранняя диагностика и интенсивная терапия острого респираторного дистресс-синдрома у пациентов с тяжелыми пневмониями вирусно-бактериальной этиологии»
На основании абзаца седьмого части первой статьи 1 Закона Республики Беларусь от 18 июня 1993 года «О здравоохранении» в редакции Закона Республики Беларусь от 20 июня 2008 года, подпункта 8.3 пункта 8 и подпункта 9.1. пункта 9 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Ранняя диагностика и интенсивная терапия острого респираторного дистресс-синдрома у пациентов с тяжелыми пневмониями вирусно-бактериальной этиологии».
2. Настоящее постановление вступает в силу через пятнадцать рабочих дней после его подписания.