продолжительность жизни форменных элементов крови у человека
Форменные элементы крови
Кровь представляет собой жидкий вид соединительной ткани, находящийся в постоянном движении. Благодаря этому, обеспечиваются многие ее функции – питательная, защитная, регуляторная, гуморальная и другие. В норме форменные элементы крови составляют около 45%, оставшуюся часть занимает плазма. В статье рассмотрим, какие частицы включает жизненно важная соединительная ткань, а также их основные функции.
Функции крови
Клетки крови являются очень важными для нормального функционирования всего организма. Нарушение этого состава ведет к развитию различных заболеваний.
Все эти функции обеспечиваются, благодаря лейкоцитам, эритроцитам, тромбоцитам и некоторым другим элементам.
Эритроциты
Красные кровяные тела, или эритроциты, являются транспортными клетками с двояковыпуклой дисковидной формой. Состоит такая клетка из гемоглобина и некоторых других веществ, благодаря чему с током крови обеспечивается перенос кислорода по всем тканям. Красные кровяные тела берут кислород в легких, затем разносят его по органам, возвращаясь оттуда уже с углекислым газом.
Образование эритроцитов проходит в красном костном мозге длинных костей рук и ног (в детском возрасте) и в костях черепа, позвоночника и ребер (у взрослых людей). Общая продолжительность жизни одной клетки составляет около 90–120 суток, после чего тела поддаются гемолизу, проходящему в тканях селезенки и печени, выводятся из организма.
Под воздействием различных заболеваний происходит нарушение формирования эритроцитов и искажение их формы. Это вызывает снижение выполнения ими своих функций.
Важно! Исследование количества и качества эритроцитов выступает в роли важного диагностического значения.
Лейкоциты
Лейкоцитами называют белые кровяные тела, выполняющие защитную функцию. Выделяют несколько видов этих клеток, различающихся по назначению, строению, происхождению и некоторым другим характеристикам.
Образуются лейкоциты в красном костном мозге и лимфатических узлах. Их роль в организме – защита от вирусов, бактерий, грибов и прочих патогенных микроорганизмов.
Нейтрофилы
Нейтрофилы – это одна из групп кровяных тел. Эти клетки относятся к наиболее многочисленному виду. Они составляют до 96% от всех лейкоцитов.
Эозинофилы
Концентрация в крови эозинофилов меньшая, но они выполняют не менее важную защитную функцию. После попадания в организм чужеродных клеток эозинофилы быстро движутся для их устранения к пораженному участку. Они с легкостью проникают через ткани кровеносных сосудов, поглощают непрошенных гостей.
Еще одна важная функция – связь и поглощение некоторых медиаторов аллергии, включая гистамин. То есть эозинофилы выполняют противоаллергическую роль. Кроме этого, они эффективно борются с гельминтами и глистными инвазиями.
Моноциты
Главная роль этого вида лейкоцитов – поглощение мертвых тканей, устранение микробов, опухолевых процессов, паразитарных форм жизни. Часто эти клетки называют «дворниками организма». Такое название они получили из-за своей способности обновлять кровь, тем самым очищая ее.
Моноциты отвечают за синтез белка интерферона. Именно интерферон обеспечивает блокировку распространения вирусов, способствует разрушению оболочки болезнетворных микроорганизмов.
Базофилы
Как и другие форменные элементы крови, базофилы вырабатываются в тканях красного костного мозга. После синтеза они попадают в кровоток человека, где находятся около 120 минут, после чего переносятся в клеточные ткани, где выполняют свои главные функции, находятся от 8 до 12 суток.
Главная роль этих клеток – своевременно выявить и нейтрализовать аллергены, остановить их распространение по организму, призвать другие гранулоциты к месту распространения чужеродных тел.
Кроме участия в аллергических реакциях, базофилы несут ответственность за кровоток в тонких капиллярах. Роль клеток в защите организма от вирусов и бактерий, а также в формировании иммунитета очень мала, несмотря на то, что основная их функция – фагоцитоз. Этот вид лейкоцитов берет активное участие в процессе свертываемости крови, увеличивает проницаемость сосудов, активно участвует в сокращении некоторых мышц.
Лимфоциты
Лимфоциты представляют собой важнейшие клетки иммунной системы, выполняющие ряд сложных задач. К ним относятся:
Иммунные клетки делятся на Т-лимфоциты, В-лимфоциты и NK-лимфоциты. Каждая из групп выполняет свою функцию.
Т-лимфоциты
По уровню этих тел в составе крови можно определить те или иные иммунные нарушения. Увеличение их количества говорит о повышенной активности природной защиты, что свидетельствует об иммунопролиферативных нарушениях. Низкий уровень говорит о дисфункции иммунитета. Во время лабораторного исследования учитывается число Т-лимфоцитов и других форменных элементов, благодаря чему и удается установить диагноз.
В-лимфоциты
Клетки этого вида имеют специфическую функцию. Их активация происходит только в тех условиях, когда в организм проникают определенные типы возбудителей. Это могут быть штаммы вируса, тот или иной вид бактериальной инфекции, белки или другие химические вещества. Если возбудитель носит другой характер, В-лимфоциты не оказывают на него никакого воздействия. То есть, главная функция этих тел – синтез антител и выполнение гуморальной защиты организма.
NK-лимфоциты
Этот тип антител может реагировать на любые патогенные микроорганизмы, перед которыми Т-лимфоциты оказываются бессильными. Благодаря этому, NK-лимфоциты называют натуральными киллерами. Именно эти тела эффективно борются с онкологическими клетками. На сегодняшний день ведутся активные исследования этого форменного элемента крови в сфере лечения раковых заболеваний.
Тромбоциты
Тромбоцитами называют мелкие, но очень важные клетки крови, без которых остановка кровотечения и заживление ран было бы невозможным. Синтезируются эти тела путем отщепления небольших частиц цитоплазмы от больших структурных образований – мегакариоцитов, расположенных в красном костном мозге.
Тромбоциты берут активное участие в процессе свертываемости крови, благодаря чему раны и ссадины имеют свойство заживать. Без этого любое поражение кожи или внутренних органов было бы смертельным для человека.
При повреждении сосуда тромбоциты быстро склеиваются между собой, образовывая кровяные сгустки, которые предотвращают дальнейшее кровотечение.
Норма форменных элементов в крови
Для выполнения всех необходимых функций крови количество всех форменных элементов в ней должно отвечать определенным нормам. В зависимости от возраста эти показатели изменяются. В таблице можно найти данные о том, какие цифры считаются нормальными.
Любые отклонения от нормы служат поводом к дальнейшему обследованию пациента. Для исключения ложных показателей человеку важно соблюдать все рекомендации по сдаче крови на лабораторное исследование. Сдавать анализ следует утром на голодный желудок. Вечером перед посещением больницы важно отказаться от острой, копченой, соленой пищи и алкогольных напитков. Забор крови осуществляется исключительно в условиях лаборатории с использованием стерильных приборов.
Регулярная сдача анализов и своевременное выявление тех или иных нарушений поможет вовремя диагностировать различные патологии, провести лечение, сохранить здоровье на долгие годы.
Биохимия крови
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Нарушения метаболизма. Биохимия специализированных тканей. (Для клин.ордов КЛД) |
| Книга: | Биохимия крови |
Оглавление
1. Общие сведения
2. свойства крови
3. Состав крови. Гематокрит
3.1. Плазма крови
Пла́зма кро́ви (от греч. πλάσμα — нечто сформированное, образованное) — жидкая часть крови, в которой взвешены форменные элементы — вторая часть крови. Процентное содержание плазмы в крови составляет 52—61 %. Макроскопически представляет собой однородную несколько мутную (иногда почти прозрачную) желтоватую жидкость, собирающуюся в верхней части сосуда с кровью после осаждения форменных элементов. Гистологически плазма является межклеточным веществом жидкой ткани крови.
Центрифуги-сепараторы выделяют из крови плазму. Плазма крови состоит из воды, в которой растворены вещества — белки (7—8 % от массы плазмы) и другие органические и минеральные соединения. Основными белками плазмы являются альбумины — 55—65 %, α1-глобулины — 2—4 %, α2-глобулины 6—12 %, β-глобулины8 — 12 %, γ-глобулины — 2-4 % и фибриноген — 0,2—0,4 %. В плазме крови растворены также питательные вещества (в частности глюкоза и липиды), гормоны, витамины, ферменты и промежуточные и конечные продукты обмена веществ, а также неорганические вещества.
В среднем 1 литр плазмы человека содержит 900—950 г воды, 65—85 г белка и 20 г низкомолекулярных соединений. Плотность плазмы составляет от 1,025 до 1,029, pH — 7,36—7,44.
Существует обширная практика собирания донорской плазмы крови. Плазма отделяется от эритроцитов центрифугированием с помощью специального аппарата, после чего эритроциты возвращаются донору. Этот процесс называется плазмаферезом.
Плазма с высокой концентрацией тромбоцитов (богатая тромбоцитами плазма) находит все большее применение в медицине в качестве стимулятора заживления и регенерации тканей организма. В настоящее время на её основе разработана многофункциональная медицинская методика, используемая в стоматологии и косметологии.
3.2. Форменные элементы
У взрослого человека форменные элементы крови составляют около 40—50 %, а плазма — 50—60 %. Форменные элементы крови представлены эритроцитами, тромбоцитами и лейкоцитами:
Кровь относится к быстро обновляющимся тканям. Физиологическая регенерация форменных элементов крови осуществляется за счёт разрушения старых клеток и образования новых органами кроветворения. Главным из них у человека и других млекопитающих является костный мозг. У человека красный, или кроветворный, костный мозг расположен в основном в тазовых костях и в длинных трубчатых костях. Основным фильтром крови является селезёнка (красная пульпа), осуществляющая в том числе и иммунологический её контроль (белая пульпа).
4. Биохимия эритроцита
4.1. Транспорт кислорода кровью
4.2. Созревание эритроцита
4.3. Структурно-метаболические особенности эритроцита
Особенности структурной организации мембраны эритроцитов
Эритроцит окружен плазматической мембраной, структура которой хорошо изучена, идентична таковой в других клетках. Цитоплазматическая мембрана эритроцитов включает бислой фосфолипидов, в то время как белки или «плавают» на поверхности мембран, или пронизывают липиды, обеспечивая прочность и вязкость мембран. Площадь мембраны одного эритроцита составляет около 140 мкм2.
На долю белков приходится примерно 49 %, липидов – 44 %, углеводов –7 %. Углеводы химически связаны либо с белками, либо с липидами и образуют соответственно гликопротеиды и гликолипиды.
Важнейшими компонентами мембраны эритроцитов являются липиды, включающие до 48 % холестерина, 17-28 % – фосфотидилхолина, 13-25 % – сфингомиелина и ряд других фосфолипидов.
Фосфотидилхолин мембраны эритроцитов несет нейтральный заряд, практически не вступает в реакции взаимодействия с положительно заряженными каналами Са2+,, обеспечивая тем самым атромбогенность эритроцитов. Благодаря таким свойствам, как текучесть, пластичность, эритроциты способны проходить через капилляры диаметром
Белки мембраны эритроцита делят на периферические и интегральные. К периферическим белкам относят спектрин, анкирин, белок 4.1., белок р55, адуцин и др. В группу интегральных белков входит фракция 3, а также гликофорины А, В, С, О, Е. Анкирин образует соединение с р-спектрином. В составе эритроцитов обнаружено около 340 мембранных и 250 растворимых белков.
Пластичность эритроцитов связана с фосфорилированием мембранных белков, особенно белков полосы 4.1.
Белок фракции 4.2. – паллидин обеспечивает связывание спектрин-актин-анкиринового комплекса с фракцией 3, относится к группе трансглутаминазных протеинов.
К числу сократительных белков мембраны эритроцитов относятся р-актин, тропомодулин, строматин и тропомиозин.
Гликофорины – интегральные белки мембраны эритроцитов, определяющие отрицательный заряд, способствующий отталкиванию эритроцитов друг от друг и от эндотелия сосуда.
Протеин 3 – основной белок актинов, регулирующий дефосфорилируемость эритроцита.
Как указывалось выше, мембрана эритроцита представляет собой сложный комплекс, включающий определенным образом организованные липиды, белки и углеводы, которые формируют наружный, средний и внутренний слои эритроцитарной мембраны.
Касаясь пространственного расположения различных химических компонентов эритроцитарной мембраны, следует отметить, что наружный слой образован гликопротеидами с разветвленными комплексами олигосахаридов, которые являются концевыми отделами групповых антигенов крови. Липидным компонентом наружного слоя являются фосфатидилхолин, сфингомиелин и неэстерифицированный холестерин. Липиды наружного слоя мембраны эритроцита играют важную роль в обеспечении постоянства структуры мембраны, избирательности ее проницаемости для различных субстратов и ионов. Вместе с фосфолипидами холестерин регулирует активность мембранно-связанных ферментов путем изменения вязкости мембраны, а также участвует в модификации вторичной структуры ферментов. Молярное отношение холестерин / фосфолипиды в мембранах клеток у человека и многих млекопитающих равно 0,9. Изменение этого соотношения в сторону увеличения наблюдается в пожилом возрасте, а также при некоторых заболеваниях, связанных с нарушением холестеринового обмена.
Снижение текучести мембраны эритроцита и изменение ее свойств отмечается также и при увеличении содержания сфингомиелина,
Средний бислой мембраны эритроцита представлен гидрофобными «хвостами» полярных липидов. Липидный бислой обладает выраженной текучестью, которая обеспечивается определенным соотношением между насыщенными и ненасыщенными жирными кислотами гидрофобной части бислоя. Интегральные белки, к которым относятся ферменты, рецепторы, транспортные белки, обладают активностью только в том случае, если находятся в гидрофобной части бислоя, где они приобретают необходимую для активности пространственную конфигурацию. Поэтому любые изменения в составе липидов эритроцитарной мембраны сопровождаются изменением ее текучести и нарушением работы интегральных белков.
Внутренний слой мембраны эритроцита, обращенный к цитоплазме, состоит из белков спектрина и актина. Спектрин является специфическим белком эритроцитов, его гибкие вытянутые молекулы, связываясь с микрофиламентами актина и липидами внутренней поверхности мембраны, формируют своеобразный скелет эритроцита. Небольшой процент липидов во внутреннем слое мембраны эритроцита представлен фосфатидилэтаноламином и фосфатидилсерином. От наличия спектрина зависит подвижность белков, удерживающих двойной бисой липидов.
Одним из важных гликопротеинов является гликофорин, содержащийся как на внешней, так и на внутренней поверхностях мембран эритроцитов. Гликофорин в своем составе содержит большое количество сиаловой кислоты и обладает значительным отрицательным зарядом. В мембране он располагается неравномерно, образует выступающие из мембраны участки, которые являются носителями иммунологических детерминант.
Строение и состояние эритроцитарной мембраны, низкая вязкость нормального гемоглобина обеспечивают значительные пластические свойства эритроцитам, благодаря которым эритроцит легко проходит по капиллярам, имеющим вдвое меньший диаметр, чем сама клетка, и может принимать самые разнообразные формы. Другим периферическим мембранным белком эритроцитов является анкирин, образующий соединение с молекулой Р-спектрина.
Функции эритроцитарной мембраны
Мембрана эритроцитов обеспечивает регуляцию электролитного баланса клетки за счет активного энергозависимого транспорта электролитов или пассивной диффузии соединений по осмотическому градиенту.
В мембране эритроцитов имеются ионно-проницаемые каналы для катионов Na+, K+, для O2, CO2, Cl– HCO3–.
Транспорт электролитов через эритроцитарную мембрану и поддержание его мембранного потенциала обеспечивается энергозависимыми Na+, K+, Ca2+ – АТФ-азными системами.
Мембрана эритроцитов хорошо проницаема для воды при участии так называемых белковых и липидных путей, а также анионов, газообразных соединений и плохо проницаема для одновалентных катионов калия и натрия.
Белковый путь трансмембранного переноса воды обеспечивается при участии пронизывающего мембрану эритроцитов белка «полосы 3», а также гликофорина.
Молекулярная природа липидного пути переноса воды через эритроцитарную мембрану практически не изучена. Прохождение молекул небольших гидрофильных неэлектролитов через эритроцитарную мембрану осуществляется также, как и перенос воды, за счет белкового и липидного путей. Перенос мочевины и глицерина через мембрану эритроцита обеспечивается за счет ферментативных реакций.
Перенос органических анионов через эритроцитарную мембрану обеспечивается, как и транспорт неорганических анионов, при участии белка «полосы 3».
Эритроцитарная мембрана обеспечивает активный транспорт глюкозы, кинетика которого обеспечивается зависимостью Михаэлиса-Ментен. Важная роль в транспорте глюкозы через эритроцитарную мембрану отводится полипептиду полосы 4,5 (белки с ММ 55 кД – возможные продукты распада полипептида полосы 3). Высказывается предположение о наличии специфического липидного окружения у белков – переносчиков сахаров в эритроцитарной мембране.
Неравномерное распределение моновалентных катионов в системе эритроцит – плазма крови поддерживается при участии энергозависимой Na+-помпы, осуществляющей трансмембранный обмен ионов Na+ эритроцитов на ионы К+ плазмы крови в соотношении 3:2. Кроме указанного трансмембранного обмена Na+/K+, Na+ помпа осуществляет еще, по крайней мере, четыре транспортных процесса: Na+→ Na+ обмен; K+→K+обмен; одновалентный вход ионов Na+, сопряженный с выходом К+.
Молекулярной основой Na+ помпы является фермент Na+, K+ –АТФ-аза – интегральный белок, прочно связанный с мембранными липидами, состоящий из 2х полипептидных субъединиц с ММ 80-100кД.
Транспортная система имеет 3 центра, связывающих ионов Na+, локализованных на цитоплазматической стороне мембраны. С наружной стороны мембраны на транспортной системе имеется 2 центра связывания ионов К+. Важная роль в поддержании высокой активности фермента отводится мембранным фосфолипидам.
Функционирование Са2+-помпы обеспечивается нуклеотидами, а также макроэргическими соединениями, преимущественно АТФ, ЦТФ, ГТФ, в меньшей степени ГТФ и ЦТФ.
Как в случае Nа+-помпы, функционирование Са2+помпы в эритроцитах связано с проявлениями активности Са2+, Mg2+ –АТФ-азы. В мембране одного эритроцита обнаруживается около 700 молекул Са2+, Mg2+ –АТФ-азы.
Наряду с барьерной и транспортной функциями, мембрана эритроцитов выполняет рецепторную функцию.
Экспериментально доказано наличие на мембране эритроцитов рецепторов к инсулину, эндотелину, церулоплазмину, а2-макроглобулину, α- и β-адренорецепторов. На поверхности эритроцитов находятся рецепторы к фибриногену, обладающие достаточно высокой специфичностью. Эритроциты также несут на мембране рецепторы к гистамину, ТхА2, простациклину.
В мембране эритроцитов обнаруживаются рецепторы для катехоламинов, снижающих подвижность жирных кислот липидов мембран эритроцитов, а также осмотическую устойчивость эритроцитов.
Установлена перестройка структуры мембраны эритроцитов под влиянием низких концентраций инсулина, гормона роста человека, простагландинов группы Е и Е2.
В мембранах эритроцитов высока и ц – АМФ активность. При увеличении концентраций в эритроцитах ц–АМФ ( до 10–6 М) усиливаются процессы фосфорилирования белков, что приводит в свою очередь к изменению степени фосфорилированности и проницаемости мембран эритроцитов для ионов Са2+.
Эритроцитарная мембрана содержит изоантигены различных систем иммунологических реакций, определяющих групповую принадлежность крови человека по этим системам.
4.4. Антигенная структура эритроцитарной мембраны
Эритроцитарная мембрана содержит различные антигены видовой, групповой и индивидуальной специфичности. Различают два вида изоантигенов эритроцитов, определяющих групповую специфичность крови человек – А и В агглютиногены. Соответственно в плазме или сыворотке крови обнаруживаются две разновидности изоантител – агглютинины α и β. В крови человека не содержатся одноименных агглютиногенов и агглютининов. Их встреча и взаимодействие может возникать при переливании несовместимых групп крови, приводить к развитию агглютинации и гемолиза эритроцитов.
Как известно, I (0) группа крови характеризуется отсутствием в эритроцитах агглютиногенов А и В при наличии в плазме или сыворотке крови агглютининов α и β, встречается у 40-50 % людей стран центральной Европы.
II (А) группа крови характеризуется наличием в мембране эритроцитов агглютиногена А, в то время как в плазме крови содержатся агглютинины β. Указанная группа крови распространена у 30–40 % людей.
III (В) группа крови характеризуется наличием агглютиногена В в мембране эритроцитов, а в плазме или сыворотке крови – наличием агглютининов типа α. Эта группа крови имеет место примерно у 10 % населения.
IV (АВ) группа крови характеризуется наличием в мембране эритроцитов фиксированных А и В агглютиногенов, при этом в плазме или сыворотке крови отсутствуют естественные агглютинины α и β. Данная группа крови встречается у 6 % населения.
Генетический контроль антигенной системы А,В,О мембран эритроцитов представлен генами О, Н, А, В, локализованными в длинном плече 9-й пары хромосом.
Агглютинины α и β относятся к классу Ig M, являются естественными антителами, образуются у ребенка на первом году жизни, достигая максимума к 8 – 10 годам.
Второе место среди антигенных свойств мембран эритроцитов по клинической значимости занимает система Rh – Hr. Впервые Резус-фактор был открыт в 1940 году К. Ландштейнером и А. Винером, содержится в эритроцитах у 85 % людей белой расы. У 15 % людей эти эритроцитарные антигены отсутствуют. В настоящее время установлена липопротеидная природа антигенов данной системы, их насчитывается около 20, они образуют различные комбинации в мембране эритроцитов. Наиболее распространенными резусантигенами являются 6 разновидностей: Rh0 (D), rh’ (C), rh’’ (E), Hr0 (d), hr’ (c), hr’’ (e). Наиболее сильным антигеном этой группы является Rh0 (D).
Антитела системы Rh и Hr – антирезусагглютинины являются приобретенными, иммунными, отсутствуют в крови Rh (-) людей с момента рождения, синтезируются при первом переливании Rh (+) крови Rh (-) реципиенту, а также при первой беременности Rh (-) женщины Rh(+) плодом. При первой беременности эти антитела синтезируются медленно в течение нескольких месяцев в небольшом титре, не вызывая серьезных осложнений у матери и плода. При повторном контакте резус-отрицательного человека с резус-положительными эритроцитами возможен резус-конфликт. Антитела системы Rh – Hr относятся к классу Ig G, поэтому они легко проникают через плацентарный барьер, вызывают реакции агглютинации и гемолиза эритроцитов плода, что сопровождается развитием гемолитической желтухи новорожденных. В случае повторного переливания несовместимой по Rh–антигенам крови донора и реципиента может наблюдаться гемотрансфузионный шок.
Продолжительность жизни форменных элементов крови у человека
Лейкоциты. Общая характеристика элементов белой крови
Лейкоциты (греческое leukos – белый, kytos – вместилище) – одна из трех разновидностей форменных элементов крови позвоночных животных и человека.
Представление о лейкоцитах сформировалось более 100 лет назад одновременно с возникновением учения о крови и кроветворении, получило развитие в трудах Р. Вирхова (1955), И.И. Мечникова (1883), А.А. Максимова (1902), А.А. Заварзина (1945) и других отечественных и зарубежных исследователей.
Лейкоциты, в отличие от эритроцитов, это ядросодержащие клетки, структурная организация которых идентична другим клеткам нашего организма. Лейкоцитарная клетка ограничена цитоплазматической мембраной, в цитоплазме содержатся митохондрии, лизосомы с набором гидролитических ферментов и биологическиактивных соединений, имеется аппарат Гольджи, система эндоплазматического ретикулума, белоксинтезирующая система, представленная рибосомами и полирибосомами, и другие органоиды. Размеры лейкоцитов варьируют от 4 до 20 мкм. Продолжительность жизни также весьма вариабельна и составляет от 4–5 дней до 20 дней для элементов гранулоцито-моноцитарного ряда, а для лимфоцитов 100–200 дней. Количество лейкоцитов в периферической крови здорового взрослого человека колеблется от 4×10 9 /л до 9×10 9 /л.
Количество лейкоцитов у новорожденных уже в течение первых суток достигает 10×10 9 /л – 30×10 9 /л, а затем несколько уменьшается и со второй недели жизни составляет в среднем 10×10 9 /л – 12×10 9 /л. Однако следует отметить, что согласно данным многочисленных авторов содержание лейкоцитов в периферической крови в течение первых лет жизни, а по некоторым данным и до 10–15 лет, может быть значительно выше аналогичного показателя крови здорового взрослого человека (таблица).
Прежде чем остановиться на морфофункциональных особенностях отдельных видов лейкоцитов, необходимо рассмотреть гистогенез элементов белой крови в костном мозге, поскольку именно четкие представления о гистогенезе позволят не только хорошо усвоить вопросы физиологии белой крови, но и современные принципы классификации лейкозов, их гематологическую характеристику.
Как известно, лейкоциты позвоночных животных и человека образуются в специальных кроветворных органах: в период эмбрионального развития такими органами являются желточный мешок, печень, селезенка и костный мозг. Во взрослом организме лейкоциты образуются в костном мозге, а лимфоциты, кроме того, в селезенке, вилочковой железе и лимфатических узлах.
В костном мозге имеется две неравнозначные группы клеток: клетки ретикулярной стромы и клетки кроветворной ткани костного мозга с их производными – зрелыми клетками крови. К клеточным элементам ретиулярной стромы относят фибробласты, остеобласты, жировые клетки, эндотелиальные клетки. Указанные клетки объединяют собирательным названием «ретикулярные клетки».
Возрастная динамика количества лейкоцитов и лейкоцитарной формулы у детей
В настоящее время четко определена гистогенетическая независимость системы кроветворной стромы и кроветворных клеток. Ретикулярные клетки имеют самостоятельные стволовые клетки, способные дифференцироваться во все клеточные элементы.
Классификация лейкоцитов. Морфологические и функциональные особенности отдельных видов лейкоцитов
Существующая в настоящее время классификация лейкоцитарных элементов является морфофункциональной и отражает уровень современных знаний по физиологии лейкоцитов.
Все морфологически идентифицируемые лейкоцитарные элементы можно разделить на две группы с учетом одной из основных функциональных характеристик клеток – способности к делению. Так, различают две подгруппы клеток – пролиферирующих и утративших способность к пролиферации (сюда входят и лейкоциты, покинувшие органы кроветворения – циркулирующие в крови и перешедшие в ткани). Циркулирующие в кровотоке лейкоциты подразделяютя на два функциональных пула: а) свободно циркулирующие в крови, б) клетки, занимающие краевое положение в сосудах и не участвующие в циркуляции, – секвестрированные, или депонированные, лейкоциты.
С учетом морфологических особенностей (наличие зернистости и гранул) все лейкоцитарные элементы делятся на две большие группы: гранулоциты и агранулоциты.
Свойства лейкоцитов
1. Все виды лейкоцитов в большей или меньшей степени обладают способностью к амебовидному движению, что обеспечивает миграцию лейкоцитов в ткани через сосудистую стенку. Этот процесс называется диапедезом. Он определяет защитную функцию лейкоитов. 50 % лейкоцитов за пределами сосудистого русла находятся в межклеточном пространстве, а 30 % – в костном мозге.
2. Лейкоциты обладают положительным хемотаксисом по отношению к бактериальным токсинам, продуктам распада бактерий и дегенерирующим клеткам организма, комплексам антиген – антитело.
3. Одним из важных свойств лейкоцитов является способность к фагоцитозу и пиноциозу.
4. Лейкоциты обеспечивают механизмы резистентности за счет лизосомальных ферментов, в частности протеаз, пептидаз, диастазы, дезоксирибонуклеазы, липаз, поступающих в окружающие ткани при жировой дегенерации лейкоцитов. Бактерицидные свойства лейкоцитов обеспечиваются и освобождением лизоцима, катионных белков, лактоферрина, активных форм кислорода.
5. Лейкоциты являются регуляторами коагуляционного потенциала крови. Это свойство лейкоцитов обусловлено содержанием в них активаторов и проактиваторов плазминогена, а также наличием в лизосомах фибринолитическиактивных протеаз, которые могут расщеплять фибрин без участия плазминогена. Вышеуказанные факторы обеспечивают создание альтернативного механизма фибринолиза наряду с плазминовой фибринолитической системой, что играет важную роль в деблокировании сосудистого русла при ДВС-синдроме.
6. Лейкоциты участвуют в развитии синдрома системного воспалительного ответа, лихорадки, регуляции лейкопоэза за счет образования цитокинов с дистантным действием.
7. Лейкоциты обеспечивают индукцию и развитие специфических иммунологических механизмов защиты, а также аллергических реакций гуморального и клеточного типов.
Гемопоэз и его регуляция
Кровь является исключительнореактогенной системой, характеризующейся разнообразными изменениями клеточного состава, а также растворимых компонентов в ответ на действие патогенных факторов.
Система крови представляет собой производное мезенхимы и включает следующие основные компоненты: кровь и лимфу, органы кроветворения и иммунопоэза, а также клетки крови, эмигрирующие в соединительную ткань, и эпителиальные ткани. Естественно, чрезвычайно важная роль в регуляции гомеостаза периферической крови отводится органам кроветворения, в частности костному мозгу, где в условиях нормы имеют место сохранение динамического равновесия между процессами гемопоэза и распада клеток, а также определенная стадийность дифференцировки элементов миелоидного, лимфоидного, эритроцитарного и мегакариоцитарного рядов.
В процессе раннего эмбрионального периода жизни (около 2-х недель очаги системы гемостаза формируются в желточном мешке, где пролифирируют и дифференцируются участки мезенхимы, мезодермальных клеток).
Основными местами гемопоэза, начиная с 11-й недели гестации и прежде всего второго триместра, являются печень и селезенка. Гемопоэз смещается из печени и селезенки в мозговые полости костей лишь с 3-го триместра гестации и остается в этих структурах к моменту рождения ребенка. В течение юности и зрелого возраста места гемопоэза постепенно смещаются из трубчатых костей скелета в плоские кости (череп, позвонки, грудина, ребра, таз), которые становятся основными местами гемопоэза у взрослых людей.
Основные гемопоэтические факторы роста включают группы гормонов и цитокинов, продуцируемых в значительной мере стромальными клетками микроокружения.
В последние годы достигнуты определенные успехи в унификации представлений о характере и механизмах процессов гемопоэза в костном мозге, роли цитокинов в гистогенезе элементов крови.
Ежедневно у человека обновляется около 100 млрд форменных элементов периферической крови. В гемопоэтической ткани костного мозга гранулоциты и их предшественники составляют около 60 %, эритроидные предшественники – 20 %, лимфо- и моноциты – около 10 %, а недифференцированные и разрушающиеся клетки – также около 10 %.
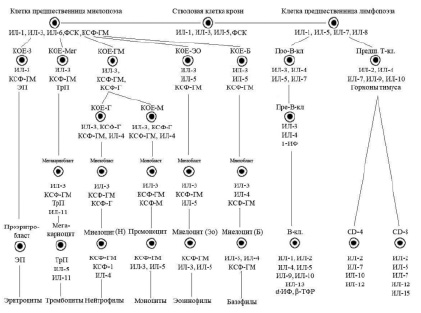
Согласно унитарной теории кроветворения, сформулированной А.А. Максимовым, источником всех линий кроветворения в костном мозге являются «родоначальные клетки». Длительное время не существовало единой терминологии для их обозначения. В настоящее время используют термин «плюрипотентные стволовые клетки» (ППСК), трансформирующиеся в костном мозге в мультипотентные стволовые клетки.
Современная схема гемопоэза была разработана А.И. Воробьевым совместно с И.Л. Чертковым (1973), которая в основном используется в настоящее время с различными дополнениями и модификациями.
Кроветворная ткань является динамичной, постоянно обновляющейся системой, в связи с этим знание кинетики гемопоэза необходимо для понимания патогенеза заболеваний различной этиологии. Гемопоэтические клетки отличаются большим разнообразием структуры и функции, обеспечивающим в процессе их созревания самые различные биологические процессы, такие, как транспорт О2, гемостаз, фагоцитоз, иммунитет.
В настоящее время очевидно наличие шести классов дифференцировки клеток периферической крови (схема), причем первые два класса клеток включают плюрипотентные и мультипотентные клетки костного мозга, морфологически не распознаваемые элементы. К III классу относят коммитированные унипотентные клетки-предшественницы, к IV классу относятся бласты – ядросодержащие клетки эритроцитарного, лимфоидного, миелоидного и мегакариоцитарного рядов, V класс – это созревающие клетки. Часть клеток миелоидного ряда (юные и палочкоядерные) уже содержатся в периферической крови, а VI класс – это зрелые клетки крови и костного мозга.
Касаясь более детальной характеристики гемопоэтических клеток костного мозга, следует отметить, что ППСК, являющиеся источником образования клеток крови, составляют 0,01 % от всех ядросодержащих клеток костного мозга. Однако этого количества достаточно для восстановления гемопоэза в случаях аплазии и гипоплазии костного мозга. Ранее считалось, что клетки крови происходят из гемоцитобласта – производного гемогистиобласта.
ППСК – морфологически не распознаваемая клетка, условно относится к I классу кроветворения, маркерной молекулой этих клеток является CD34, экспрессируемая и эндотелиоцитами сосудов. ППСК относится к категории самоподдерживающихся клеток, способных к митотическому делению до 100 раз в течение своей жизни. Всего у человека примерно 4–400×105 стволовых клеток крови, некоторые из них выходят из костного мозга и обнаруживаются в крови.
Упрощенная схема регуляции кроветворения (Алмазов В.А., 1999): ФСК – фактор стволовой клетки, КОЕ – колониеобразующая единица, ИЛ – интелейкин, КСФ – колониестимулирующий фактор, ИФ – интерферон, ТФР – трансформирующий фактор роста, ЭП – эритропоэтин, ТрП – тромбопоэтин
Миграция стволовых клеток усиливается при нарушениях гомеостаза, в частности при гипоксиях, радиации, химиотерапии и других стрессорных воздествиях, находится под контролем хемокина CXCL-12, синтезируемого остеокластами, эндотелиальными клетками, клетками стромы. Регуляторами миграции стволовых клеток являются также КСФ-Г и ИЛ-1. Стволовые клетки в покоящемся состоянии выполняют две основные функции: 1) самоподдержание за счет низкого уровня пролиферативной активности; 2) дифференцировку в сторону образования коммитированных предшественников.
Дальнейшая дифференцировка ППСК обеспечивается различными специфическими и неспецифическими механизмами. Различают локальные и длиннодистантные механизмы регуляции. Локальные механизмы регуляции обеспечиваются за счет тканевого, микрососудистого, нервного компонентов и распространяются преимущественно на I и II классы клеток кроветворения в костном мозге. Тканевый компонент регуляции гемопоэза включает межклеточное взаимодействие, а также продукцию клетками соединительной ткани, моноцитарно-макрофагальной, мегакариоцитарной линий, эндотелием различных цитокинов с ростстимулирующим действием. Микрососудистый и нервный компоненты обеспечивают соответственно оксигенацию и трофику стромы и паренхиматозных элементов, а также выход в кровоток форменных элементов.
Начиная с коммитированных клеток костного мозга, в регуляции гемопоэза доминируют длиннодистантные механизмы, обеспечиваемые различными цитокинами, системой «кейлоны – антикейлоны», гормонами.
Касаясь динамики гемопоэза в костном мозге, следует отметить, что вслед за классом ППСК возникает образование мультипотентной полустволовой клетки, или клетки – предшественницы лимфопоэза, под влиянием фактора стволовой клетки (ФСК), ИЛ-1, ИЛ-6. Параллельно происходит образование из полипотентной стволовой клетки мультипотентной полустволовой клетки – предшественницы миелопоэза под влиянием ряда цитокинов: ФСК, ИЛ-1, ИЛ-3, ИЛ-6, КСФ-Г.
Третьим классом недифференцированных клеток гемопоэза костного мозга являются коммитированные, или унипотентные, клетки. Для лимфоидного ряда – это про-Т- и про-В-лимфоциты, а для миелоидного ряда – это колониеобразующие клетки эозинофильного и базофильного рядов (КОЕ-Эо, КОЕ-Б), нейтрофильного ряда (КОЕ-Г), моноцитарного ряда (КОЕ-М), а также эритроцитарного (КОЕ-Э) и мегакариоцитарного (КОЕ-Мег) рядов.
Гемопоэтические клетки III класса – короткоживущие, интенсивно пролиферирующие, идентифицируемые клетки. Регуляторами их пролиферации и дифференцировки являются цитокины и «специфические» гемопоэтины.
Последними пролиферирующими клетками гемопоэтического ряда являются клетки IV класса – бласты – морфологически и гистохимически распознаваемые элементы (миелобласты, лимфобласты, монобласты, эритробласты). V класс дифференцировки включает созревающие клеточные элементы (для миелоидного ряда это промиелоцит, миелоцит, метамиелоцит, палочкоядерные лейкоциты; для лимфоидного ряда – пре- и про-В- и Т-лимфоциты, протоплазмоциты; для эритроцитарного ряда – пронормоцит, базофильный, полихроматофильный, оксифильный нормоцит, ретикулоцит.
VI класс включает в себя зрелые клетки костного мозга и периферической крови.
Касаясь кинетики гемопоэза, следует отметить, что для делящихся клеток-предшественниц митотический цикл, помимо митоза, включает фазу G1, во время которой происходит подготовка гемопоэтических клеток к синтезу ДНК, а далее S-фазу, характеризующуюся удвоением количества ДНК, и фазу G2, включающую период подготовки к митотическому делению. Продолжительность митотического цикла для морфологическинераспознаваемых клеток-предшественников составляет в среднем около 20 часов.
Относительно регуляции гемопоэза необходимо отметить по крайней мере два его варианта – конститутивный и индуцированный гемопоэз. Конститутивный гемопоэз регулируется цитокинами и межклеточным взаимодействием, а осуществляется в особых зонах скопления стволовых клеток. Часть стволовых клеток, медленно размножаясь, мигрирует в другие зоны костного мозга, где и дифференцируется.
Индуцированный гемопоэз возможен при нарушениях гомеостаза при различных стрессорных воздействиях (гипоксия, интоксикация, ионизирующая радиация) и регулируется в основном КСФ-Г, ИЛ-1, ФСК.
Согласно данным литературы, важнейшими стимуляторами пролиферации и дифференцировки клеток гранулоцитарного и моноцитарного рядов оказываются колониестимулирующие факторы (КСФ). Последние являются пептидами, продуцируемыми у человека моноцитарно-макрофагальными клетками крови различных тканей, в частности костного мозга, а также лимфоцитами, эндотелиальными клетками, фибробластами, тучными клетками на фоне антигенной стимуляции. Наиболее изучены мульти-КСФ (ИЛ-3), гранулоцитарно-макрофагальный КСФ (КСФ-ГМ), макрофагальный КСФ (КСФ-М), гранулоцитарный КСФ (КСФ-Г). Усиление лейкопоэза возникает под влиянием провоспалительных цитокинов: ИЛ-1, ИЛ-6, ИЛ-8, а также под влиянием ряда медиаторов воспаления, в частности лейкотриенов В4, С4, ФСК, вырабатываемого клетками микроокружения стволовых клеток. Универсальными стимуляторами гранулоцитарно-моноцитарного лейкопоэза являются гормоны адаптации: катехоламины, глюкокортикоиды, реализующие свои эффекты на костный мозг через усиление образования КСФ и интерлейкинов. К числу стимуляторов лейкопоэза относятся витамин В12, аскорбиновая кислота, фолиевая кислота, железо. Подавление костно-мозгового кроветворения возможно под влиянием ряда медиаторов воспаления, таких, как простагландины Е1, Е2, ИЛ-10, ИЛ-13, ФНО-α, трансформирующий фактор роста бета (ТФР-β), а также лактоферрина и кислого изоферритина.
Регуляция пролиферации и дифференцировки лимфоцитов находится под влиянием цитокинов, интенсивно образующихся на фоне воздействия различных антигенов инфекционной и неинфекционной природы лимфоцитами и моноцитами, в частности ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7, бластогенного и митогенного факторов. Классическими ингибиторами лимфопоэза являются гормоны адаптации: АКТГ, глюкокортикоиды, индуцирующие развитие реакции апоптоза и цитолиза в лимфоидной ткани.
В настоящее время очевидна определяющая роль цитокинов в регуляции костно-мозгового кроветворения, в частности ФСК, КСФ-Г, КСФ-М, КСФ-ГМ, а также ИЛ-3 или мульти-КСФ, регулирующих дифференцировку и созревание практически всех ростков кроветворения. К настоящему моменту для многих цитокинов определены структура и биологические свойства.
Далее приведены особенности биологических эффектов некоторых из указанных цитокинов, влияющих на процессы роста и дифференцировки гемопоэтических клеток костного мозга.
Фактор стволовых клеток (ФСК). ФСК – ростовой фактор для гемопоэтических стволовых клеток, образование которого детерминируется геном 12-й хромосомы (q22-q24). Биологическая активность ФСК проявляется в виде растворимой и мембранно-связанной форм. Трансмембранный белок состоит из 273 аминокислотных остатков, растворимая форма представлена нековалентно-связанным димером.
Рецептор ФСК, c-kit, обозначается как CD117, его связывание с ФСК приводит через ряд промежуточных реакций к активации протеинкиназы С и yak2/STAT пути клеточной активации [20]. ФСК интенсивно синтезируется в разных тканях плода, а в постнатальном периоде в фибробластах, эндотелиоцитах, недифференцированных стромальных клетках.
В организме человека ФСК оказывает интенсивное стимулирующее влияние на тучные клетки, пролиферацию предшественников Т- и В-лимфоцитов, интраэпителиальных γδ-лимфоцитов.
ФСК стимулирует CD34+ стволовые клетки человека и в сочетании с ИЛ-3, КСФ-Г, КСФ-ГМ усиливает формирование гранулоцитарно-макрофогальных и эритроцитарных колоний, предшественников тучных клеток.
Fit-3-лиганд. Другим стимулятором гемопоэза в костном мозге является Fit-3-лиганд, взаимодействующий с тирозинкиназными рецепторами. Подобно ФСК и КСФ-М, Fit-3-лиганд продуцируется стромальными клетками, клетками эндотелия и Т-лимфоцитами, а его рецептор экспрессируется на ранних гемопоэтических клетках – предшественницах миеломоноцитарного ряда и на пре-В-лимфоцитах.
Эффекты fit-3-лиганда на костно-мозговые клетки усиливаются цитокинами ИЛ-3 и КСФ-ГМ. Комбинация ФСК и Fit-3-лиганда значительно усиливает пролиферацию костно-мозговых стволовых клеток. Рекомбинантный fit-3-лиганд стимулирует пролиферацию CD34+ стволовых клеток костного мозга человека, а также ранних гемопоэтических клеток-предшественниц. Однако его эффекты слабее, чем у ФСК-ГМ.
Гранулоцитарный колониестимулирующий фактор (КСФ-Г). Образование КСФ-Г детерминируется геном хромосомы 17 у человека (С17, q11-q21). Зрелый цитокин имеет глобулярную структуру с ММ 18,6 кДа, синтезируется моноцитами, фибробластами, эндотелием, стромальными клетками, а далее поступает в системный кровоток и в костный мозг. Рецепторы цитокина экспрессируются на клетках миеломоноцитарного ростка кроветворения от миелобластов до зрелых гранулоцитов, а также на некоторых клетках моноцитарного ростка. Продукция КСФ-Г стимулируется вовлечением провоспалительных цитокинов ИЛ-1, ФНО, бактериальных эндотоксинов. Биологическое действие КСФ-Г связано с ускорением пролиферации и созревания ранних предшественников гранулоцитов, усилением фагоцитарной активности нейтрофилов, их кислородзависимого киллинга и антителонезависимой цитотоксичности, продукцией зрелыми нейтрофилами ИЛ-8 и активацией хемотаксиса под влиянием ИЛ-8.
КСФ-Г после стимулирующего влияния на гемопоэз в условиях воспаления, инфекции, оказывает активирующее влияние на продукцию ИЛ-4, ИЛ-10, стимулирует Th2, усиливает гуморальное звено иммунитета, обеспечивает антибактериальную защиту организма.
Макрофагальный колониестимулирующий фактор (КСФ-М). Макрофагальный колониестимулирующий фактор КСФ-М продуцируется стромальными клетками костного мозга, фибробластами, моноцитами, макрофагами, гепатоцитами, эндотелием, гладкомышечными клетками. КСФ-М кодируется геном, расположенным на коротком плече первой хромосомы в зоне р13-р21, а также на 5-й хромосоме(CD q33). Мономер КСФ-М состоит из 256 аминокислот, существует в виде растворимой и мембранно-связанной формы. КСФ-М увеличивает экспрессию антигенов МНС II на макрофагах, усиливает их цитотоксичность.
Рецепторы M-CSF относятся к семейству рецепторов ростовых факторов, кодируются протоонкогеном c-fmg, экспрессируются на всех клетках моноцитарного ряда, гладкомышечных клетках и на трофобласте.
Ген КСФ-М во многих клетках экспрессируется конститутивно, усиление синтеза цитокина возникает под влиянием ИЛ-10, ФНО-α, КСФ-ГМ, прогестероном, ИЛ-4.
КСФ-М стимулирует пролиферацию, дифференцировку клеток – предшественниц моноцитарного ряда, вызывает развитие моноцитоза, тромбоцитопении, иногда нейтропении, повышает противоопухолевую антителозависимую цитотоксичность моноцитов и антибактериальную активность клеток моноцитарно-макрофагального ряда.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (КСФ-ГМ). КСФ-ГМ – ростовой фактор, он синтезируется в условиях нормы в незначительных количествах, а при воспалении различного генеза интенсивность синтеза возрастает под влиянием бактериальных эндотоксинов, провоспалительных цитокинов.
Зрелый КСФ-ГМ имеет ММ 14,5 кДа, состоит из 127 аминокислотных остатков. Интенсивное гликозилирование КСФ-ГМ в процессе синтеза приводит к увеличению его ММ и синтетической биологической активности.
Рецепторы КСФ-ГМ обладают высокой аффинностью связывания лиганда.
После связывания КСФ-ГМ с рецепторами активируется МАР-киназа, Scr-киназа и фосфатидилинозитол-3-зависимая киназа, киназа Jak-2.
Биологическая активность КСФ-ГМ направлена на стимуляцию и дифференцировку миеломоноцитарных предшественников гемопоэза, колоний мегакариоцитов, а также на усиление функциональной активности нейтрофилов, эозинофилов, моноцитов за счет стимуляции хемотаксиса, адгезии, продукции активных форм кислорода.
КСФ-ГМ вызвает усиление антигенпрезентирующей функции моноцитов, цитотоксичности моноцитов в отношении опухолевых клеток.