применение электролитической диссоциации в жизни человека
Электролитическая диссоциация (общие сведения, процесс, свойства, термин, применение)
Общие сведения
Терминология
Свойства электролитов
Константа диссоциации
Константа диссоциации является количественной мерой диссоциации электролита. Чем больше значение КД электролита, тем лучше он распадается в растворе и тем больше концентрация ионов.
Классическая теория электролитической диссоциации
Активность ионов означает эффективную условную концентрацию, согласно которой ионы действуют в химических реакциях. Напр. активность ионов Na + i Cl- в 1 М растворе NaCl равна 0,65 моль / л. Отношение активности ионов к концентрации растворов называют коэффициентом активности и обозначают f: f = a-CМ, отсюда а = f ⋅ CМ. В очень разбавленных растворах сильных электролитов f приближается к 1 (а ≈ СМ). Для растворов сильных электролитов на основе закона действующих масс по значению активности ионов вычисляют константы диссоциации. Например, для соляной кислоты: HCl → H + + Cl-.Electrolit_3.eps.
Экспериментально установлено, что с увеличением ионной силы раствора коэффициент активности снижается.
Определение ионной силы растворов сильных электролитов необходимо при количественных определениях веществ в химическом анализе, а также для проведения биологических исследований. Такие сильные электролиты, как NaCl, KCl, CaCl2, MgCl2, содержатся в крови и лимфе живых существ. Поэтому при изучении действия растворов сильных электролитов на организм следует применять растворы одинаковой ионной силы.
Литература
Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Электролитическая диссоциация
Что такое электролитическая диссоциация
В 1877 г. в одном из научных журналов появилась статья Аррениуса «О диссоциации растворенных в воде веществ». В этой статье Аррениус, приводя результаты своих исследований по электропроводности растворов, обращает внимание на тесную связь между способностью растворов проводить электрический ток и неподчинением тех же растворов законам Рауля и Вант-Гоффа.
Аррениус показал, что, измерив электропроводность раствора, можно рассчитать величину его осмотического давления, а следовательно, и поправочный коэффициент для данного раствора. Величины i, выведенные им из электропроводности, очень близко совпали с величинами, найденными Вант-Гоффом для тех же растворов иными методами.
Причиной чрезмерно высокого осмотического давления раствора электролитов является, по мнению Аррениуса, диссоциация молекул электролитов на заряженные электричеством частицы,
Сумма положительных зарядов, приобретаемых ионами одного рода, равна сумме отрицательных зарядов ионов другого рода, вследствие чего весь раствор в целом остается электрически нейтральным.
Тема диссоциация
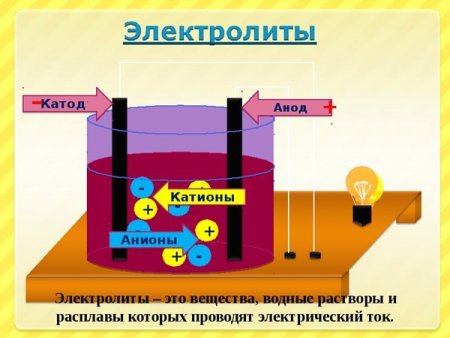
При пропускании через раствор электрического тока ионы начинают перемещаться в растворе по двум противоположным направлениям: положительно заряженные ионы направляются к отрицательно заряженному электроду — катоду, отрицательные ионы, наоборот, двигаются к положительному электроду —аноду. Ионы, перемещающиеся к катоду, получили название катионов, а перемещающиеся к аноду — анионов. Достигнув электродов, ионы разряжаются, теряя вместе с тем свои характерные свойства, обусловленные присутствием зарядов, и превращаются в нейтральные атомы или группы атомов. Последние или выделяются из раствора или подвергаются дальнейшим изменениям, образуя новые вещества.
Существенно важным в теории Аррениуса является утверждение, что разложение на ионы происходит не под влиянием тока, как думали раньше, но уже при растворении электролита в воде. Свободные ионы имеются во всяком растворе, способном проводить ток, независимо от того, производится ли электролиз такого раствора или нет. Действие же тока на раствор заключается лишь в перемещении ионов к электродам, где они разряжаются.
Распад электролитов под действием растворителя на ионы получил название электролитической диссоциации или ионизации и изображается обычными химическими уравнениями в которых слева пишут формулы распадающихся веществ, а справа —образующиеся из них ионы. Заряды находящихся в растворе свободных ионов мы будем обозначать знаками • и ‘, сохранив обозначения + и — для ионов, связанных в кристаллах солей и в других ионных соединениях. Так, например, диссоциация НCl на ионы выразится уравнением.
Присутствие в растворах электролитов положительно и отрицательно заряженных ионов может быть доказано следующим опытом.
Запаянная трубка с раствором йодистого калия KJ закрепляется на вращающемся диске (рис. 72). В трубку впаяны платиновые проволочки, к которым прикреплены платиновые электроды. Концы проволочек при помощи особого приспособления соединены с чувствительным вольтметром. При быстром вращении диска стрелка вольтметра заметно отклоняется, указывая на появление у электродов а и b разноименных зарядов. При этом оказывается, что конец трубки, расположенный у края диска, за ряжается отрицательно, а расположенный у центра диска — положительно.
Очевидно, что отрицательно заряженные ионы иода, как более тяжелые, отбрасываются с большей силой и потому на большее расстояние от оси вращения, чем более легкие ионы калия, заряженные положительно. Поэтому в том конце трубки, который находится у края диска, оказывается больше ионов иода, чем калия, и расположенный там электрод заряжается отрицательно. Наоборот, на конце трубки, который находится у центра диска, оказывается больше ионов калия и появляется положительный заряди
При таком же опыте с раствором азотнокислого серебра AgNO3 конец трубки, расположенный у края диска, где скопляются более тяжелые ионы серебра, заряжается положительно, а конец, расположенный у центра диска, — отрицательно.
Эти опыты являются хорошим доказательством действительного существования в растворах электролитов противоположно заряженных ионов.
Присутствием ионов в растворах электролитов легко объясняются те ненормальные осмотические явления, о которых говорилось в начале этой главы. В качестве примера мы приводили осмотическое давление разбавленного раствора поваренной соли, которое оказывается почти вдвое больше вычисленного по закону Вант-Гоффа. Теперь нам нетрудно будет ронять, почему это происходит. «Молекула» поваренной соли (во времена Аррениуса еще не было известно, что в кристаллах поваренной соли нет отдельных молекул) распадается в растворе на два иона: Na • и Сl’. Бели все перешедшие в раствор «молекулы» диссоциируют на ионы, то число образовавшихся ионов будет вдвое больше числа взятых молекул. Из граммолекулы поваренной соли получится не 6,02 • 10 23 частиц, а вдвое большее их число. А так как осмотическое давление зависит не от природы находящихся в растворе частиц, а только от их числа, то оно тоже должно увеличиться вдвое.
Точно так же в очень разбавленном растворе хлористого бария, диссоциирующего по уравнению
осмотическое давление оказывается втрое больше, чем вычисленное по закону Вант-Гоффа, так как число частиц в растворе втрое больше, чем если бы хлористый барий находился в нем в виде молекул ВаСl2.
Таким образом, особенность водных растворов электролитов, противоречащая с первого взгляда закону Вант-Гоффа, была объяснена на основе этого же закона.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах. Являясь по существу механистической, она рассматривала ионы как совершенно свободные, независимые от молекул растворителя частицы. Теории Аррениуса противостояла химическая, или гидратная, теория Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем (о соединении частиц растворенного вещества с частицами растворителя). Заслуга преодоления кажущегося противоречия обеих теорий принадлежит И. А. Каблукову, впервые высказавшему очень важное предположение о гидратации ионов, т. е. об образовании ими неустойчивых соединении с молекулами воды. Это предположение, являющееся сейчас неоспоримым фактом, привело в дальнейшем к объединению теорий Аррениуса и Менделеева. Все последующее развитие химии растворов показало, что теория электролитической диссоциации не только не противоречит гидратной теории, но и не может развиваться иначе, как на основе представлений, созданных Менделеевым.

Иван Алексеевич Каблуков родился 2 сентября 1857 г. в селе Пруссы Московской губернии. Окончив Московский университет в 1880 г., он работал первое время в области органической химии. В 1889 г. Иван Алексеевич отправляется в Лейпциг, в лабораторию Оствальда, где работает некоторое время, вместе с Аррениусом, по электропроводности растворов. По возвращении в Россию он продолжает исследования в области электропроводности растворов. Результатом их является его докторская диссертация «Современные теории растворов (Вант-Гоффа и Аррениуса) в связи с учением о химическом равновесии», оказавшая большое влияние на развитие физической химии в России и способствовавшая дальнейшему развитию теории электролитической диссоциации.
Из многочисленных работ Каблукова особенно важными являются также его исследования в области солевых равновесий.
Всю свою жизнь И. А. Каблуков вел большую педагогическую и культурно-просветительную работу. Он читал лекции в Московском университете и в Сельскохозяйственном институте, написал учебники «Основные начала неорганической химии» и «Основные начала физической химии», по которым училось не одно поколение химиков, состоял членом многих научных обществ.
Вы читаете, статья на тему Теория электролитической диссоциации
Похожие страницы:
Понравилась статья поделись ей
Применение электролитов
Основные свойства
Обычная вода и многие другие вещества не способны проводить ток. Растворы становятся токопроводимыми, только если вещества могут распадаться на ионы. В отличие от металлов электролиты называют проводниками второго порядка. Ими могут выступать некоторые кристаллы и расплавы, например иодид серебра, диоксид циркония.
Основным свойством электролитов является возможность электролитической диссоциации, представляющей собой процесс распада молекул при взаимодействии с водой, другими растворителями. В результате распада появляются заряженные ионы.
В зависимости от типа образующихся ионов различают такие электролиты:
В щелочных электропроводимость обеспечивается ионами ОН и металлов. В кислотных – ионами Н+, а также остатками оснований кислот. Процесс диссоциации зависит от таких факторов:
Если говорить об аккумуляторах, то для них важна плотность токопроводящих сред. Она определяет емкость батарей и срок их службы.
Возможности для применения
В основном применение электролитов распространено в промышленности. С их помощью изготавливают источники тока разного назначения. Это могут быть автомобильные аккумуляторы и различные виды батарей. Для них используются щелочные вещества, проводящие ток.
Аналитическая практика предполагает использование ионометров и рН-метров, которые заполнены солевыми веществами, проводящими ток. Приборы применяют для измерения кислотности среды, концентрации определенных веществ.
Если говорить об электрохимической индустрии, то многие растворы для гальванирования металлов создаются на основе веществ, способных к диссоциации. Также они применяются в биологии и медицине. Многие диагностические методы построены на анализе кислотно-щелочного и водно-солевого балансов. Применение электролитов довольно разнообразно, как и их составы.
К достоинствам аккумуляторов, построенных на щелочных веществах, способных к диссоциации, относят:
Если говорить об автомобильной индустрии, в ней являются востребованными кислотные аккумуляторы. К их непосредственным преимуществам относятся:
Основные меры предосторожности
Все популярные вещества, способные проводить ток, созданы на основе щелочи или серной кислоты. Они могут стать причиной ожога, поэтому при обращении с ними важно предпринимать меры предосторожности. Среди правил обращения с такими опасными веществами главными являются следующие:
Важно при работе соблюдать все правила техники безопасности, чтобы избежать ожогов. Основные из них:
Если при выполнении работ предполагается кипение вещества, оно будет сопровождаться выделением взрывоопасного и горючего газа – водорода. Соответственно, в помещении необходимо предусмотреть его отвод, взрывобезопасную проводку, защитить все электроприборы.
Хранение опасных веществ организовывают в пластиковых емкостях. Для работы с ними подходит фарфоровая, керамическая и стеклянная посуда.
Презентация по химии на тему «Электролитическая диссоциация»
Описание презентации по отдельным слайдам:
Еще одна тайна воды! Урок по теме «Электролитическая диссоциация» 8 класс Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школа № 11» г. Алатыря.
Цели урока: 1. Повторить химические свойства воды. 2. Познакомиться с новыми понятиями: электролиты, неэлектролиты, электролитическая диссоциация. 3. Рассмотреть механизм электролитической диссоциации. 4. Рассмотреть вопрос: электролитическая диссоциация и жизнь человека,
Вода! Викторина 6CO2 + 6H2O → C6H12O6 + 6O2 «Вода, у тебя нет ни вкуса, ни запаха, тебя не опишешь, тобою наслаждаешься, не понимая, что ты такое! Ты не просто необходима для жизни: ты и есть жизнь». Антуан де Сент-Экзюпери.
Zn + H2O → ZnO + H2 Викторина Какие из предложенных веществ будут вступать с водой в реакции замещения? Zn S Na HCl 2Na+2H2O → 2NaOH + H2
Викторина Какие из предложенных веществ будут вступать с водой в реакции соединения? Оксиды металлов Металлы Кислоты Оксиды неметаллов
Электрический ток – направленное движение заряженных частиц. NaCl NaCl ↓ Na++ Cl- H2O CuSO4 CuSO4 ↓ Cu2+ + SO42- SO3 NaOH NaOH ↓ Na+ + OH-
Эксперимент Исследовать электрическую проводимость веществ: Вещество Электропроводность Тип химической связи металлическая ионная хим. связь ионная хим. связь ионная хим. связь ионная хим. связь ионная хим. связь ковалентная полярная хим. связь ионная хим. связь ковалентная мало- полярная хим. связь
Водные растворы которых проводят электрический ток – Водные растворы которых тока не проводят – электролиты неэлектролиты
Строение молекулы воды: H2O Молекула воды образована ковалентной полярной химической связью Молекула воды имеет угловое строение Молекулу воды изображают в виде диполя Механизм электролитической диссоциации
Механизм электролитической диссоциации 1. Ориентация молекул – диполей воды около ионов кристалла 2. Гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла 3. Диссоциация (распад) кристалла электролита на гидратированные ионы NaCl → Na+ + Cl-
Роль процесса электролитической диссоциации для жизни человека
Роль процесса электролитической диссоциации для жизни человека. Биологическая роль некоторых металлов. Ca2+, в скелете, зубах, крови Замедление роста Кальцификация костей, тканей, увеличивает свертываемость крови Fe 2+/ 3+,образование гемоглобина и дыхательных ферментов Анемия,нарушается синтез гемоглобина Поражение печени, сердца, эндокринной системы Зоб, ранний склероз. У детей – задержка развития Раздражительность, учащенное серцебиение, резкое исхудание Атеросклероз,задержка роста, повышение сахара в крови Аллергия, рак легких, язва желудка Замедление роста, нарушение развития скелета Рахит I¯, образование гормонов щитовидной железы Cr 3+, кровь, участвует в обмене белков, жиров, углеводов Mn 2+, кости, печень, поджелудочная железа
Роль процесса электролитической диссоциации для жизни человека. Витамины. FeSO4 MnSO4 CrCl3 KI FeSO4→Fe2+ + SO42- MnSO4→Mn2+ + SO42- CrCl3 → Cr3+ + 3Cl- KI → K+ + I-
Если вода темная, даже чернильная, с железистым привкусом – скорее всего, в ней превышено содержание солей марганца и железа. Вода соленая на вкус – возможно превышение хлоридов, Вода горчит – наверняка в ней сверх нормы сульфатов. Еще один показатель – накипь на нагревательных элементах бытовых приборов, что свидетельствует о повышенном содержаниии солей кальция и магния.
Домашнее задание §35 (перессказ) вопросы 1,2,4,5 Спасибо за внимание
Список использованных источников: http://детсад2684.рф/prava.html http://www.domwoda.com/main.php?part=help http://www.eco-center.ru/sysfilter-ironwater.php http://www.vodakup.com.ua/articles.html?type=4 http://apteka03.tomsk.ru/index.php?productID=28056
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Номер материала: ДВ-011502
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Рособрнадзор оставил за регионами решение о дополнительных школьных каникулах
Время чтения: 1 минута
В России объявлены нерабочие дни с 30 октября по 7 ноября
Время чтения: 2 минуты
Минпросвещения разрешило школам вводить каникулы до 30 октября
Время чтения: 1 минута
Названы лучшие по качеству проведения ЕГЭ регионы России
Время чтения: 1 минута
В школе в Пермском крае произошла стрельба
Время чтения: 1 минута
Путин поручил создать 21,5 тыс. новых учебных мест в школах Дальнего Востока
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Сильные и слабые электролиты в природе, в быту. Степень диссоциации. вычисление степени диссоциации.
Дата: Класс: 9 урок 6
Тема: Сильные и слабые электролиты в природе, в быту. Степень диссоциации. вычисление степени диссоциации.
углубить понятия об электролитах и ЭД
Показать влияние разбавления, температуры на степень диссоциации
Определить понятие «степень электролитической диссоциации», сильные и слабые электролиты
Умение определять силу электролита в зависимости от степени диссоциации
умение учащихся на основе теоретических знаний сравнивать, анализировать, обобщать, логически рассуждать, делать выводы, развивать устную речь.
Ученики осмысливают поставленную цель.
II. Проверка домашней работы. С помощью метода «Ромашка Блума» осуществляет проверку домашней работы
1.Выбрать только электролиты:
AL(OH)3 NaCl CH4 Mg(NO3 )2 AL2O3 HNO3 HCl KOH
2.Распределить на 2 группыи дать названия ионам:
Fe2+ SO42- CO32-Cl-Mg2+
3. Написать уравнение диссоциации веществ:
Почему металлы проводят электрический ток?
Какая кристаллическая решетка характерна для Ме?
Что находится в узлах к.р.?
Что в Ме является проводником э/ тока
Есть ли еще какие-либо частицы, которые под действием электрического тока, подобно свободным электронам в металлическом кристалле, могут приобретать упорядоченное (направленное) движение?
Есть ли такие частицы в растворе хлорида натрия? Ответ обоснуйте, вспомнив о типе химической связи и типе кристаллической решетки в хлориде натрия.
Почему твердая соль, также содержащая в своем составе ионы, не проводит электрический ток?
Можем ли мы предположить, что ионы хлорида натрия (освобождаются (становятся подвижными) при растворении соли в воде?
Ученики отвечают на разноуровневые вопросы.
(Попробуем ответить на такой вопрос: все ли электролиты в одинаковой степени распадаются на ионы? Сравним электропроводность концентрированных растворов хлорида натрия и уксусной кислоты. В растворе соли лампочка загорается ярко, а в уксусной кислоте – очень слабо. Разбавим растворы, добавив к ним воды. Электропроводность раствора хлорида натрия не изменяется, а в растворе уксусной кислоты лампочка горит ярче. Хлорид натрия даже в концентрированных растворах диссоциируют полностью. Молекулы же уксусной кислоты в концентрированных растворах почти не диссоциируют. При разбавлении уксусной кислоты число диссоциированных молекул увеличивается, равновесие диссоциации смещается вправо:
Вещества с ионной кристаллической решеткой полностью диссоциируют на ионы в водных растворах. Отношение числа диссоциированных молекул (n) к общему числу молекул (N), находящихся в растворе, называют степенью диссоциации (). Величина может принимать значения от 0 (диссоциации нет) до 1 (диссоциация полная).)
.1Демонстрационный опыт. В два стакана нальем по 50 мл раствора метилоранжа в ацетоне. В первый стакан добавим 1–2 капли концентрированной серной кислоты, появляется малиновое окрашивание. Чтобы во втором стакане появилась такая же окраска, придется добавить в 10 раз больше (10–20 капель) уксусной кислоты, т.к. степень диссоциации кислоты CH3COOH незначительная и концентрация ионов водорода в ней невелика.
Сделайте Вывод. Сила кислот и оснований определяется их степенью диссоциации.
(по степени диссоциации)
А как составить таблицу, решите сами в парах.
Если сульфат меди растворить в воде, то наблюдается синее окрашивание раствора и раствор проводит ток, а, если растворить сульфат меди в бензине, то окрашивания не наблюдается, раствор не становится синим. Объясните это явление. Проделайте этот опыт Найдите сульфат меди в таблице растворимости. Напишите для него уравнение диссоциации Какой это электролит по силе?
1гр- сильные электролиты
2 гр- средние электролиты
3 гр- слабые электролиты
IV. Закрепление урока. Работа в парах по методике « Кубизм » Что вы поняли по данной теме?
Самостоятельное работа по группам
1. Выпадение осадка.
3. Образование слабого электролита (например, воды).
Ученики обсуждают между собой, отвечают на вопросы своих одноклассников.
V. Итог урока. Этап рефлексии: Стратегия «Телеграмма»
— Что тебе понравилось на уроке?
— Что не понравилось?
— Насколько трудным был урок?
Кратко написать самое важное, что уяснил с урока с пожеланиями соседу по парте и отправить.
Оценивают работу своих одноклассников, пишут телеграммы.
VI. Домашнее задание. Объясняет особенности выполнения домашней работы.
Записывают домашнюю работу в дневниках.
дифференциация. Как вы планируете поддерживать учащихся? Как вы планируете стимулировать способных учащихся
оценивание. Как вы планируете увидеть приобретенные знания учащихся?
межпредметные связи, соблюдение СанПиН ИКТ компетентность. Связи с ценностями
были ли цели обучения реалистичными?
Что учащиеся сегодня узнали? На что было направлено обучение?
Хорошо ли сработала запланированная дифференциация? Выдерживалось ли время обучения?
Какие изменения из данного плана я реализовал и почему?
Какие два аспекта в обучении прошли очень хорошо( с учетом преподавания и учения)?
Какие два обстоятельства могли бы улучшить урок( с учетом преподавания и учения)?
Что узнал об учениках в целом или отдельных лицах?