pparg ген за что отвечает
Роль генетических факторов в развитии СПКЯ
Ключевые гены, имеющие отношение к развитию клинических проявлений СПКЯ представлены двумя основными группами.
В первую группу включены гены, контролирующие метаболические процессы обмена глюкозы и, соответственно, состояния гиперинсулинемии и инсулинорезистентности.
Во вторую группу включены гены, отвечающие за синтез стероидных гормонов и индивидуальную чувствительность тканей к андрогенам.
Изменения в структуре одного или нескольких из этих генов могут вызвать развитие тех или иных клинических симптомов (или симптомокомплексов), характерных для синдрома поликистозных яичников. Разнообразие клинических и биохимических проявлений синдрома поликистозных яичников объясняется взаимодействием между небольшим числом ключевых генов и внешними факторами.
Информация о генетической предрасположенности к СПКЯ позволяет врачу выявить причинно-следственные связи возникновения различных клинических проявлений СПКЯ и может быть полезна при выборе методов лечения.
Ген инсулина (INS)
PPARγ2 (PPARG, PPARG2, PPAR-gamma2)
CYP11A
Ген, кодирующий цитохром P450scc (side chain cleavage enzyme, фермент отщепляющий боковую цепь).
AR
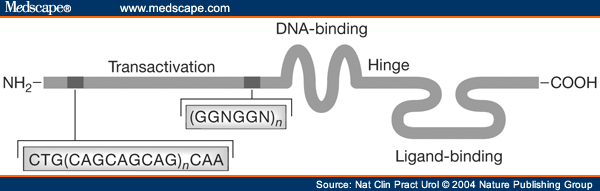
Ген рецептора андрогенов (AR) располагается на длинном плече X хромосомы (Xq12-13). Это один из самых загадочных генов, участвующих в реализации действия мужских половых гормонов на уровне клетки.
В регуляторном участке рецептора (участке транскрипции и активации), который получил название домена трансактивации находится высокополиморфная зона, состоящая из разного количества повторов аминокислоты гуанина, который кодируется разным числом повторов CAG в гене рецептора (цитозин-аденин-гуанин). В исследованиях in vitro было четко показано, что чем меньшее количество повторов в этой области присутствует в гене AR, тем большую активность проявляют андрогены на уровне клетки. Эти исследования были подтверждены клиническими исследованиями мужчин. Было показано, что мужчины-носители так называемых «коротких» форм рецептора (число повторов меньше 22) подвержены повышенному риску развития аденомы и рака предстательной железы.
У женщин наблюдается гораздо более сложная картина, связанная с тем, что в каждой клетке женщины имеется не одна (как у мужчин), а 2 X-хромосомы, причем только одна X-хромосома является «рабочей», а другая инактивирована. В разных клетках даже одной ткани могут быть инактивированы разные X-хромосомы, поэтому в разных клетках яичника могут быть включены разные варианты андрогеновых рецепторов.
Исследования полиморфизма AR в клинической практике базируются на классической публикации Hickey и соавт. (2002), показавших на популяции австралийских женщин европейского происхождения на первый взгляд парадоксальную связь между гиперандрогенией, ассоциированной с синдромом поликистозных яичников, и длиной полиморфного участка в домене трансактивации. Оказалось, что классическая форма синдрома поликистозных яичников ассоциирована с «длинными» (больше 22 повторов) вариантами гена AR.
Другие исследования показали достаточно сложную связь между количеством повторов и различными проявлениями гиперандрогении. В частности, сообщается о повышении риска СПКЯ при нормальном уровне тестостерона у женщин при наличии коротких форм полиморфизма, а также о возможной роли коротких форм полиморфизма как дополнительного фактора инсулинорезистентности при гиперандрогенных состояниях у женщин.
Генетические маркеры синдрома поликистозных яичников (СПКЯ): (PPARG`), (CYP11A), (AR), (INS-VNTR)
Стоимость анализа
стоимость указана без учета стоимости забора биологического материала
Добавить в корзину
Готовность результатов анализа
Обычные*: 8-12 р.д.
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Где и когда можно сдать
Забор биоматериала
Методы выполнения и тесты
гены: Ген PPARg (ген рецептора фактора активации пероксисом) (PPARG`); Ген CYP11А (CYP11A); Ген рецептора андрогенов (AR); инсулин (INS-VNTR) (ДНК-диагностика. Качественный
Файлы
Для чего это нужно
Ключевые гены, имеющие отношение к развитию клинических проявлений СПКЯ представлены двумя основными группами.
В первую группу включены гены, контролирующие метаболические процессы обмена глюкозы и, соответственно, состояния гиперинсулинемии и инсулинорезистентности.
Во вторую группу включены гены, отвечающие за синтез стероидных гормонов и индивидуальную чувствительность тканей к андрогенам. Читать дальше…
В нашей лаборатории проводится генетическое тестирование по 4 генам:
Показания к проведению анализа:
Значение анализов
CYP11A1 – ген 20,22-десмолазы, отвечает за начальный этап синтеза стероидных гормонов. Повышение активности фермента имеется у людей, у которых отсутствует аллель 4R.
INS – ген инсулина. VNTR означает варьирующее число тандемных повторов. В зависимости от числа тандемных повторов различают полиморфизмы класса I (малое число), класса II (среднее число) и класса III (высокое число). Чем длиннее зона VNTR, тем активнее происходит транскрипция находящихся по соседству генов INS (инсулина) и IGF2 (инсулиноподобного фактора роста II). У носителей аллелей III имеется более высокий фоновый (натощак) уровень инсулина, повышается риск абдоминального ожирения, СПКЯ и СД2.
AR (ген рецептора андрогенов). VNTR гена AR связан с чувствительностью тканей к андрогенам. Ген находится на X хромосоме, поэтому у мужчин имеется в одном варианте, у женщин – в двух вариантах. Количество повторов в европейской популяции колеблется от 11 до 31. Среднее значение – 20. Ген ассоцирован с неслучайной инактивацией X-хромосомы: в каждой клетке у женщины работает только одна из двух Х хромосом. Рабочей в большинстве клеток будет та, на которой меньшее количество повторов. Риск будет тем выше, чем ближе меньшее значение или среднее значение к 11R.
rs1801282 гена PPARG2 (рецептора пероксисом гамма-2). Наличие SNP rs1801282 гена PPARG2 ассоциировано с трехкратным повышением риска инсулинорезистентности, ожирения и СПКЯ.
Образец результата анализа:
| AR | Рецептор андрогенов | Метаболизм андрогенов | (CAG)n | Exon1 | 20R/22R* |
| CYP11A | цитохром P450scc | Биосинтеза стероидных гормонов | (TAAAA)n | Promotor | 4R/6R* |
| INS-VNTR | инсулин | Метаболизм глюкозы | -23NphI (rs689) | VNTR class I/III | I/I ** |
| PPARG’ | рецептор активатора пероксисом | Метаболический синдром | C/G | Pro12Ala | C/G *** |
* количество повторов в каждом из генов
** гомозиготное состояние по нормальному гену
*** данный ген находится в гетерозиготном состоянии
Pparg ген за что отвечает
Исследуется для выявления эффективности аэробных тренировок, риска инсулинорезистентности, генетической предрасположенности к сахарному диабету 2-го типа, предрасположенности к увеличению массы тела, накоплению жировой ткани.
Полиморфизм длин рестрикционных фрагментов.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
OMIM
Локализация гена на хромосоме
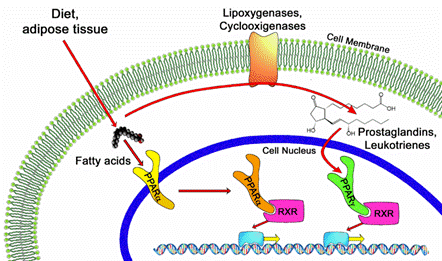
Ген PPARG кодирует белок – рецептор, активируемый пролифераторами пероксисом, гамма-ядерный рецептор, регулирующий экспрессию генов, участвующих в дифференцировке клеток, в метаболизме мышечных тканей и определяющих обмен жиров и углеводов.
Генетический маркер C68777G
Участок ДНК в кодирующей белок области гена PPARG, в котором цитозин (С) заменяется на гуанин (G), называется генетическим маркером C68777G. В результате происходит замена аминокислоты пролин на аланин (Pro12Ala) в позиции 12 аминокислотной последовательности белка PPARG.
Возможные генотипы
Встречаемость в популяции
Встречаемость G-аллеля в европейской популяции составляет 12 %.
Ассоциация маркера с заболеваниями
Общая информация об исследовании
Жиры необходимы любому организму как источник энергии и незаменимый компонент жизнедеятельности клетки. Нет ни одного биологического процесса, в котором липиды не играли бы регуляторной роли. Нарушения обмена липидов (избыток свободных жирных кислот в крови и накопление метаболически активной жировой ткани в брюшной полости и других органах) являются источником хронического неконтролируемого системного воспаления, которое может стать причиной развития атеросклероза и его ишемических осложнений, артериальной гипертензии, сахарного диабета 2-го типа, гепатостеатоза и многих других заболеваний.
Пероксисомы – это клеточные структуры, участвующие в окислении жирных кислот, синтезе липидов, холестерина, обезвреживающие токсичные вещества, а также выполняющие множество других функций. Они представляют собой микротельца, богатые аэробными дегидрогеназами и каталазой.
Ключевыми регуляторами обмена липидов являются рецепторы, активируемые пролифераторами пероксисом (Peroxisome proliferator-activated receptor (PPAR). Свое название они получили из-за того, что оказались способными связывать активирующие пероксисомы вещества в клетках лягушек. В клетках человека PPAR не стимулируют пролиферацию пероксисом, но активно участвуют в углеводном и липидном обмене.
Белки PPAR различают трех типов: PPARα, PPARγ и PPARβ/δ. Они синтезируются в основном в жировой ткани и активируются жирными кислотами и их производными (окисленные ненасыщенные жирные кислоты, такие как олеиновая, линоленовая, эйкозапентаеновая и арахидоновая) и служат так называемыми липидными датчиками организма, при активации которых метаболизм углеводов и липидов может изменяться.
PPAR являются транскрипционными факторами, т.е. белками, регулирующими экспрессию целого ряда других генов, участвующих в обмене углеводов и липидов, в воспалительных и других процессах, протекающих в организме. Липиды, стимулирующие хроническое воспаление, активируют PPAR, которые выступают в роли противовоспалительных факторов, тормозящих активность провоспалительных ядерных транскрипционных факторов.
Рецептор, активируемый пролифераторами пероксисом, гамма (PPAR-γ), кодируется геном PPARG. В результате альтернативного сплайсинга могут синтезироваться четыре изоформы белка PPAR-γ: PPAR-γ-1, PPAR-γ-2, PPAR-γ-3 и PPAR-γ-4, имеющие разное количество аминокислот в своей полипептидной последовательности. Продукт гена PPARG регулирует дифференцировку адипоцитов, а также метаболизм липидов и чувствительность к инсулину.
Самые высокие уровни PPAR-γ-2 наблюдаются в жировой ткани и толстой кишки, промежуточный уровень – в почках, печени и тонком кишечнике, и едва обнаруживаются в мышцах. Участок ДНК в кодирующей белок области гена PPARG, в котором цитозин (С) заменяется на гуанин (G), называется генетическим маркером C68777G. Происходит замена аминокислоты пролин на аланин (Pro12Ala) в позиции 12 аминокислотной последовательности изоформы PPAR-γ-2. В результате такой замены снижается способность PPAR-γ-2 связываться с промоторами генов-мишеней, которые он активирует.
Среди группы людей среднего возраста и пожилых лиц, не страдающих диабетом, было обнаружено, что аллель G ассоциирован со сниженной инсулинорезистентностью. При изучении полиморфизма у больных сахарным диабетом II типа было выявлено, что аллель С ассоциирован с повышенным риском развития данного заболевания. Замена пролина на аланин в белке (аллель G) приводит к повышению чувствительности к инсулину и повышению утилизации глюкозы, что и служит защитой от развития сахарного диабета.
При изучении влияния полиморфизма гена PPARG на предрасположенность к увеличению массы тела было показано, что индекс массы тела, уровень свободных жирных кислот и лейкоцитов ниже у пациентов с генотипом G/G по сравнению с лицами с C/C или C/G генотипами. Генотип G/G может обеспечивать защиту от раннего атеросклероза у лиц с риском развития диабета.
Полиморфизм гена PPARG также оказывает влияние на восприимчивость к занятиям спортом. В группе высококвалифицированных спортсменов, занимающихся видами спорта с преимущественно анаэробным характером энергообеспечения (спринтеры), аллель G гена PPARG встречается чаще, чем в группах спортсменов, занимающихся видами спорта с преимущественно аэробным характером энергообеспечения (стайеры). Возможно, данные отличия возникли в процессе многолетнего отбора, так как G-аллель способствует высокой спортивной работоспособности в данных видах спорта (устанавливает необходимый уровень контроля липидного и углеводного обмена в мышечной ткани).
Среди спортсменов, занимающихся видами спорта с преимущественно анаэробными механизмами энергообеспечения, G-аллель чаще встречается у бегунов на короткие дистанции.
Результаты исследования должны интерпретироваться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Для данного маркера не существует понятия «норма» и «патология», т. к. исследуется полиморфизм гена.
ДНК-диета
Для поддержания хорошей физической формы, сохранения фигуры тела и хорошего здоровья для организма необходима достаточная физическая нагрузка и правильное питание. Однако в современном мире эти правила очень сложно соблюдать, и наш организм отвечает увеличением массы (ожирение) и развитием метаболических нарушений, приводящих к сахарному диабету, артериальной гипертензии, атеросклерозу, артрозу и т. п. Это состояние принято называть «метаболический синдром». Но, находясь в равных условиях жизни, не у всех людей развивается метаболический синдром. Следовательно, существуют внутренние факторы организма, не зависящие от окружающей среды, которые регулируют обменные процессы. Особенность работы этих систем определяется генетическим кодом или определенным набором ДНК, которые являются основой человеческого организма и определяют его суть.
В «догенетическую» эру ученые вывели формулу метаболического синдрома: преобладание поступления калорий над их расходом. Так же было доказано, что ограничение в рационе жиров и простых углеводов (сладости и выпечка) приводит к снижению веса. Но на практике оказалось, что эффективность этих мероприятий не у всех одинакова, так же как и появление определенных болезней или особенностей течения заболеваний. Это объясняется наличием у каждого человека своего, индивидуального, набора генов, который кодирует все процессы жизнедеятельности и делает человека не похожим ни на кого больше.
В настоящее время разработано большое количество генетических тестов, определяющих генотип тех или иных метаболических процессов человеческого организма, склонность к определенным заболеваниям, переносимость лекарственных препаратов, а так же пищевых продуктов. Учеными Стэнфорского университета был разработан нутригенетический тест, который включал в себя анализ участков ДНК, наиболее тесно связанных с набором веса.
ДНК-диета — генетическое исследование полиморфизма определенных генов, отвечающих за метаболизм жиров и углеводов, а так же за чувствительность организма к определенным физическим нагрузкам. Гены, входящие в этот тест, в зависимости от их строения определяют количество жира, которое усваивается из еды, или меняют углеводный обмен. Всего для теста было определено 4 гена и 5 их модификаций:
Pparg ген за что отвечает
Начнем рассказ про очередную гонку на миллиарды: биотех-компании соревнуются, кто первым найдет лекарство от неалкогольного жирового стеатогепатита, НАСГ.
Итак, у нас есть НАСГ (неалкогольный жировой стеатогепатит, non-alcoholic steatohepatitis, NASH) — он более страшный, развивается из НАЖБП. И есть НАЖБП (неалкогольное жировое поражение печени, nonalcoholic fatty liver disease, NAFLD) — менее страшное, более общее название, достаточно распространённая штука: в мире им болеет каждый четвёртый [1]. Только в США это 75–100 млн человек: возникает у 90% людей с ожирением, у 60% диабетиков и даже у каждого пятого человека с нормальным весом [2,3].
НАЖБП — это заболевание, при котором в клетках печени накапливается жир. И, как следует из названия, связано это накопление не с употреблением алкоголя, а с чем-то другим: вирусы, диета (много омега-6 жирных кислот и фруктозы, характерные для западной диеты, американской в частности), генетика. Это спутница метаболического синдрома: чем больше в популяции людей, страдающих нарушением обмена веществ, тем больше людей с больной и «жирной» печенью.
Нам, изучающим старение, НАЖБП тоже интересна: с возрастом риск её развития увеличивается [4], в чём, скорее всего, играют роль возраст-зависимые изменения метаболизма, гормонов и микробиоты. 10-летняя выживаемость у пациентов с НАЖБП составляет около 80%.
Неалкогольное жировое поражение печени бывает двух типов: неалкогольная жировая дистрофия (НАФЛ, она полегче) и неалкогольный стеатогепатит (НАСГ, он тяжелее, развивается у 20% пациентов с НАЖБП). Почему к кому-то в результате приходит НАСГ, а кто-то отделывается НАФЛ, непонятно [5]. НАСГ отличается в том числе воспалением и фиброзом, позднее может развиться рак печени.
Есть ещё одна неприятность с этой печенью: НАЖБП, и НАСГ в частности, долгое время остаются незамеченными, выражаются в размытых и непонятных синдромах — в слабости и недомогании [6]. И только когда печень совсем серьезно повреждена, появляются боль, желтуха и даже накопление жидкости в брюшине, сама печень увеличивается. Так что НАЖБП и НАСГ нужно диагностировать как можно раньше.
В общем, рынок НАСГ, он же NASH, огромный, пациентов очень много, и находятся они в смертельной опасности.
Основные пищевые источники омега-3-ненасыщенных жирных кислот. Основной — это рыба: жирная морская рыба, рыбий жир и морепродукты (особенно мелкая рыба, находящаяся в самом низу пищевой цепочки: скумбрия, анчоусы, сардины и сельдь, а также тунец, пикша и форель). Размолотые семена льна и льняное масло, семена чиа, рыжиковое, горчичное и рапсовое масло, семена технической конопли и её масло, листья портулака и шпината, морские водоросли, мясо диких животных.
Соотношение омега-6/омега-3 жирных кислот в пище должно быть от 1/1 до 4/1. То есть Омега-6 всегда больше, но должно быть не более, чем в 4 раза больше.
Диета
Потребление калорий и состав питательных веществ играют ключевую роль при НАЖБП. Потребление фруктозы связано со стеатозом печени, ожирением и инсулинорезистентностью, играет ключевую роль в запуске воспаления печени и, соответственно, в развитии НАСГ. Насыщенные диетические жиры индуцируют липогенез de novo, стресс эндоплазматического ретикулума и апоптоз. Потребление трансжиров связано с НАЖБП. Холестерин, избыток железа и низкий уровень меди связаны с НАСГ.
Западная диета включает большое количество насыщенных жиров и полиненасыщенных жирных кислот (ПНЖК) омега-6 и небольшое количество ПНЖК омега-3. Было показано, что этот дисбаланс связан с воспалением и развитием НАСГ. Недавнее исследование показало, что красное мясо и переработанное мясо связаны с инсулинорезистентностью и НАЖБП, но для подтверждения этого вывода необходимы более крупные исследования [8].
Это схема про развития HCC через этапы NASH/NAFLD. Но здесь также интересны указанные риск-факторы и сроки развития заболеваний.
Иллюстрация Jill K. Gregory, CMI. Mount Sinai Health System из статьи Natural history of nonalcoholic steatohepatitis/nonalcoholic fatty liver disease-hepatocellular carcinoma: Magnitude of the problem from a hepatology clinic perspective: Natural History of NASH/NAFLD-HCC, 2016.
Генетика
Два гена, PNPLA3 и TM6SF2, связаны с риском накопления жиров в печени.
Также было определено множество других генов, скорее всего, участвующих в развитии НАЖБП и НАСГ, роль которых до конца не изучена. Логично, что эти гены вовлечены в метаболизм жиров, сигнальные пути инсулина, воспаление, окислительный стресс и другие процессы.
Эпигенетика
Некоторые метилированные гены (FGFR2, MAT1A и CASP1) могут различать пациентов с запущенным НАСГ и пациентов с простым стеатозом.
МикроРНК
Было показано, что экспрессия в печени определенных miRNA, включая miR-181a, miR-34a, miR-122, miR-200 и miR-192, коррелирует с гистологическими особенностями НАСГ. Здесь важно не забывать, что корреляция не означает каузацию. Тем не менее, микроРНК-терапия может сработать.
Микробиом играет важную роль, есть разница между микробиомом тех, у кого НАСГ и тех у кого НАЖБП. Здесь то же самое: непонятно, сработает ли терапия, направленная на микробиом, но почему бы и нет.