острый лейкоз у детей симптомы прогноз для жизни
Острый лейкоз у детей симптомы прогноз для жизни
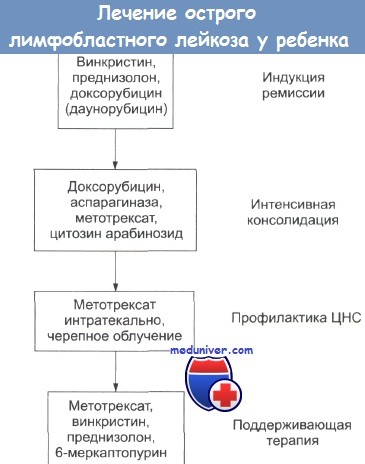
Индукция и консолидация ремиссии при острой лейкемии. Существует риск смертельного исхода в первые несколько недель индукционной терапии. Этот риск можно свести к минимуму поддерживающими мероприятиями в процессе проведения химиотерапии или перед ее началом. Необходимо корректировать анемию.
Если почки увеличены или повышается уровень креатинина, то сильно возрастает риск возникновения синдрома лизиса опухоли. Необходимо принять меры для предотвращения и лечения этих осложнений. В более тяжелых случаях, таких как В-клеточная ОЛЛ и ОМЛ, может оказаться необходимой терапия, направленная на поддержание уровня тромбоцитов.
Инфекции необходимо выявлять на ранних стадиях и принимать решительные меры (см. также острая лейкемия у взрослых, поддерживающая терапия). Обычно гематологическая и клиническая ремиссия при ОЛЛ достигается использованием винкристина, преднизолона и L-аспарагиназы. В период индукции необходимы усиленная гидратация, аллопуринол и лекарства, понижающие кислотность мочи.
При таких мероприятиях обычно до 95% пациентов достигает состояния ремиссии в течение трех недель. У детей с В-клеточной ОЛЛ и в случае других плохих прогнозов эти стандартные приемы терапии не дают эффекта. Необходимы более интенсивные процедуры с использованием циклофосфамида, цитозинарабинозида, антрациклинов и метотрексата.
При ОМЛ ремиссия индуцируется цитозином и даунорбуцином. Новейшими исследованиями была дана оценка использованию дополнительных препаратов, таких как тиогуанин и этопозид. Миелосупрессия намного более выражена при использовании этих препаратов и необходима привычная поддерживающая терапия.
Полной или частичной ремиссии при ОЛЛ достигают интенсификацией лечения с использованием аспарагиназы, антрациклина (даунорбуцина, доксорбуцина), цитозинарабинозида и циклофосфамида. Метотрексат в высоких дозах увеличивает продолжительность ремиссии. Эти лекарства являются миелосупрессорами, но на данной стадии костный мозг восстанавливается вслед за гибелью большинства популяций лейкемических клеток.
Интенсификация при ОМЛ ставит большую проблему в лечении. Результат стандартной интенсивной химиотерапии улучшается в тех случаях, когда удачно проведена аллогенная трансплантация. Для многих детей трудно подобрать доноров, остается единственная возможность использовать подходящего неродственного донора для пациентов с высоким риском рецидива после достигнутой ремиссии, в таких случаях как моносомия 7 или аутологичная ТКМ (обычно назначаемая после нескольких циклов интенсивной стандартной терапии). В настоящее время эти различные подходы изучаются.
Поддерживающая терапия при детской лимфобластиой лейкемии
Продолжительность «поддерживающей» химиотерапии не может быть установлена. При более интенсивных мероприятиях индукции и консолидации представляется возможным снижение длительности поддерживающей терапии. Широко используют лекарства, такие как 6-меркаптопурин и метотрексат, часто в сочетании с винкристином и преднизолоном. В случаях плохих прогнозов используют более жесткие режимы, например лучевую терапию.
В конце курса лечения берут биопсию яичников (если профилактическое облучение не применяли) для определения латентного заболевания. Рецидивы, в некоторых случаях возникающие через год после лечения, прекращаются. Тиогуанин не используют при поддерживающей терапии, поскольку его длительное применение повышает риск возникновения спленомегалии и портальной гипертензии из-за закупорки протоков печени (без цирроза).
Профилактика заболеваний центральной нервной системы
Важность профилактики нарушений со стороны ЦНС была продемонстрирована в начале 1970-х годов. До этого времени инфильтрация мозговых оболочек лейкемическими клетками являлась причиной возникающих рецидивов в половине всех случаев. Лимфобласты проникают в мозговые оболочки диффузно и распространяются до оболочек спинного мозга и черепно-мозговых нервов.
Профилактика в значительной мере уменьшает частоту рецидивов со стороны нервной системы. В настоящее время обычный режим включает в себя черепное облучение (18 Гр в 8-10 фракциях в течение 2 недель) и интратекальное введение метотрексата (10 мг/см2 4 раза в период облучения). Однако отдаленные последствия облучения ЦНС заставляют искать способы избежать профилактического облучения.
Результаты непросто интерпретировать. Кажется, что для «типичного риска» (WBC ниже 50 х 109/л) интратекальное введение метотрексата является адекватной профилактической мерой, а облучение ЦНС необходимо в случаях повышенного риска. Непонятно, как дополнительные лекарства (такие как цитозинарабинозид) способствуют улучшению состояния.
В случае установленных поражений ЦНС (которые сейчас возникают в 5-10% случаев) применяют интратекальное введение метотрексата дважды в неделю вместе с черепным облучением в более высоких дозах (24 Гр в течение 2-3 недель) и вместе (или с последующим) облучением спинного мозга. В постоянном контроле состояния ЦНС, однако, нет необходимости. Пациентам, которые устойчивы к метотрексату, необходимо интратекальное введение цитозинарабинозида.
Профилактика и лечение тестикулярных нарушений
Рецидив заболеваний яичек происходит часто. Это одна из причин худшего прогноза для мальчиков при ОЛЛ. Частота тестикулярных рецидивов может быть снижена в режимах, использующих высокую дозу метотрексата. Это происходит у 25% мальчиков пубертатного возраста, но менее распространено у более взрослых детей. Рецидив клинически может проявляться не всегда видимой первичной припухлостью, которая позднее иногда затвердевает.
Возникает обычно в обоих яичках, тестикулярная биопсия выявляет претубулярную лейкемическую инфильтрацию. В лечении применяют облучение яичек обычно в дозах порядка 24 Гр в течение 2-3 недель. Необходимость профилактического облучения до сих пор не выяснена.
Лечение рецидивов острой лейкемии у ребенка
Если рецидив у детей возникает при поддерживающей терапии или через год после прекращения лечения, прогноз плохой и необходима ТКМ. Поздние рецидивы купируются с помощью режимов интенсивной терапии и достигаемые ремиссии достаточно устойчивы, хотя и не в каждом случае, однако необходимость ТКМ может рассматриваться и для этой группы больных.
Аллогенная ТКМ применялась в попытках улучшить результаты у детей с плохим прогнозом при ОЛЛ. Эта процедура не имеет достоверно показанного преимущества в выживании в сравнении с химиотерапией рецидива в группе стандартного риска при ОЛЛ.
Следующие клинические ситуации рассматривают как показания к применению аллогенной ТКМ: вторая или третья ремиссия, особенно если рецидив возник во время проведения поддерживающей терапии; случаи плохого прогноза, такие как t(4;11), острая недифференцируемая лейкемия (AUL), t(8;14) В-клеточная ОЛЛ и Ph’-положительная ОЛЛ. Такие дети могут иметь преимущества перед теми, кому ТКМ назначают после первой ремиссии.
Результаты ТКМ при первой ремиссии в группе высокого риска обнадеживают. В 55% случаев отмечают период трех лет жизни без рецидивов. В группе стандартного риска при второй ремиссии — в 65% случаев фиксируют 5-летний период жизни без рецидивов. Результаты в значительной мере зависят от факторов, используемых при отборе пациентов.
Аутологичная ТКМ или трансплантация стволовых клеток имеет, в целом, меньший успех, чем аллогенная, возможно потому, что костный мозг оказывается инфицированным, а также, потому, что некоторые высокодозовые режимы не включают в себя тотальное облучение тела (ТО). Новые лечебные режимы, включающие в себя комбинацию химиотерапии и ТО, могут дать улучшение результатов ТКМ. При аллогенной ТКМ смертность выше, чем при аутологичной, частично потому, что происходит отторжение трансплантата.
Если, несмотря на профилактику, возникают рецидивы со стороны ЦНС, можно вызвать ремиссию интратекальным введением метотрексата или краниоспинальным облучением. Метотрексат можно вводить через резервуар Оммая или Рикхама, который позволяет непосредственно доставлять лекарство в церебрально-вентрикулярную систему. Систематические рецидивы неизбежны, поэтому в дальнейшем обычно требуется систематическая терапия.
Рецидив ОМЛ является серьезным событием. При традиционной реиндукционной химиотерапии только 20% детей остается живыми в течение двух лет, поэтому предприняты попытки интенсификации процедур индукции ремиссии после первого рецидива с использованием аллогенной и аутологичной трансплантации. Представляется возможным, что хотя бы каждый третий ребенок с рецидивом ОМЛ мог быть излечен этим методом.
Прогноз острой лейкемии у ребенка
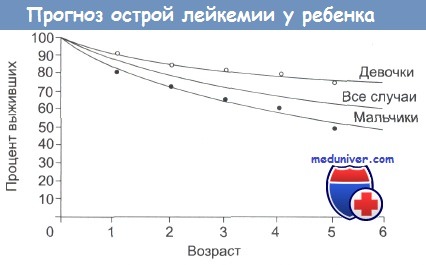
Важные прогностические признаки представлены в таблице ниже. Выживаемость среди девочек выше, чем среди мальчиков. Последствия лечения продолжают рассматриваться. Они включают в себя неврологические осложнения после облучения ЦНС и позвоночника, которые приводят к рассмотрению целесообразности уменьшения дозы облучения и использования в случаях небольшого риска.
Осложнение в виде опухоли мозга, индуцированное облучением ЦНС, наиболее распространено у детей, проявляющих полиморфизм по ферменту, детоксицирующему меркаптопурин (тиопуринметилтрансфераза), что делает их в большей степени подверженными острой токсичности и развитию вторичной ОМЛ. Эти соображения являются основными для введения адаптированных к риску стратегий лечения, которые включают известные прогностические факторы, но превносят быстрый результат и минимальные остаточные проявления болезни. Использование технологии микрозондирования может сделать возможным дальнейшее улучшение в решении задач лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лейкоз у детей
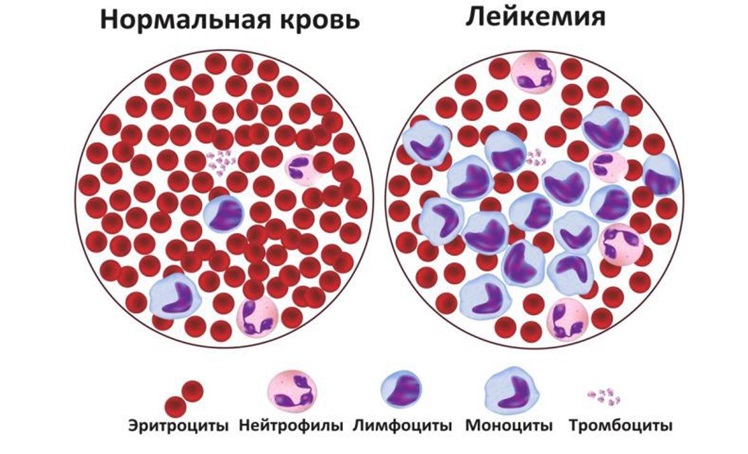
Лейкоз у детей – злокачественное заболевание крови, характеризующееся опухолевой пролиферацией незрелых клеток-предшественников лейкоцитов. Клинические проявления лейкоза у детей могут включать увеличение лимфатических узлов, геморрагический синдром, боли в костях и суставах, гепатоспленомегалию, поражение ЦНС и др. Диагностике лейкоза у детей способствует развернутый общий анализ крови, проведение стернальной пункции с исследованием пунктата костного мозга. Лечение лейкоза у детей проводится в специализированных гематологических стационарах с помощью химиотерапии, иммунотерапии, заместительной терапии, трансплантации костного мозга.
Общие сведения
Лейкоз у детей (лейкемия) – системный гемобластоз, сопровождающийся нарушением костномозгового кроветворения и замещением нормальных клеток крови незрелыми бластными клетками лейкоцитарного ряда. В детской онкогематологии частота лейкозов составляет 4-5 случаев на 100 тыс. детей. Согласно статистике, острый лейкоз является самым частым онкологическим заболеванием детского возраста (примерно 30%); наиболее часто рак крови поражает детей в возрасте 2-5 лет. Актуальной проблемой педиатрии служит наблюдаемая в последние годы тенденция к росту заболеваемости лейкозами среди детей и сохраняющаяся высокая летальность.
Причины лейкоза у детей
Некоторые аспекты развития лейкоза у детей до настоящего времени остаются неясными. На современном этапе доказано этиологическое влияние радиационного излучения, онкогенных вирусных штаммов, химических факторов, наследственной предрасположенности, эндогенных нарушений (гормональных, иммунных) на частоту возникновения лейкоза у детей. Вторичный лейкоз может развиться у ребенка, перенесшего в анамнезе лучевую или химиотерапию по поводу другого онкологического заболевания.
На сегодняшней день механизмы развития лейкоза у детей принято рассматривать с точки зрения мутационной теории и клоновой концепции. Мутация ДНК кроветворной клетки сопровождается сбоем дифференцировки на стадии незрелой бластной клетки с последующей пролиферацией. Таким образом, лейкозные клетки – есть не что иное, как клоны мутировавшей клетки, неспособные к дифференцировке и созреванию и подавляющие нормальные ростки кроветворения. Попадая в кровь, бластные клетки разносятся по всему организму, способствуя лейкемической инфильтрации тканей и органов. Метастатическое проникновение бластных клеток через гематоэнцефалический барьер приводит к инфильтрации оболочек и вещества головного мозга и развитию нейролейкоза.
Отмечено, что у детей с болезнью Дауна лейкоз развивается в 15 раз чаще, чем у других детей. Повышенный риск развития лейкоза и других опухолей имеется у детей с синдромами Ли-Фраумени, Клайнфельтера, Вискотт-Олдрича, Блума, анемией Фанкони, первичными иммунодефицитами (Х-сцепленной агаммаглобулинемией, атаксией-телеангиэктазией Луи-Барр и др.), полицитемией и др.
Классификация лейкоза у детей
На основании продолжительности заболевания выделяют острую (до 2-х лет) и хроническую (более 2-х лет) формы лейкоза у детей. У детей в абсолютном большинстве случаев (97%) встречаются острые лейкозы. Особую форму острого лейкоза у детей представляет врожденный лейкоз.
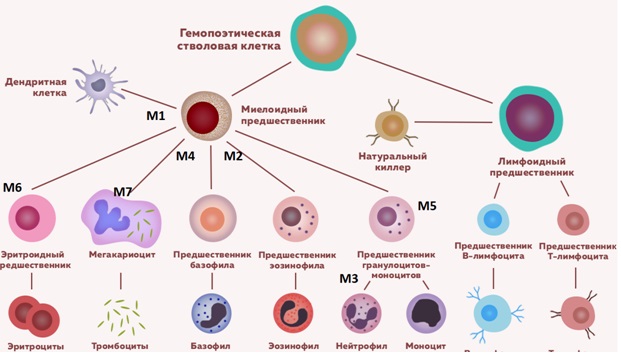
В ряду нелимфобластных лейкозов, в зависимости от преобладания тех или иных бластных клеток, различают миелобластный малодифференцированный (M1), миелобластный высокодифференцированный (М2), промиелоцитарный (М3), миеломонобластный (М4), монобластный (М5), эритромиелоз (М6), мегакариоцитарный (М7), эозинофильный (М8), недифференцированный (М0) лейкоз у детей.
В клиническом течении лейкоза у детей выделяют 3 стадии, с учетом которых выстраивается лечебная тактика.
Симптомы лейкоза у детей
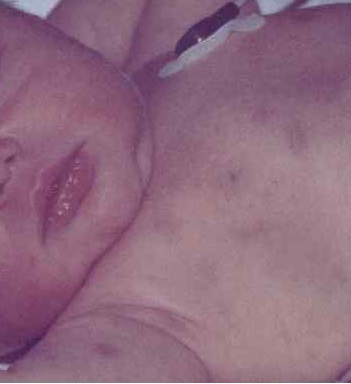
В большинстве случаев клиника лейкоза развивается исподволь и характеризуется неспецифическими симптомами: утомляемостью ребенка, нарушением сна, снижением аппетита, оссалгиями и артралгиями, немотивированным повышением температуры тела. Иногда лейкоз у детей манифестирует внезапно с интоксикационного или геморрагического синдрома.
У детей, страдающих лейкозом, отмечается выраженная бледность кожных покровов и слизистых оболочек; иногда кожа приобретает желтушный или землистый оттенок. Вследствие лейкемической инфильтрации слизистых оболочек у детей нередко возникают гингивит, стоматит, тонзиллит. Лейкемическая гиперплазия лимфатических узлов проявляется лимфаденопатией; слюнных желез – сиаладенопатией; печени и селезенки – гепатоспленомегалией.
Для течения острого лейкоза у детей типичен геморрагический синдром, характеризующийся кровоизлияниями в кожу и слизистые, гематурией, носовыми, маточными, желудочно-кишечными, легочными кровотечениями, кровоизлияниями в полость суставов и др. Закономерным спутником острого лейкоза у детей является анемический синдром, обусловленный угнетением эритропоэза и кровотечениями. Выраженность анемии у детей зависит от степени пролиферации бластных клеток в костном мозге.
Кардиоваскулярные расстройства при лейкозах у детей могут выражаться развитием тахикардии, аритмии, расширением границ сердца (по данным рентгенографии органов грудной клетки), диффузными изменениями миокарда (по данным ЭКГ), снижением фракции выброса (по данным ЭхоКГ).
Интоксикационный синдром, сопровождающий течение лейкоза у детей, протекает со значительной слабостью, лихорадкой, потливостью, анорексией, тошнотой и рвотой, гипотрофией. Проявлениями иммунодефицитного синдрома при лейкозе у детей служит наслоение инфекционно-воспалительных процессов, которые могут принимать тяжелое, угрожающее течение. Гибель детей, страдающих лейкозом, нередко происходит вследствие тяжелой пневмонии или сепсиса.
Крайне опасным осложнением лейкоза у детей является лейкемическая инфильтрация головного мозга, мозговых оболочек и нервных стволов. Нейролейкоз сопровождается головокружением, головной болью, тошнотой, диплопией, ригидностью затылочных мышц. При инфильтрации вещества спинного мозга возможно развитие парапареза ног, нарушения чувствительности, тазовых расстройств.
Диагностика лейкоза у детей
Ведущая роль в первичном выявлении лейкозов у детей принадлежит педиатру; дальнейшее обследование и ведение ребенка осуществляется детским онкогематологом. Основу диагностики лейкозов у детей составляют лабораторные методы: исследование периферической крови и костного мозга.
Стернальная пункция и исследование миелограммы являются обязательными в диагностике лейкоза у детей. Решающим аргументом в пользу заболевания служит содержание бластных клеток от 30% и выше. При отсутствии четких данных за лейкоз у детей по результатам исследования костного мозга, прибегают к трепанобиопсии (пункции подвздошной кости). Для определения различных вариантов острого лейкоза у детей выполняются цитохимические, иммунологические и цитогенетические исследования. С целью подтверждения диагноза нейролейкоза проводится консультация детского невролога и детского офтальмолога, люмбальная пункция и исследование цереброспинальной жидкости, рентгенография черепа, офтальмоскопия.
Вспомогательное диагностическое значение имеют УЗИ лимфатических узлов, УЗИ слюнных желез, УЗИ печени и селезенки, УЗИ мошонки у мальчиков, рентгенография органов грудной клетки, КТ у детей (для выявления метастазов в различных анатомических регионах). Дифференциальную диагностику лейкозов у детей следует проводить с лейкозоподобной реакцией, наблюдаемой при тяжелых формах туберкулеза, коклюше, инфекционном мононуклеозе, цитомегаловирусной инфекции, сепсисе и имеющей обратимый транзиторный характер.
Лечение лейкоза у детей
Дети с лейкозами госпитализируются в специализированные учреждения онкогематологического профиля. В целях профилактики инфекционных осложнений ребенок помещается в отдельный бокс, условия в котором максимально приближенны к стерильным. Большое внимание уделяется питанию, которое должно быть полноценным и сбалансированным.
Основу лечения лейкозов у детей составляет полихимиотерапия, направленная на полную эрадикацию лейкозного клона. Протоколы лечения, используемые при острых лимфобластных и миелобластных лейкозах, различаются комбинацией химиопрепаратов, их дозами и способами введения. Поэтапное лечение острого лейкоза у детей предполагает достижение клинико-гематологической ремиссии, ее консолидацию (закрепление), поддерживающую терапию, профилактику или лечение осложнений.
В дополнение к химиотерапии может проводиться активная и пассивная иммунотерапия: введение лейкозных клеток, вакцины БЦЖ, противооспенной вакцины, интерферонов, иммунных лимфоцитов и др. Перспективными методами лечения лейкоза у детей служит трансплантация костного мозга, пуповинной крови, стволовых клеток.
Симптоматическая терапия при лейкозах у детей включает переливание эритроцитарной и тромбоцитарной массы, проведение гемостатической терапии, антибиотикотерапию инфекционных осложнений, дезинтоксикационные мероприятия (внутривенные инфузии, гемосорбцию, плазмосорбцию, плазмаферез).
Прогноз лейкоза у детей
Перспективы развития заболевания определяются многими факторами: возрастом возникновения лейкоза, цитоиммунологическим вариантом, стадией диагностирования и т. д. Худший прогноз следует ожидать у детей, заболевших острым лейкозом в возрасте до 2-х лет и старше 10-ти лет; имеющих лимфаденопатию и гепатоспленомегалию, а также нейролейкоз на момент установления диагноза; Т- и В-клеточные варианты лейкоза, бластный гиперлейкоцитоз. Прогностически благоприятными факторами служат острый лимфобластный лейкоз L1 типа, раннее начало лечения, быстрое достижение ремиссии, возраст детей от 2 до 10 лет. У девочек с острым лимфобластным лейкозом вероятность излечение несколько выше, чем у мальчиков.
Отсутствие специфического лечения лейкоза у детей сопровождается 100%-ной летальностью. На фоне современной химиотерапии пятилетнее безрецидивное течение лейкоза отмечается у 50-80% детей. О вероятном выздоровлении можно говорить после 6-7 лет отсутствия рецидива. Во избежание провокации рецидива детям не рекомендуется физиотерапевтическое лечение, изменение климатических условий. Вакцинопрофилактика проводится по индивидуальному календарю с учетом эпидемической ситуации.
Лейкозы у детей: симптомы, диагностика, лечение
Лейкозы относятся к большой группе злокачественных новообразований системы крови под названием «гемобластозы». Лейкоз (от греческого слова «leukos» — белый) — злокачественная опухоль, возникающая из ранних незрелых кроветворных клеток костного мозга и метастазирующая из костного мозга в кровь, лимфатические узлы, печень, селезенку, головной мозг, спинной мозг и другие органы и ткани.
Все лейкозы можно разделить на острые лимфобластые, острые миелоидные лейкозы (ОМЛ) и хронический миелолейкоз.
Острый лимфобластный лейкоз
Более 80% всех лейкозов у детей составляет острый лимфобластный лейкоз (ОЛЛ). Причиной его развития является химерный ген TEL/AML, формирование которого происходит внутриутробно, возможно, в результате спонтанных ошибок в процессе репликации и репарации ДНК. Накопление генетических аномалий в опухолевом клоне ведет к блоку нормальной клеточной дифференцировки и нарушениям в процессе пролиферации и апоптоза.
В соответствии с франко-американо-британской (FAB) классификацией выделяют три морфологических варианта: L1, L2, L3.
Клинические симптомы ОЛЛ обусловлены степенью инфильтрации костного мозга лимфобластами, а также наличием экстрамедуллярного распространения процесса. Нередко отмечаются общие симптомы опухолевой интоксикации, а именно, повышение температуры тела, снижение аппетита, слабость, вялость. В течение процесса выделяют несколько периодов: начальный, развернутый, период ремиссии.
Развернутый период характеризуется бурным началом, многообразием клинических симптомов. К симптомам общей интоксикации присоединяются костные боли вследствие лейкозной инфильтрацией костной ткани (чаще поражаются диафизы длинных трубчатых костей), артралгии, вызванные лейкемической инфильтрацией суставов. Кожные покровы и слизистые становятся бледными. К сожалению, нередко на них появляются кровоизлияния, обусловленные геморрагическим синдромом, а также кровотечения (носовые, желудочно-кишечные, почечные). Увеличение периферических лимфатических узлов (шейно-надключичных, подмышечных, паховых) является одним из основных симптомов заболевания. Практически у всех пациентов отмечается обусловленное пролиферацией лейкозных клеток увеличение печени и селезенки. В некоторых случаях у пациентов поражение кожи и слизистых оболочек проявляется в виде лейкемидов, некроза, гингивита и стоматита.
Таким образом, можно выделить несколько симптомокомплексов, характерных для ОЛЛ:
При диагностике оцениваются морфологические особенности бластов костного мозга и периферической крови. Помимо обнаружения опухолевых клеток лимфоидной линии кроветворения при окраске по Романовскому – Гимзе, проводятся следующие методы исследования:
Для подтверждения диагноза ОЛЛ необходимо комплексное обследование, в котором ведущая роль отводится морфологическому методу.
В настоящее время используются программы лечения BFM (БФМ: Берлин-Франкфурт-Мюнстер) и МВ (МБ: Москва-Берлин).
Все лечение можно разделить на базисное и сопроводительное. Базисная терапия представляет собой системную и локальную химиотерапию и, при необходимости, лучевую терапию. Сопроводительное лечение обязательно назначается для профилактики инфекционных осложнений и коррекции постцитостатических реакций. Выделяют следующие этапы в лечении злокачественных процессов: индукция ремиссии, консолидация ремиссии (как правило, несколько фаз), поддерживающее лечение.
Острый миелоидный лейкоз
Острый миелоидный лейкоз составляет 15% всех острых лейкозов у детей. Существующая FAB-классификация (Франко-Американо-Британская) позволяет разделить ОМЛ на следующие варианты:
Схема гемопоэза с клетками предшественниками острого миелоидного лейкоза
Клиническая картина ОМЛ также складывается из анемического, геморрагического и токсического синдромов, которые являются следствием снижения продукции эритроцитов, тромбоцитов и гранулоцитов.
У 50% пациентов отмечается увеличение размеров печени (гепатомегалия) и селезенки (спленомегалия) вследствие инфильтрации органов опухолевыми клетками.
Внекостномозговые проявления заболевания связаны с лейкозной инфильтрацией центральной нервной системы и метастатическим поражением оболочек и вещества головного и спинного мозга (нейролейкемия). В этих ситуациях отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, могут быть нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, выявляются ригидность затылочных мышц, симптом Кернига.
Решающую роль в диагностике также имеет цитохимическое, иммунофенотипическое и морфологическое исследование бластов в костном мозге и периферической крови.
Ремиссию заболевания можно достичь посредством проведения высокодозной полихимиотерапии с последующей трансплантацией гемопоэтических стволовых клеток от HLA-геноидентичного родственного или альтернативного (неродственного, гаплоидентичного) донора у пациентов группы высокого риска рецидива. Благодаря адаптивным протоколам удается достичь ремиссии у 90% детей.
Хронические миелолейкоз
Хронический лейкоз – это вариант гемобластоза, субстратом которого являются созревающие клетки. У детей встречается только хронический миелолейкоз, который характеризуется пролиферацией гранулоцитарного ростка, гиперплазией миелоидной ткани, миелоидной метаплазией кроветворных органов, ассоциированной с хромосомной транслокацией t(9;22)(q34;q11), в результате которой образуется химерный онкоген BCR-ABL.
В течение хронического миелолейкоза выделяют три фазы:
В дебюте заболевание трудно диагностировать, поскольку основные симптомы обусловлены общим опухолевым симптомокомплексом и носят преходящий характер. Наиболее частые симптомы, присоединяющиеся позднее – гепатомегалия и спленомегалия. Нарастающая интоксикация приводит к появлению слабости, утомляемости, повышению температуры тела, болям в костях.
В периферической крови отмечается гиперлейкоцитоз (до 200 – 300 х 10 9 /л и более) с увеличением содержания гранулоцитов до 95% и преобладанием незрелых клеток гранулоцитарного ряда: промиелоцитов, миелоцитов, метамиелоцитов, миелобластов, базофилов (до 10%) и эозинофилов (до 5%). Характерна анемия и повышение СОЭ. Уровень тромбоцитов преимущественно в норме, однако может отмечаться гипертромбоцитоз (до 600 х 10 9 /л и более).
В пунктате костного мозга отмечается увеличение числа миелокариоцитов за счет пролиферирующего пула клеток гранулоцитарного ряда с увеличением базофилов и эозинофилов. Позднее отмечается угнетение эритронормобластического и мегакариоцитарного ростков кроветворения.
Основным средством терапии и стандартом лечения хронического миелолейкоза в настоящее время является применение ингибиторов тирозинкиназы (ИТК). Данные препараты имеют механизм таргетного (целенаправленного) воздействия на BCR-ABL-положительные опухолевые клетки и должны назначаться всем пациентам после подтверждения диагноза. Для оценки эффективности и переносимости терапии ИТК рекомендуется регулярный мониторинг гематологических, цитогенетических и молекулярно-генетических и других показателей у пациента.
Список литературы
Авторская публикация:
Кулева С.А.
Заведующая отделением, врач-детский онколог, ведущий научный сотрудник, профессор НМИЦ онкологии им. Н.Н. Петрова
Иванова Светлана Вячеславовна
Врач-детский онколог, научный сотрудник, кандидат наук НМИЦ онкологии им Н.Н. Петрова