олигодендроглиома головного мозга полное выздоровление образ жизни
Олигодендроглиома головного мозга полное выздоровление образ жизни
Глиобластома — это наиболее часто встречающаяся первичная опухоль ЦНС. Ее диагностика, в отличие от астроцитомы или анапластической астроцитомы, несложна. Это наиболее злокачественная опухоль, которая практически в 100% случаев приводит к летальному исходу. Опухоль обычно поражает людей на шестом десятилетии жизни. Неврологические симптомы наблюдаются не более 6 месяцев до установления диагноза.
Наиболее благоприятными прогностическими факторами являются высокая эффективность химиотерапии и так же, как и для больных анапластической астроцитомой, минимальный неврологический дефицит и возраст больного. Существенную роль также играют ранняя диагностика и раннее начало лечения. До сих пор не установлено влияние объема хирургического вмешательства на прогноз.
Лечение глиобластомы аналогично лечению анапластической астроцитомы. Больным, способным перенести хирургическую операцию, рекомендуют выполнение максимальной резекции опухоли с последующим облучением в высоких дозах — 6000 кГр и более. Химиотерапия кармустином (BCNU) назначается через две недели после окончания облучения. Длительность курса — 6—8 недель. Рецидивы лечат по схеме PCV или только прокарбазином в высоких дозах. Каждый курс состоит из 28-дневного приема 150 мг/м2/сут. с последующим 28-дневным перерывом.
Для решения вопроса о схеме химиотерапии необходима консультация нейроонколога. Перед каждым курсом химиотерапии проводится КТ-или МРТ-исследование.
Прогноз у больных глиобластомой плохой. Средняя выживаемость у больных, получивших только хирургическое лечение, составляет 14—26 недель; при дополнительном облучении этот срок удлиняется до 40 недель. Назначение химиотерапии производными нитрозомочевины, например, прокарбазином и кармустином, удлиняет жизнь больных до 50 недель, а в отдельных случаях до 18 месяцев. Однако даже при самых благоприятных прогностических факторах большинство больных живут менее 1 года, и только для 15% пациентов этот срок составляет два года.
Олигодендроглиома
Течение олигодендроглиомы. Олигодендроглиомы развиваются из клеток-предшественниц олигодендроглии и обычно поражают людей на четвертом—пятом десятилетии жизни. Частота локализации опухоли определяется объемом белого вещества, поэтому наиболее часто эти опухоли локализуются в лобной доле. Связь между гистологическим строением опухоли и ее злокачественностью непостоянна. Данных о частоте злокачественной трансформации олигодендроглиом немного, хотя известно, что в некоторых случаях эти опухоли перерождаются в глиобластомы.
К благоприятным прогностическим факторам относятся доброкачественное гистологическое строение опухоли, послеоперационная лучевая терапия, полное хирургическое иссечение опухоли и минимальный неврологический дефицит до и после операции. Очень важно дальнейшее диспансерное наблюдение больных.
Лечение олигодендроглиомы. Разработано несколько методов лечения олигодендроглиомы. Первым этапом является максимальное хирургическое иссечение опухоли. После операции рекомендована лучевая терапия по той же схеме, что и при анапластической астроцитоме или глиобластоме. Хотя строгой связи между гистологическими данными анаплазии и злокачественностью опухоли не обнаружено, большинство нейроонкологов рекомендуют комбинированную химиотерапию прокарбазином и винкристином для лечения больных с анапластическими олигодендроглиомами.
Пациентам с неанапластическими олигодендроглиомами химиотерапию обычно назначают только при рецидивах опухоли. МРТ- или КТ-исследование необходимо проводить перед началом химиотерапии и каждые 6—8 недель больным с анапластическими новообразованиями и каждые 3 месяца больным с неанапластическими опухолями в первый год заболевания. Если нет признаков рецидива, то в последующем МРТ проводится один раз в 6 месяцев.
Прогноз у больных с олигодендроглиомой лучше, чем при анапластической астроцитоме или глиобластоме. Большинство больных живут более 5 лет и 24% — более 10 лет. В отдельных случаях с благоприятными прогностическими факторами возможно более длительное выживание.
Анапластическая олигодендроглиома
Эпидемиология анапластической олигодендроглиомы
Этиология и факторы риска развития анапластических глиом
Диагностика анапластической олигодендроглиомы
ПЭТ при анапластической олигодендроглиоме
Несмотря на то, что МРТ является «золотым стандартом» диагностики анапластических глиом, в ряде случаев полученной с его помощью информации может быть недостаточно для принятия клинического решения. Вспомогательной и высокоинформативной методикой является позитронно-эмиссионная томография, позволяющая оценивать интенсивность накопления радиофармпрепарата и косвенно степень биологической активности (злокачественность) опухоли. С этой целью используются различные радиофармпрепараты (трейсеры). В настоящее время наиболее широко распространена методика ПЭТ-КТ с 11С-метионином.
Более подробно показания к исследованию и интерпретация результатов описаны в разделе ПЭТ-КТ.
Следует помнить, что олигодендроглиомы и анапластические олигодендроглиомы имеют более высокий индекс накопления радиофармпрепарата, чем другие опухоли идентичного grade.
Клиническая картина анапластической олигодендроглиомы
Морфогенетическая диагностика анапластической олигодендроглиомы
Лечение анапластической олигодендроглиомы
Для анапластических олигодендроглиом стандартом лечения является хирургия + лучевая терапия в суммарной общей дозе (СОД) 54-60 Гр, разбитая на фракции по 1,8-2 Гр.
Химиотерапия анапластических олигодендроглиом
АО являются высокочувствительными к химиотерапии опухолями.
Первые статьи, посвященные чувствительности АО к химиотерапии, посвящены результатам лечения пациентов по схеме PCV (прокарбазин, винкристин, нитрозомочевина) или с применением темозоломида.
Вопрос о том, какой режим химиотерапии более эффективен, пока остается без четкого ответа. К настоящему времени не проведено исследований, способных представить убедительные результаты сравнения химиотерапии в этих 2 режимах для рецидивов олигодендроглиальных опухолей. Явным преимуществом темозоломида является меньшая выраженность побочных эффектов, заключающихся в основном в умеренной миелосупрессии и легко контролируемой тошноте/рвоте. С этой точки зрения использование темозоломида более предпочтительно и потому вошло в рутинную практику большинства клиник.
«Вторая линия» химиотерапии другими агентами
Лишь несколько агентов использовались в качестве второй линии терапии для АО – паклитаксел, CPT-11, карбоплатин, этопозид+цисплатин. Последняя схема, этопозид+ цисплатин, показала низкую эффективность (с учетом очень небольшого числа пациентов в исследуемой группе) – 1/3 пациентов находились в безрецидивном периоде через 6 месяцев и все продемонстрировали прогрессию по истечении года. Недостатком некоторых из названных режимов (например, паклитаксел, CPT-11) является тот факт, что их метаболизм протекает с вовлечением цитохрома CYP3A4, активного которого может быть индуцирована противоэпилептическими препаратами.
Препарат иматиниб, ингибитор PGFR-рецептора тирозин-киназы, не продемонстрировал значимой эффективности в химиотерапии ОДГ или АО
Ингибиторы ангионеогенеза
Несколько исследований посвящено изучению эффективности бевацизумаба – моноклонального антитела против циркулирующего сосудистого эндотелиального фактора роста (VEGF)-A у пациентов с рецидивами АО. Причиной для проведения этих исследований были результаты аналогичных научных работ с вовлечением пациентов с глиобластомами, где был зарегистрирован достаточно высокий ответ на лечение; продолжительность жизни пациентов при этом была не столь впечатляющей. По-видимому, это можно объяснить снижением патологически высокой опухолевой сосудистой проницаемости на фоне лечения, что проявлялось уменьшением контрастирования и расценивалось как отсутствие рецидива.
Олигодендроглиома головного мозга полное выздоровление образ жизни
ГУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Башкортостан, Уфа
ГБУЗ «Башкирский республиканский клинический онкологический диспансер», Уфа
Олигодендроглиальные опухоли: современный взгляд на молекулярно-биологические характеристики и возможности лечения
Журнал: Онкология. Журнал им. П.А. Герцена. 2013;2(6): 64-71
Борисов К. Е., Сакаева Д. Д. Олигодендроглиальные опухоли: современный взгляд на молекулярно-биологические характеристики и возможности лечения. Онкология. Журнал им. П.А. Герцена. 2013;2(6):64-71.
ГУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Башкортостан, Уфа
В обзоре представлены данные о молекулярной биологии олигодендроглиальных опухолей головного мозга, которые представляют группу глиальных опухолей, существенно отличающуюся по своей биологии от опухолей астроцитарного ряда. Наличие характерных мутаций, таких как LOH 1p/19q, мутация IDH1, метилирование гена-промотра MGMT, а также частое наличие гиперметилированного фенотипа (GCIMP), обусловливают, с одной стороны, менее злокачественное, по сравнению с астроцитомами, течение заболевания, а с другой стороны, высокую чувствительность олигодендроглиальных опухолей к химиотерапии. Отдаленные результаты крупных рандомизированных исследований подтверждают преимущества использования химиотерапии у больных с LOH 1p/19q. Лучевая терапия как единственная адъювантная лечебная опция не может больше рассматриваться как адекватное лечение у этой группы больных. Схемы химиотерапии на основе нитрозомочевины и темозоломид имеют равную эффективность. Для второй и последующих линий химиотерапии возможно применение карбоплатина, тенипозида (или этопозида), иринотекана и бевацизумаба. Целесообразность назначения таргетных препаратов требует дальнейших клинических исследований.
ГУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Башкортостан, Уфа
ГБУЗ «Башкирский республиканский клинический онкологический диспансер», Уфа
Олигодендроглиомы (ОД) и смешанные олигоастроцитомы (ОА) составляют от 5 до 20% всех глиальных опухолей головного мозга. Они встречаются преимущественно в возрасте от 30 до 50 лет, причем ОД низкой степени злокачественности — у более молодых пациентов, а анапластические формы (АОД и АОА) — у более зрелых. Мужчины заболевают примерно в 2 раза чаще, чем женщины.
Долгое время диагноз олигодендроглиальных опухолей (ОДО) базировался на морфологическом исследовании и ассоциировался с высокой чувствительностью к химиотерапии (ХТ) [1, 2]. Однако морфологическая диагностика ОДО сопряжена с субъективным мнением и квалификацией патоморфолога. Так, в исследовании EORTC 26951 (было подвергнуто экспертизе 114 образцов опухолей) независимые эксперты достигли консенсуса по диагнозу АОД, выставленному локальными патологами, лишь в 52% случаев, а по диагнозу АОА консенсус был достигнут лишь в 8% случаев [3]. Несколько лучшие результаты были получены в исследовании RTOG 9402 [4], где консенсус в отношении диагноза был достигнут в 83% случаев. Таким образом, очевидна потребность в дополнительных, более надежных диагностических и прогностических критериях.
Со временем была идентифицирована комбинированная потеря генетического материала короткого плеча хромосомы 1 (1р) и длинного плеча хромосомы 19 (19q) как наиболее характерная для ОДО генная аберрация [5]. Может утрачиваться как копия хромосомы 1р и/или 19q целиком (потеря гетерозиготности — loss of heterozygosity — LOH), так и частичная делеция в указанных регионах. Утрата генетического материала одновременно на 1-й и 19-й хромосомах объясняется несбалансированной транслокацией t(1;19)(q10;p10) [6] с образованием двух деривативных хромосом: der(1;19)(q10;p10), которая обнаруживается в метафазных пластинках, и der(1;19)(p10;q10), которая затем утрачивается [7]. На основании анализа данных 33 исследований, в которые были включены в общей сложности 2666 больных, было установлено, что при ОД частота делеции 1р составляет 65,4%, частота коделеции 1р19q — 63,3%. При ОА эти показатели составляют 28,7 и 21,6%, при анапластической астроцитоме (АА) — 13,2 и 7,5%, при мультиформной глиобластоме (МГБ) — 11,6 и 2,9% соответственно [8]. LOH 1p/19q более характерна для ОДО и редко встречается при астроцитарных, частичная коделеция с преимущественным вовлечением 1р36 и 19q13 локусов чаще бывает при астроцитарных опухолях и редко при ОДО. Наличие LOH 1p/19q строго коррелирует с классической олигодендроглиальной гистологией, характерной для ОДО локализацией в лобных долях и хорошим прогнозом [4, 9, 10]. Частичная делеция 1р и/или 19q не является фактором хорошего прогноза [11], а при МГБ имеет даже негативное прогностическое значение [12]. Идентифицировано несколько генов, чья инактивация положительно влияет на выживаемость больных. Это DIRAS3 на локусе 1р31, CITED4 на локусе 1р34.2, ЕМР3 на локусе 19q13.3 [13]. При ОДО одна аллель этих генов утрачена из-за LOH 1p/19q, а вторая аллель подвергается гиперметилированию. Таким образом, улучшение выживаемости больных при LOH 1p/19q может быть связано с утратой функции части генов, участвующих в онкогенезе. С другой стороны, частичная делеция 1р дистальнее 1р36 ведет к утрате гена CDKN2C/p18INK4C, кодирующего ингибитор циклин-зависимых киназ CDK4 и СDK6, и гена FAF1, кодирующего FAS-ассоциированный фактор 1, участвующий в апоптозе. Утрата обоих этих генов приводит к клеточной пролиферации и торможению апоптоза и имеет неблагоприятное прогностическое значение. Кроме этого, на 19-й хромосоме находится еще несколько генов, которые могут участвовать в глиомагенезе, но их роль до конца не выяснена. Это гены семейства калликреиновых пептидаз (KLK6-14), гены семейства ZNF (zink finger protein) и KLF (Kruppel-like factor), которые участвуют в процессах клеточной пролиферации и дифференцировки, а также онкогены AKT2 (элемент PI3K-сигнального пути) и CCNE1 (кодирует циклин Е) [11].
С LOH 1р/19q часто сочетаются некоторые другие мутации. Так, в 80—90% случаев ОДО наблюдается конкурентное метилирование гена-промотора метилгуанинметилтрансферазы (MGMT) [14]. Известно, что метилирование гена-промотора MGMT является фактором лучшей выживаемости при лечении больных МГБ темозоломидом [15]. Однако при АОД значимость метилирования гена-промотора MGMT недостаточно ясна. В рамках исследования EORTC 26951 было проведено определение MGMT-статуса у 152 больных [16]. Метилирование было обнаружено у 80% больных, имело сильную корреляцию с LOH 1р/19q (р=0,00043) и было фактором благоприятного прогноза. При наличии метилирования 2-летняя выживаемость без прогрессирования (ВБП) равнялась 53% с медианой 34 мес, в то время как при отсутствии метилирования — лишь 16% с медианой 8,6 мес. 2-летняя общая выживаемость (ОВ) при наличии метилирования составила 69% с медианой 61 мес, а при отсутствии метилирования — лишь 39% с медианой 15,9 мес. При этом выигрыш в выживаемости при метилированном гене-промоторе MGMT наблюдался как в группе лучевой терапии (ЛТ), так и в группе ЛТ + ХТ. Это свидетельствует о различных биологических эффектах MGMT при МГБ и АОД. При МГБ метилирование гена-промотра MGMT повышает чувствительность к ХТ, а при АОД является частью более общего и прогностически благоприятного фенотипа опухоли (GCIMP — CpG island methylator phenotype), который проявляется гиперметилированием множественных цитозин-гуаниновых последовательностей ДНК (CpG-islands). GCIMP-позитивными являются 93% ОДО и 46% астроцитом; при МГБ такой фенотип встречается крайне редко. GCIMP-статус коррелирует с метилированием гена-промотора MGMT, LOH 1p/19q, мутацией IDH1 и с выживаемостью: медиана ОВ составляет 5,62 года при GCIMP(+) и 1,24 года при GCIMP(–) (р 2 /сут с 1-го по 7-й и с 15-го по 22-й день каждые 4 нед с последующим конкурентным химиолучевым лечением (ХЛЛ), когда темозоломид применялся по 75 мг/м 2 /сут на протяжении 6 нед ЛТ, был назначен 39 больным с ОДО (АОД — 33%, АОА — 67%) после хирургического лечения (44% — тотальная резекция, 46% — частичная резекция). Такая методика обеспечила достижение полного ответа (ПО) у 6% больных, частичного ответа (ЧО) — у 26%, стабилизации заболевания (СЗ) — у 52%, т.е. контроль опухолевого роста (КОР) был достигнут у 84% больных. ВБП в течение 30 мес составила 64%, ОВ за этот же период — 81%. Прогрессирование в процессе лечение наблюдалось лишь у 10% больных, что вдвое меньше, чем в исследовании IRTOG 9402. Токсичность III степени наблюдалась у 44% больных, IV степени — у 8%.
В схожем исследовании Н. Gan и соавт. [41] также изучалось применение темозоломида в первой линии после хирургического лечения (тотальная резекция — 22%, субтотальная резекция — 68%) у больных с ОДО (АОД — 28% больных, АОА — 72%). Консолидирующая ЛТ проводилась не всем больным, а только по решению лечащего врача. ПО наблюдался у 38%, ЧО — у 15%, СЗ — у 23% больных. Таким образом, КОР был достигнут у 76% больных. Шестимесячная ВБП составила 77% с медианой 21 мес, медиана ОВ — 43 мес. Все больные с АОД имели метилирование гена-промотора MGMT и 71% коделецию 1р19q. При АОА эти изменения наблюдались намного реже — 23 и 31% соответственно. Как коделеция 1р19q, так и метилирование гена-промотора MGMT ассоциировались с повышением частоты опухолевого ответа (72% против 37% для 1р19q-статуса и 70% против 27% для MGMT-статуса). Переносимость темозоломида была удовлетворительная. Токсичность III—IV степени (чаще гематологическая и кожная) наблюдалась у 18% больных.
Принимая во внимание высокую химиочувствительность ОДО, были предприняты попытки отказа от ЛТ на первом этапе лечения. В исследовании Y. Iwadate и соавт. [42] 25 пациентов с АОД (60%) и АОА (40%) получали после операции только ХТ по схеме PAV (прокарбазин, ACNU, винкристин) без ЛТ. 5-летняя ВБП составила 45,3% с медианой 50 мес, а 5-летняя ОВ — 62%, медиана не достигнута. Таким образом, было показано, что АОДО могут быть успешно лечены без применения ЛТ.
В небольшом исследовании А. Taliansky-Aronov и соавт. [43] больным после хирургического лечения назначался темозоломид в стандартном 5-дневном режиме (200 мг/м 2 ) до прогрессирования или до неприемлемой токсичности. В среднем было проведено по 14 курсов ХТ (от 3 до 24). Объективный ответ (OO) был отмечен у 75% больных, медиана ВБП составила 24 мес. ВБП больных с LOH 1p/19q была значительно выше, чем у больных с интактными хромосомами: двухгодичная ВБП — 100% против 20% (р=0,057). Токсичность III—IV степени наблюдалась лишь у 10% больных.
В исследовании Т. Mikkelsen и соавт. [44] больные с АОД с LOH 1p19q получали адъювантные циклы МХТ темозоломидом после операции, а больные с АОД без LOH 1p19q получали в адъювантном режиме МХТ темозоломидом с последующим ХЛЛ. Несмотря на более агрессивное лечение, у больных без LOH 1p/19q медиана ВБП составила всего 13,5 мес по сравнению с 28,7 мес у больных с LOH 1p/19q. Таким образом, опухоли с LOH 1p/19q по своей биологии принципиально отличаются от других опухолей, а больные с указанной генной мутацией могут быть успешно лечены одной только ХТ без ухудшения прогноза.
Для выяснения преимуществ того или иного вида адъювантного лечения было предпринято исследование NOA-04, в котором больным с анапластическими глиомами (52% — АА, 48% — АОД и АОА) в адъювантном режиме назначалась только одна лечебная опция: либо ХТ, либо ЛТ. Больные были рандомизированы в соотношении 1:1:2 соответственно на адъювантную ХТ по схеме PCV или адъювантную ХТ темозоломидом или адъювантную ЛТ. При прогрессировании больные получали альтернативную лечебную опцию. Исследование продемонстрировало равную эффективность ХТ и ЛТ в первой линии лечения [45]. Медиана ВБП для всех больных составила 30,6 мес при использовании на первом этапе ЛТ и 31,9 мес при использовании ХТ (р=0,87), в том числе при ОДО 52,1 и 52,7 мес соответственно. ОВ также не различалась в зависимости от проводимого лечения. На основании полученных данных было сделано заключение, что ХТ может быть рекомендована как единственная адъювантная опция при анапластических глиомах, включая АОД и АОА. При этом эффективность темозоломида и PCV одинакова. Также в этом исследовании была подтверждена высокая прогностическая значимость обнаружения LOH 1p/19q, метилирования гена-промотора MGMT и мутации IDH1.
Поскольку ОДО считаются высокочувствительными к ХТ, были предложены методики изначальной интенсификации лечения с целью достижения более выраженного ОО и более длительных ремиссий. В частности, использовалась комбинация двух наиболее активных при глиомах препаратов — темозоломида и производных нитрозомочевины. В исследовании О. Chinot и соавт. [46] применялся BCNU в дозе 150 мг/м 2 в 1-й день и темозоломид в дозе 110 мг/м 2 с 1-го по 5-й день каждого 42-дневного цикла (всего 6 циклов). В исследование помимо анапластических с ОДО включались также больные с ОДО с некрозами, которые по современной классификации относятся к МГБ. Результаты ПХТ не превзошли результаты МХТ темозоломидом: ОО наблюдался при АОД — у 50% больных, при АОА — у 33% больных. Медиана ВБП составила 16 мес. Токсичность комбинации была умеренной.
Несколько исследований было посвящено применению при вновь выявленных АОД высокодозной ХТ с поддержкой аутологичными гемопоэтическими стволовыми клетками (АГСК). В исследовании L. Abrey и соавт. [47] после высокодозного режима PCV проводилась ВДХТ тиофосфамидом с поддержкой АГСК. При таком лечении медиана ВБП составила 78 мес, а медиана ОВ при длительности наблюдения более 80 мес не была достигнута. Это исследование подтвердило, что на первом этапе можно обойтись без ЛТ.
Схожие результаты были получены и в другом исследовании N. Mohile и соавт. [48]. При вновь выявленных АОД проводилось 4 цикла ПХТ по схеме PCV. ОО наблюдался у 70% больных, которые в дальнейшем получали высокодозную консолидацию бусульфаном и тиофосфамидом с последующей трансплантацией АГСК. При сроках наблюдения 36 мес медиана ВБП и медиана OВ не были достигнуты. Основным осложнением явилась окклюзия вен, которая развилась у 3 из 14 больных и у 1 больного привела к смертельному исходу. Длительный ответ на лечение наблюдался как при наличии LOH 1p/19q, так и при ее отсутствии.
Для выбора оптимальной тактики лечения больных с АОДО А. Lassman и соавт. [49] провели ретроспективное исследование результатов лечения 1013 больных (см. таблицу). 
Режим карбоплатин AUC 5 в 1-й день + этопозид 120 мг/м 2 с 1-го по 3-й день каждые 4 нед также оказался эффективен при рецидивах ОДО. Среди 32 больных с ОДО (20 АОД/АОА и 12 ОДО НСЗ) ПO был достигнут у 15,6% больных, ЧО — у 31,3%, СЗ — у 34,4%. Таким образом, КОР наблюдался у 81,3% больных. Однолетняя ВБП составила 46,9% с медианой 8 мес [57].
При темозоломид-рефрактерных рецидивах АОД с наличием LOH 1p/19q неплохие результаты показал иринотекан. Он вызывал ЧО у 23% больных и СЗ — у 36%. При этом медиана ВБП составила 4,5 мес, медиана ОВ — 5,5 мес, 6-месячная ВБП — 33%, однолетняя ВБП — 4,5%. Такая эффективность сопоставима с эффективностью других препаратов [59].
Олигодендроглиома головного мозга (олигоастроцитома)
Госпитализация и лечение по квоте ОМС. Подробнее после просмотра снимков.
Оглавление:
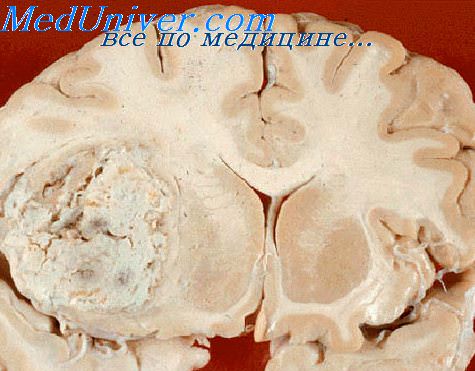
Олигодендроглиома головного мозга – патологическое образование, берущее начало из клеток глии – олигодендроцитов. Их функция образовывать специальные липидные оболочки для защиты нервных клеток. Для опухолей данного типа характерно медленное развитие, поэтому первые клинические проявления формируются длительно, проявления скудные, больные люди не сразу замечают серьезность болезни. Лечение олигодендроглиомы всегда носит комплексный характер: основной выбор – операция по удалению опасных узлов. Прогноз жизни относительно благоприятный, многое зависит от степени злокачественности и результатов радикального удаления неоплазии.
Олигодендроглиома головного мозга — что это?
Олигодендроглиома имеет разные степени злокачественности и может развиться в любом возрасте, однако, она более характерна для взрослых. Мужчины заболевают чаще, нежели женщины, примерно на 25-30%. На долю олигодендроглиом приходится около 3% из числа всех опухолевых новообразований в головном мозге. Для новообразований этого типа свойственен медленный экспансивно-инфильтративный рост. Если опухоль локализируется в белом веществе полушарий, то ее объем может достигнуть значительных размеров. В большинстве случаев характерные признаки проявляются поздно. Часто должно пройти 3-5 лет от образования опухоли до момента, когда начнут проявляться первые симптомы.
Обратите внимание. На постановку правильного диагноза могут понадобиться годы, поскольку ранняя клиника малоспецифичная, часто трудно понять истинную причину неблагоприятной симптоматики.
Особенности локации и гистологии
Чаще всего олигодендроглиома образуется вдоль стенок желудочков головного мозга. Патогенные клетки прорастают в них, а также распространяются на кору большого мозга. Реже всего олигодендроглиома формируется в стволе головного мозга, мозжечке и нервах, иннервирующих зрительные анализаторы.
Сама опухоль имеет бледноватый розовый оттенок, с четко обособленными границами. Для этого вида неоплазий характерно наличие кистообразовательного процесса, поэтому внутри образования могут быть кисты (обособленные полости, заполненные экссудатом). Цитогистологическими особенностями олигодендроглиомы головного мозга является наличие в опухоли большого числа миелиновых волокон. Есть отдельные крупные клетки с хорошо структурированной гиалоплазмой и мелкие клетки, с плохо дифференцированным содержимым, но хорошо заметными и относительно крупными ядрами.
Обратите внимание. Отличительной чертой олигодендроглиомы от других опухолей головного мозга является наличие петрификатов (кальцинатов) в ткани.
Классификация олигодендроглиом
Различают три вида олигодендроглиомы, зависимо от их агрессивности и характера поведения.
Олигодендроглиома 2 степени злокачественности
Это типичная олигодендроглиома головного мозга. Для нее характерен медленный рост, низкая агрессивность и митотическая активность клеток. То, сколько живут после операции по удалению опухоли – вопрос индивидуальный. В данном случае прогноз, как правило, благоприятный, нежели при диагностировании других видов опухолей.
Обратите внимание. Олигодендроглиома головного мозга 2-й стадии диагностируется чаще других опухолей данного типа.
Анапластическая олигодендроглиома 3 степени злокачественности
Анапластическая олигодендроглиома характеризуется высокой агрессивностью. Для неоплазии характерен быстрый рост клеток и их распространение на соседние ткани. Является достаточно редким видом новообразований. На их долю приходится около одного процента из числа всех злокачественных новообразований в головном мозге.
Чаще всего анапластическая олигодендроглиома образуется в лобной доле головного мозга, несколько реже опухоль формируется в височной области. Клинические признаки сходны с другими новообразованиями данного рода, но для анапластической олигодендроглиомы основным отличительным признаком является формирование судорожных или нервных припадков, что характерно как для первичной опухоли, так и для рецидивов, которые малигнизируются в анапластическую глиому – более опасный вид рака.
Заметка. Анапластическая олигодендроглиома чаще встречается у взрослых людей.
Гистологической особенностью анапластической олигодендроглиомы является то, что патогенным клеткам характерен высокий уровень митотической активности. При этом отмечается клеточная атипия. В редких случаях развивается некроз, в опухоли могут сильно разрастаться мелкие кровеносные сосуды.
Для анапластической олигодендроглиомы характерно наличие патологических реактивных астроцитов. Данная особенность может затруднить диагностику, потому что даже у опытных клиницистов иногда возникают определенные трудности при дифференциации олигодендроглиомы и глиобластомы с олигодендроглиальными элементами.
Лечение анапластической олигодендроглиомы – только радикальное, с последующим облучением и химиотерапией. Важно удалить всю олигодендроглиому, а если это невозможно, то большую ее часть.
Олигоастроцитома головного мозга
Олигоастроцитома головного мозга является опухолью смешанного типа. Ее относят к третьей степени злокачественности. Характерной особенностью олигоастроцитомы головного мозга является то, что она способна перерождаться в глиобластому – опасный вид рака. Для олигоастроцитомы свойственен быстрый рост, поражение близкорасположенных мозговых тканей и метастазы. Это представляет реальную угрозу для жизни, поэтому выживаемость в данном случае низкая (3 и 4 стадии канцерогенеза/grade).
Обратите внимание. Олигодендроглиомы первой степени злокачественности не существует.
Клинические проявления
Признаки олигодендроглиомы, олигоастроцитомы и анапластической олигодендроглиомы довольно схожи, с той разницей, что при низкой степени злокачественности симптоматика развивается медленно. Клиника обуславливается увеличением внутричерепного давления и поражением локальных зон мозга, отвечающих за те или иные функции. В первом случае признаки носят общий характер, вторые называют специфическими проявлениями.
К общим признакам опухоли в головном мозге относят:
Специфические признаки будут зависеть от пораженного участка мозга. В таком случае возможны нарушения слуха, речи, письма, координации движений, проблемы с памятью или мышлением и так далее.
Диагностика и лечение
Основной выбор терапевтической тактики – радикальное удаление опухоли (тотальное или субтотальное) путем проведения операции (резекция или трепанация). Полное удаление патологических тканей является самым эффективным способом лечения. После этого назначается радио- и химиотерапия. В последнее время широкое применение приобретают стереотаксические системы оперирования под контролем МРТ-системы, что представляет собой менее инвазивный способ удаления опухоли.
При неоперабельных опухолях лучевая терапия является основным видом лечения с одновременным назначением цитостатических препаратов. Эффективность терапии будет зависеть от многих факторов:
Прогноз жизни после операции
Выживаемость пациента зависит от эффективности лечения, стадии, наличия метастаз и рецидивов. Немаловажное значение имеет локализация опухоли. Чем раньше будет выявлено патологическое новообразование и проведено оперативное лечение, тем лучше прогноз.
При классическом типе новообразования 2-й степени злокачественности у больных до 40 лет после проведения операции и комплексном лечении – прогноз благоприятный: средний период без рецидивов составляет 5 лет, а десятилетняя выживаемость сохраняется на уровне 35%. Около 30% больных проживут более 5 лет, после постановки первичного диагноза. Прогноз ухудшается пропорционально усугублению степени злокачественности.
Консультация нейрохируга
Нейрохирург, доктор медицинских наук
— Нейрохирург 9 отделения НИИ нейрохирургии им. Н.Н.Бурденко (2002 — 2019)
— Ведущий нейрохирург сети клиник «Медси» (2019 — н.в.)