Что значит моноклональные антитела
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА: РОЛЬ И ПОТЕНЦИАЛ
Моноклональные антитела — это одно из самых важных крупных достижений в фармакологии за последние два десятилетия. Что именно они из себя представляют и каковы их функции?
Что такое антитела?
Иммунная система организма естественным образом вырабатывает антитела, чтобы защитить нас от внешних атак (бактерий, токсинов, вирусов). Все антитела работают одинаково и связываются с ответственными за атаку чужеродными агентами (также называемыми антигенами, которые преимущественно являются белками), чтобы нейтрализовать их. Антитела естественным образом вырабатываются нашими В-лимфоцитами. Эти лимфоциты, входящие в состав клеток крови, объединенных общим названием лейкоциты, играют важную роль в иммунологической защите организма.
Моноклональные антитела — это антитела, разработанные в лаборатории и вводимые пациентам в рамках специализированной терапии. Эти антитела (также называемые иммуноглобулинами) вызывают прицельный ответ организма, чтобы защитить его от атаки чужеродными антигенами.
Эти антитела обладают двумя основными фармакологическими свойствами: с одной стороны, это способность с высокой степенью специфичности связываться с антигеном, а с другой — характер взаимодействия с иммунной системой. Эти два свойства дополняют друг друга, обеспечивая оптимальную терапевтическую эффективность. [1]
ПРОИСХОЖДЕНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
В 1975 году аргентинский биохимик Сезар Мильштейн и немецкий биолог Георг Келер первые создали моноклональные антитела из клеток мыши.
Это были антитела, полученные из зрелых гибридных клеток или гибридом клеток, полученных в результате гибридизации in vitro нормальных лейкоцитов с клетками злокачественных опухолей. Эти клетки обладают существенным преимуществом, поскольку они могут бесконечно делиться с образованием идентичных дочерних клеток, каждая из которых вырабатывает одно и то же антитело, называемое «моноклональным». Моноклональные антитела происходят из одной клетки, имеют идентичные свойства (одна и та же аминокислотная последовательность и активность) и оптимизированный эффект (выраженная способность связывать и/или разрушать антиген). [2]
Некоторые ограничения в использовании моноклональных антител, полученных из гибридных клеток мышей, через несколько лет привели к созданию полностью человеческих моноклональных антител с помощью генной инженерии.
Сегодня во всем мире различные моноклональные антитела (более 75) получили регистрационные удостоверения для применения при трудно поддающихся лечению состояниях, таких как злокачественные новообразования, воспалительные и неврологические заболевания. Моноклональные антитела расширили терапевтический арсенал средств, доступных врачам для лечения пациентов. [3]
КАКОВА РОЛЬ АНТИТЕЛ В МЕДИЦИНЕ?
Моноклональные антитела имеют различное применение. Результаты исследований в онкологии позволили использовать моноклональные антитела для распознавания опухолевых клеток и замедления или остановки их роста: такой подход получил название иммуно-онкологической терапии. В этой области достигнуты значительные успехи. В частности, были получены беспрецедентные результаты при использовании моноклональных антител, которые, присоединяясь к лимфоцитам, восстанавливают их активность в отношении опухолевых клеток и, таким образом, обеспечивают противоопухолевую защиту организма. Некоторые из этих препаратов можно использовать отдельно или в сочетании с химиотерапией и/или хирургическим вмешательством. В течение нескольких лет исследователи также работали над использованием антител в качестве вектора для молекул химических препаратов: антитела, помимо своей основной миссии, могут переносить химическое соединение как можно ближе к опухолевой клетке, чтобы обеспечить большую точность воздействия. [4]
Разработка терапевтических антител для лечения инфекционных заболеваний быстро набирает обороты, и некоторые антитела уже одобрены органами здравоохранения по всему миру. В последнее время моноклональные антитела активно изучаются для борьбы с SARS-CoV-2 (COVID-19). [5]
Существует и другое терапевтическое применение моноклональных антител, в частности, при заболеваниях нервной системы и сердца, но их использование в настоящее время ограничено и требует дальнейшего изучения.
Таким образом, создание моноклональных антител – это настоящая революция в терапии. Полученные результаты являются крайне обнадеживающими, особенно в онкологии. Однако по-прежнему существуют нерешенные медицинские проблемы, связанные с коррекцией ряда побочных эффектов и даже с противоопухолевой терапией, поскольку некоторые пациенты не отвечают на эти препараты [6] . Поэтому потенциальная комбинация различных моноклональных антител к различным антигенам откроет дополнительные возможности в лечении рефрактерных форм заболевания.
Достижения фармацевтики: моноклональные антитела
Роза Ягудина о значении моноклональных антител в современной медицине и перспективах их применения
Моноклональные антитела (МАТ) сегодня применяются при лечении заболеваний, большинство из которых еще несколько десятков лет назад считались неизлечимыми. Это онкологические, аутоиммунные, сердечно-сосудистые и инфекционные заболевания, воспалительные реакции различного генеза, системный склероз, идиопатический фиброз легких, гепатит В, СПИД, ревматоидный артрит, системная красная волчанка, аллергические реакции, мышечная дистрофия, болезнь Альцгеймера, астма, диабет и другие заболевания.
Препараты, изготовленные на основе моноклональных антител, относятся к новейшим в современной медицине. С середины 90-х годов до сегодняшнего дня на мировом фармацевтическом рынке одобрено более 30 лекарственных средств, имеющих в составе моноклональные антитела. Первоначально надежность методов и технологий производства моноклональных антител и безопасность их применения вызывали опасения у фармацевтических производителей. Однако сегодня научный и медицинский опыт показал возможность их эффективного и безопасного применения в медицине. Сейчас большинство фармацевтических компаний работают над разработкой новых препаратов и лекарственных средств на основе моноклональных антител. На этапе разработки в мире находится около 300 МАТ.
В чем же уникальность и специфика применения моноклональных антител?
Иллюстрации и примеры в статье взяты из: Ягудина Р.И., Тихомирова А.В. История развития моноклональных антител, их настоящее и будущее // Современная организация лекарственного обеспечения. – 2013. – №1. – 6–27
История открытия
История получения и применения моноклональных антител уходит своими корнями в исследования конца 19 века. С тех пор, за прошедшие более чем сто лет, моноклональные антитела успели несколько раз совершить революцию в медицине, полностью перевернув представления о возможностях лекарственной терапии.
Первый шаг — иммунизация антителами животных (XIX в. – начало XX в.)
Ученых с давних пор интересовал вопрос о том, каким образом организм создает множество различных антител, обладающих уникальной специфичностью в отношении чужеродных веществ (антигенов), и каким образом эти антитела работают. Один из первых шагов к ответу на этот вопрос был сделан группой ученых, работавших в Институте инфекционных болезней в Берлине и открывших методы лечения дифтерии. В конце XIX века дифтерия у детей считалась смертельным неизлечимым заболеванием. Врач иммунолог-бактериолог Эмиль Беринг (Emil Behring) предположил, что лечение дифтерии может быть успешным в случае проявления естественной защитной реакции человеческого организма, а именно, если секретируемый дифтерийными бактериями токсин нейтрализовать. В 1890 г. Беринг совместно с японским ученым Сибасабуро Китасато установили, что неиммунизированные животные могут быть защищены от токсина дифтерийных бактерий с помощью инъекции антитоксина (антитоксической сыворотки) иммунизированных животных. В 1894 г. в период эпидемии дифтерии, унесшей жизни 50 000 детей в Германии, были произведены первые 25 000 доз антитоксина для применения в лечении людей. В 1901 г. Эмилю Берингу была присуждена Нобелевская премия за работу по сывороточной терапии. Однако на тот момент эффективность сыворотки была достаточно низкой, поскольку антитела в сыворотке вырабатывались клетками животных, а не самого пациента и вызывали лишь пассивный иммунитет. Антитоксин необходимо было вводить сразу после инфицирования, иначе было слишком поздно.
Еще одним примером использования антисыворотки в терапии людей стали исследования Чарльза Ричета (Charles Richet) и Жюля Эрикура (Jules Héricourt), применявших для лечения онкологических заболеваний антисыворотку, полученную путем иммунизации животных тканями саркомы. С середины 30-х годов практика пассивной иммунизации сошла на нет в связи с открытием антибиотиков широкого спектра действия.
Второй шаг — расшифровка структуры моноклональных антител (30–70-е гг. XX в.)
В 30-х гг. появились ультрацентрифуги, позволявшие разделять антитела по размеру и форме. В 40-х гг. ученые научились сортировать антитела по электрическому заряду и размеру. Однако дальнейшая расшифровка структуры антитела была пока недоступна из-за их большого размера, в 20 раз превышавшего размер молекул белков, структуры которых к тому времени уже были расшифрованы. Только в 1962 г. на базе многочисленных исследований, проводившихся различными учеными, Родни Портер (Rodney Porter) расшифровал основную структуру антител, стало известно, что антитело состоит из легкой и тяжелой цепи. Позже Родни Портеру совместно с Джеральдом Эдельманом (Gerald Edelman) удалось определить последовательность 1300 аминокислот, входящих в белковую цепь антитела, производимого клетками раковой опухоли миеломы. В то время это была самая большая расшифровка аминокислотной последовательности, за что в 1972 году ученые получили Нобелевскую премию. В результате исследований Портера и Эдельмана стало известно, что антитело имеет форму буквы Y, в которой нижняя часть (тяжелая цепь) имеет постоянную структуру для разных антител, а плечи (легкие цепи) значительно различаются у различных антител. Именно эти плечи отвечают за связывание антитела с антигеном и его нейтрализацию.
(Рисунок 1. Структура антитела, за которую ученые Родни Портер и Джеральд Эдельман в 1972 г. получили Нобелевскую премию по физиологии и медицине)
Третий шаг — разработка первой технологии синтеза антител (70–80-е гг. XX в.)
К 1970-м годам уже были известны некоторые важные моменты о том, каким образом в организме человека вырабатываются антитела. В частности, было известно, что за продуцирование антител отвечают В-лимфоциты, причем каждый В-лимфоцит может вырабатывать только одно специфическое антитело, при этом он редуплицируется и за счет этого быстро производит большое количество идентичных по структуре антител — так называемых моноклональных, то есть произошедших от одной клетки-предшественницы.
Добиться столь же быстрой выработки антител в лабораторных условиях удалось в 1975 году ученым Георгу Кёлеру (Georges Köhler) и Сезару Мильштейну (César Milstein). На тот момент была исследована способность клеток раковой опухоли миеломы быстро производить идентичные самим себе клетки. Кроме того, существовала возможность выделения антителопродуцирующих клеток из организма животных. Технология Кёлера и Мильштейна включала несколько этапов: у мыши вырабатывался иммунитет к известному антигену, затем из ее селезенки выделялись антителопродуцирующие клетки, эти клетки с помощью особой технологии соединялись с клетками миеломы с получением гибридомы, клетки которой непрерывно в большом количестве синтезировали антитела против известного антигена. Эта методика произвела переворот в изучении антител, поскольку позволила получать антитела с удивительно точным соответствием определенной структуре. В дальнейшем технология была усовершенствована, и в 1984 году Кёлер, Мильштейн и датский иммунолог Нильс Ерне (Niels Jerne) получили Нобелевскую премию за участие в создании антител, которые можно использовать для диагностических исследований и создания лекарственных средств. В дальнейшем было разработано множество технологий, позволивших усовершенствовать синтез антител за счет развития технологий рекомбинации ДНК, технологий клонирования клеток и других достижений генной инженерии.
Четвертый шаг — применение искусственно синтезированных антител для лечения заболеваний (80-е гг. XX в.)
При первых попытках применения для лечения людей антител, искусственно синтезированных из клеток животных, ученые столкнулись с трудностями. В 1979 г. впервые в мире ученые Филип Сташенко (Philip Stashenko) и Ли Надлер (Lee Nadler) применили искусственно синтезированные моноклональные антитела, полученные из клеток мышей, против антигенов, которые вырабатываются на поверхности клеток раковых опухолей. Однако было выявлено, что мышиные антитела в незначительной степени связывались с опухолевыми антигенами и воспринимались организмом как чужеродные клетки.
С 1986 г. на фармацевтическом рынке началась реализация препарата компании Janssen «Ортоклон ОКТ3» (муромонаб), который позволяет купировать реакцию отторжения трансплантата почки, оказывая избирательное иммуноподавляющее действие. Препарат имеет полностью мышиное происхождение, то есть синтезируется мышиными гибридомами, полученными слиянием мышиной миеломы и мышиных В-лимфоцитов. Вскоре после выхода препарата на рынок стало ясно, что при длительном применении мышиных моноклональных антител в качестве лекарственных средств их эффективность снижалась. Это связано с тем, что мышиные белки являются иммуногенными для организма человека, то есть воспринимаются как чужеродные объекты. В связи с этим у пациентов, которым вводят мышиные антитела, быстро образуются человеческие антимышиные антитела (human antimurine antibody – HAMA). Образующиеся HAMA-антитела нейтрализуют эффект мышиных антител.
Пятый шаг — создание химерных антител (90-е гг. XX в.)
В начале 90-х гг. с использованием молекулярно-биологических методов, основанных на применении рекомбинантной ДНК, были созданы химерные антитела. В химерных антителах часть «мышиной» молекулы с помощью методов генной инженерии заменялась на участок человеческого происхождения, а часть оставалась фрагментом мышиного происхождения. Поскольку белковая последовательность химерных антител на 75% состояла из «человеческих» последовательностей аминокислот, то у пациентов, получавших химерные антитела, HAMA-антитела образовывались в значительно меньшем количестве, и это сделало препараты на основе химерных антител значительно более эффективными, чем на основе мышиных. В дальнейшем был выпущен целый ряд лекарственных средств на основе химерных антител: ритуксимаб, выпускаемый под брендами «Мабтера» и «Ритуксан», — для лечения раковых опухолей, «Ремикейд» (инфликсимаб) — для лечения болезни Крона, «Симулект» (базиликсимаб) — для профилактики острого отторжения трансплантата почки, «Реопро» (абциксимаб) — для профилактики стенокардии и острого инфаркта миокарда, а также другие препараты.
Разработка химерных антител позволила практически полностью отказаться от использования мышиных антител. Однако в некоторых случаях использование мышиных антител и сегодня остается оправданным. Из одобренных к применению лекарственных средств сегодня лишь три являются мышиными: «Ортоклон-ОКТ3» (муромонаб-CD3), «Зевалин» (ибритумомаб тиуксетан) и «Бексар» (тозитумомаб-йод 131). Два последних являются радиоактивно мечеными мышиными МАТ. Их функция заключается в доставке радиоизотопов к клеткам лимфомы. Наличие радиоактивной метки позволяет применять эти антитела в очень небольших количествах, поэтому иммуногенность, обусловленная мышиными последовательностями, в этом случае не так значима. То, что эти препараты включают именно мышиные, а не гуманизированные или человеческие формы делает их более эффективными, потому что гуманизированные формы могли бы связываться одновременно не только с клетками-мишенями, но и со здоровыми клетками, нанося им вред. Также к применению сегодня одобрен один препарат на основе крысино-мышиного МАТ — это препарат «Ремоваб» (катумаксомаб) для лечения злокачественного асцита.
Шестой шаг — создание гуманизированных и человеческих моноклональных антител (конец 90-х гг. XX в. — 2000-е гг. XXI в.)
В конце 90-х гг. с помощью методов генной инженерии удалось свести к минимуму процент мышиных последовательностей аминокислот в искусственно синтезируемых антителах, благодаря чему были получены гуманизированные антитела, еще в меньше степени вызывающие образование HAMA-антител у человека. Начиная с конца 90-х гг. на рынок было выпущено множество препаратов на основе гуманизированных антител.
Примеры препаратов на основе моноклональных антител:
В 2000-х годах усовершенствованные методы генной инженерии наконец позволили добиться долгожданного результата и получить человеческие МАТ. В настоящее время человеческие МАТ чаще всего получают с помощью технологии трансгенных мышей (мышей, выведенных с использованием фрагментов чужеродной ДНК) или фагового дисплея (особый метод генной инженерии с использованием вирусов-бактериофагов). Например, сегодня для клинического применения одобрены такие препараты, созданные на основе человеческих МАТ, как «Бенлиста» (белимумаб) — для лечения красной волчанки, «Ервой» (ипилимумаб) — для лечения меланомы, «Симпони» (голимумаб) — для лечения ревматоидного артрита, псориатического артрита, болезни Бехтерева, а также другие препараты.
Еще один тип веществ, созданных методами генной инженерии для лечения пациентов, — это так называемые «белки слияния», в которых искусственно соединены два отдельных белка, зачастую с различными функциями. Например, на основе такого вещества создан препарат «Амевив» (алефацепт) моноклональные антитела при псориазе, орфанный препарат «Аркалист» (рилонацепт) — для лечения редких генетических аутовоспалительных заболеваний, относящихся к группе криопинсвязанных периодических синдромов, и другие препараты.
Разработка новых моноклональных антител сегодня
Разработка лекарственного средства с использованием моноклональных антител — это очень длительный и дорогостоящий процесс. Например, первый препарат на основе мышиных антител «Ортоклон OKT3» был зарегистрирован в 1986 г., только через 11 лет после того, как мышиные антитела были впервые описаны. Первый препарат на основе химерного МАТ «Реопро» был одобрен в 1994 г., через 10 лет после первых работ по изучению химерных МАТ. Первый препарат на основе гуманизированного МАТ «Зенапакс» был утвержден в 1997 г., через 11 лет после первого доклада о конструкции гена гуманизированного антитела. Препарат «Энбрел» на основе слитых белков был одобрен в 1998 г., через 10 лет после описания «белков слияния». Препарат «Хумира» на основе человеческих МАТ был одобрен в 2002 году, через 12 лет после первой статьи о подобных МАТ.
Сегодня интерес к разработке новых препаратов на основе моноклональных антител со стороны производителей очень высок. В настоящее время на территории Российской Федерации стадию клинических исследований проходит более 10 препаратов на основе МАТ. Общее количество препаратов, находящихся на стадии разработки в мире, исчисляется сотнями.
Перед современными учеными, исследующими моноклональные антитела, стоит множество актуальных задач. В частности, поиск решения проблемы иммуногенности препаратов, изготовленных на основе МАТ. Большинство препаратов на основе МАТ, которые сегодня проходят стадию клинических исследований, включают в состав человеческие антитела. Использование этого типа антител снизило иммуногенность препаратов, однако не устранило проблему полностью, поскольку иммунная система человека способна вырабатывать антитела против любого терапевтического белка.
Еще одна проблема, связанная с применением препаратов на основе моноклональных антител, обусловлена тем, что МАТ представляют собой крупные молекулы, которые не способны проникать внутрь клетки или глубоко в ткани. Сегодня МАТ нельзя применять внутрь, так как их концентрация для достижения эффекта должна в несколько тысяч раз превышать концентрацию молекул-мишеней. В связи с этими особенностями, сегодня ученые озабочены созданием нового поколения лекарственных средств, которые объединят в себе преимущества МАТ и мелкомолекулярных препаратов. На этом пути сделано уже несколько важных научных открытий. Первое из них — создание шведской компанией Affibody особых «аффител», которые обладают свойствами обычных антител, но имеют в десятки раз меньшую молекулярную массу, что позволяет им лучше проникать в ткани. Еще одно достижение науки — разработка «нанотел» бельгийской компанией Ablynx. Эти препараты характеризуются высокой стабильностью, что позволяет использовать их внутрь и местно. Кроме того, они просты в производстве. Сейчас на стадии клинических исследований у пациентов с тромбозами и остеопорозом находятся четыре «нанотела». Наконец, еще одно сверхсовременное направление — разработка доменовых антител американской компанией Domantis. Эти антитела должны соответствовать различным отделам тяжелой и легкой цепи антител человека и быть в десять раз меньше обычного антитела, что позволит применять их внутрь и ингаляционно.
Пока что длительность и высокая стоимость производства лекарственных средств с использованием моноклональных антител делает их не всегда доступными для пациентов. Однако ученые работают над созданием новых технологий, которые позволят выпускать новые препараты быстрее и по более низкой стоимости. Благодаря современным технологиям, уже сегодня многие препараты стали доступными для большого количества пациентов и позволили излечить заболевания, ранее считавшиеся неизлечимыми. Можно надеяться, что в будущем спектр излечимых заболеваний еще более расширится, а лекарственные средства на основе моноклональных антител станут еще более эффективными.
Номенклатура моноклональных антител
В октябре 2008 г. на заседании Экспертной группы ВОЗ по международным непатентованным названиям (МНН) были утверждены рекомендации, касающиеся номенклатуры МАТ. МНН моноклональных антител должны включать в себя:
Терапевтические моноклональные антитела
Терапевтические моноклональные антитела
Моноклональные антитела — один из современных инструментов для лечения различных заболеваний
Автор
Редакторы
В четвертой статье спецпроекта о моноклональных антителах мы обсудим их способность лечить различные заболевания: от злокачественных опухолей до болезни Альцгеймера. Мы разберемся в многообразии современных препаратов, созданных на основе моноклональных антител, расскажем, какие особенности структуры антител могут быть использованы в современной фармацевтике.
Терапевтические антитела
Спецпроект об антителах, истории их изучения, методах работы с ними, а также о применении антител в современной медицине и биотехнологии.
Партнер спецпроекта — Департамент вычислительной биологии одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
В первой статье мы рассказали об истории открытия и применения антител [1]. Второй текст был посвящен тому, как эти молекулы распознают чужеродные нашему организму вещества и участвуют в иммунных процессах [2]. Сложный многоступенчатый процесс получения моноклональных антител стал темой третьего материала спецпроекта [3]. Эта статья будет посвящена моноклональным антителам, которые используются в качестве лекарств.
Лекарства-гурманы и препараты-обжоры
Когда человеку предстоит принимать новое лекарство, он обычно задает вопросы о безопасности и побочных эффектах. Многим врачам знакомы дотошные пациенты, приходящие на повторные приемы с инструкциями от препаратов и вопросами о возможных «побочках». Доктора много объясняют, приводят примеры и статистику, но для некоторых пациентов побочные эффекты могут стать весомой причиной для отказа от терапии. Побочные эффекты часто связаны с тем, что лекарство действует не только на болезнь, но и на нормально протекающие в организме процессы. По этому признаку лекарства можно поделить по избирательности. Избирательность в данном случае — это специфичность воздействия лечебной молекулы на процессы и реакции, лежащие в основе патологических изменений. Таргетная терапия с применением лекарств, направленных на конкретную молекулярную цель, является основой современной (доказательной) медицины [4]. Чем выше избирательность препарата, тем меньше его способность влиять на «здоровую» часть организма.
Препараты можно сравнить с человеком, подошедшим на завтрак по типу шведского стола. Гурман будет поедать только те блюда, которые он выберет в ходе пристального рассматривания тарелок, и будет почти незаметен в ресторане гостиницы. Через некоторое время на завтрак ворвется обжора, который шумно накинется на еду и будет поглощать всё без разбора. При этом он разольет по столу кофе, смешает между собой хлопья для завтрака и будет громко нахваливать поваров. Разница между едоками будет очевидна всем окружающим, особенно официантам, которым предстоит разбираться с последствиями нападения на ничего не подозревающий стол с завтраком.
Лекарства отличаются друг от друга. Одни действуют аккуратно и точно, а другие врываются в наш организм ураганом, выполняя свою задачу, но оставляя заметные разрушения после себя в виде побочных эффектов. Любой препарат ценен и опасен тем, на какие процессы он влияет. Чем ниже избирательность лекарства, чем в большее число нормальных процессов оно способно вмешаться, тем опаснее лекарство для организма. Использование «неразборчивых» медикаментов грозит более высоким риском осложнений.
Благодаря Паулю Эрлиху, внесшему огромный вклад в изучение антител [1], теоретическая медицина обогатилась концепцией «волшебной пули» [5]. Под этим названием скрывается идея о том, что можно создать препарат, обладающий высокой избирательностью. Такое лекарство должно подавлять патологические процессы и не наносить вреда организму человека, который его принял. Высокая эффективность и отсутствие побочных эффектов у препарата — мечта любой фармкомпании и любого специалиста.
Неразборчивые лекарства
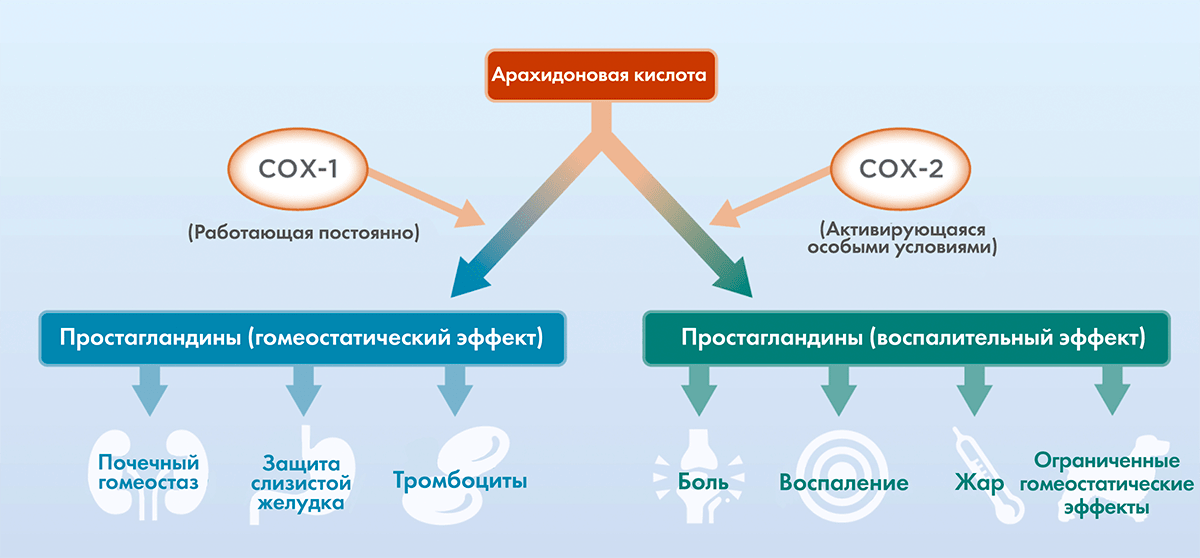
Селективность всегда была проблемой для лекарств. Хорошей иллюстрацией этого являются нестероидные противовоспалительные препараты (НПВС). Ацетилсалициловая кислота (аспирин) обладает способностью подавлять активность двух ферментов: циклооксигеназ (ЦОГ) 1 и 2. ЦОГ-1 — это фермент, который работает в нашем организме всегда. Благодаря ему производится относительно небольшое количество биологически активных веществ, которые позволяют осуществлять нормальные процессы. К таким процессам можно отнести образование защитной пленки на слизистой желудка. ЦОГ-2 «включается» при воспалении и производит массу медиаторов воспаления. НПВС принимают для того, чтобы уменьшить активность ЦОГ-2, но при приеме аспирина (препарата из «старого» поколения НПВС) «за компанию» ингибируется и ЦОГ-1. Это может вызвать такие побочные эффекты, как кровотечения и язвы слизистой желудка (ульцерогенное действие НПВС) (рис. 1).
Рисунок 1. Две изоформы ЦОГ превращают арахидоновую кислоту в простагландины. ЦОГ-1 делает так, чтобы эти вещества образовывались в небольших количествах и поддерживали физиологические процессы. Реакция воспаления тоже происходит благодаря простагландинам, но для этого их должно быть намного больше, чем при нормальных условиях. Такое ударное производство простагландинов обеспечивает ЦОГ-2. «Старые» НПВС (ацетилсалициловая кислота) подавляли активность обеих изоформ, а препараты новых поколений (коксибы) избирательно ингибируют «патологическую» изоформу фермента.
Высокая эффективность у ацетилсалициловой кислоты сочетается с низкой селективностью. Со временем фарминдустрия смогла освоить методы поиска и синтеза более селективных и не менее эффективных препаратов. Среди таких НПВС можно назвать целекоксиб, который избирательно подавляет работу ЦОГ-2 и не влияет на ЦОГ-1. И воспаление подавлено, и слизистая цела.
О том, как вычислительные технологии используются компанией BIOCAD для производства и испытания новых препаратов, мы расскажем в пятой статье спецпроекта.
Плюсы, минусы, подводные камни
Антитела — это специальные молекулы, производимые клетками иммунной системы. Они умеют распознавать антигены — структуры, чуждые для нашего организма, — и помогают в атаке на них [2]. Антитела уже давно используются в лечении различных заболеваний [1]. Тот этап развития медицинского знания, который мы видим сейчас, был бы невозможен без исследований конца XIX — начала XX веков, например, развития метода гибридóм, о котором мы уже не раз писали [1], [9], [10].
Моноклональные антитела — это класс препаратов, которые обладают высокой селективностью в отношении молекулярной мишени, являющейся, как правило, одним из ключевых компонентов патологического процесса. Антитела обладают способностью точно связываться с антигеном благодаря специальным антигенсвязывающим участкам, имеющим к нему высокую специфичность. Для лекарств на основе антител это определяет их селективность в отношении конкретной мишени.
Новые лекарства используют новые точки приложения, действуют там, куда не добрались предыдущие. По этой причине они могут быть эффективнее предшественников или использоваться там, где те не справились, — в случаях, когда болезнь оказалась резистентной к традиционным препаратам. Традиционные лекарства (будем для удобства называть их химическими) действуют за счет того, что напрямую вмешиваются в биохимические реакции синтеза и распада. В медицинской практике мы встречаемся, как правило, как раз с химическими лекарствами. Жаропонижающие, антибиотики, противоопухолевые препараты (цитостатики), антидепрессанты — это препараты, полученные традиционными методами химического синтеза. Так, пенициллин — первый из числа антибиотиков, получивших медицинское применение, — убивает микробы не каким-то неизвестным волшебным образом. Он препятствует синтезу элементов клеточной стенки бактерий, которая из-за этого становится непрочной, и бактерии погибают.
Новые лекарства — новые мишени?
Когда на рынок выходит новый препарат, у специалистов возникает обоснованный вопрос, чем это лекарство отличается от предыдущих. В случае с моноклональными антителами его актуальность усиливается из-за высокой стоимости препаратов этого класса. Насколько обоснованным является выбор в их пользу?
Моноклональные антитела как новый класс препаратов имеют принципиально новые мишени (точки приложения), которые раньше не затрагивались другими препаратами. Так, цитостатики, применяемые для терапии аутоиммунных и онкологических заболеваний, в качестве точки приложения используют процессы репликации ДНК. Нарушение этих процессов в итоге приводит к прекращению роста опухолей. Звучит хорошо, но на деле химиотерапия цитостатиками напоминает применение напалма в джунглях Вьетнама. Прекращается рост не только опухолевых клеток, но и здоровых.
Кроме новизны точек приложения для моноклональных антител характерна высокая избирательность действия. Даже если мишень для препарата новая, лекарство может снова бить без разбора, нанося вред и здоровым клеткам. Моноклональные антитела способны точечно воздействовать на патологический процесс, не вмешиваясь в жизнь нормально функционирующих клеток.
Моноклональные антитела действуют тоньше, чем традиционные методы терапии. Они вмешиваются в патологические процессы не внутри клетки, а снаружи. Моноклональные антитела связываются с внеклеточными структурами, и в этом одно из их принципиальных отличий.
Лекарственные антитела выгодно отличаются от химических препаратов избирательностью действия. Этот класс лекарств относится к биологическим препаратам (biopharmaceuticals, biologics). Лекарства этой группы производятся на основе компонентов биологического происхождения и включают в себя вакцины, препараты генной и клеточной терапии.
Рисунок 2. Антитела способны выполнять множество задач в организме пациента. Это очень удачный инструмент для расширения лечебного воздействия при онкологических заболеваниях.
Традиционные препараты действовали грубо и топорно при этих расстройствах. Так, для терапии аутоиммунных заболеваний можно использовать преднизолон — глюкокортикостероид, который вмешивается в разнообразные каскады иммунных реакций. Противоопухолевые препараты тоже действуют не очень изящно. Циклофосфамид — это соединение, которое применяют для лечения множества опухолей: от рака лёгких до лейкозов. Противоопухолевое действие циклофосфамида основано на его способности образовывать сшивки между нитями ДНК. Такая ДНК не способна реплицироваться, и нарушается процесс деления клеток опухоли. Всё было бы здорово, но циклофосфамид не разбирается, где опухолевая клетка, а где здоровая. Итогом его применения становится нарушение митоза в здоровых клетках организма. «Под раздачу» попадают клетки с самыми высокими темпами деления, например, кроветворные клетки и клеточные элементы крови — тромбоциты, лейкоциты, предшественники эритроцитов. По этой причине среди побочных эффектов циклофосфамида и других цитостатиков значатся кровотечения из-за недостатка тромбоцитов, подавление иммунитета из-за дефицита лейкоцитов и анемия (уменьшение количества эритроцитов).
По большому счету эти препараты пытаются держать ручку двери, которую уже вскрыл взломщик. Он дергает ее иногда так сильно, что может сломать и саму дверь, то есть вызвать серьезные побочные эффекты. Вмешательство в патологические процессы сопровождается нарушениями нормально протекающих процессов.
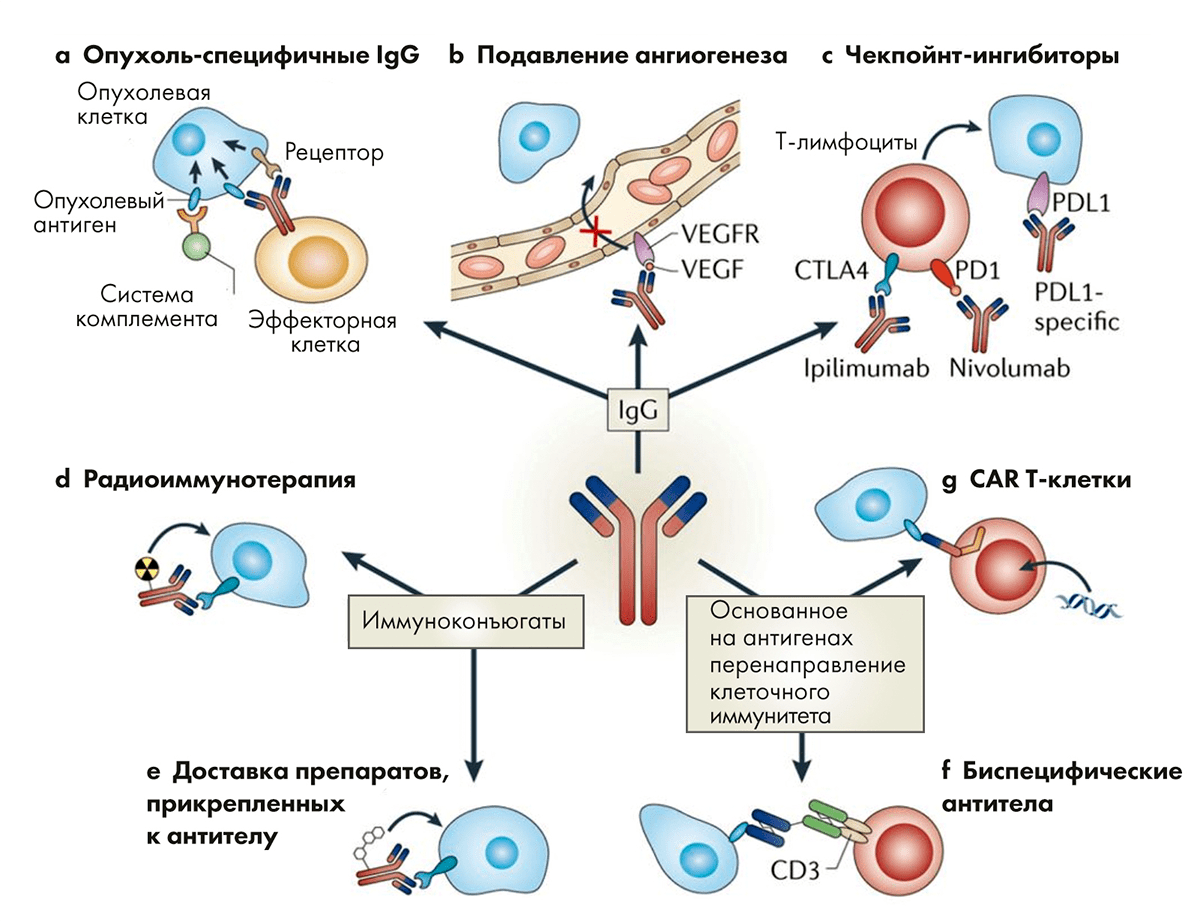
Лекарственные антитела действуют более аккуратно. Они работают не внутри клетки, а за ее пределами. Антитело связывается со специфическим сайтом и не дает запустить внутриклеточные процессы, приводящие к патологическим изменениям в тканях и органах. Моноклональные антитела защищают замки от взлома, и это более тонкая и безопасная стратегия, чем у традиционных препаратов. Антитела как лекарства имеют множество направлений для применения. Это не только блокирование сайтов связывания, но и доставка радионуклидных препаратов точно в цель (рис. 2) [16].
Опухолевую «крепость» можно не просто осаждать, а перекрыть ей пути поступления пищи. Антитела могут заблокировать действие фактора роста эндотелия сосудов (VEGF), за счет чего рост новых сосудов в опухоли остановится, и она начнет гибнуть из-за несоответствия потребностей и поступающих питательных веществ.
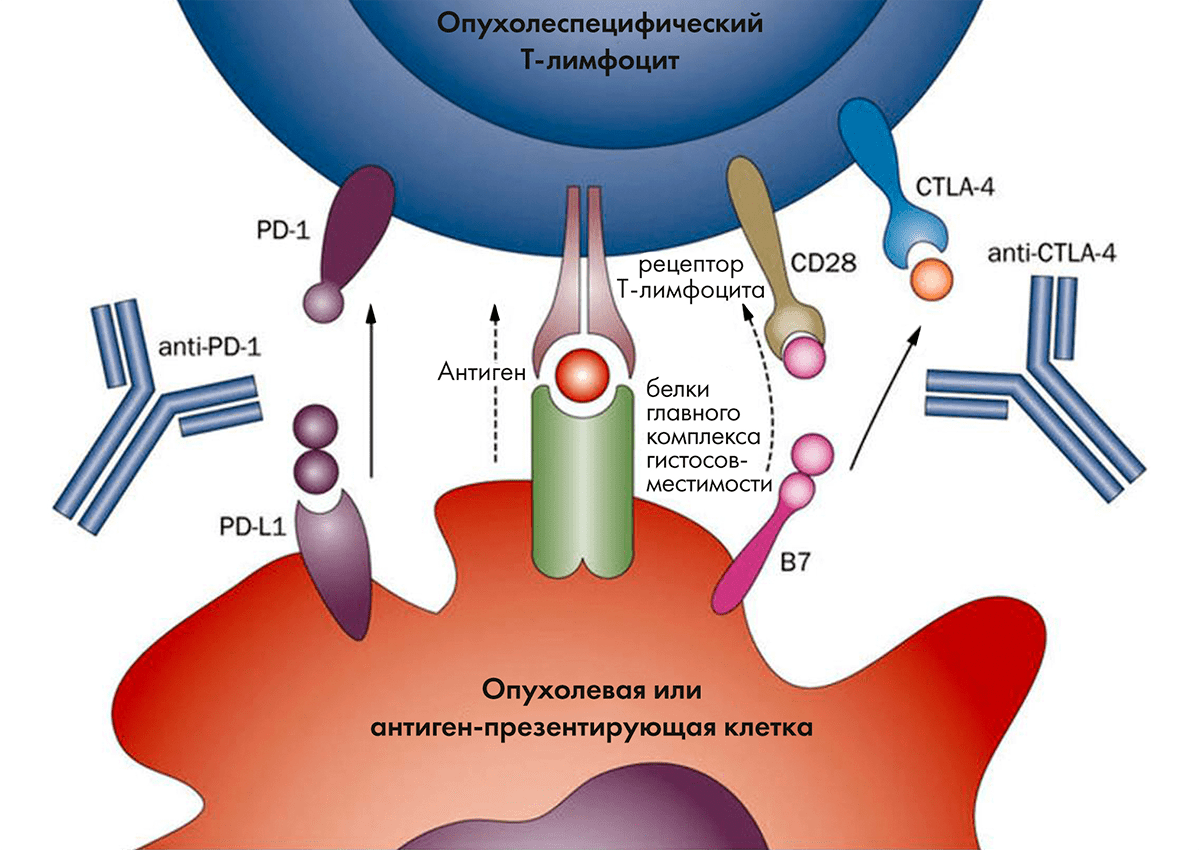
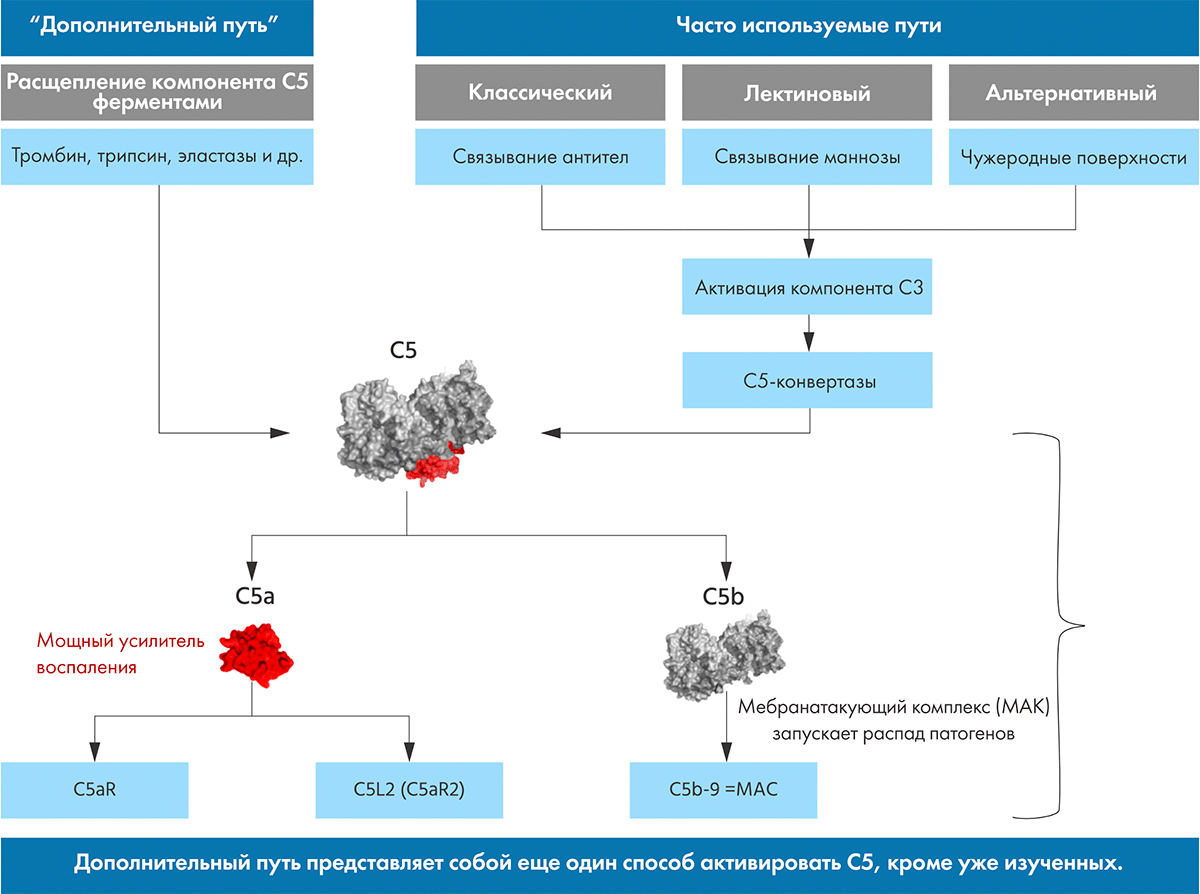
Еще один способ борьбы с опухолями — это ингибирование иммунных чекпоинтов. Воздействие одних веществ усиливает иммунную реакцию организма, а других — подавляет ее (рис. 3) [17]. Стратегия разблокировки подавляющих путей используется препаратами чекпоинт-ингибиторами. Антитела могут блокировать факторы, подавляющие иммунитет, что приводит к развитию и усилению собственной иммунной реакции, направленной на опухолевые клетки.
Рисунок 3. Мишенью для чекпоинт-ингибиторов стали молекулы, подавляющие собственный иммуннитет организма. Это цитотоксический Т-лимфоцитарный антиген 4 (cytotoxic T-lymphocyte antigen 4, CTLA4) и система PD-1/PD-L1. Пояснения к тому, как работают эти молекулы, можно найти в тексте статьи.
Цитотоксический Т-лимфоцитарный антиген 4 (cytotoxic T-lymphocyte antigen 4, CTLA4) известен также под обозначением CD152. Стимуляция CTLA4 подавляет активность T-лимфоцитов на уровне получения информации от антигенпрезентирующих клеток. Ипилимумаб и тремелимумаб способны связываться с CTLA4, не давая другим лигандам подавлять иммунный ответ на этом этапе [18].
Другое направление в терапии — это химерные антигенные рецепторы. Т-клетки, вооруженные ими, способны выборочно уничтожать опухолевые клетки. Химерный антигенный рецептор собран из двух частей. Антительный компонент, находящийся на поверхности Т-клетки, обладает высокой специфичностью и способен выявлять опухолевую клетку. Этот компонент закреплен на белковом фрагменте, который пронизывает мембрану и погружен в цитоплазму. Когда антительный фрагмент взаимодействует с мишенью, происходит активация Т-лимфоцита, и он атакует раковую клетку.
Биспецифические антитела могут связывать вместе иммунную и раковую клетки [20]. Благодаря такой «усиленной дружбе» происходит усиление иммунного ответа, и раковые клетки гибнут. В некоторых случаях они находят третьего товарища в виде макрофага: здесь также произойдет усиление иммунных реакций против клеток опухоли. Иммуноконъюгаты — это класс веществ, где антитело соединено с лекарством, которое надо точечно доставить к раковой клетке. В качестве лекарства может быть радионуклид или противоопухолевое лекарство — то, что может ударить по всем клеткам, но лучше бы било только по опухолевым.
Разработка и получение моноклональных антител стандартизированы и хорошо контролируются производителями. Моноклональные антитела — это блестящий на солнце лекарственный биотех. Он существенно отличается от «паровых котлов» традиционной фармакотерапии. Однако аварии происходят даже с самыми современными машинами. В случае моноклональных антител побочные эффекты также могут возникнуть, но обычно они легче, чем при традиционной терапии химическими препаратами. Гриппоподобные синдромы, инфекционные осложнения, поражение кожи и слизистых могут сопровождать терапию моноклональными антителами. Известны случаи, когда введение экспериментальных лекарственных антител приводило к развитию «цитокинового шторма» [21]. При этом состоянии иммунные клетки нашего тела начинают активно вырабатывать медиаторы воспаления, и человек впадает в состояние, похожее на септический шок, только без бактериального возбудителя. Лекарство всегда остается лекарством. Если вещество может принести пользу, значит, оно может и навредить. Побочных эффектов нет только у гомеопатических препаратов, потому что они не работают.
Следом за селективностью подтянулись безопасность и стоимость. Оригинальные лекарства дороги, потому что в их стоимость закладывается множество трат. Стоимость разработки препарата, всех этапов тестирования, расходы на тупиковые ветки (лекарства, которые не показали своей эффективности) — всё это спрятано в цене, которую мы видим в аптеке. Фармацевтический рынок заполнен не только оригинальными препаратами: большую часть полок в аптеках занимают лекарства-аналоги. Оригинальные препараты защищены от копирования патентом: в течение какого-то времени на рынке будет только новый препарат от одного производителя. Когда срок действия патента истечет, другие производители смогут выпустить на рынок свои препараты с этим же веществом. Такие легальные копии оригинального препарата называются лекарствами-аналогами или дженериками (англ. generics) [22].
Фармакологическим компаниям, занимающимся дженериками, не надо тратиться на весь исследовательский этап: в некоторых случаях даже не надо полностью подтверждать эффективность препарата. Можно сделать цену на дженерик ниже, чем цена оригинального препарата, а прибыли получить гораздо больше. Эта одна из причин, по которым у фармкомпаний снижается интерес к поиску и производству новых препаратов. Стоимость лекарств на основе моноклональных антител высока также потому, что процесс их получения отличается от синтеза традиционных лекарств. Это серьезная биотехнологическая процедура, для которой нужны специальные условия производства и люди с образованием, отличающимся от традиционного в этой индустрии [3].
Арсенал судьи Дредда
Если говорить о лекарствах как о пулях, то моноклональные антитела — это арсенал судьи Дредда. Существующее множество биологических препаратов позволяет проводить терапию самых разных болезней. Стоит оговориться, что моноклональные антитела приобретают особую ценность в лечении заболеваний с мощным иммунным компонентом патогенеза. В патогенезе многих аутоиммунных заболеваний можно обнаружить ключевую иммунную реакцию — процесс, на котором держится весь патологический каскад. Его блокировка способна приостановить развитие аутоиммунного процесса и значительно облегчить состояние пациента.
Антительный «арсенал» сегодня составлен из множества препаратов. Они представлены в первой статье спецпроекта в виде таблицы [1]. Каждое из этих лекарств «нацелено» на 2–3 заболевания. Причина кроется в избирательности антител: они метят в молекулу, которая имеет ключевое значение для развития или поддержания болезни. Аутоиммунные заболевания и заболевания с вовлечением других иммунных процессов — это подходящая область для терапии моноклональными антителами. Патогенез этих болезней включает большое количество собственных белковых молекул пациента со специальной функцией, на которые мы можем воздействовать.
Системная красная волчанка
Белимумаб, применяемый при системной красной волчанке (СКВ) [23], способен связываться с фактором, активирующим В-клетки (B-cell activating factor, BAFF) [24]. BAFF — это цитокин, избирательно повышающий активность B-лимфоцитов и позволяющий им превращаться в плазматические клетки [25]. Для этого цитокину нужно связаться с рецепторами на поверхности клетки. Это событие запустит цепочку сигналов, срабатывание которой приведет к увеличению выработки антител. Для СКВ выработка антител — это ключевой компонент патогенеза. Если антитела перестанут вырабатываться или будут производиться в меньшем количестве, это положительно скажется на течении заболевания. Например, может уменьшиться поражение почек, часто встречающееся при СКВ. Белимумаб связывается с циркулирующим в крови BAFF, не давая ему прицепляться к рецепторам на B-лимфоцитах. Из-за отсутствия этого стимула B-лимфоциты не производят аутоантитела и не превращаются в плазматические клетки. Кроме этого, страдает производство не только антител против собственных тканей, но и против патогенной микрофлоры. По этой причине осложнением при использовании моноклональных антител могут стать инфекционные заболевания. Впрочем, это родовое проклятие всех иммуносупрессантов, в том числе давно используемого и хорошо изученного преднизолона.
Ревматоидный и псориатический артриты
Антитела нашли применение [26] и в лечении ревматоидного артрита (РА) — заболевания, поражающего крупные и мелкие суставы и приводящего к потере способности самостоятельно передвигаться [12]. Инфликсимаб и другие моноклональные антитела активно вмешиваются в воспалительное звено патогенеза РА. Большинство терапевтических антител, используемых при РА, бьют по фактору некрозу опухоли (ФНО или TNF). Тоцилизумаб связывается со свободным и расположенным на мембране интерлейкином-6 (ИЛ-6). Отдельно от этих препаратов стоят этанерцепт и абатацепт. Это гибридные белки, или фьюжн-белки. Они представляют собой два белка, которые кодируются разными генами, но сшиваются в одну молекулу. Этанерцепт — это комбинация рецептора к ФНО и Fc-участка IgG. Этот гибридный белок блокирует избыток ФНО, не позволяя поддерживать воспалительную реакцию при аутоиммунных заболеваниях. Абатацепт представляет собой домен молекулы CTLA-4, соединенный с Fc-участком IgG. Такой фьюжн-белок связывается с рецепторами CD80 и CD86 на поверхности T-лимфоцитов и не дает им полностью активироваться и вести разрушительную деятельность в хрящевой ткани суставов. Инфликсимаб также эффективен при другом заболевании, поражающем суставы — при анкилозирующем спондилите (болезни Бехтерева).
Другой мишенью для терапии моноклональными антителами стало поражение суставов при псориазе — псориатический артрит (ПА). Этанерцепт, адалимумаб и инфликсимаб, как и при РА, мешают ФНО выполнять свою работу. Три препарата сравнивали в отдельном исследовании, где показали бóльшую безопасность адалимумаба по сравнению с двумя остальными молекулами [27].
«Лотесса» против «Ремикейда»
Оригинальный инфликсимаб («Ремикейд») сравнивали по эффективности и безопасности с инфликсимабом компании BIOCAD («Лотесса»). Данное исследование, включившее почти 200 человек, установило, что «Ремикейд» и «Лотесса» сравнимы по этим параметрам. Результаты клинического испытания были опубликованы летом 2018 года в журнале Annals of the Rheumatic Disease [28]. Кроме того, BIOCAD создал оригинальный моноклональный препарат левилимаб, мишенью которого также стал ИЛ6.
Антитела для суставов
Адалимумаб от BIOCAD ждет выхода на рынок и сейчас проходит дополнительные исследования безопасности и эффективности, где его сравнивают с оригинальной «Хумирой». Предварительные результаты исследований будут известны позже. Мишенью другого — уже оригинального — препарата от BIOCAD, нетакимаба, стал ИЛ17. Сейчас препарат тестируют в отношении псориаза и анкилозирующего спондилита (болезни Бехтерева).
Материал предоставлен партнёром — Департаментом вычислительной биологии компании BIOCAD
Кроме этих заболеваний с иммунным компонентом моноклональные антитела оказались полезны при язвенном колите и болезни Крона — воспалительных заболеваниях, поражающих желудочно-кишечный тракт. Ведолизумаб используется при обеих патологиях. Он препятствует миграции Т-хелперов из кровеносных сосудов в стенку кишечника. Ведолизумаб способен избирательно связываться с белком α4β7-интегрином, расположенным на клетках кишечника. Его блокировка нарушает процесс соединения молекул клеточной адгезии слизистой оболочки с адрессином-1 (MAdCAM-1) на Т-лимфоцитах. Соответственно, Т-лимфоциты не могут закрепиться на клетках кишечника, и иммунная реакция не запускается.
Реакция отторжения трансплантата
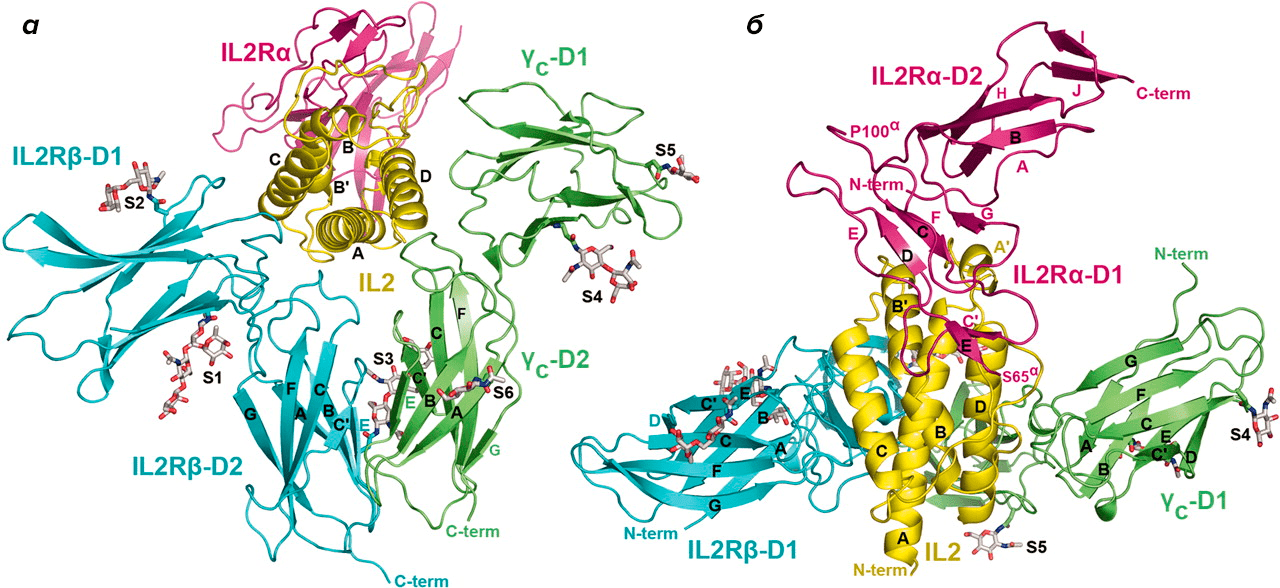
Антитела могут оказаться полезными при лечении иммунных осложнений — реакции отторжения пересаженного органа. Оба препарата, одобренных для борьбы с отторжением трансплантата почки (басиликсимаб и даклизумаб), препятствуют связыванию интерлейкина-2 (ИЛ2) со специфическим рецептором. Это происходит благодаря блокированию α-субъединицы рецептора (рис. 4) [29]. В отличие от всех случаев, описанных выше, антитело связывается с рецептором, а не с молекулой, которая его активирует. При таком взаимодействии всегда есть опасность, что вместо ингибирования реакции вещество запустит ее. В ходе длительных работ по отбору антител были получены такие молекулы, которые лишены способности стимулировать рецепторы и запускать иммунную реакцию.
Рисунок 4. Строение рецептора к ИЛ2. а — Вид сбоку. б — Вид сверху. Мишень для моноклональных антител (α-субъединица рецептора) нарисована красным.
Пароксизмальная ночная гемоглобинурия
Болезнь Альцгеймера
Болезнь Альцгеймера — это не такое редкое заболевание, как пароксизмальная ночная гемоглобинурия [32]. Широта его распространения и неудовлетворенность существующими методами лечения заставляет ученых искать новые методы лечения. Сейчас мы знаем, что в патогенезе болезни Альцгеймера важную роль играет накопление β-амилоида (в соответствии с амилоидной гипотезой). Сам β-амилоид при этом, видимо, является частью системы врожденного иммунитета [33], значит, у антител есть потенциальная возможность воздействовать на этот процесс.
Надежды пока не оправдываются. Компания Pfizer уже прекратила клинические исследования двух моноклональных антител против β-амилоида [34]. Бапинеузумаб и его модифицированная версия оказались неэффективны против накопления белковых отложений в нейронах. Адуканумаб показывает более убедительные результаты, и в настоящее время идут испытания третьей фазы. Разница в эффективности антител может быть связана с различиями в принципе их действия. Бапинеузумаб задумывался как препарат, способный усилить очищение нервной ткани от β-амилоида, в том числе путем его захвата микроглией. Получилось антитело-метка для собственной иммунной системы мозга. Он связывается с мономерами и полимерами β-амилоида. Адуканумаб селективно связывается с β-амилоидными полимерами, которые токсически воздействуют на нейроны [35]. В этих условиях иммунным клеткам не приходится тратить ресурсы на борьбу с безопасным вариантом β-амилоида, и они сосредоточиваются на борьбе с полимерной версией.
По данным предварительных исследований, еще один препарат на основе моноклональных антител показывает хорошую эффективность и переносимость [36]. Это соланезумаб. Эти антитела связываются с растворимыми частицами β-амилоида, которые еще не упакованы в полимеры. Впоследствии β-амилоид выводится из нервной ткани и не оказывает токсического влияния на синапсы. Несмотря на это, пока не существует одобренного способа лечения болезни Альцгеймера при помощи антител. Человечество ждет результатов клинических исследований.
Онкологические заболевания
В борьбе со злокачественными новообразованичми антитела используют четыре механизма [37]:
Лекарства против рака
Компания BIOCAD предлагает несколько препаратов против онкологических заболеваний. Собственный ритуксимаб («Ацеллбия») компании BIOCAD оказался эффективен при неходжкинской лимфоме. Препаратом сравнения выступала оригинальная «МабТера», и «Ацеллбия» не оказалась хуже зарубежного лекарства от топового игрока фармрынка. Препарат, используемый для лечения рака молочной железы, трастузумаб, блокирует рецептор HER2 и не дает эпидермальным факторам роста стимулировать рост опухолевых клеток. Компания BIOCAD выпускает собственный трастузумаб («Гертикад»), который не уступает оригинальному препарату по своей клинической эффективности. Терапия собственным бевацизумабом («Авегра БИОКАД») при немелкоклеточном раке легких в сочетании с карбоплатином и паклитакселом показала схожую эффективность и безопасность терапии оригинальным препаратом («Авастин»), дополненную теми же веществами.
BIOCAD разработала и исследует препараты из класса чекпоинт-ингибиторов, о которых мы рассказали выше. Первое исследование препарата под названием «пролголимаб» было посвящено изучению нового чекпоинт-ингибитора при меланоме, раке легкого и почечной карциноме. Завершенные в настоящее время клинические испытания препарата показали его эффективность в отношении меланомы. Теперь осталось дождаться выхода нового лекарства на рынок.
Материал предоставлен партнёром — Департаментом вычислительной биологии компании BIOCAD
Заключение
Департамент вычислительной биологии компании BIOCAD — спонсор спецпроекта
BIOCAD — международная биотехнологическая компания, которая создала умную технологическую платформу, объединившую в себе компьютерное моделирование и современные принципы синтеза генов de novo.
В компании реализован полный цикл выпуска лекарственных препаратов: от поиска лекарственной молекулы до массового производства и маркетинговой поддержки.
Компания ведет два масштабных проекта:
Для разработки лекарственных препаратов BIOCAD применяет технологию structure-based drug design, использующую методы компьютерного моделирования. Это позволяет сделать поиск молекул направленным. С помощью математического моделирования отобранная молекула оптимизируется под конкретную мишень, а затем воспроизводится в реальной лаборатории.
В основе большинства разработок компании лежит математическое моделирование. То, что раньше было возможно осуществить исключительно in vitro в стенах лабораторий, по мнению исследователей BIOCAD, сегодня может быть воплощено in silico силой чистого разума.
Здесь собрали одну из лучших команд биоинформатиков в стране, которая занимается научными исследованиями, разрабатывает и внедряет новейшие методы интеллектуального анализа данных. В ее распоряжении один из мощнейших вычислительных кластеров, и если еще 2–3 года назад можно было только мечтать о решении задач направленного дизайна белковых молекул, то сейчас это одно из направлений работ Департамента вычислительной биологии.
Материал предоставлен партнёром — Департаментом вычислительной биологии компании BIOCAD