Что вызывает коррозию алюминия
Коррозия алюминия
Алюминий – это материал, без дополнительной защиты и соблюдения правил использования склонный к появлению коррозии. Процесс приводит к его разрушению, вызывает сильную порчу изделий, непригодность к дальнейшей эксплуатации.
Чтобы понять методы защиты, рассмотрим виды коррозии алюминия, особенности ее протекания и катализаторы в зависимости от типа среды. Также затронем факторы дополнительной защиты от внешнего негативного воздействия.
Виды коррозии алюминия
В зависимости от среды, в которой находится материал и дополнительных внешних рисков, может отличаться характер протекания коррозии и ее основные характеристики, степень негативного воздействия на материал.
Далее будут приведены основные виды повреждений.
Общая коррозия (сплошная)
Легко опознать по типу протекания – на материале появляется большое количество небольших точек-язв. Постепенно алюминиевый лист становится тоньше, сильно уменьшается его прочность.
При этом истончение с течением времени протекает равномерно без концентрации в конкретном участке.
Сплошная коррозия характерна для изделий, помещенных в кислотные и щелочные среды. В них происходит смывание оксидной пленки с поверхности, поражение прогрессирует и распространяется по металлу все дальше и дальше.
В зависимости от типа сплава, стойкость материала к общей коррозии сильно отличается. Если в составе содержится мало меди, менее 0,10%, то такое алюминиевое изделие будет стойким к угрозам разрушения.
Когда меди более 0,5%, выбирать область использования алюминия нужно будет уже более осторожно. Не допускается эксплуатация без защитного покрытия и там, где попадание веществ извне может привести к созданию на поверхности сильнокислотной или щелочной среды.
Контактная коррозия
Коррозия алюминия на воздухе и других средах может часто проявляться в контактном виде. Этот вариант также распространен под названием гальванического.
Чтобы такой процесс запустился, в непосредственной близости друг от друга должны находиться металлы.
При этом, появляется электрический мостик – этого достаточно чтобы алюминий начал медленно портиться.
Вероятность создания катодно-анодной связи во многом зависит от того, с какими металлами ведется работа. Причиной появления гальванических поражений становится отказ учитывать особенности материалов при проектировании различных сооружений.
Во многом интенсивность распространения и сам риск появления такого поражения зависят от среды, уровня влажности, загрязненности атмосферы. Так, если воздух сухой, в нем нет посторонних примесей, вероятность развития становится значительно меньше.
На практике не рекомендуется использовать алюминий вместе с оцинкованной сталью. Потенциально это может создать большой риск появления гальванической коррозии.
Щелевая коррозия
Один из видов повреждений, характеризующийся локальным появлением. Возникает из-за того, что в щелях и углублениях часто скапливаются продукты окисления, происходит контакт между двумя металлами.
От такого поражения часто страдают детали с большим количеством выемок, заклепок, болтов. В зону риска попадают и сварные швы. Если вы используете металлоконструкцию на открытом воздухе, стоит периодически прочищать все места, где могут скапливаться грязь, песок, продукты горения и другие посторонние соединения.
Проблема может появиться даже при перевозке большого количества деталей из алюминия. В таком случае, профиль будет страдать поверхностным поражением.
Особенно велик риск в том случае, если груз во время перевозки сильно намокает, попадает под дождь, возникает конденсат. Все перечисленное актуально и для хранения алюминиевых деталей, потому лучше всего складывать их в крытом, сухом помещении, где нет риска намокания.
Нитевидная коррозия
Часто алюминиевые изделия окрашиваются, чтобы увеличить уровень защиты от коррозии и не допустить контакта с катализаторами окисления.
Но если нанести лакокрасочное покрытие с нарушениями, не зачистить поверхность материала, оставить на нем дефекты, велик риск возникновения нитевидной коррозии.
Скорость коррозии алюминия в таком случае будет достаточно высокой. Сама она проявляется в появлении на металле продольных полос, толщина которых составляет не более 0,5 мм.
Коррозия под напряжением
По сравнению с другими описанными случаями, такая проблема встречается не так часто. Но ее опасность в том, что могут быть поражены даже высокопрочные сплавы.
Причина – длительное использование алюминия под сильной нагрузкой, которая в ряде случаев может превышать предельно допустимые значения.
Если проблему не пресечь, на металле появятся трещины, он постепенно потеряет свою прочность, срок эксплуатации значительно сократится.
Межкристаллическая коррозия
Если рассмотреть алюминий под микроскопом, можно заметить его зернистую структуру. При таком варианте поражения, ржавчина начинает появляться на границе таких зерен.
Это не слишком распространенный тип повреждений. Чаще всего он встречается, когда в сплав попадает большое количество кремния и структура постепенно начинает меняться.
Подповерхностная коррозия
Еще один тип проблемы сплавов с высокой прочностью. В этом случае металл оказывается поражен в подповерхностном слое. Может произойти отслоение, возникнут иные проблемы. Использовать даже такое изделие будет уже нельзя.
Особенности влияния среды на состояние алюминия
Стойкость алюминия к коррозии во многом зависит от того, в какой среде используется материал. Внешние условия оказывают значительное влияние на качество сплава. Рассмотрим основные факторы и варианты агрессивных сред.
Воздух
Вариант защиты алюминия от коррозии будет отличаться в зависимости от того, в какой среде он используется. Есть несколько основных факторов, влияющих на вероятность возникновения проблемы и потенциальную скорость ее прогрессирования:
Почва
Грунт представляет угрозу для любого металла. Есть несколько факторов, которые могут усугубить такую проблему:
Если в почве есть блуждающие токи, она неоднородна, присутствует большое количество кислорода, опасность возрастает.
Коррозия алюминия в воде начинается в том случае, если химический состав оказывается катализатором. Среди основных катализаторов:
Алюминиевые изделия могут применяться в разных условиях, как в пресной, так и в морской воде. Главное – обратить внимание на состав сплава и исключить нахождение рядом элементов из нержавеющей или оцинкованной стали.
Щелочь
Коррозия алюминия в кислой среде, в местах с высоким содержанием щелочей очень распространена.
Потому нужно проявлять особое внимание в случае использования таких конструкций на стройках, там, где есть риск разбрызгивания строительных растворов.
В частности, очень высоким содержанием щелочи обычно отличается бетон.
Методы защиты материалов от коррозии
Алюминий относится к типу сплавов, которые хорошо переносят опасность появления коррозии в разных условиях – в почве, на открытом воздухе, при контакте с водой.
Три рекомендации, помогающие значительно увеличить степень защищенности материала:
В случае если проблема все-таки возникнет, можно будет решить вопрос как удалить коррозию с алюминия.
Для этой цели применяется механическая очистка, специальные составы-ингибиторы, которые могут значительно увеличить степень защищенности и не допустить дальнейшего распространения повреждений.
Окисление алюминия на воздухе
Алюминий и его оксид
Алюминий имеет отрицательный окислительно-восстановительный потенциал (–1,66 В), а магний, его важный легирующий элемент, имеет даже более низкий потенциал (–2,38 В). Поэтому, как и большинство других металлов, алюминий встречается в природе только как очень стабильный оксид. Химически это означает наиболее стабильное состояние на самом низком энергетическом уровне. При электролизе металл вынуждают отделиться от кислорода путем подъема его энергетического потенциала. При контакте с кислородом алюминий стремится вернуться к более низкому энергетическому уровню в виде оксида алюминия. Из-за его высокого сродства к кислороду эта реакция происходит мгновенно.
Защита алюминия от коррозии
Алюминий и его сплавы отличаются отличной устойчивостью к разрушениям различного характера. Однако, несмотря на это — коррозия алюминия представляет собой не такое уж и редкое явление. Различные формы коррозии представляют собой основную причину порчи этих материалов. Для борьбы с разрушительными процессами необходимо обязательно понимать факторы, которые являются причиной их появления.
Коррозия алюминия представляет собой реакцию, которая имеет место между металлом и окружающей средой. Этот процесс может иметь как естественное, так и химическое происхождение. Самой распространенной формой разрушения металла можно назвать появление на его поверхности процессов ржавления.
Особенностью всех видов металлов можно назвать их свойство вступать в реакцию с водой и окружающей средой. Отличием для каждого вида металла считается только интенсивность данного процесса. К примеру, у благородных металлов типа золота скорость такой реакции не будет слишком быстрой, а вот железо, в том числе и алюминий, будут реагировать на воздействия такого характера достаточно быстро.
Можно выделить два фактора, которые оказывают непосредственное влияние на интенсивность протекания процесса коррозии. Одним из них можно назвать степень агрессивности окружающей среды, а вторым металлургическую или химическую структуру. Атмосфере, которая нас окружает, всегда характерен определенный уровень влажности. Кроме того, ей характерен определенный уровень загрязнений и отходов.
Если учесть, что свойства атмосферы часто определяются регионом и степенью индустриализации, на сегодняшний день можно выделить:
Для большинства случаев, кислоты неорганического типа, даже при низкой концентрации смогут растворить алюминий. И даже натуральная пленка оксида алюминия не сможет стать достаточной защитой от возникновения коррозийных процессов.
Самыми мощными растворителями можно назвать фтор, калий и натрий. Кроме того, алюминию характерна довольно низкая сопротивляемость к соединениям хлора и брома. Весьма агрессивны к различным сплавам алюминиевых металлов, являются известковые и цементные растворы.
Можно выделить несколько разновидностей проявления коррозии алюминия и его сплавов:
Толщина оксидной пленки на твердом алюминии
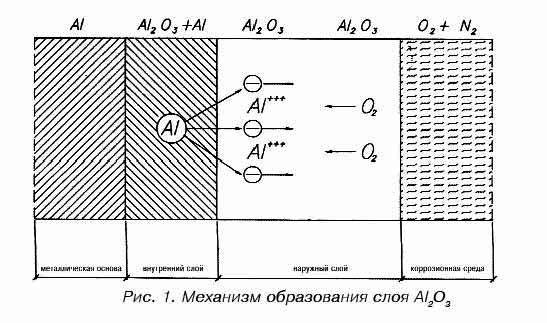
Толщина естественной оксидной пленки довольно тонкая – от 1 до 3 нм в зависимости от сплава и температуре образования оксида (до 300 °С). На рисунке 1 показано постепенное увеличение толщины оксидной пленки на чистом алюминии при ее образовании при температуре от комнатной до 400-500 °С. Затем происходит разрыв в скорости окисления и резкое увеличение толщины оксидной пленки до 20 нм. Причиной этого считается переход от аморфной структуры оксида алюминия к его кристаллической структуре. Именно поэтому при сушке измельченного алюминиевого лома и обжиге с него органических покрытий его не нагревают выше 400 °, чтобы избежать чрезмерного окисления.

Рисунок 1
В твердом состоянии алюминия оксид алюминия играет положительную роль, так как оксидная пленка имеет форму γ-Al2O3 и толщину несколько нанометров. Она надежно изолирует поверхность алюминия и останавливает дальнейшее окисление. При постоянной температуре толщина оксидной пленки растет сначала очень быстро, но затем скорость роста замедляется и сводится практически к нулю.
Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
Алюминий при взаимодействии с воздухом переходит в пассивное состояние. При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2O3•H2O.
Реакция взаимодействия алюминия с кислородом:
Толщина этой оксидной пленки составляет от 5 до 100 нм (в зависимости от условий эксплуатации). Оксид алюминия обладает хорошим сцеплением с поверхностью, удовлетворяет условию сплошности оксидных пленок. При хранении на складе, толщина оксида алюминия на поверхности металла составляет около 0,01 – 0,02 мкм. При взаимодействии с сухим кислородом – 0,02 – 0,04 мкм. При термической обработке алюминия толщина оксидной пленки может достигать 0,1 мкм.
Окисление алюминиевой стружки
С особенностью роста оксидной пленки, которая показана на рисунке 1, связан интересный феномен. Он происходит при хранении алюминиевых отходов в виде стружки. Этот вид алюминиевого лома возникает при механической обработке алюминия и поступает на переплав в основном в виде токарной и сверлильной стружки. Эта стружка имеет после механической обработке свежую, чистую поверхность, которая сразу же начинает окисляться. Так как стружка перед переплавом хранится в прессованных пакетах, то, казалось бы, окисляться должен только наружный их слой, а внутренние слои пакета сохраняться без окисления. Однако по изменению веса пакета было установлено, что окисление его в целом продолжается в течение длительного времени. Причина этого в том, что в пакете есть щели и полости, через которые воздух медленно, но уверено проникает во внутренние его слои. Большинство отдельных стружек очень тонкие, и оксидный слой, хотя и еще более тонкий, дает значительную долю в общем весе пакета. Поэтому при длительном хранении стружки потери металла возникают просто ниоткуда. Вывод из этого может быть только один – стружку необходимо переплавлять немедленно после ее поступления.
Чистка в домашних условиях
Чтобы вернуть алюминиевой посуде первозданный вид, требуется немало времени, проводить процедуры очистки следует осторожно, чтобы не повредить поверхность изделия. Для чистки алюминиевых кастрюль в домашних условиях чаще всего используют подручные средства:
Чистка от нагара
Нагар, который образуется во время эксплуатации, не только портит внешний вид алюминиевой посуды, но и делает ее непригодной для дальнейшего использования. Очистить алюминиевую кастрюлю можно следующими способами:
Кастрюли из алюминия очень удобны в использовании и не так капризны в уходе, как аналоги из других материалов. Несмотря на доступность таких изделий, нужно знать, как очистить алюминиевую кастрюлю, чтобы любимая посуда смогла прослужить максимально долго. Прежде, чем попытаться оттереть предмет до блеска с помощью абразивных средств, жестких губок или наждачной бумаги, следует изучить правила обращения с такими предметами. Существует немало менее опасных, но при этом очень эффективных методов восстановления посуды из алюминия в домашних условиях.
Удельная поверхность алюминиевого лома
Потеря алюминия из-за его окисления при переплаве в печи какой-нибудь загрузки лома пропорциональна удельной площади этого лома. Удельная площадь выражается соотношением
где m – общая масса партии лома, A – общая площадь поверхности всех кусочков лома, составляющих эту загрузку.
Удельная площадь поверхности алюминиевых отходов является критическим параметром. Ее величина увеличивается с уменьшением размеров частиц лома. Так, у куба со стороной 10 см площадь поверхности равна 600 кв. см, а у эквивалентных по массе 1000 кубиков со стороной 1 см – в 10 раз больше. Поэтому скорость окисления этих кубиков будет в 10 раз больше, чем большого куба.
Зависимость интенсивности окисления жидкого алюминия от температуры
С ростом температуры расплава скорость окисления алюминия возрастает. Она довольно медленно возрастает вплоть до интервала температуры от 760 до 780 °С, а затем следует резкое увеличение скорости окисления, как это показано на рисунке 2. Нагрев алюминиевого расплава выше этих температур приводит к повышенным потерям алюминия от его окисления. Эти потери часто называют «угар алюминия

Рисунок 2
Чем очистить алюминий от продуктов коррозии и окиси
Давайте посмотрим, как убирать коррозию, окисления, нагар, налет и прочие загрязнения:
Уксус – эффективное средство
Данный метод ухода за алюминиевой посудой и изделиями достаточно простой и эффективный. Нужно взять уксус или уксусную эссенцию. В жидкости смачивают салфетки и очищают загрязненный участок. Уксус легко уберет окиси разной сложности.
Если грязь не поддается, то обрабатываете деталь в кипящем уксусе. Жидкость доводят до кипения, а затем остужают. Когда уксус остынет, то можно заняться очисткой обрабатываемой детали. Если загрязнение сильное, то изделие кипятят в уксусе.
Сода и клей против застарелых окислов
Чистить окислы и нагар можно при помощи этих веществ. В домашних условиях можно приготовить очень сильное средство, которое не только сделает алюминиевую деталь чистой, но и придаст ей новый вид. В емкость наливают горячую воду, а затем в нее добавляют пищевую соду и клей. Ингредиенты берут в следующих пропорциях – на 10 л воды нужно 100 г соды и 100 г канцелярского клея. Все компоненты нужно тщательно перемешать.
Также нужен небольшой брусок обычного мыла, натрите его на терке и добавьте в воду с клеем и содой. Обрабатываемую деталь кладут в готовый раствор на 2-3 час. Затем, когда пройдет время, нужно промыть изделие в воде и насухо вытереть салфетками. Этот способ позволит удалить окисную плёнку.
Языки
Вход на сайт
МИУЗ в соцсетях
Клининговый поиск
Сбор новостей
Коррозия алюминия и его сплавов (док)
Низкая плотность и механическая прочность в сочетании с удовлетворительной стойкостью к коррозии делают алюминий привлекательным конструкционным материалом, который широко используется в строительстве. Однако с химической точки зрения алюминий — один из наиболее реакционноспособных металлов, который активно взаимодействует не только с кислотами и щелочами, но и с водой! Кажущееся противоречие очень просто объясняется: под воздействием кислорода (или других окислителей) поверхность металлического алюминия покрывается прочной, химически устойчивой оксидной пленкой, предохраняющей металл от разрушения. Это явление называется пассивацией. Металл пассивен в том случае, когда при взаимодействии с потенциальным источником коррозии он не подвергается изменениям, и активен тогда, когда агрессивное вещество его разрушает.
Напомним, что коррозией называется процесс разрушения металлов и их сплавов в результате химического или электрохимического воздействия окружающей среды.
Металл, стойкий к коррозии в одних условиях, может разрушаться в других. Так, например, алюминий стоек к коррозии, вызываемой жидким топливом, и не стоек к действию натриевой щелочи (так называемое явление пассивности и активности).
Окись алюминия создает химически инертный защитный слой, толщина которого составляет 20—100Å. Алюминий, поверхность которого очищена от защитной пленки, может реагировать с водой, выделяя при этом водород. Под влиянием окислителей поверхность алюминия пассивируется, поэтому кислород, содержащийся в воздухе или растворенный в воде, повышает его коррозионную стойкость.
Коррозионная стойкость алюминия в значительной степени зависит от содержания примесей других металлов. Как известно, при контакте двух металлов, погруженных в среду электролита, образуется гальваническая пара, где более активный металл становится анодом, а менее активный — катодом. В результате электрохимической реакции анод разрушается. Большинство примесей (за исключением металлов, более активных, чем алюминий) играют роль катода по отношению к алюминию, т.е. способствуют его разрушению.
По этой причине алюминий высокой чистоты отличается более высокой коррозионной стойкостью, чем технический металл, который, в свою очередь, более устойчив к коррозии, чем сплавы алюминия. Кроме того, коррозионная стойкость алюминия зависит от характеристик окружающей среды и от реакций, вызываемых этой средой в алюминии.
Механизм коррозии алюминия
В присутствии окислителей поверхность алюминия покрывается защитным слоем окиси алюминия.
Защитный слой, в свою очередь, состоит из двух слоев:
Виды коррозии
Коррозию металлов можно разделить на химическую и электрохимическую.
Электрохимическая коррозия происходит при действии на металл растворов электролитов (т.е. растворов, содержащих носители электрического тока — ионы) и сопровождается возникновением электрического тока.
Химическая коррозия происходит при воздействии на металл сухих газов, пыли, жидких веществ (не электролитов) и не сопровождается возникновением электрического тока.
Разрушающее действие коррозии всегда начинается с поверхности металла. Затем коррозия распространяется в глубину со скоростью, зависящей от вида металла или сплава, его состава, структуры, характеристик, а также состава и характеристик окружающей среды. Этому процессу чаще всего сопутствуют изменения внешнего вида поверхности: она становится матовой, изменяет цвет, появляются точки, пятна, вздутия и т. д.
В результате взаимодействия алюминия с окружающей средой образуются вещества (продукты коррозии), свойства которых в значительной мере влияют на протекание коррозионных процессов. Рассмотрим возможные разновидности такого влияния:
В зависимости от свойств продуктов коррозии можно выделить следующие разновидности последней:
Электрохимическая коррозия
В техническом алюминии (или в его сплавах) содержатся примеси металлов в виде отдельных вкраплений (магний, титан, железо, марганец и др.)
Благодаря наличию таких вкраплений сплав, погруженный в электролит, представляет собой совокупность большого количества микроскопических гальванических очагов. В результате электрохимической реакции, возникающей в этих очагах, металл, выступающий в роли анода (а в нашем случае это основной компонент сплава, алюминий), растворяется, в то время как на микрокатодах выделяется водород (рис. 2).
Такие микроисточники коррозии по своей природе являются обычными гальваническими элементами и отличаются:
Процесс электрохимической коррозии не всегда является результатом возникновения микроскопических гальванических элементов. В ряде случаев очаги коррозии имеют «видимые» (макроскопические) размеры.
Механизм электромеханического коррозионного разрушения для разной величины поверхности катода (сталь) и анода (алюминий) представлен на рис. 3.
Атмосферная коррозия
Атмосферной коррозией называют процесс разрушения металлов на воздухе в результате происходящих на их поверхности химических и электрохимических реакций. Это наиболее распространенный пример разрушения металлов.
Основной причиной атмосферной коррозии является тонкий слой влаги, который образуется на поверхности металла, если его температура находится ниже точки росы. С понижением температуры или при увеличении содержания водяного пара в воздухе излишек пара оседает в виде капель воды.
Если поверхность негладкая, покрыта пылью и слоями продуктов коррозии, то значительно раньше достижения точки росы во всех углублениях, порах и трещинах конденсируется пар и образуется слой воды.
Некоторые газообразные вещества, содержащиеся в атмосфере, такие как оксиды азота, серы, хлорид водорода и другие, растворяются в конденсированной влаге, образуя кислоты. Поскольку растворимость этих веществ в воде очень высока, они концентрируются в слое воды даже тогда, когда их содержание в воздухе сравнительно невелико.
Скорость коррозии зависит как от характеристик коррозионной среды (внешних факторов), так и от характера самого металла (внутренних факторов).
К внешним факторам относятся:
К внутренним факторам относятся:
Влияние атмосферы на процесс коррозии зависит от климатической зоны, уровня развития промышленности в регионе и загрязненности атмосферы. Наиболее существенными факторами, определяющими коррозионные свойства атмосферы, являются содержание пыли, газов, влажность и температура.
Влиянием этих факторов объясняется различная скорость процесса коррозии в различных точках земного шара. Например, чем ближе к морю, тем больше в воздухе морских солей, ускоряющих коррозию, особенно NaCl. В регионах, где много промышленных объектов, в воздухе много таких соединений, как SO2.
Отметим, что скорость коррозии на воздухе, как правило, значительно ниже, чем в пресной воде или почве. Атмосферную коррозию можно разделить на сухую, влажную и морскую.
Сухая (газовая) атмосферная коррозия проходит в условиях полного отсутствия влаги на поверхности металла. Этот вид коррозии протекает очень медленно. Если в атмосфере содержатся агрессивные газы, то скорость коррозии значительно ускоряется.
Влажная атмосферная коррозия протекает в слое электролита малой толщины. Скорость процесса зависит от влажности воздуха, атмосферных загрязнений и гигроскопичности продуктов коррозии: если эти вещества задерживают влагу на поверхности металла, скорость коррозии возрастает.
Морская атмосферная коррозия. В регионах с морским климатом в состав атмосферы входит большое количество солей, на поверхности металла собираются капли морской воды, соли и другие загрязнения, ускоряющие коррозию.
Взаимодействие алюминия и его сплавов с другими металлами и сплавами
В среде электролита два различных металла, соприкасающиеся между собой или соединенные проводником, образуют гальванический элемент, в котором генерируется электрический ток. Направление движения электронов в гальваническом элементе определяется величинами электродных потенциалов металлов, значения которых приведены в таблице 1. Электроны движутся от металла с более высоким потенциалом (анода) к металлу с низшим потенциалом (катоду). В такой ситуации металл с высоким потенциалом (и большей химической активностью) разрушается.
Таблица 1.
Реакция на
электродах
Стандартный
потенциал
окисления
В таблице 1 представлены значения стандартных электродных потенциалов (электрохимический ряд напряжений) для элементов, которые входят в состав алюминиевых сплавов или металлических соединений, использующихся в алюминиевых конструкциях.
Интенсивность коррозии, возникающей при соединении двух металлов, зависит от их расположения в ряду напряжений (разности потенциалов), от соотношения площади поверхности и уровня их поляризации.
Чем больше разность потенциалов в гальваническом элементе, тем выше напряжение и тем интенсивнее разрушается анод. Значения потенциалов, приведенные в электрохимическом ряде напряжений, определены для стандартных условий (температура 25°С и единичная активность ионов в растворе электролита). Нужно учитывать, что в зависимости от состава электролита эти значения могут меняться. Так, например, в щелочных растворах алюминий корродирует значительно сильнее, чем в кислых.
Цинк, потенциал которого близок к потенциалу алюминия, может использоваться для непосредственного контакта с алюминием. Если такой контакт происходит в нейтральных и кислых средах, цинк выполняет функцию анода и поэтому защищает катодный алюминий от коррозии. Однако в щелочных средах, наоборот, активность алюминия возрастает, поэтому цинк ускоряет коррозию алюминия.
При контакте стальных оцинкованных деталей (шурупов и т.д.) с алюминием слой цинка вначале обеспечивает защиту алюминия, но после стирания цинка стальная поверхность становится открытой, что может привести к коррозии алюминия. В контакте с алюминием рекомендуется применение стали, оцинкованной горячим методом, поскольку в этом случае толщина покрытия больше, чем при электролитической оцинковке.
Ни в коем случае алюминий не должен соединяться с медью и ее сплавами, поскольку это приводит к быстрой коррозии алюминия (так называемой «катастрофической коррозии»). В связи с этим в алюминиевых конструкциях недопустимы всякого рода элементы и дополнения из меди.
По этой же причине не следует допускать влияния на алюминий дождевой воды, которая стекает с медных крыш и труб непосредственно на алюминиевые конструкции, даже тогда, когда она содержит небольшие количества ионов меди.
Следует также избегать контакта с оловом и его соединениями, особенно в атмосфере, загрязненной промышленными отходами. Соли олова, образующиеся в кислой среде, сильно разрушают поверхность алюминия.
Свинцовый сурик, при наличии влаги, содержащей кислоту, проявляет сильную коррозионную активность. Поэтому при контакте с алюминием следует избегать стальных элементов, покрытых свинцовым суриком.
Ртуть и ее соли уже в присутствии следов влаги вызывают сильную коррозию алюминия. В этом случае процесс коррозии усиливается благодаря образованию амальгамы: амальгамированный алюминий интенсивно взаимодействует с водой в даже отсутствие кислот и щелочей! Поэтому при складировании алюминиевых профилей даже пары ртути (из разбитой лампочки) могут привести к мгновенной коррозии.
Соединение алюминия и стали допустимо в сельской местности, но на приморских и промышленных территориях сталь ускоряет коррозию алюминия. Поэтому при контакте стали и алюминия необходимо избегать их непосредственного контакта, например, путем оцинковки стали, покраски алюминия с одновременным использованием изолирующих прокладок из синтетических материалов.
При соединении железа, никеля и хрома с алюминием возникает значительная разность потенциалов, поэтому их не следует соединять непосредственно друг с другом. Кроме того, соли этих металлов (хлориды, сульфаты и т. д.), которые образуются в результате их коррозии, также способствуют разрушению алюминия.
Химическая коррозия
Процесс химической коррозии протекает при воздействии сухих газов, жидких неэлектролитов и других материалов (в том числе и строительных) на алюминий.
В результате химической коррозии на поверхности алюминия образуется защитный слой, состоящий из продуктов коррозии и препятствующий взаимодействию агрессивных веществ с металлом. Скорость и вид химической коррозии определяет процесс диффузии агрессивного вещества через защитный слой.
Как мы упоминали ранее, слой окиси алюминия возникает на поверхности в результате окисления металла кислородом воздуха. На воздухе в отсутствие влаги толщина этого слоя в течение нескольких минут достигает 10 Å.
Химическая стойкость сплавов алюминия
В дистиллированной воде алюминий проявляет очень хорошие показатели стойкости к коррозии при любой температуре.
Дождевая вода может разрушать алюминий, если в атмосфере содержится значительное количество промышленных газов. Растворяясь в воде, это газы (SO2, NO2, хлороводород и т.д.) образуют кислоты, разрушающие алюминий. Поэтому во избежание коррозии алюминиевые конструкции следует проектировать так, чтобы свести до минимума скапливание дождевой воды на поверхности металла.
Водопроводная вода действует на алюминий по-разному, в зависимости от содержащихся в ней примесей. В кислых или щелочных водах алюминий может подвергаться коррозии. Процесс коррозии ускоряют ионы хлора или тяжелых металлов, содержащиеся в водопроводной воде.
Промышленные сточные воды вызывают очень сильную коррозию, которую ускоряют ионы тяжелых металлов.
Водород, азот и благородные газы (гелий, аргон, неон, криптон, ксенон) не действуют на алюминий даже при повышенных температурах.
Галогены (хлор, бром, йод, фтор) в отсутствие влаги не действуют на алюминий. При взаимодействии с водой они образуют кислоты, агрессивные по отношению к алюминию.
Сухие хлороводород, бромоводород, йодоводород, фтороводород не действуют на алюминий. Но водные растворы этих газов — кислоты, активно разрушающие алюминий.
Сероводород не разрушает алюминий при температуре до 500°С.
Двуокись серы в отсутствие водяного пара не разрушает алюминий (до 400°С), хотя при наличии влаги вызывает коррозию. Аналогично действует и триокись серы.
Аммиак в газообразном состоянии не действует на алюминий даже при высоких температурах.
Оксид углерода СО разрушает алюминий только при температуре свыше 550°С.
Углекислый газ ведет себя аналогично СО. В воде углекислый газ образует угольную кислоту, не вызывающую значительных коррозионных разрушений.
Неорганические соединения
Алюминий не стоек к действию кислот. Исключение составляют концентрированные азотная и серная кислоты — их окислительные свойства настолько сильны, что при контакте с алюминием на его поверхности образуется прочный слой оксида алюминия, препятствующий дальнейшему разрушению металла (поэтому концентрированную азотную или серную кислоту перевозят в алюминиевых цистернах). Разбавленная азотная или серная кислота — более слабый окислитель — энергично реагирует с алюминием.
В кислотах алюминий растворяется тем хуже, чем меньше содержит дополнительных примесей. Следует помнить, что анодное окисление не защищает от воздействия кислот, поскольку они разрушают слой Al2O3. Химическая активность кислот увеличивается с ростом температуры. Например, с возрастанием температуры на 10°С скорость коррозии удваивается. Увеличение концентрации кислоты, как правило, увеличивает скорость коррозии (концентрированные серная и азотная кислоты — исключение).
Соляная кислота вызывает сильную коррозию. Действие этой кислоты нельзя ослабить добавлением ингибиторов.
Фтороводородная кислота оказывает самое сильное влияние на алюминий. Даже непродолжительное взаимодействие разбавленной кислоты ведет к полному растворению алюминия.
Кислородсодержащие кислоты хлора (HClO4, HClO3, HClO) вызывают сильную коррозию алюминия.
Серная кислота вызывает равномерную коррозию алюминия, интенсивность которой зависит от концентрации. Разбавленная кислота средней концентрации при комнатной температуре отличается умеренной агрессивностью. Наиболее агрессивна кислота концентрации 80%. Некоторые вещества, входящие в состав алюминиевых сплавов, а также ионы, содержащиеся в воде (особенно фториды и хлориды), усиливают действие серной кислоты.
Сернистая кислота вызывает локальную коррозию алюминия.
Сера и халькогены (селен и теллур) на алюминий не действуют.
Фосфорная кислота разрушает алюминий умеренно или сильно (в зависимости от концентрации).
Мышьяк при комнатной температуре не действует на алюминий.
Мышьяковая кислота (H3AsO4) и окись мышьяка сильно разрушают алюминий, а мышьяковистая кислота (H3AsO3) без нагревания на него не влияет.
Азотистая кислота (HNO2) при комнатной температуре не действует на алюминий.
Азотная кислота (HNO3) воздействует на алюминий по-разному, в зависимости от концентрации. Разбавленные растворы интенсивно разрушают алюминий. В концентрированных растворах вследствие окислительных процессов поверхность алюминия пассивируется и коррозия замедляется. Наиболее сильную коррозию вызывает кислота концентрацией 10-60%. Действие азотной кислоты приводит к равномерной коррозии. С увеличением чистоты алюминия возрастает его стойкость к коррозии. Наличие в составе слава примесей меди, кремния, магния усиливает воздействие азотной кислоты.