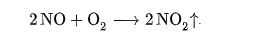Что выделяется при сжигании водорода
Водородное топливо
LH2 является самым экологически чистым видом моторного топлива, поэтому его перспективы очевидны
Водородное топливо
В Австралии на бурых углях в штате Виктория отрабатывается технология технология газификации угля с последующим выделением водорода, вернее удаления серы, ртути и двуокиси углерода (СО2).
Водород
Водород (H) является самым распространенным элементом на Земле, но в обычных условиях он не встречается ни в виде водорода H, ни в виде газообразного водорода (H2).
Благодаря своим характеристикам он легко вступает в реакцию с другими органическими соединениями с образованием, например, воды (H2O).
Во время этой реакции образования воды из водорода и воздуха выделяется энергия, которую можно использовать в качестве электричества.
Чтобы сделать эту реакцию полезной для промышленного производства электроэнергии, необходимо произвести водород, например из воды путем разделения атомов на кислород и водород посредством электролиза.
Есть другие технологии:
Реакция взаимодействия водорода с кислородом происходит с выделением тепла.
Если взять 1 моль H2 (2 г) и 0,5 моль O2 (16 г) при стандартных условиях и возбудить реакцию, то согласно уравнению
после завершения реакции образуется 1 моль H2O (18 г) с выделением энергии 285,8 кДж/моль.
1 м³ водорода весит 89,8 г (44,9 моль), поэтому для получения 1 м³ водорода будет затрачено 12832,4 кДж энергии.
1 кВт*ч = 3600 кДж, поэтому получим 3,56 кВт*ч электроэнергии.
Целесообразность перехода на водородное топливо можно оценить, сравнив имеющийся тариф на 1 кВт*ч электричества и, к примеру, стоимость 1 м³ газа или стоимость другого энергоносителя.
Получение водорода
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
Конверсия с водяным паром: CH4 + H2O ⇄ CO + 3H2 (1000 °C) Каталитическое окисление кислородом: 2CH4 + O2 ⇄ 2CO + 4H2
Физические свойства
Химические свойства
Молекулы водорода Н₂ довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении.
Он может «отнимать» кислород от некоторых оксидов, например:
Реакция восстановления противоположна реакции окисления.
Обе эти реакции всегда протекают одновременно как 1 процесс: при окислении (восстановлении) одного вещества обязательно одновременно происходит восстановление (окисление) другого.
С галогенами образует галогеноводороды:
F2 + H2 → 2 HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + H2 → 2 HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
Экологические проблемы сжигания водорода
Все мы знаем формулу Н2О. Некоторые еще знают, что при сжигании водорода выделяется энергия (около 140 МДж/кг). Особо упоротые еще знают, что водород производят на водородных станциях, а кислород на кислородных станциях.
Еще кто-то слышал, что это самое экологичное топливо, так как выхлоп целиком состоит из водяного пара Н2О.
На этом «знания» заканчиваются.
Про то, что водяной пар — это главный парниковый газ я писал тут:
https://smart-lab.ru/blog/659641.php
Теперь перейдем непосредственно к самому процессу сжигания.
Приблизительно процесс описывается формулой 2H2 + O2 = 2H2O + E
Проблема в том, что при сжигании водорода используют не чистый водород, а атмосферный воздух.
атмосферный воздух состоит из азота на 78%, кислорода на 21 % — кислород. 1% приходится на другие газы, включая ныне нелюбимый всеми СО2.
Так что же происходит?
Всё дело в том, что при температуре горения более 600 оС, а особенно после 1500оС начинается реакция азота и кислорода: 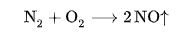
тепловой эффект реакции −180,9 кДж
NO не имеет запаха, но при вдыхании может связываться с гемоглобином, подобно угарному газу переводя его в форму, не способную переносить кислород.
При комнатной температуре и атмосферном давлении происходит окисление NO кислородом воздуха:
Оксид азота (IV) NO2 (диоксид азота; двуокись азота) в высоких концентрациях раздражает лёгкие и может привести к серьёзным последствиям для здоровья. NO2 соединяется с водой, хорошо растворяется в жире и может проникать в капилляры лёгких, где он вызывает воспаление и астматические процессы. Концентрация NO2 свыше 200 ppm считается летальной, но уже при концентрации свыше 60 ppm могут возникать неприятные ощущения и жжение в лёгких. Долговременное воздействие более низких концентраций может вызывать головную боль, проблемы с пищеварением, кашель и лёгочные заболевания.
В клинике острого отравления оксидами азота различают четыре периода: латентный, нарастания отёка лёгких, стабилизации и обратного развития[3]. В скрытом периоде мнимого благополучия, который может продолжаться 4—12 часов, больного может беспокоить конъюнктивит, ринит и фарингит за счёт раздражения слизистых оболочек, проявляющиеся кашлем, слезотечением, общим недомоганием, однако его общее состояние в целом удовлетворительное. Затем состояние больного ухудшается: по мере развития отёка лёгких появляется влажный кашель со слизистой или кровянистой мокрота, одышка, цианоз, тахикардия, субфебрильное или фебрильное повышение температуры. Возникает чувство страха, психомоторное возбуждение и судороги. В отсутствие квалифицированной медицинской помощи это может привести к летальному исходу.
Токсичность! Оксид азота (II) — ядовитый газ с удушающим действием.
Ответствен за смог!
Смог — это чрезмерное загрязнение воздуха вредными веществами, выделенными в результате работы промышленных производств, транспортом и теплопроизводящими установками при определённых погодных условиях. Выбросы NOx считаются одной из основных причин образования фотохимического смога:
ru.wikipedia.org/wiki/%D0%A1%D0%BC%D0%BE%D0%B3
Но это мелочи!
Соединяясь с парами воды в атмосфере, NOx образуют азотную кислоту, и, вместе с оксидами серы, являются причиной образования кислотных дождей.
Лес после кислотного дождя:
Именно по оксидам азота сильно ударили экологические нормы ЕВРО, начиная с ЕВРО-3: 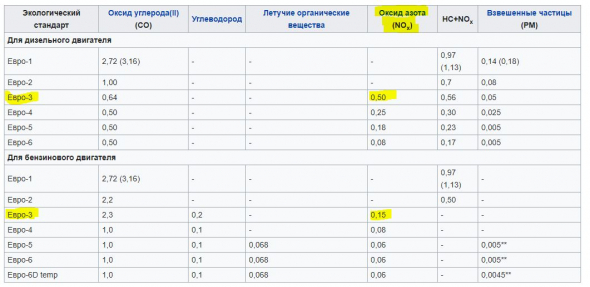
ru.wikipedia.org/wiki/%D0%95%D0%B2%D1%80%D0%BE-6
И так, а что же при сжигании водорода?
Температура более 1500 градусов, что приводит к недопустимо высоким выбросам NOx.
при горении водорода в воздухе достигается температура около 2000°С.
(Кстати, эти любимые всеми клапана EGR в автомобилях как раз и призваны снижать образование оксидов азота)
Особо забавно читать выводы по эксплуатации экспериментальных энергических установок на водороде:
Газовая турбина на водороде
Ключевая технология, необходимая для масштабного использования водорода в газовой электроэнергетике, – водородная турбина. По оценке компании Mitsubishi Hitachi Power Systems (MHPS), на существующих газотурбинных установках можно увеличить долю водорода до 20% в смеси его с природным газом без существенных изменений в конструкции. MHPS успешно испытала в Японии сверхмощную газовую турбину серии J в работе на топливной смеси из природного газа (70%) и водорода (30%). Испытания были проведены на заводе в Такасаго на парогазовой установке мощностью 700 МВт (КПД – 63% с температурой газов после камеры сгорания ГТУ – 1600°C). Для сжигания топлива использовались горелки с вихревым перемешиванием. Благодаря водороду выбросы CO2 сократились на 10%, а выбросы оксидов азота, по мнению компании, «остались на удовлетворительном уровне».
Т.е. если мы меняем смесь природного газа и водорода на (60%) и (40%), то очевидно что выбросы оксидов азота, даже по мнению компании оказываются уже на каком-то совершенно неприличном уровне!
Кстати, ранее именно из-за оксидов азота был похоронен проект автомобиля на газотурбинном двигателе:
Водород
В трудах химиков XVI-XVIII вв. упоминался «горючий» или «воспламеняемый воздух», который в сочетании с обычным давал взрывчатые смеси. Получали его, действуя на некоторые металлы (железо, цинк, олово) разбавленными растворами кислот – серной и соляной. Первым ученым, описавшим свойства этого газа, был Г.Кавендиш. Он определил его плотность и изучил горение на воздухе, однако приверженность теории флогистона помешала исследователю разобраться в сути происходящих процессов. Кавендиш принял «горючий воздух» (водород) за чистый флогистон – невидимую субстанцию, которую тела теряют при горении или при растворении в кислотах. Тогда металлы считали сложными веществами, содержащими флогистон, его-то они якобы и выделяют под действием кислоты.
Дальнейшее развитие химии показало ошибочность этой теории. Теперь общеизвестно, что водород входит в состав кислот, а металлы являются простыми веществами. Однако способ получения водорода, открытый в те времена, используется в лабораториях до сих пор. Для этого в аппарат Киппа загружают палочки, отлитые из цинка, и заливают 20-процентную серную кислоту:
А.Л.Лавуазье в 1779 г. получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубку с железными опилками. При температуре красного каления железо вступает в реакцию с водяным паром, и выделяется водород: 3Fe + 4H2O = Fe3O4 + 4H2↑

Лавуазье также доказал, что при взаимодействии «горючего воздуха» с кислородом образуется вода, причем газы реагируют в объемном соотношении 2:1. Это позволило ученому определить состав воды – Н2О. Название элемента – Hydrogenium – Лавуазье и его коллеги образовали от греческих слов «гидор» — «вода» и «геннао» — «рождаю». Русское слово «водород», т.е. «рождающий воду», является точным переводом латинского названия.
Водород относится к числу наиболее распространенных химических элементов. В земной коре он встречается почти исключительно в виде соединений: входит в состав нефти, природного газа, каменного угля, некоторых минералов. В свободном состоянии он обнаружен в незначительном количестве в вулканических газах, а также среди продуктов разложения органических веществ микроорганизмами. Но конечно, самое известное соединение водорода – это его оксид, вода. По оценкам ученых, на Земле 1,4∙10 18 т поверхностных вод, и еще около 1,3∙10 13 т – в виде пара в атмосфере. Обширны также запасы подземных вод.
Кроме того, водород самый распространенный элемент во Вселенной. Энергия, излучаемая Солнцем и другими звездами, выделяется в результате ядерных реакций с участием его ядер.
Элемент образует несколько изотопов: наряду с обычным водородом с относительной атомной массой 1 (его называют протием, 1 Н), на Земле встречаются два тяжелых изотопа – дейтерий( 2 Н или D) и тритий ( 3 Н или Т). Содержание дейтерия в природном водороде очень незначительно: лишь один из 100 тыс. атомов водорода является атом дейтерия. Этот изотоп был выделен в 1931 г. при испарении жидкого водорода. Радиоактивного трития еще меньше – примерно один атом на каждые 10 18 атомов 1 Н. Недавно зафиксировано образование сверхтяжелых изотопов водорода – 4 Н и 5 Н.
Водород – бесцветный газ без вкуса и запаха, слаборастворимый в воде. Он в 14,5 раз легче воздуха – самый легкий из газов. Поэтому водородом раньше наполняли аэростаты и дирижабли.
Молекулы Н2 настолько малы, что способны легко проходить не только через мелкие поры, но и сквозь металлы. Некоторые из них, например никель и палладий, могут поглощать большое количество водорода и удерживать его в атомарном виде в пустотах кристаллической решетки. Нагретая до 250 о С палладиевая фольга свободно пропускает водород: этим пользуются для тщательной очистки его от других газов.
Подобно Н2, дейтерий при нормальных условиях – газ, состоящий из молекул D2. Однако по сравнению с обычным водородом он имеет более высокую температуру кипения (-249 о С ).
Химические свойства водорода
В химических реакциях водород может быть как восстановителем (что для него более характерно), так и окислителем.
Водород взаимодействует как восстановитель:
Смесь 2 объемов Н2 и 1 объема О2 при поджигании взрывается (так называемый «гремучий газ»);
б) с серой при нагревании:
в) с хлором при поджигании и облучении смеси газов УФ-светом:
г) с фтором при обычных условиях:
д) с азотом при повышенном давлении и нагревании в присутствии катализаторов(реакция необратима):
Как окислитель водород взаимодействует только с активными (щелочными и щелочноземельными) металлами. В результате образуются гидриды металлов, представляющие собой солеобразные ионные соединения, которые содержат гидрид-ионы Н — :
Гидриды металлов – нестойкие кристаллические вещества белого цвета. Они являются сильными восстановителями, так как степень окисления – 1 малохарактерна для водорода. Так, при действии воды гидриды разлагаются, восстанавливая при этом воду до водорода:
а) При высокой температуре водород может восстанавливать большинство оксидов металлов; например:
в) Водород способен присоединяться ко многим органическим молекулам. Такие реакции называются гидрированием и будут подробно рассмотрены в разделе «Органическая химия».
Получение водорода
Существует достаточно много способов получения водорода. Рассмотрим наиболее широко используемые лабораторные (первые три) и промышленные способы.
Применение водорода
В химической промышленности водород служит сырьем для получения аммиака NH3, хлороводорода НСl, метанола СН3ОН и других органических веществ. В пищевой промышленности водород используют для выработки твердых жиров путем гидрогенизации растительных масел. В металлургии водород используется для восстановления некоторых цветных металлов из их оксидов. Как уже отмечалось выше, водород – очень легкий газ, поэтому им заполняют воздушные шары, зонды и другие летательные аппараты. Высокая экзотермичность реакции горения водорода в кислороде обусловливает использование «водородной» горелки для сварки и резки металлов (температура водородного пламени достигает 2600 о С ). Жидкий водород является одним из наиболее эффективных видов ракетного топлива.
В последние годы все больше внимание уделяется водородной энергетике, т.е. использованию водорода в качестве топлива, в частности для двигателей внутреннего сгорания. Это представляет особый интерес с экологической точки зрения, так как при горении водорода в выделяющихся газах не содержится вредных веществ (продукт горения – вода!).
Пероксид водорода (Н2О2)
Раствор пероксида водорода имеет кислую реакцию среды, что обусловлено диссоциацией его молекул по типу слабой кислоты:
Как кислота пероксид водорода взаимодействует с основаниями:
Некоторые пероксиды металлов, например Na2O2, BaO2, можно рассматривать как соли слабой кислоты пероксида водорода. Из них можно получать Н2О2 действием более сильных кислот:
Графическая формула пероксида водорода: Н – О – О – Н. «Пероксидный мостик» из двух атомов кислорода обусловливает неустойчивость молекулы. При хранении на свету, нагревании, в присутствии катализатора пероксид водорода разлагается на воду и кислород:
Данная реакция относится к типу реакций диспропорционирования. Способность пероксида водорода к самоокислению-самовосстановлению объясняется тем, что атомы кислорода в его молекуле находятся в промежуточной степени окисления – 1. Этим же обусловлено участие Н2О2 в различных реакциях в роли окислителя или в роли восстановителя. В реакциях с типичными восстановителями пероксид водорода проявляет свойства окислителя и восстанавливается до воды или гидроксид-ионов; например:
При взаимодействии с сильными окислителями Н2О2 проявляет восстановительные свойства и окисляется до свободного кислорода; например:
Пероксид водорода применяют как дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство в виде 3%-ного раствора.
Скачать:
Скачать бесплатно реферат на тему: «Водород» Водород.docx (236 Загрузок)
Скачать бесплатно реферат на тему: «Водород и Вселенная» Водород-и-Вселенная.docx (219 Загрузок)
Скачать бесплатно реферат на тему: «Вода» Вода.docx (227 Загрузок)
Скачать бесплатно реферат на тему: «Водородная связь» Водородная-связь.docx (250 Загрузок)
Скачать бесплатно реферат на тему: «Вода и ее свойства» Вода-и-её-свойства.docx (217 Загрузок)
Скачать бесплатно реферат на тему: «Водные ресурсы» ВОДНЫЕ-РЕСУРСЫ.docx (213 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Электролиз ( огонь из воды )
Расчет необходимых энергозатрат на электролиз воды можно вести многими способами. Ограничимся тремя принципиально различными. Во-первых, памятуя о существовании закона сохранения энергии, можно рассчитать энергозатраты на электролиз через данные о теплотворной способности водорода как топлива. Используются результаты, полученные методом калориметрии — сколько энергии выделяется при горении водорода, столько же ее должно быть поглощено при его получении путем электролиза. Во-вторых, расчет энергозатрат можно вести по данным резонансной спектроскопии, поскольку при электролизе разрываются одни связи (с разрушением молекул воды) и замыкаются другие (с образованием молекул газов), а в настоящее время энергии каждого вида связи известны. В-третьих, можно произвести расчет, используя законы электролиза Фарадея и некоторые физические константы. Каждый метод имеет свои плюсы и минусы, а также погрешности.
Первый способ (по теплотворной способности водорода)
Продуктами сгорания любого углеводородного топлива являются углекислый газ и вода. В термодинамике и теплотехнике различают низшую и высшую удельную (т.е. отнесенную к единице количества) теплотворную способность топлив. Низшая теплотворная способность включает в себя тепло, полученное при горения топлива и охлаждения продуктов реакции до температуры топлива без учета теплоты конденсации паров воды. Высшая теплотворная способность включает в себя помимо низшей еще и теплоту конденсации паров воды в жидкую фазу и охлаждения ее до температуры топлива. Температура топлива принимается равной 15°C. Критерий низшей теплотворной способности используется в теплотехнике, поскольку продукты горения топлив как правило удаляются из теплообменников с заведомо высокой температурой и теплота конденсации паров воды для потребителей недоступна. В нашем же случае необходимо воспользоваться критерием высшей теплотворной способности водорода. Логика очевидна – для электролиза мы берем в составе электролита жидкую воду, следовательно после всего круговорота поглощения и выделения энергии мы к ней же должны и вернуться.
Высшая теплотворная способность водорода составляет 33850 ккал/кг = 33850 ккал/кг * 4,2 Дж/кал = 142,2 Мдж/кг (источник). Один килограмм водорода при н.у. (нормальные условия — давление 101325 Па, температура 273,15К) при плотности 0,0899 г/л (источник) имеет объем 11124 литра. Гремучий газ по объему на 2/3 состоит из водорода и на 1/3 из кислорода. Поскольку горючим компонентом является только водород, то при сгорании гремучего газа выделяется энергия = 2/3 * 142,2 Мдж/кг : 11124 л/кг = 8522 Дж / л = 8522 Вт*сек / л = 8522 Вт * (час / 3600) / л = 2,37 Вт*час / л.
Второй способ (по энергиям связей в молекулах).
Энергия связи в молекуле водорода составляет 432 кДж/моль (источник), в молекуле кислорода — 493 кДж/моль (источник). В молекуле воды есть две равноценных связи O-H. При последовательном их разрыве энергия первой разрываемой из них составит 495 кДж/моль, второй – 435 кДж/моль. В расчетах берут среднее значение 465 кДж/моль (источник).
При электролизе 2 моль воды превращаются в 2 моль водорода и 1 моль кислорода — суммарное уравнение реакции:
В двух молекулах воды разрываются 4 связи О-Н, в образовавшихся продуктах замыкаются две связи Н-Н и одна О-О. Уравнение энергобаланса должно выглядеть следующим образом:
Энергия электролиза – Энергия разрыва связей + Энергия образования связей = 0
Энергия электролиза — 2*465 кДж/моль * 2 моль + (432 кДж/моль * 2 моль + 493 кДж/моль * 1 моль) = 0
Энергия электролиза = 503 кДж.
Эта энергия идет на образование гремучего газа (2 моль водорода и 1 моль кислорода). Один моль любого газа при нормальных условиях занимает обьем 22,4 л (источник). Таким образом, суммарный объем гремучего газа, полученного из двух молей воды, составит 2 моль * 22,4 л/моль + 1 моль * 22,4 л/моль = 67,2 л.
Энергия получения гремучего газа = 503 кДж/67,2 л = 7,485 кДж/л = 7,485 * 1000 * Вт * сек / л = 7485 * Вт * (час/3600) / л = 2,08 Вт*час/л.
Третий способ (из законов электролиза).
По закону электролиза Фарадея для получения одного грамм-эквивалента любого вещества в электрохимической ячейке необходимо перенести 96485 Кл заряда (источник).
Электрохимический процесс – это всегда совокупность двух (групп) реакций – окисления и восстановления. Заряд при этом переносится от одной химической сущности, находящейся на аноде, к другой, пребывающей на катоде. Таким образом, правильнее будет сказать, что при переносе 96485 Кл заряда получается один грамм-эквивалент вещества на аноде и один грамм-эквивалент вещества на катоде. В случае электролиза воды – это совокупность водорода и кислорода, т.е. гремучий газ.
Масса одного грамм-эквивалента водорода – 1 грамм (1/2 моль), что соответствует объему 11,2 литра (н.у.). Масса одного грамм-эквивалента кислорода – 8 граммов (1/4 моль), что соответствует объему 5,6 литра (н.у.). Следовательно, при прохождении 96485 Кл заряда выделяется 11,2 л + 5,6 л = 16,8 литров гремучего газа, а значит для его получения удельные затраты электричества (заряда) составят 96485 Кл : 16,8 л = 5743 Кл / л.
Теперь необходимо вспомнить, что заряд в электрохимической ячейке переносится сторонними силами (ЭДС источника для электролиза) против градиента электрохимического потенциала. Говоря проще, для переноса заряда в данном случае нужно приложить некоторое электрическое напряжение, минимально необходимая величина которого равна сумме равновесных потенциалов реакций на противоположных электродах. В случае воды минимальная ЭДС составляет 1,23 В (Якименко Л.М. Электролиз воды, стр.38) и не зависит от рН среды используемого электролита.
Энергозатраты на получение гремучего газа:
1,23 В * 5743 Кл / л = 7064 В*А*сек / л = 7064 Вт*(час / 3600) / л = 1,96 Вт*час/л.
Метод расчета Энергозатраты, Вт*час/л
1. По теплотворной способности водорода 2.37
2. По энергиям связей в молекулах 2.08
3. Из законов электролиза 1.96
В качестве эталона энергозатрат мы предпочитаем минимальную теоретически необходимую для электролиза энергию 1,96 Вт*час/л. Оценка КПД в данном случае – самая худшая из всех возможных, но в случае с проверкой КПД наших установок мы идем на это намеренно.
Попутно с освещением вопроса энергозатрат при электролизе воды необходимо вспомнить о таких понятиях как выход реакции по току и энергетическая эффективность процесса (КПД).
Выход реакции по току.
Выход электрохимической реакции по току представляет собой отношение количества электричества (в кулонах, ампер-часах или любых других внесистемных единицах), потраченного на получение некоторого количества вещества, к теоретически необходимому для этого получения количеству электричества.
Выход по току не может превышать 100%. Причиной снижения этого показателя (в отсутствие прямых утечек тока при коротком замыкании через электролит) может быть прохождение на электроде других электрохимических реакций, не дающих данного целевого продукта. При электролизе воды в электролите всегда есть некоторое количество растворенных кислорода и водорода в молекулярной форме, т.е. в форме незаряженных молекул, не образующих отдельной фазы. Отсутствие заряда и процессы диффузии приводят к тому, что часть выделившегося при электролизе кислорода может восстанавливаться на катоде, а часть полученного водорода – окисляться на аноде. При отсутствии в ячейке разделительной диафрагмы и сравнительно небольшой толщине слоя электролита затраты тока на эти конкурирующие реакции могут составлять от 3 до 5%. Таким образом, токовый выход бездиафрагменных электролизеров не может превышать 95-97%. Все конструкции электролизеров для получения гидроксигаза на борту авто именно бездиафрагменные и с тонким слоем электролита в ячейках. Кроме того подавляющее большинство из них — проточные, а значит имеющие утечки тока еще и по конструктивным причинам — вследствие шунтирования по электролиту. Вследствие этого токовые выходы должны быть еще ниже, особенно на малых токах (подробнее).
Миф I. Одноатомный водород.
Многие производители систем для получения гидроксигаза на борту авто уверяют потенциальных покупателей в том, что в их системах получается именно химически активный одноатомный газ (ННО), состоящий в основном из атомов водорода и кислорода, а не молекул. При этом приводятся такие данные о соответствии скорости выработке газа и потребляемого системой тока, которые соответствуют почти 200%- ному токовому выходу. Если поверить в одноатомность этого газа, которая неявно предполагает удваивание объема по сравнению с обычным двухатомным, то данные о производительности по току выглядят как будто бы убедительно. Попробуем разобраться.
При повышении температуры все большая доля молекул распадается на атомы. Порядок энергии связи в молекулах таков, что даже при температуре в 2000°C степень диссоциации (распада) молекул на атомы составляет для водорода и кислорода 0,081% и 0,03% соответственно, полная диссоциация наблюдается при температуре на короне Солнца – выше 6000°C (источник (водород), источник (кислород)). Таким образом говорить об одноатомном гидроксигазе при температуре заведомо более низкой невежественно до неприличия. Учитывая это, нужно с необходимостью признать, что если предлагаемые системы и тестировались производителями, то приведенные значения результатам этих тестов не соответствуют и явно завышены.
Миф II. Сверхэффективный электролиз.
Существуют прецеденты, когда производители публикуют данные о производительности своих систем, не ссылаясь на одноатомность получаемого газа, но анализ этих данных также приводит к выводу о токовой сверхэффективности. В качестве объяснения этого феномена, если об этом и возникает разговор, предлагается невыполнение законов электролиза Фарадея, в частности в системах, разработанных для так называемого резонансного электролиза в объеме электролита или даже просто чистой воды. Несмотря на обилие в Интернете материалов, посвященных данным технологиям, в том числе и патентов на изобретения, нигде не описана достаточно внятная и научно обоснованная теория вопроса и не проведено результатов сколько-нибудь серьезной экспериментальной экспертизы. Таким образом, приведенные данные о производительности систем также кажутся подозрительными.
Производительность системы по гидроксигазу.
Какова же должна быть зависимость между величиной тока, подаваемого в электролизер, и его производительностью по гремучему газу в идеале?
Вспомним из предыдущего изложения, что для получения при нормальных условиях одного литра газа в одной электрохимической ячейке через нее необходимо пропустить 5743 Кл электричества. Какая сила тока должна быть подана на ячейку, чтобы это количество заряда прошло через нее за одну минуту?
5743 Кл = 5743 А*сек = 5743 А*(мин/60) = 95,72 А*мин.
Т.е. для производительности одной ячейки по газу в один литр в минуту необходима сила тока 95,72 А. Это достаточно большая величина. Уменьшить ее можно, набирая ячейки в секцию с последовательным электрическим подключением. Тогда во сколько раз увеличено количество ячеек, во столько же раз можно уменьшить ток для получения того же объема газа в минуту.
При последовательном соединении проводников суммарное падение напряжения в цепи равно сумме падений на элементах. В реальных условиях падение напряжения на одной ячейке составляет нескольким более 2 вольт. Целесообразно собирать системы в среднем из 6 (коммерческие варианты от 5 до 7) или 12 (10-14) ячеек — при бортовом напряжении автомобилей 12(14) или 24(28) вольт.
Предположим, мы имеем идеальный по токовому выходу электролизер, имеющий 6 последовательно соединенных ячеек. Для получения производительности этого электролизера по газу в один литр в минуту он должен потреблять ток 95,72/6 = 15,95 ампер. Если учитывать, что при электролизе в предлагаемых системах получаемый газ имеет как минимум комнатную температуру, то получается очень просто запоминаемое соотношение:
6 ячеек — потребление тока 15 ампер — выход газа 1 литр в минуту.
Если используется идеальный по токовому выходу электролизер с 12 ячейками, то производительность по газу при том же токе удваивается:
12 ячеек — потребление тока 15 ампер — выход газа 2 литра в минуту.
Энергетическая эффективность процесса электролиза (КПД электролизера).
Как было отмечено выше, минимальное напряжение, при котором процесс электролиза воды может происходить в одной электролизной ячейке, составляет 1,23 вольта – это так называемый равновесный потенциал обратимой реакции. В реальных условиях для электрохимического получения достаточных количеств продуктов необходима существенно большая разность потенциалов, связанная с явлениями поляризации электродов (перенапряжение). Но мы не будем вникать в тонкости электрохимической кинетики.
КПД электролизера численно равен отношению минимально необходимой для получения единицы массы вещества электрической энергии к практически затрачиваемой, выраженному в процентах.
Приложение разности потенциалов (напряжения) к электродам позволяет перенести некоторый заряд, поддерживая некоторую силу тока через ячейку в течение некоторого промежутка времени. Очевидно, чем меньшее напряжение будет приложено и чем больший токовый выход будет иметь место при всех прочих равных условиях, тем больше будет и энергетическая эффективность процесса. Таким образом, максимальный КПД может быть получен при напряжении на ячейке, равном равновесному потенциалу (1,23В), при 100%- ном токовом выходе.
Основываясь на предыдущем изложении, получаем формулу:
U — среднее напряжение на электролизере [В], I — ток через электролизер [А], t — время [сек], в течение которого производится объем газа V[л], 7060 Дж/л — минимальная энергия для производства одного литра газа при нормальных условиях.
Поскольку в реальных условиях одна и та же масса газа будет иметь разный объем в зависимости от его температуры и атмосферного давления, необходимо делать соответствующую поправку (источник)
В следующем выражении учтены температура газа и атмосферное давление:
Когда нами проводились эксперименты с целью отработки конструкции электролизной системы, было сделано несколько опытов для проверки правильности расчетов ее КПД. Для этого в лабораторных условиях электролизер какой-либо очередной конструкции, соединенный с ним резервуар электролита (термостатирующий контур не подключен), а также газоотводящий шланг и барботер с водой для промывки газа термоизолировались пенопластом или вспененным полиэтиленом, после чего через электролизер подавали постоянный ток 25-35 ампер (стабилизация по току) в течение продолжительного времени – 30-50 минут. Поскольку КПД электролизера заведомо был ниже 100%, часть мощности тратилась на нагревание. Были известны –время эксперимента (электронный секундомер), исходная и конечная температура электролита и всех частей установки, включая технологические жидкости (прямое измерение), а также их масса (прямое измерение) и теплоемкости (справочные данные по использованным материалам), кроме того, в течение эксперимента через короткие интервалы времени регулярно измерялись рабочее напряжение (мультиметр) и стабилизированный ток (амперметр с шунтом 50А, 75 мВ). Производительность по газу определялась с помощью газовых часов. Атмосферное давление определялось бытовым барометром. После очередного эксперимента по данным о темпе газовыделения, токе и усредненном по времени напряжении делался расчет КПД (метод законов электролиза). Параллельно производился и расчет калориметрическим способом – по темпу тепловыделения. Последний метод всегда давал завышенное значение КПД системы по сравнению с первым, очевидно, вследствие неучтенных теплопотерь. Однако, расхождение результатов расчетов не превышало 10-12%.