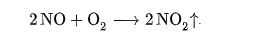Что выделяется при сгорании водорода с воздухом
Температура горения водорода: описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Что такое водород?
Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.

Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 oC) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).

Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Химическая реакция горения
Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).

С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
Процентное содержание газов в горючей смеси

Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 oC для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 oC (для других концентраций она может достигать 2500 oC), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 oC). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 oC).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м3 этого газа весит всего 90 грамм. Если сжечь этот 1 м3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.
Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Водород. Заблуждения
В завтрашний день могут смотреть не только лишь все. Мало кто может это делать!
Прочитанная недавно статья очередного эксперта по газу и водороду привела меня в неистовую печаль.
Настолько, что захотелось выматериться поделиться своими соображениями, о блуждающих в массах заблуждениях касательно водорода.
Очень часто при обсуждении вопроса производства, хранения и использования водорода, упираются в некие ограничения, которые в реальности таковыми не являются.
Например следующее утверждение:
Водород очень подвижный газ и потребует для развития водородной энергетики новых материалов уже прямо завтра. Отдельные комментаторы в интернетах указывают, что температура горения водорода очень высока и составляет 2500-2800 градусов и что не имеется в достаточном количестве необходимых материалов для широкого использования котлов на водороде и что эти материалы слишком дороги.
Во-вторых, давайте рассмотрим ближайшие перспективные планы «водородных активистов», на период до 2030-го года.
From 2025 to 2030, hydrogen needs to become an intrinsic part of our integrated energy system, with at least 40 gigawatts of renewable hydrogen electrolysers and the production of up to ten million tonnes of renewable hydrogen in the EU.
Что в переводе на русский означает производство 10 млн тонн электролизного водорода в год.
Измерение топливного газа в массовых величинах с химической точки зрения более правильно, чем в объёмных, т.к. количество извлекаемой энергии зависит напрямую от массы вещества вступающей в реакцию горения, но поскольку многим привычней объёмные «попугаи», то для упрощения понимания переведём в них.
Ранее в сериале, рассматривая вопросы стимулирования энергоперехода, было прикинуто, что 1 кг водорода потенциально содержит 120 МДж энергии, что приблизительно эквивалентно 4-4,5 куб.м. метана, или 1 тыс. куб.м. метана энергетически эквивалентна 220-250 кг водорода. Таким образом, можно приблизительно оценить что 10 млн. тонн водорода это энергетический эквивалент 42,5 млрд. куб.м. метана.
Потребление Европы по данным Газпрома, оценивается в 500-550 млрд куб.м. в год, т.е. объём предполагаемого производства водорода к 2030г. предполагается на уровне 7-8% от потребляемого газа.
Mitsubishi Hitachi Power Systems (MHPS) еще несколько лет назад успешно испытала газовую турбину большой мощности на одной из своих электростанций, подав в камеру сгорания природный газ с добавкой 30% водорода. Температура газов на выходе – 1600 градусов, оборудование такую нагрузку, хоть и не без сложностей, но выдержало. КПД незначительно, но увеличился, а вот количество образовавшегося углекислого газа оказалось ниже сразу на 10%, а по поводу оксидов азота японская компания информацию раскрыла не полностью, ограничившись фразой «остались на приемлемом уровне». Рекомендация MHPS – экономически оправдано и экологически полезно использовать топливную смесь из 80% природного газа и 20% водорода.
Как видим из текущих планов на ближайшее время проблем хранения, транспортировки и сжигания нет.
А что есть? Как ранее уже обсуждалось, в настоящее время в мире производится 75 млн тонн водорода. Более ¾ производят методом реформинга природного газа и лишь около 100 тысяч тонн производится электролизом. При реализации планов увеличить за 8-9 лет производство электролизного водорода только в ЕС (не считая австралийских и американских планов) до уровня в 10 миллионов тонн означает по существу создание новой индустрии с нуля.
Вот она индустрия и «есть» к 2030-му году. Она же и будет финансировать НИОКР на повышение собственной эффективности, разрешение вопросов хранения и транспортировки чистого водорода уже в дальнейшем. Расширение масштабов производства техники снизит её стоимость, точно так же как снизилась себестоимость энергии от солнечных панелей (в 4 раза за 10 лет) и ветрогенераторов (на 20% за 10 лет).
Оксид азота (NOx)
Отдельно хочется остановиться и рассмотреть это заблуждение интернет-экспертов.
Довольно часто от некоторых комментаторов приходится слышать про то, как в процессе горения водорода будет высокая температура и начнёт резко окисляться азот из воздуха, который используется в процессе горения. Чаще всего ссылаются на механизм Зельдовича и что вот именно водородное-то горение его и запускает.
Механизм Зельдовича, описанный в 1947 году, представляет собой реакцию окисления атмосферного азота в топке, при высокой температуре. Начинается сей процесс уже при 1800-1850К, или примерно при 1550 град. С. т.е. при достижении указанной температуры (без разницы от сжигания дров, угля, метана или кизяка) начинается процесс окисления азота.
Общая схема выглядит примерно так:
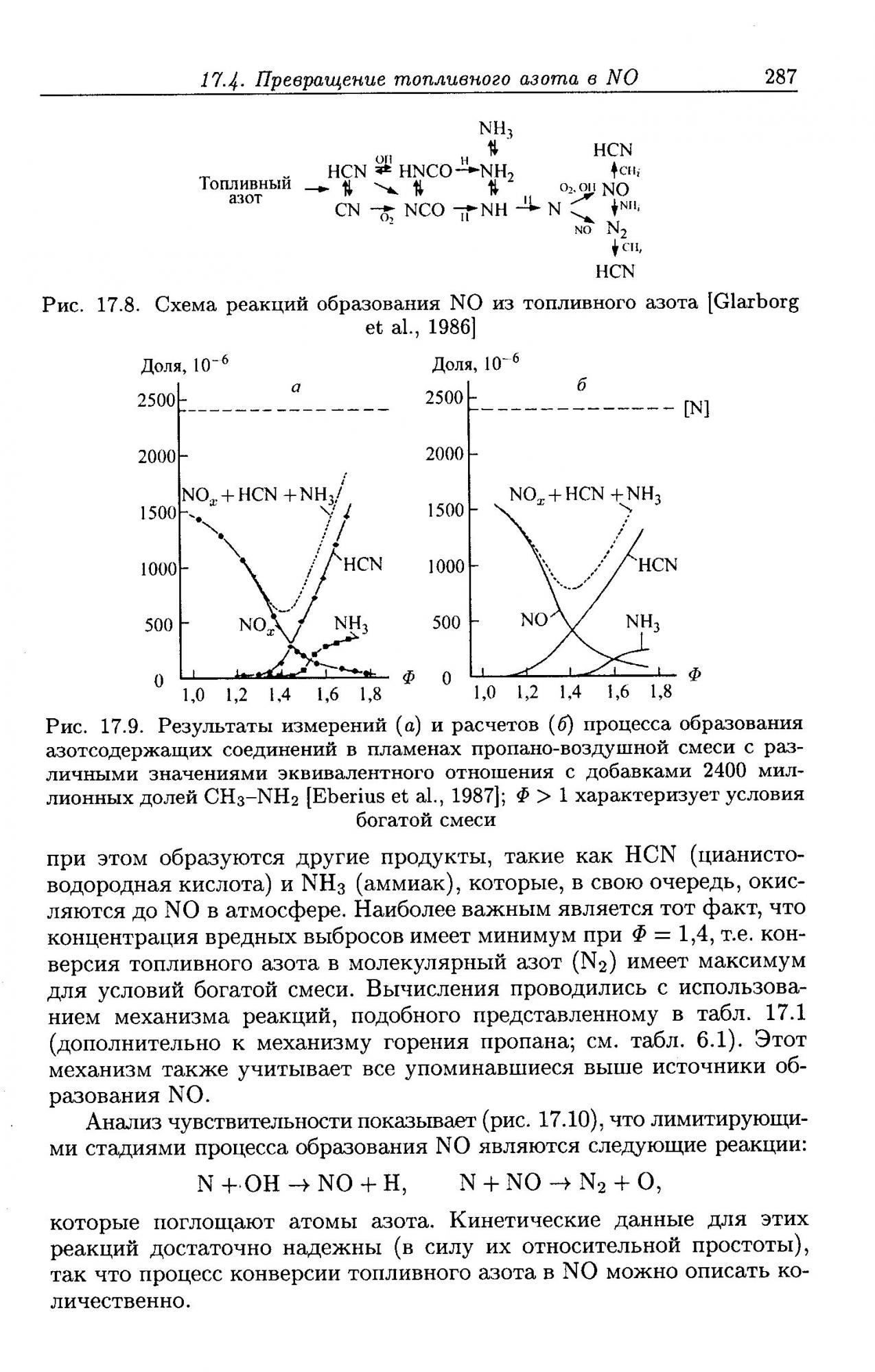
N + OH NO + H (3) (добавлена по расчётам Ч. Фенимора в 1957 г.)
Совокупность реакций (1-3) называется расширенным механизмом Зельдовича. В силу того что энергия тройной связи в молекуле N2 составляет около 950 кДж/моль, реакция (1) имеет большую энергию активации и может проходить с заметной скоростью только при высоких температурах.
Существует ещё и механизм образования оксидов азота им. т-ща Фенимора (Чарльза, а не Купера 
Считаю неправильным останавливаться на полумерах и предлагаю всем обоср…. т.е. испугаться по взрослому и с размахом. Взять и рассмотреть ещё и механизм Фенимора в том числе.
Для этого возьмём и откроем скушную книшку, написанную двумя профессорами Штутгартского университета и ещё одним из университета Беркли:
Крайне интересного текста там немного, но а тем же, кому лень читать источник фиги или кто в принципе не хочет вникать, поясню коротко, тезисно и на пальцах:
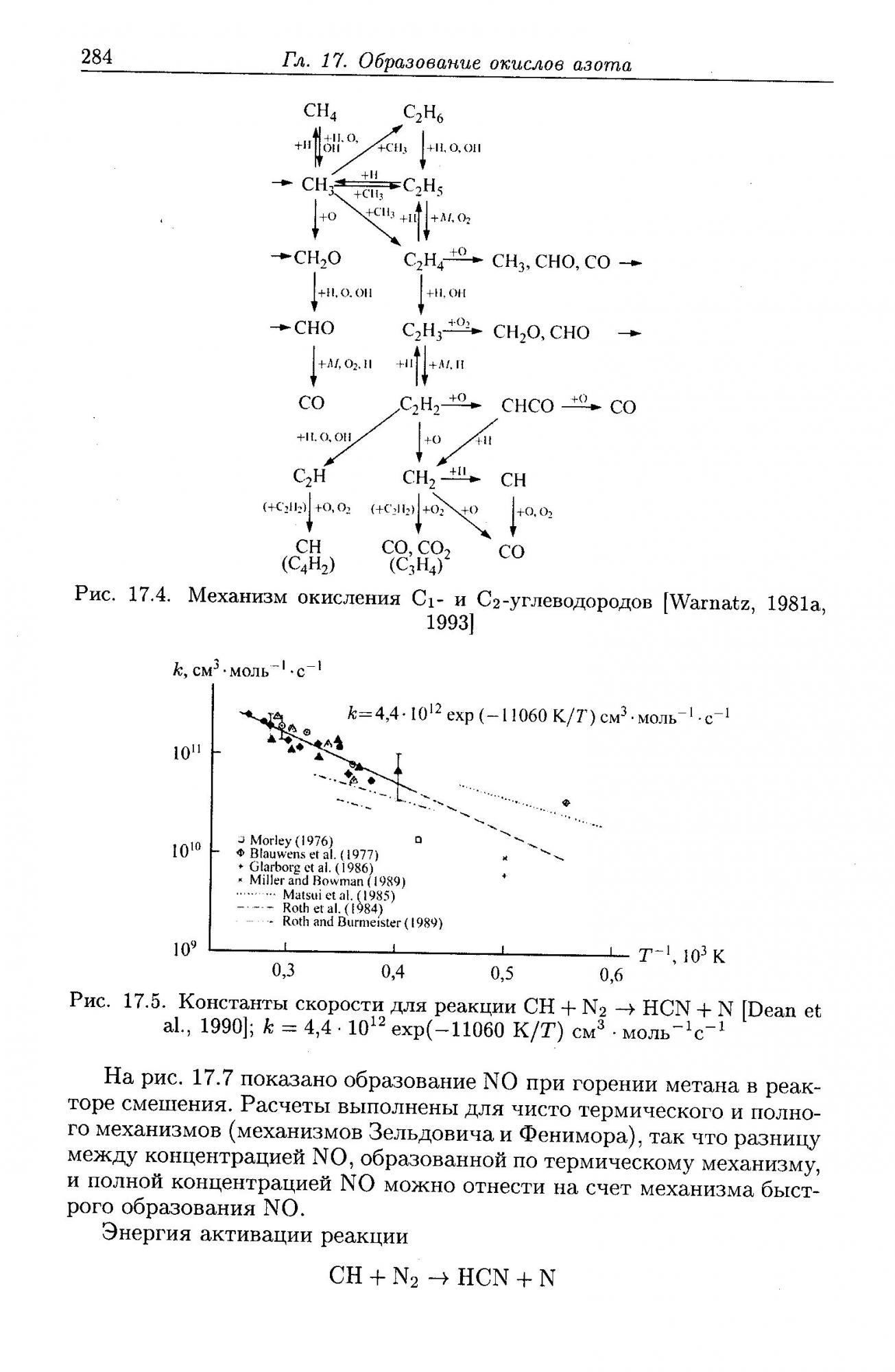
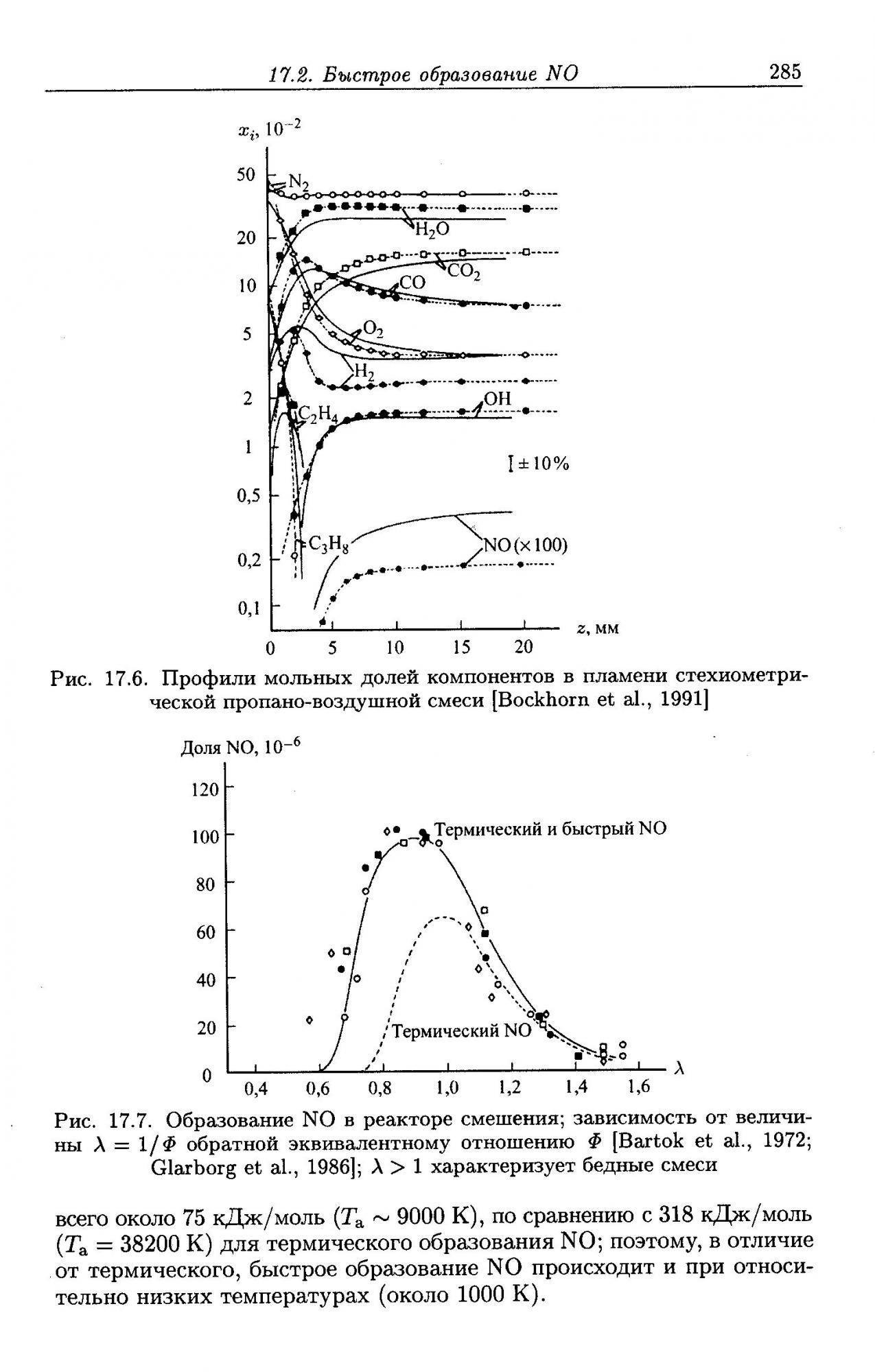
2. По причине 1 при сжигании углеводородного топлива (метан, этан, пропан, уголь, бензин, дрова и прочее без разницы) оксидов азота при горении выделяется больше, чем при горении водорода по механизму Зельдовича, причём больше существенно (см. рис. 17.7)
3. При горении углеводородных топлив, особенно угля, (где даже в особо чистых образцах имеется до 1% азота), содержащийся в топливе связанный азот окисляется вообще независимо от уровня температуры, тем самым увеличивая общий выхлоп оксидов азота.
4. При высокотемпературном сжигании природного газа, (что практикуется на мусоросжигательных заводах особенно, где разгоняют температуру до 2200-2300 град. С), промежуточно образуется HCN – синильная кислота. И хотя она лишь промежуточный продукт, но при высокой температуре может быть кинетически выброшена из зоны реакции и тем самым составит пусть и мизерную но часть выхлопа.
Не смотря на вышеуказанные проблемы образования оксида азота при сжигании природного газа и угля, не спешите хвататься за валидол.
Решение по уменьшению выхода оксидов азота имеются и применяются на существующих котельных и реакторных установках. Кроме указанных ранее способов регулировки температуры горения в топке, довольно широко применяется запатентованный в 1975 году компанией Exxon Research Engineering, метод селективного некаталитического восстановления водородом из аммиака, когда в выхлопную трубу в отводящие газы подаётся аммиак и в диапазоне температур от 800 до 1100 град. С и происходит восстановление азота по схеме:
4NO + 4NH3 + O2 => 4N2 + 6H2O
Поскольку водород очень хороший восстановитель, то при использовании чистого водорода, достаточно обеспечить камеру вторичного дожига, где отходящие выхлопные газы, содержащие CO и NOx будут восстанавливаться чистым водородом, без лишних танцев с бубном.
Экологические проблемы сжигания водорода
Все мы знаем формулу Н2О. Некоторые еще знают, что при сжигании водорода выделяется энергия (около 140 МДж/кг). Особо упоротые еще знают, что водород производят на водородных станциях, а кислород на кислородных станциях.
Еще кто-то слышал, что это самое экологичное топливо, так как выхлоп целиком состоит из водяного пара Н2О.
На этом «знания» заканчиваются.
Про то, что водяной пар — это главный парниковый газ я писал тут:
https://smart-lab.ru/blog/659641.php
Теперь перейдем непосредственно к самому процессу сжигания.
Приблизительно процесс описывается формулой 2H2 + O2 = 2H2O + E
Проблема в том, что при сжигании водорода используют не чистый водород, а атмосферный воздух.
атмосферный воздух состоит из азота на 78%, кислорода на 21 % — кислород. 1% приходится на другие газы, включая ныне нелюбимый всеми СО2.
Так что же происходит?
Всё дело в том, что при температуре горения более 600 оС, а особенно после 1500оС начинается реакция азота и кислорода: 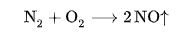
тепловой эффект реакции −180,9 кДж
NO не имеет запаха, но при вдыхании может связываться с гемоглобином, подобно угарному газу переводя его в форму, не способную переносить кислород.
При комнатной температуре и атмосферном давлении происходит окисление NO кислородом воздуха:
Оксид азота (IV) NO2 (диоксид азота; двуокись азота) в высоких концентрациях раздражает лёгкие и может привести к серьёзным последствиям для здоровья. NO2 соединяется с водой, хорошо растворяется в жире и может проникать в капилляры лёгких, где он вызывает воспаление и астматические процессы. Концентрация NO2 свыше 200 ppm считается летальной, но уже при концентрации свыше 60 ppm могут возникать неприятные ощущения и жжение в лёгких. Долговременное воздействие более низких концентраций может вызывать головную боль, проблемы с пищеварением, кашель и лёгочные заболевания.
В клинике острого отравления оксидами азота различают четыре периода: латентный, нарастания отёка лёгких, стабилизации и обратного развития[3]. В скрытом периоде мнимого благополучия, который может продолжаться 4—12 часов, больного может беспокоить конъюнктивит, ринит и фарингит за счёт раздражения слизистых оболочек, проявляющиеся кашлем, слезотечением, общим недомоганием, однако его общее состояние в целом удовлетворительное. Затем состояние больного ухудшается: по мере развития отёка лёгких появляется влажный кашель со слизистой или кровянистой мокрота, одышка, цианоз, тахикардия, субфебрильное или фебрильное повышение температуры. Возникает чувство страха, психомоторное возбуждение и судороги. В отсутствие квалифицированной медицинской помощи это может привести к летальному исходу.
Токсичность! Оксид азота (II) — ядовитый газ с удушающим действием.
Ответствен за смог!
Смог — это чрезмерное загрязнение воздуха вредными веществами, выделенными в результате работы промышленных производств, транспортом и теплопроизводящими установками при определённых погодных условиях. Выбросы NOx считаются одной из основных причин образования фотохимического смога:
ru.wikipedia.org/wiki/%D0%A1%D0%BC%D0%BE%D0%B3
Но это мелочи!
Соединяясь с парами воды в атмосфере, NOx образуют азотную кислоту, и, вместе с оксидами серы, являются причиной образования кислотных дождей.
Лес после кислотного дождя:
Именно по оксидам азота сильно ударили экологические нормы ЕВРО, начиная с ЕВРО-3: 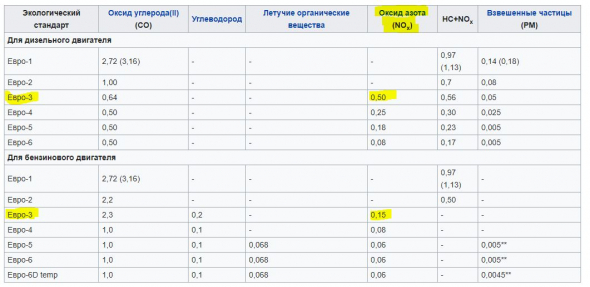
ru.wikipedia.org/wiki/%D0%95%D0%B2%D1%80%D0%BE-6
И так, а что же при сжигании водорода?
Температура более 1500 градусов, что приводит к недопустимо высоким выбросам NOx.
при горении водорода в воздухе достигается температура около 2000°С.
(Кстати, эти любимые всеми клапана EGR в автомобилях как раз и призваны снижать образование оксидов азота)
Особо забавно читать выводы по эксплуатации экспериментальных энергических установок на водороде:
Газовая турбина на водороде
Ключевая технология, необходимая для масштабного использования водорода в газовой электроэнергетике, – водородная турбина. По оценке компании Mitsubishi Hitachi Power Systems (MHPS), на существующих газотурбинных установках можно увеличить долю водорода до 20% в смеси его с природным газом без существенных изменений в конструкции. MHPS успешно испытала в Японии сверхмощную газовую турбину серии J в работе на топливной смеси из природного газа (70%) и водорода (30%). Испытания были проведены на заводе в Такасаго на парогазовой установке мощностью 700 МВт (КПД – 63% с температурой газов после камеры сгорания ГТУ – 1600°C). Для сжигания топлива использовались горелки с вихревым перемешиванием. Благодаря водороду выбросы CO2 сократились на 10%, а выбросы оксидов азота, по мнению компании, «остались на удовлетворительном уровне».
Т.е. если мы меняем смесь природного газа и водорода на (60%) и (40%), то очевидно что выбросы оксидов азота, даже по мнению компании оказываются уже на каком-то совершенно неприличном уровне!
Кстати, ранее именно из-за оксидов азота был похоронен проект автомобиля на газотурбинном двигателе: