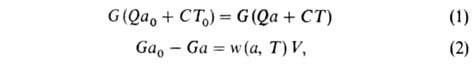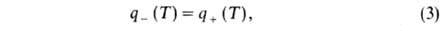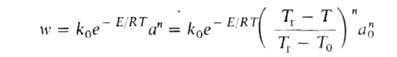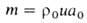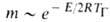Что выделяется при реакции горения
Горение
Что такое горение
Горение – это совокупность одновременно протекающих физических процессов (плавление, испарение, ионизация) и химических реакций окисления горючего вещества и материала, сопровождающееся, как правило, световым и тепловым излучением и выделением дыма. В основе горения лежит взаимодействие горючего вещества с окислителем, преимущественно с кислородом воздуха.
Однако горения может осуществляться без доступа воздуха (кислорода), если в состав горючей массы (среды) входит окислитель в виде примеси или составной части молекулы. В производственных условиях или ракетной технике горения может осуществляться в атмосфере таких окисляющих газов, как фтор, хлор, окислы азота и другие.
Некоторые вещества (порошкообразные титан и цирконий) способны гореть в атмосфере азота, двуокиси углерода, не относящимся к традиционным окислителям.
Виды горения
В зависимости от способа подвода окислителя различают:
При пожаре отмечается смешанный тип горения. В зависимости от скорости горение может быть медленным (тление), нормальным (дефлаграция) и взрывообразным (взрыв), переходящим в детонационное (детонация).
По внешнему проявлению горение может быть пламенным или беспламенным.
Беспламенное горение может возникнуть в результате дефицита окислителя (тление) или при низком давлении насыщенных паров горючего вещества (горение тугоплавких металлов и кокса).
По механизму развития горение может быть тепловым, при котором причиной самоускорения реакций окисления является повышение температуры, и автокаталитическим (цепным), когда ускорение процесса достигается накоплением промежуточных катализирующих продуктов (активных центров). Автокаталитическое горение осуществляется при сравнительно низких температурах. При достижении определенных концентраций промежуточных каталитических продуктов автокаталитическое горение может переходить в тепловое. При этом температура горения резко возрастает.
Горение может возникать и развиваться спонтанно, стихийно (пожар), но может быть специально организованным, целесообразным: энергетическое горение (в целях получения тепловой или электрической энергии) и технологическое горение (доменный процесс, металлотермия, синтез тугоплавких неорганических соединений и т.д.).
Характеристики горения
Горение характеризуется такими величинами, как: температура, скорость, полнота, состав продуктов. Располагая данными о механизме горения и его характерных особенностях, можно увеличивать скорость и температуру горения (промотирование горения) или снижать их вплоть до прекращения горения (ингибирование горения).
Источники: Основные характеристики горения. Мальцев В.М., Мальцев М.И., Кашпоров Л.Я. —М., 1977; Процессы горения в химической технологии и металлургии. Мержанов А.Г. —Черноголовка, 1975; Физика горения и взрыва. Хитрин Л.Н. —М., 1957.
Горение и медленное окисление
I. Горение и медленное окисление
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.
Мемориал славы в г. Сыктывкаре
Пламя, огонь, как одно из проявлений реакции горения, имеет и свое монументальное отражение. Яркий пример – мемориал славы в г. Сыктывкаре.
Раз в четыре года в мире происходит событие, сопровождающееся переносом «живого» огня. В знак уважения к основателям олимпиад огонь доставляют из Греции. По традиции один из выдающихся спортсменов доставляет этот факел на главную арену олимпиады.
Об огне сложены сказки, легенды. В старину люди думали, что в огне живут маленькие ящерицы – духи огня. А были и такие, которые считали огонь божеством и строили в его честь храмы. Сотни лет горели в этих храмах, не угасая, светильники, посвященные богу огня. Поклонение огню было следствием незнания людьми процесса горения.
М.В.Ломоносов говорил: «Изучение природы огня и без химии предпринимать отнюдь невозможно».
Схематически этот процесс окисления можно выразить следующим образом:
Для возникновения горения необходимы:
нагревание горючего вещества до температуры воспламенения
Температура воспламенения у каждого вещества различна.
В то время как эфир может воспламениться от горячей проволоки, для того чтобы поджечь дрова, нужно нагреть их до нескольких сот градусов. Температура воспламенения веществ различна. Сера и дерево воспламеняются при температуре около 270 °С, уголь – около 350 °С, а белый фосфор – около 40 °С.
Однако не всякое окисление непременно должно сопровождаться появлением света.
Существует значительное число случаев окисления, которые мы не можем назвать процессами горения, ибо они протекают столь медленно, что остаются незаметными для наших органов чувств. Лишь по прошествии определенного, часто весьма продолжительного времени мы можем уловить продукты окисления. Так, например, обстоит дело при весьма медленном окислении ( ржавлении ) металлов
или при процессах гниения.
Разумеется, при медленном окислении выделяется теплота, но это выделение вследствие продолжительности процесса протекает медленно. Однако сгорит ли кусок дерева быстро или подвергнется медленному окислению на воздухе в течение многих лет, все равно – в обоих случаях при этом выделится одинаковое количество теплоты.
Медленное окисление – это процесс медленного взаимодействия веществ с кислородом с медленным выделением теплоты (энергии).
Примеры взаимодействия веществ с кислородом без выделения света : гниение навоза, листьев, прогоркание масла, окисление металлов (железные форсунки при длительном употреблении становятся тоньше и меньше), дыхание аэробных существ, т. е. дышащих кислородом, сопровождается выделением теплоты, образованием углекислого газа и воды.
Познакомимся с характеристикой процессов горения и медленного окисления приведённой в таблице.
Характеристика процессов горения и медленного окисления
Химия пламени
Чем проклинать тьму,
лучше зажечь хотя бы
одну маленькую свечу.
Конфуций
В начале
Первые попытки понять механизм горения связаны с именами англичанина Роберта Бойля, француза Антуана Лорана Лавуазье и русского Михаила Васильевича Ломоносова. Оказалось, что при горении вещество никуда не «исчезает», как наивно полагали когда-то, а превращается в другие вещества, в основном газообразные и потому невидимые. Лавуазье в 1774 году впервые показал, что при горении из воздуха уходит примерно пятая его часть. В течение XIX века ученые подробно исследовали физические и химические процессы, сопровождающие горение. Необходимость таких работ была вызвана прежде всего пожарами и взрывами в шахтах.
Существуют два вида пламени. Топливо и окислитель (чаще всего кислород) могут принудительно или самопроизвольно подводиться к зоне горения порознь и смешиваться уже в пламени. А могут смешиваться заранее — такие смеси способны гореть или даже взрываться в отсутствие воздуха, как, например, пороха, пиротехнические смеси для фейерверков, ракетные топлива. Горение может происходить как с участием кислорода, поступающего в зону горения с воздухом, так и при помощи кислорода, заключенного в веществе-окислителе. Одно из таких веществ — бертолетова соль (хлорат калия KClO3); это вещество легко отдает кислород. Сильный окислитель — азотная кислота HNO3: в чистом виде она воспламеняет многие органические вещества. Нитраты, соли азотной кислоты (например, в виде удобрения — калийной или аммиачной селитры), легко воспламеняются, если смешаны с горючими веществами. Еще один мощный окислитель, тетраоксид азота N2O4 — компонент ракетных топлив. Кислород могут заменить и такие сильные окислители, как, например, хлор, в котором горят многие вещества, или фтор. Чистый фтор — один из самых сильных окислителей, в его струе горит вода.
Цепные реакции
Основы теории горения и распространения пламени были заложены в конце 20-х годов прошлого столетия. В результате этих исследований были открыты разветвленные цепные реакции. За это открытие отечественный физикохимик Николай Николаевич Семенов и английский исследователь Сирил Хиншельвуд были в 1956 году удостоены Нобелевской премии по химии. Более простые неразветвленные цепные реакции открыл еще в 1913 году немецкий химик Макс Боденштейн на примере реакции водорода с хлором. Суммарно реакция выражается простым уравнением H2 + Cl2 = 2HCl. На самом деле она идет с участием очень активных осколков молекул — так называемых свободных радикалов. Под действием света в ультрафиолетовой и синей областях спектра или при высокой температуре молекулы хлора распадаются на атомы, которые и начинают длинную (иногда до миллиона звеньев) цепочку превращений; каждое из этих превращений называется элементарной реакцией:
Cl + H2 → HCl + H,
H + Cl2 → HCl + Cl и т. д.
На каждой стадии (звене реакции) происходит исчезновение одного активного центра (атома водорода или хлора) и одновременно появляется новый активный центр, продолжающий цепь. Цепи обрываются, когда встречаются две активные частицы, например Cl + Cl → Cl2. Каждая цепь распространяется очень быстро, поэтому, если генерировать «первоначальные» активные частицы с высокой скоростью, реакция пойдет так быстро, что может привести к взрыву.
Таким образом, за ничтожный промежуток времени одна активная частица (атом H) превращается в три (атом водорода и два гидроксильных радикала OH), которые запускают уже три цепи вместо одной. В результате число цепей лавинообразно растет, что моментально приводит к взрыву смеси водорода и кислорода, поскольку в этой реакции выделяется много тепловой энергии. Атомы кислорода присутствуют в пламени и при горении других веществ. Их можно обнаружить, если направить струю сжатого воздуха поперек верхней части пламени горелки. При этом в воздухе обнаружится характерный запах озона — это атомы кислорода «прилипли» к молекулам кислорода с образованием молекул озона: О + О2 = О3, которые и были вынесены из пламени холодным воздухом.
Возможность взрыва смеси кислорода (или воздуха) со многими горючими газами — водородом, угарным газом, метаном, ацетиленом — зависит от условий, в основном от температуры, состава и давления смеси. Так, если в результате утечки бытового газа на кухне (он состоит в основном из метана) его содержание в воздухе превысит 5%, то смесь взорвется от пламени спички или зажигалки и даже от маленькой искры, проскочившей в выключателе при зажигании света. Взрыва не будет, если цепи обрываются быстрее, чем успевают разветвляться. Именно поэтому была безопасной лампа для шахтеров, которую английский химик Хэмфри Дэви разработал в 1816 году, ничего не зная о химии пламени. В этой лампе открытый огонь был отгорожен от внешней атмосферы (которая могла оказаться взрывоопасной) частой металлической сеткой. На поверхности металла активные частицы эффективно исчезают, превращаясь в стабильные молекулы, и потому не могут проникнуть во внешнюю среду.
Полный механизм разветвленно-цепных реакций очень сложен и может включать более сотни элементарных реакций. К разветвленно-цепным относятся многие реакции окисления и горения неорганических и органических соединений. Таковой же будет и реакция деления ядер тяжелых элементов, например плутония или урана, под воздействием нейтронов, которые выступают аналогами активных частиц в химических реакциях. Проникая в ядро тяжелого элемента, нейтроны вызывают его деление, что сопровождается выделением очень большой энергии; одновременно из ядра вылетают новые нейтроны, которые вызывают деление соседних ядер. Химические и ядерные разветвленно-цепные процессы описываются сходными математическими моделями.
Что надо для начала
Чтобы началось горение, нужно выполнить ряд условий. Прежде всего, температура горючего вещества должна превышать некое предельное значение, которое называется температурой воспламенения. Знаменитый роман Рэя Брэдбери «451 градус по Фаренгейту» назван так потому, что примерно при этой температуре (233°C) загорается бумага. Это «температура воспламенения», выше которой твердое топливо выделяет горючие пары или газообразные продукты разложения в количестве, достаточном для их устойчивого горения. Примерно такая же температура воспламенения и у сухой сосновой древесины.
Температура пламени зависит от природы горючего вещества и от условий горения. Так, температура в пламени метана на воздухе достигает 1900°C, а при горении в кислороде — 2700°C. Еще более горячее пламя дают при сгорании в чистом кислороде водород (2800°C) и ацетилен (3000°C). Недаром пламя ацетиленовой горелки легко режет почти любой металл. Самую же высокую температуру, около 5000°C (она зафиксирована в Книге рекордов Гиннесса), дает при сгорании в кислороде легкокипящая жидкость — субнитрид углерода С4N2 (это вещество имеет строение дицианоацетилена NC–C=C–CN). А по некоторым сведениям, при горении его в атмосфере озона температура может доходить до 5700°C. Если же эту жидкость поджечь на воздухе, она сгорит красным коптящим пламенем с зелено-фиолетовой каймой. С другой стороны, известны и холодные пламена. Так, например, горят при низких давлениях пары фосфора. Сравнительно холодное пламя получается и при окислении в определенных условиях сероуглерода и легких углеводородов; например, пропан дает холодное пламя при пониженном давлении и температуре от 260–320°C.
Только в последней четверти ХХ века стал проясняться механизм процессов, происходящих в пламени многих горючих веществ. Механизм этот очень сложен. Исходные молекулы обычно слишком велики, чтобы, реагируя с кислородом, непосредственно превратиться в продукты реакции. Так, например, горение октана, одного из компонентов бензина, выражается уравнением 2С8Н18 + 25О2 = 16СО2 + 18Н2О. Однако все 8 атомов углерода и 18 атомов водорода в молекуле октана никак не могут одновременно соединиться с 50 атомами кислорода: для этого должно разорваться множество химических связей и образоваться множество новых. Реакция горения происходит многостадийно — так, чтобы на каждой стадии разрывалось и образовывалось лишь небольшое число химических связей, и процесс состоит из множества последовательно протекающих элементарных реакций, совокупность которых и представляется наблюдателю как пламя. Изучать элементарные реакции сложно прежде всего потому, что концентрации реакционно-способных промежуточных частиц в пламени крайне малы.
Внутри пламени
Оптическое зондирование разных участков пламени с помощью лазеров позволило установить качественный и количественный состав присутствующих там активных частиц — осколков молекул горючего вещества. Оказалось, что даже в простой с виду реакции горения водорода в кислороде 2Н2 + О2 = 2Н2О происходит более 20 элементарных реакций с участием молекул О2, Н2, О3, Н2О2, Н2О, активных частиц Н, О, ОН, НО2. Вот, например, что написал об этой реакции английский химик Кеннет Бэйли в 1937 году: «Уравнение реакции соединения водорода с кислородом — первое уравнение, с которым знакомится большинство начинающих изучать химию. Реакция эта кажется им очень простой. Но даже профессиональные химики бывают несколько поражены, увидев книгу в сотню страниц под названием «Реакция кислорода с водородом», опубликованную Хиншельвудом и Уильямсоном в 1934 году». К этому можно добавить, что в 1948 году была опубликована значительно большая по объему монография А. Б. Налбандяна и В. В. Воеводского под названием «Механизм окисления и горения водорода».
Современные методы исследования позволили изучить отдельные стадии подобных процессов, измерить скорость, с которой различные активные частицы реагируют друг с другом и со стабильными молекулами при разных температурах. Зная механизм отдельных стадий процесса, можно «собрать» и весь процесс, то есть смоделировать пламя. Сложность такого моделирования заключается не только в изучении всего комплекса элементарных химических реакций, но и в необходимости учитывать процессы диффузии частиц, теплопереноса и конвекционных потоков в пламени (именно последние устраивают завораживающую игру языков горящего костра).
Откуда все берется
Основное топливо современной промышленности — углеводороды, начиная от простейшего, метана, и кончая тяжелыми углеводородами, которые содержатся в мазуте. Пламя даже простейшего углеводорода — метана может включать до ста элементарных реакций. При этом далеко не все из них изучены достаточно подробно. Когда горят тяжелые углеводороды, например те, что содержатся в парафине, их молекулы не могут достичь зоны горения, оставаясь целыми. Еще на подходе к пламени они из-за высокой температуры расщепляются на осколки. При этом от молекул обычно отщепляются группы, содержащие два атома углерода, например С8Н18 → С2Н5 + С6Н13. Активные частицы с нечетным числом атомов углерода могут отщеплять атомы водорода, образуя соединения с двойными С=С и тройными С≡С связями. Было обнаружено, что в пламени такие соединения могут вступать в реакции, которые не были ранее известны химикам, поскольку вне пламени они не идут, например С2Н2 + О → СН2 + СО, СН2 + О2 → СО2 + Н + Н.
Постепенная потеря водорода исходными молекулами приводит к увеличению в них доли углерода, пока не образуются частицы С2Н2, С2Н, С2. Зона сине-голубого пламени обусловлена свечением в этой зоне возбужденных частиц С2 и СН. Если доступ кислорода в зону горения ограничен, то эти частицы не окисляются, а собираются в агрегаты — полимеризуются по схеме С2Н + С2Н2 → С4Н2 + Н, С2Н + С4Н2 → С6Н2 + Н и т. д.
горение
ГОРЕНИЕ
физ.-хим. процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло- и массообменом с окружающей средой. В отличие от взрыва и детонации протекает с более низкими скоростями и не связано с образованием ударной волны. В основе Г. лежит химическая реакция, способная протекать с прогрессирующим самоускорением вследствие накопления выделяющегося тепла (тепловое Г.) или активных промежут. продуктов (цепное Г.). наиб. распространено тепловое Г.; цепное Г. в чистом виде встречается сравнительно редко, гл. обр. в случае некоторых газофазных реакций при низких давлениях.
Условия термич. самоускорения м. б. обеспечены для всех реакций с достаточно большими тепловыми эффектами и энергиями активации. Наиб. обширный класс реакций Г. — окисление углеводородов, напр. при Г. прир. топлив, водорода, металлов и т. п.; окислители-кислород, галогены, нитросоединения, перхлораты. В режиме Г. могут происходить: разложение озона, ацетилена, гидразина, динитрогликоля, метилнитрата и др.; окислительно-восстановит. реакции, в которых восстановители-элементы с высоким сродством к кислороду (Са, Al, Si, Mg и др.); синтез из элементов оксидов, галогенидов, халькогенидов, гидридов, интерметаллидов, тугоплавких нитридов и карбидов.
Г. может начаться самопроизвольно в результате самовоспламенения либо быть инициированным зажиганием ( см. воспламенение). При фиксиров. внеш. условиях (давление, температура, размеры реактора, параметры тепло- и массопереноса и др.) непрерывное Г. может протекать в стационарном режиме, когда осн. характеристики процесса — скорость реакции, количество тепла, выделяющегося в единицу времени (мощность тепловыделения), температура и состав продуктов — не изменяются во времени, либо в периодич. режиме, когда эти характеристики колеблются около своих средних значений. Вследствие сильной нелинейной зависимости скорости реакции от температуры Г. отличается высокой чувствительностью к внеш. условиям: при их незначит. изменении медленная реакция может перейти в режим Г. или, наоборот, развитое Г. может прекратиться. Это же свойство Г. обусловливает существование неск. стационарных режимов при одних и тех же условиях (гистерезисный эффект).
Теория горения.
При адиабатич. сжигании горючей смеси, т. е. в отсутствие теплообмена между реагирующей системой и окружающей средой, м. б. рассчитаны количество выделившегося при Г. тепла, температура ТГ, которая была бы достигнута при полном сгорании ( т. наз. адиабатич. температура Г.), и состав продуктов, если известны состав исходной смеси и термодинамич. функции исходной смеси и продуктов. Если состав продуктов заранее известен, ТГ м. б. рассчитана из условия равенства внутр. энергии системы (при пост. объеме) или ее энтальпии (при пост. давлении) в исходном и конечном состояниях с помощью соотношения: ТГ = Т0 + Qr/C, где Т0-начальная температура смеси, С-средняя в интервале температур от Т0 до ТГ уд. теплоемкость исходной смеси (с учетом ее изменения при возможных фазовых переходах), (QГ-УД- теплота сгорания смеси при температуре ТГ. При относительном содержании а0 в смеси компоненты, полностью расходуемой в реакции ( напр., горючего), QГ = Q*а0 где Q-тепловой эффект реакции Г. Значение Тр при пост, объеме больше, чем при пост. давлении, поскольку в последнем случае часть внутр. энергии системы расходуется на работу расширения. На практике условия адиабатич. Г. обеспечиваются в тех случаях, когда реакция успевает завершиться прежде, чем станет существенным теплообмен между реакц. объемом и окружающей средой, напр. в камерах сгорания крупных реактивных двигателей, в больших реакторах, при быстро распространяющихся волнах горения.
Термодинамич. расчет дает лишь частичную информацию о процессе — равновесный состав и температуру продуктов. Полное описание Г., включающее также определение скорости процесса и критич. условий при наличии тепло- и массообмена с окружающей средой, можно провести только в рамках макрокинетич. подхода, рассматривающего химическую реакцию во взаимосвязи с процессами переноса энергии и вещества ( см. макрокинетика). В случае заранее перемешанной смеси горючего и окислителя реакция Г. может происходить во всем пространстве, занятом горючей смесью (объемное Г.), или в сравнительно узком слое, разделяющем исходную смесь и продукты и распространяющемся по горючей смеси в виде т. наз. волны Г. В неперемешанных системах возможно диффузионное Г., при котором реакция локализуется в относительно тонкой зоне, отделяющей горючее от окислителя, и определяется скоростью диффузии реагентов в эту зону.
Объемное горение происходит, напр., в теплоизолиров. реакторе идеального перемешивания ( см. безградиентный реактор), в который поступает при температуре Т0 исходная смесь с относит. содержанием горючего а0; при другой температуре Г реактор покидает смесь с иным относит. содержанием горючего а. При полном расходе G через реактор условия баланса энтальпии смеси и содержания горючего при стационарном режиме Г. могут быть записаны уравнениями:
где w(а, Т)-скорость реакции Г., К-объем реактора. Используя выражение для термодинамич. температуры ТГ, можно из (1) получить: а = а0(ТГ — Т)/(ТГ — Т0) и записать (2) в виде:
где q—(T) = GC(T- Т0)-скорость отвода тепла из реактора с продуктами сгорания, q+(T) = Qw(a, Т) V-скорость выделения тепла при реакции. Для реакции и-го порядка с энергией активации:
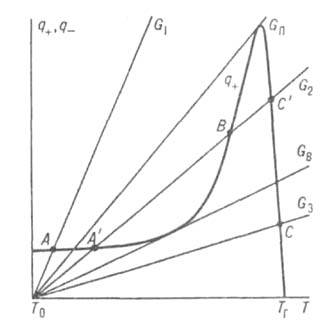
(k0-предэкспоненц. множитель в уравнении Аррениуса). На диаграмме q — Т (рис. 1) зависимость q—(T)выражается прямой линией, угол наклона которой тем больше, чем больше расход через реактор; q + (T)выражается кривой с резким максимумом вблизи ТГ. Восходящая ветвь этой кривой обусловлена быстрым ростом скорости реакции с температурой (в выражении для w осн. вклад дает экспоненц. множитель); при значит. выгорании горючего смесь сильно разбавляется продуктами, преобладающее влияние на скорость реакции начинает давать множитель а n и реакция резко замедляется. Поскольку для реакций Г. характерны большие значения Е, максимум на кривой q+(T)выражен очень резко и сильно смещен к ТГ, т. е. Наиб. быстро реагирует смесь, сильно нагретая выделяющимся теплом, хотя и значительно разбавленная продуктами. При разл. расходах G условия баланса (1) и (2), которым отвечают точки пересечения q+ (T)и q—(Т), могут выполняться при разл. температурах. Соответственно и реакция может протекать по-разному: в низкотемпературном режиме без прогрессирующего самоускорения, с незначит. саморазогревом (Т 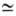
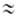
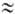
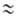
Рис. 1. Зависимость скоростей тепловыделения q+ и теплоотвода q— от температуры Т реагирующей системы при разл. значениях расхода через реактор С (пояснения в тексте); Т0 — температура окружающей среды. ТГ — адиабатич. температура горения.
Критич. и гистерезисные явления, характерные для Г., возникают не только при изменении расхода, но и при изменении др. внеш. условий (Т0, V и т. д.).
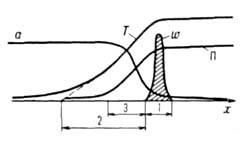
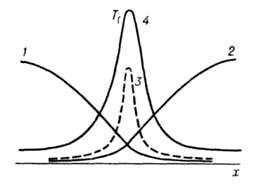
Волны горения обусловлены характерным свойством Г. — способностью к распространению в пространстве, занятом горючей смесью. Начавшись в одном слое горючей смеси, заполняющей к.-л. объем, напр. трубу, реакция Г. инициируется в соседних слоях вследствие их нагрева горячими продуктами или из-за диффузии активных центров из реагирующего слоя. В результате возникает распространяющийся вдоль трубы фронт Г., перед которым находится горючая смесь при начальной температуре Т0, за ним-продукты сгорания при температуре ТП. При отсутствии потерь тепла через стенки трубы ТП = ТГ. В стационарном режиме Г. все точки плоского волнового фронта перемещаются с одинаковой скоростью м, постоянной во времени. Скорость реакции w, температура Т и концентрация горючей компоненты а распределены во фронте Г. неравномерно, образуя вдоль координаты распространения фронта х три зоны (рис. 2). В т. наз. зоне реакции 1 температура принимает значения в узком интервале 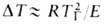
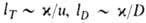
RTT 2 /E(TГ — Т0). В случаях реакции со сложным механизмом ( напр., при сильном торможении реакции продуктом) lр м. б. сравнима и даже превосходить lТ.
Рис. 2. Изменение скорости реакции w, температуры Т реагирующей системы, концентраций горючего а и продуктов П вдоль координаты х распространения фронта горения; 1 — зона реакции, 2 — зона прогрева, 3 — зона диффузии.
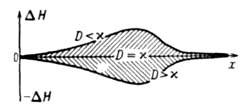
В соответствии с текущими значениями Т и а распределена во фронте Г. и полная энтальпия смеси Н (рис. 3). При 
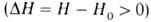
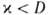
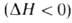
Рис. 3. Изменение энтальпии Н реагирующей системы вдоль координаты х распространения фронта горения; 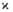
При сложных реакциях, протекающих по многостадийному механизму, структура фронта Г. может оказаться более сложной, чем в случае простой (одностадийной) реакции. В зависимости от соотношения между кинетич. константами разл. стадий сложной реакции эти стадии могут либо протекать в одной зоне (режим слияния), либо могут быть пространственно разделенными и взаимод. между собой посредством тепловых и диффузионных потоков (режим управления), либо не будут испытывать никакого взаимного влияния (режим отрыва). Скорость распространения фронта Г. с неск. зонами реакции, как правило, определяется к.-л. одной из них ( т. наз. ведущая зона).
Количество горючего, сгорающего на единице поверхности фронта Г. в единицу времени, наз. массовой скоростью Г. т. Она определяется выражением: 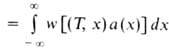
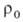
Расчет скоростей Г. — массовой m и линейной u-связан с отысканием распределения температур и концентраций всех компонентов смеси во фронте Г. и требует совместного решения дифференц. уравнений тепло- и массопереноса в реагирующей среде. Согласно Зельдовичу-Франк-Каменецкому, для простой (одностадийной) реакции
где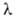
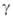
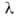
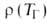
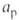
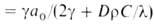
В реальных условиях распространение фронта Г. всегда сопровождается потерями тепла во внеш. среду (излучением, теплопроводностью), что приводит к уменьшению температуры и скорости Г. по сравнению с их адиабатич. значениями. Если отношение интенсивности теплопотерь к мощности тепловыделения превышает некоторое критич. значение, самораспространение реакции по горючей смеси становится невозможным. Срыв Г. с ростом теплопотерь осуществляется скачком: непосредственно перед потуханием скорость Г. отлична от нуля и даже м. б. близка к скорости адиабатич. Г. Со срывом Г. вследствие теплопотерь связаны понятия разл. пределов Г. Так, если содержание воздуха в горючей смеси становится меньше стехиометрического, сильно уменьшаются скорости реакции и тепловыделения. При неизменной теплоотдаче это приводит к росту отношения интенсивности теплопотерь к мощности тепловыделения. При некоторой концентрации горючего это отношение достигает критич. значения, ниже которого смесь становится негорючей в данных условиях; соответствующая концентрация горючего наз. концентрационным пределом Г. Аналогично определяются пределы Г. по начальной температуре, давлению, диаметру трубы и т. п.
Диффузионное горение имеет место в условиях, когда горючее и окислитель диффундируют в зону реакции с противоположных сторон; таково, напр., Г. свечи, фитиля. Если при этом константа скорости k реакции Г. много меньше константы скорости диффузии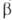
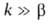
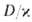
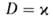
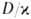
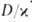
Рис. 4. Распределение концентрации окислителя (1), горючего (2), продуктов реакции (3) и температуры смеси (4) во фронте диффузионного горения; х-пространственная координата, ТГ-адиабатич. температура горения.
Особенности горения в различных средах.
При Г. газовых смесей на скорость распространения фронта Г. (пламени) и форму его поверхности существенно влияет гидродинамич. течение среды. Скорость и распространения пламени по неподвижной среде зависит от состава смеси, температуры и давления и является физ.-хим. характеристикой смеси. Она наз. нормальной, или фундаментальной, скоростью Г. Для реакции и-го порядка и
В ламинарно движущейся горючей смеси пламя распространяется со скоростью и в направлении, нормальном к его поверхности. Пламя имеет стабилизированную в пространстве форму при условии, что и равна нормальной составляющей скорости потока VH. В случае вытекания из горелки радиуса r заранее перемешанной смеси со скоростью потока v = const стабилизированная поверхность пламени (т. н. факел) имеет форму конуса с высотой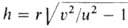
При турбулентном течении горючей смеси пульсации потока интенсифицируют тепло- и массоперенос в пламени, искривляют и дробят его поверхность, расширяют зону реакции, что приводит к резкому ускорению Г. Скорость распространения турбулентного пламени может превосходить и в десятки и сотни раз. В сильно шероховатых трубах турбулизация потока и ускорение пламени могут даже привести к переходу Г. в детонацию.
В конденсированных (безгазовых) системах ведущая Г. экзотермич. реакция протекает в твердой или жидкой фазе с образованием конденсиров. продуктов; газофазные вещества либо не участвуют в реакции, либо не влияют на распространение фронта Г. Примеры подобных процессов-Г. некоторых термитных составов (смесей порошков оксидов и металлов-восстановителей), самораспространяющийся высокотемпературный синтез, фронтальная полимеризация. Для Г. безгазовых смесей характерна высокая плотность выделения энергии, скорость Г. для разл. систем принимает значения от 10 −1 до 10 см/с и постоянна в широком интервале изменения давления; отсутствует диффузия продуктов в исходную смесь, изменение концентрации реагентов происходит только в пределах зоны реакции (зоны 1и 3 на рис. 2 сливаются в одну). Такая структура фронта Г. обусловливает макс. количество избыточной энтальпии в прогретом слое вещества перед зоной реакции. В сочетании с высокой температурной чувствительностью скорости реакции (сверхкритич. значения энергии активации реакции Е) это может привести к возникновению автоколебаний фронта Г. с резкими пульсациями температуры и скорости Г. Если поверхность фронта велика, колебания отд. точек теряют синхронность и возникают пространственно неоднородные нестационарные эффекты, напр. т. наз. спиновое Г., при котором реакция локализуется в небольшом ярком пятне, движущемся по спирали с пост. скоростью в сторону несгоревшего вещества (рис. 5). При Г. смесей порошков, напр. металла с углеродом, часто возникают широкие (намного превышающие зону прогрева) зоны тепловыделения, обусловленные сильным торможением реакции продуктами. Интенсивная реакция, определяющая скорость распространения фронта Г., протекает при температурах, намного меньших ТГ, дальнейшее догорание растягивается на большое пространство.
Рис. 5. Спиновое горение тантала в азоте: 1 сгоревшая часть образца (светятся горячие продукты горения); 2 — очаг реакции, распространяющийся по спирали (стрелка указывает направление движения); 3 — несгоревшая часть образца (исходное вещество).
При Г. газифицирующихся конденсированных систем ( напр., твердых и жидких ВВ) происходит интенсивное газовыделение вследствие испарения горючего или его хим. разложения, обусловленных потоком тепла из зоны Г. Ведущая Г. экзотермич. реакция может протекать в образующейся газовой фазе ( т. наз. летучие системы) либо в конденсиров. фазе (нелетучие системы). Стационарное Г. летучих систем описывается той же теорией, что и Г. газовых смесей с заранее перемешанными компонентами. В нелетучих системах выделение большого количества газообразных продуктов может приводить к мех. разрушению и диспергированию вещества вблизи поверхности. В результате зона реакции сильно растягивается и тепловыделение происходит в осн. в мелкодисперсной смеси частиц горючего и продуктов его первичного хим. разложения. Линейные скорости и Г. порохов и других ВВ составляют от долей мм/с до десятков см/с; аномально высокие и (десятки м/с) наблюдаются при проникновении горячих газообразных продуктов в поры гранулированного твердого топлива (конвективное Г.). Как и при Г. газов, для и характерна степенная зависимость от р типа и
Г. гетерогенных систем — твердых или жидких топлив в газообразном окислителе — может происходить так же, как и Г. гомогенных газовых смесей, если перемешивание компонентов происходит достаточно быстро и не лимитирует реакцию ( напр., при распылении топлива из форсунки). При низкой дисперсности частиц горючего осуществляется режим диффузионного Г. При Г. капли жидкого топлива вокруг нее образуется диффузионное пламя, поддерживающее интенсивное испарение. Время диффузионного Г. частиц топлива пропорционально квадрату их размера. Помимо миним. размера, отвечающего пределу интенсификации диффузионного Г., существует макс. размер частицы, при котором топливо не может гореть вследствие радиац. теплопотерь.
Распространение пламени по взвеси частиц топлива в газе (аэровзвеси) протекает с большими скоростями (
10 м/с) вследствие того, что световое излучение от горящих частиц топлива нагревает исходную смесь на больших расстояниях перед фронтом Г. В больших объемах Г. аэровзвеси может переходить в детонацию вследствие самоускорения пламени, а также из-за автотурбулизации течения газа горящими частицами твердого топлива.
В макрогетерог. системах (крупные куски угля, пластины полимеров в атмосфере окислителя) возможно распространение диффузионного пламени вдоль поверхности горючего материала. Скорость Г. определяется тепло- и массоперено-сом в передней кромке пламени и зависит от величины и направления потока газа, концентрации в нем окислителя, свойств горючего.
Практич. применения Г. развиваются по двум направлениям-энергетическому, в котором Г. используется для выделения энергии топлива, и технологическому, в котором назначение Г. — получение целевого продукта. Первое направление составляют теплоэнергетика, моторостроение, ракетная техника, разработка МГД-генераторов и др.; второе — доменный процесс, металлотермия, неполное сжигание углеводородов в производстве сажи, ацетилена, этилена, самораспространяющийся высокотемпературный синтез, разработка нефтяных месторождений путем внутрипластового Г. и др. Изучение Г. имеет первостепенное значение в разработке научных основ пожаро- и взрывобезопасности ( см. пожарная опасность).
Лит.: Хитрин Л. Н., Физика горения и взрыва, М., 1957; Льюис Б., Эльбе Г., Горение, пламя и взрывы в газах, пер. с англ., 2 изд., М., 1968; Процессы горения в химической технологии и металлургии, Черноголовка, 1975; Мержанов А. Г., Руманов Э. Н., Горение без топлива, М., 1978; Математическая теория горения и взрыва, М., 1980; Теория горения и взрыва, М., 1981.
А. Г. Мержанов, А. П. Алдушин