Тромботическая микроангиопатия что это такое
Болезнь Мошковица – это полисиндромная патология, сочетающая в себе тромбоцитопению, гемолитическую анемию, окклюзию артериол с развитием ишемических поражений органов. Клинически протекает с лихорадкой, кровотечениями, неврологическими нарушениями, абдоминальным синдромом. Возможно развитие ТИА, инфаркта миокарда и почек, гепатита, мезентериальной ишемии. Диагностика основана на исследовании крови (ОАК, тромбоциты, ЛДГ, активность металлопротеиназы), биоптатов почек, кожи, костного мозга. Лечение предполагает использование дезагрегантов, антикоагулянтов, глюкокортикоидов; проведение плазмафереза, переливание плазмы, по показаниям – гемодиализ.
МКБ-10
Общие сведения
Причины
Этиология болезни Мошковица остается предметом исследования в гематологии. Важным прорывом последних десятилетий в этом вопросе служит выявление связи ТТП с недостаточностью фермента ADAMTS-13 – металлопротеазы, расщепляющей фактор Виллебранда. Нарушение ферментной активности может быть вызвано как врожденными, так и приобретенными причинами:
Патогенез
Дефицит или ингибирование ADAMTS-13 приводит к повышенной активности VWF (фактора фон Виллебранда), который начинает стимулировать неконтролируемую внутрисосудистую агрегацию тромбоцитов и тромбообразование в микроциркуляторном русле. Количество циркулирующих тромбоцитов уменьшается, развивается тромбоцитопения.
Одновременно происходит пролиферация эндотелия мелких сосудов, что вызывает дополнительное сужение их просвета. Механическое затруднение для тока крови и высвобождение различных эндотелиальных факторов способствует фрагментации эритроцитов с развитием внутрисосудистого гемолиза.
Агрегаты тромбоцитов вызывают закупорку артериол и капилляров головного мозга, сердца, почек, легких. На коже и слизистых возникает геморрагическая пурпура, внутренние органы увеличиваются, в них обнаруживаются отложения гемосидерина. На фоне микроангиопатии формируются ишемические и некротические изменения тканей, возникают инфаркты сердечной мышцы, церебральной ткани, почечной паренхимы.
Классификация
С точки зрения влияния этиологических факторов, болезнь Мошковица подразделяется на наследственные и приобретенные варианты. Эти группы (особенно приобретенная форма) крайне неоднородны, отличаются по времени дебюта, доброкачественности течения, прогнозу:
1. Наследственная. Представлена синдромом Апшоу–Шульмана с аутосомно-рецессивным механизмом наследственной передачи. Чаще манифестирует в детском возрасте, однако известны эпизоды начала заболевания в 35 лет. Течение хроническое, рецидивирующее.
2. Приобретенные формы ТТП.
Симптомы болезни Мошковица
В большинстве случаев заболевание манифестирует остро и внезапно. Часто отмечается простудоподобное продромальное состояние. Клиника развивается стремительно. Классическая форма болезни Мошковица характеризуется пентадой признаков: тяжелой тробоцитопенией, гемолитической анемией, неврологическими нарушениями, лихорадкой и почечным синдромом.
В дебюте ТТП у 35% больных возникает абдоминальный синдром: рвота, выраженные боли в животе, свидетельствующие о мезентериальной ишемии. Типична лихорадка. Может выявляться гепатит, панкреатит, желтуха, спленомегалия. Иногда заболевание манифестирует с инфаркта миокарда, ОРДС, рабдомиолиза, гангрены.
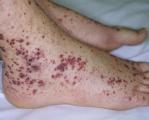
Тромбоцитопения сопровождается появлением петехиальной сыпи на коже, кровотечений различной степени выраженности и локализации (десневые, носовые, меноррагии, мелена, кровохарканье, кровоизлияние в подпаутинное пространство). Церебральные и почечные нарушения отражают ишемические поражения органов. В неврологическом статусе отмечаются цефалгии, судороги, нарушения сознания. Могут возникать парезы и гемиплегия, атаксия, афатические расстройства. В тяжелых случаях возможна кома.
Признаками почечного синдрома служат массивные отеки, артериальная гипертензия, гематурия. Нарастание олигурии, электролитного дисбаланса и азотемии свидетельствует о развитии острой почечной недостаточности. Чаще болезнь Мошковица протекает остро или подостро. Возможно рецидивирующее течение.
Осложнения
Без экстренного назначения адекватного лечения смертность от болезни Мошковица составляет 85-100%. Летальные исходы обусловлены ишемическим поражением органов-мишеней (острый инфаркт миокарда, ОНМК, инфаркт почек), геморрагическим синдромом (церебральные кровоизлияния, внутренние кровотечения), органной дисфункций (ОПН, СН). Описаны случаи внезапной сердечной смерти, связанные с фатальными аритмиями, кардиогенным шоком. В поздних стадиях развивается ДВС-синдром.
Диагностика
Сложность распознавания болезни Мошковица объясняется отсутствием патогномоничной клинической картины. Больные часто поступают в стационар с клиникой инсульта, острой коронарной недостаточности, абдоминальной ишемии и безуспешно лечатся от соответствующих синдромов. Между тем, наряду с осмотром врача-невролога, кардиолога, нефролога, пациентам необходима консультация гематолога:
Дифференциальный диагноз
На основании лабораторно-инструментальных данных дифференциальная диагностика болезни Мошковица осуществляется с:
Лечение болезни Мошковица
При малейшем подозрении на ТТП рекомендуется незамедлительно начинать патогенетическое лечение. Пациенты, как правило, госпитализируются в ОРИТ, где проводится постоянный мониторинг клинико-лабораторных показателей. Терапия болезни Мошковица включает несколько направлений:
При рефрактерных к стандартной терапевтической схеме формах болезни Мошковица применяются цитостатики, иммунодепрессанты, моноклональные антитела. В целях снижения риска рецидивов показана спленэктомия.
Прогноз и профилактика
Болезнь Мошковица ‒ тяжелая, сложно диагностируемая патология с агрессивным течением. Без своевременного лечения летальность очень высока. При быстрой постановке диагноза и раннем начале лечения (проведении экстракорпоральной гемокоррекции) удается спасти свыше 80% больных. В дальнейшем для пролонгирования ремиссии необходима постоянная поддерживающая терапия. Часто сохраняются остаточные изменения в виде энцефалопатии, ХПН. Профилактика ТТП не разработана. При наследственных формах проводится генетическое консультирование.
Тромботическая микроангиопатия в акушерстве
Введение
Преэклампсия и HELLP-синдром являются грозным осложнением беременности. В настоящее время они рассматриваются как варианты тромботической микроангиопатии (ТМА). Наиболее грозным представителем ТМА является атипичный гемолитико-уремический синдром (аГУС), к развитию которого предрасполагают генетические аномалии в системе иммунитета. Установлено, что беременность сама по себе может активировать патологический иммунный ответ, причем выраженность активации возрастает при наличии акушерских осложнений, достигая максимума у пациенток с преэклампсией. Генетический дефект в сочетании с преэклампсией приводит к неконтролируемой активации иммунного ответа, являющегося при акушерском аГУС основой развития полиорганной недостаточности, которая не может быть устранена без специфического лечения.
Критерии диагноза ТМА
ТМА представляет собой синдром, в основе которого лежит повреждение эндотелия сосудов микроциркуляторного русла (МЦР) различными способами, но имеющий сходные проявления и диагностические признаки. Результатом эндотелиального повреждения служит тромботическая микроангиопатия — особый тип поражения мелких сосудов, представленный их тромбозом и воспалением сосудистой стенки.
Морфологическая картина ТМА: отек эндотелиальных клеток, их отслойка от базальной мембраны (эндотелиоз), некроз, деструкция, расширение субэндотелиального пространства, тромбы в просвете капилляров и артериол, содержащие тромбоциты и фибрин, нередко с полной окклюзией просвета сосудов.
Клинико-лабораторные признаки ТМА:
Тромботические микроангиопатии классифицируют на первичные и вторичные.
Вторичные ТМА вследствие следующих состояний:
Критерии диагноза аГУС в акушерстве
Диагноз аГУС в акушерстве — это диагноз исключения. Дифференциальная диагностика с другими формами ТМА приведена в табл. 1.
Положительный результат при бактериологическом исследовании кала: посев на среду для выявления STEC (Mac Conkey для 0157:Н7), определение в образцах фекалий ДНК энтеро-геморрагических E.coli методом ПЦР; выявление в сыворотке антител к липополисахаридам наиболее распространенных в данном регионе серотипов E.coli.
Наследственная или приобретенная ТТП
Дефицит ADAMTS-13 — активность менее 10%, антитела к ADAMTS-13
Беременность. Исключить преэклампсию и HELLP-синдром
Ферменты печени, срок гестации, критерии преэклампсии и тяжелой преэклампсии, положительная динамика непосредственно после родоразрешения
Аутоиммунные заболевания (системная красная волчанка, антифосфолипидный синдром)
Анти-ДНК-антитела, антинуклеарные антитела, антитела к кардиолипину IgG и/или IgM изотипов, антитела к (32 GP 1 IgG и/или IgM изотипов с помощью стандартизованного иммуноферментного метода, волчаночный антикоагулянт стандартизованным коагулологическим методом
Положительные результаты иммунного блоттинга на ВИЧ- инфекцию
Наличие очага инфекции и полиорганной недостаточности (острое изменение по шкале SOFA >2 баллов)|
Генетическое исследование и биопсия почки не являются необходимыми для установления диагноза аГУС и не играют роли для решения вопроса о тактике лечения больного.
Преэклампсия и HELLP-синдром являются специфическими ассоциированными с беременностью формами ТМА. Всем пациенткам, госпитализированным с диагнозом тяжелая преэклампсия и/или HELLP-синдром, необходимо до родоразрешения исследовать ЛДГ, гаптоглобин в сыворотке крови и шизоциты в мазке периферической крови, а также определить количество тромбоцитов и уровень креатинина.
Истинные тяжелая преэклампсия и HELLP-синдром требуют родоразрешения с целью элиминации секретирующегося анти-ангиогенного фактора sFlt-1 плаценты.
Поскольку термин «HELLP-синдром» — собирательное понятие и его причины до конца не выяснены, тактика родоразрешения и интенсивной терапии строится в соответствии с тактикой при тяжелой преэклампсии (родоразрешение). В этом случае диагноз формулируется в соответствии с МКБ Х — «Тромботическая микроангиопатия (HELLP-синдром)».
Принципы и схемы терапии
При развитии клиники HELLP-синдрома в послеродовом периоде необходимо строить тактику интенсивной терапии в зависимости от следующих клинических вариантов:
Вариант 1. У пациентки сохранены: сознание, диурез более 0,5 мл/кг/ч (вне зависимости от цвета мочи), стабильная гемодинамика (или с тенденцией к артериальной гипертензии), отсутствует геморрагический синдром любой локализации. При лабораторном исследовании выявлены тромбоцитопения, повышены уровни АСТ, АЛТ, ЛДГ, массивного внутрисосудистого гемолиза нет. Плазменные факторы свертывания в норме. В данном случае, в течение суток оценивается динамика клинико-лабораторных
проявлений HELLP-синдрома и при отсутствии отрицательных проявлений интенсивная терапия ограничивается базовой терапией преэклампсии и инфузией кристаллоидов Пациентка получает нутритивную поддержку и активизируется. Проводится тромбопрофилактика НМГ при количестве тромбоцитов более 70000 в мкл.
Вариант 2. Уже с первых часов после родоразрешения развивается клиника острой печеночной недостаточности (тромбоцитопения, рост АСТ, АЛТ, коагулопатия, кровотечение, шок, ОПН, ОРДС и т.д.), в основе, которой лежит некроз печени (подкапсульная гематома). Требует проведения комплексной посиндромной интенсивной терапии острой печеночной недостаточности в условиях многопрофильного ЛПУ с возможностью хирургического лечения.
Вариант 3. Развитие массивного внутрисосудистого гемолиза (свободный гемоглобин в крови и моче, анемия) уже в первые часы осложняется развитием ОПН (по шкалам RIFLE, AKIN, KDIGO) и требует проведения заместительной почечной терапии. Противопоказано применение магния сульфата и инфузионной терапии. Требует проведения комплексной посиндромной интенсивной терапии ОПН в условиях многопрофильного ЛПУ. При сохранении или прогрессировании симптомов ТМА (тромбоцитопения и МАГА) в течение 48 часов следует, как один из вероятных диагнозов рассматривать аГУС и проводить соответствующую терапию.
Вариант 4. В исключительных случаях верификации диагноза ТТП в послеродовом периоде на основании сочетания признаков HELLP-синдрома, нарастающей тромбоцитопении, симптомов поражения почек и/или ЦНС со снижением активности ADAMTS-13 менее 10% показана инфузия свежезамороженной плазмы и проведение плазмообмена«.
Вариант 5. Женщинам, перенесшим акушерскую ТМА (преэклампсия, HELLP-синдром), следует устанавливать диагноз аГУС, если после родоразрешения их состояние не улучшается или ухудшается, в короткие сроки приводя к формированию
полиорганной недостаточности, что свидетельствует о персистировании ТМА с генерализацией микроангиопатического процесса.
В первую очередь о возможном аГУС следует думать при развитии тяжелого HELLP-синдрома с признаками внепеченочного поражения, особенно если родоразрешение не сопровождается положительной динамикой состояния пациентки, несмотря на лечение в соответствии с клиническими рекомендациями (протоколом лечения) МЗ РФ «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» 2016 г. Быстрое нарастание анемии при отсутствии выраженной кровопотери свидетельствует об усилении микроангиопатического гемолиза, что, как правило, сопровождается усугублением тромбоцитопении и стремительным ухудшением функции почек, приводящим к развитию олигурической.
Родильницам с установленным диагнозом аГУС следует назначать патогенетическую терапию, направленную на блокирование С5-компонента системы комплемента, играющего ключевую роль в развитии данного осложнения. Антикомплементарная терапия проводится согласно рекомендациям по лечению аГУС взрослых.
Экулизумаб — рекомбинантное гуманизированное моноклональное антитело класса Ig G к С5 компоненту комплемента. Препарат блокирует расщепление С5, препятствуя образованию мембрано-атакующего комплекса и предотвращая тем самым повреждение эндотелия и, следовательно, прекращая процессы микроциркуляторного тромбообразования. Применение Экулизумаба приводит к обратному развитию ТМА и/или предупреждает прогрессирование поражения почек. Критериями эффективности терапии Экулизумабом являются прекращение микроангиопатического гемолиза (снижение уровня ЛДГ до нормальных значений) и нормализация числа тромбоцитов, а также улучшение функции почек.
Начальный курс терапии Экулизумабом рассчитан на 5 недель, далее подразумевается переход на цикл поддерживающего лечения.
Индукционный курс: 1 раз в неделю вводят по 900 мг Экулизумаба на протяжении недель. На пятой неделе дозу увеличивают до 1200 мг.
Поддерживающий этап: каждые 14 (плюс/минус 2 дня) дней вводят по 1200 мг.
В ожидании Экулизумаба родильницы с установленным диагнозом аГУС должны получать в случае необходимости почечную заместительную терапию при наличии ОПН. Свежезамороженная плазма в больших объемах у пациенток с тяжелой преэклампсией может вызвать перегрузку объемом (TACO-синдром) или развитие иммунного TRALI-синдрома и в отсутствие клинических проявлений коаулопатии и кровотечения противопоказана! Свежезамороженная плазма применяется только при верификации диагноза ТТП.
Тромботическая микроангиопатия
С.В. АКИНЬШИНА, В.О. БИЦАДЗЕ, М.Д. АНДРЕЕВА, А.Д. МАКАЦАРИЯ
Первый Московский государственный медицинский университет им. И.М. Сеченова, 119991, г. Москва, ул. Трубецкая, д. 8, стр. 2
Акиньшина Светлана Владимировна — кандидат медицинских наук, научный сотрудник кафедры акушерства и гинекологии медико-профилактического факультета, 109004, г. Москва, ул. Земляной Вал, д. 62, стр. 1, тел. +7-903-238-80-48, e-mail: gemostasis@mail.ru¹
Бицадзе Виктория Омаровна — доктор медицинских наук, профессор кафедры акушерства и гинекологии медико-профилактического факультета, 109004, г. Москва, ул. Земляной Вал, д. 62, стр. 1, тел. +7-926-231-38-29, e-mail: gemostasis@mail.ru¹
Андреева Маргарита Дарчиевна — кандидат медицинских наук, докторант кафедры акушерства и гинекологии медико-профилактического факультета, 109004, г. Москва, ул. Земляной Вал, д. 62, стр. 1, тел. +7-918-388-61-11, e-mail: gemostasis@mail.ru¹
Макацария Александр Давыдович — доктор медицинских наук, профессор, чл.-корр. РАМН, заведующий кафедрой акушерства и гинекологии медико-профилактического факультета, 109004, г. Москва, ул. Земляной Вал, д. 62, стр. 1, тел. +7-903-728-08-97, e-mail: gemostasis@mail.ru¹
В настоящее время к тромботической микроангиопатии относят тромботическую тромбоцитопеническую пурпуру (ТТП), гемолитико-уремический синдром, гепарин-индуцированную тромбоцитопению, HELLP-синдром. Одним из важнейших триггеров к возникновению тромботической микроангиопатии является беременность. Этот факт открывает широкие перспективы к изучению патогенеза тромботической микроангиопатии в контексте физиологических изменений гемостаза во время беременности. В то же время открытие молекулярных механизмов тромботической микроангиопатии позволяет по-новому взглянуть на патогенез тромботических осложнений, связанных с беременностью, а также на патогенез так называемых плацентарных акушерских осложнений, в том числе тяжелых форм преэклампсии.
Ключевые слова: тромботическая микроангиопатия, гемостаз, гемолитическая анемия, беременность, HELLP-синдром.
S.V. AKINSHINA, V.O. BITSADZE, M.D. ANDREEVA, A.D. MAKATSARIYA
I.M. Sechenov First Moscow State Medical University,8 Trubetskaya St., bld.2, Moscow, Russian Federation 119991
Thrombotic microangiopathy
Akinshina S.V. — Candidate of Medical Science, research associate of the Department of Obstetrics and Gynaecology of Public Health faculty, 62 Zemlyanoy Val St., bld.1., Moscow, Russian Federation 109004, tel. +7-903-238-80-48, e-mail: gemostasis@mail.ru¹
Bitsadze V.O. — D.Med.Sc., Professor of the Department of Obstetrics and Gynaecology of Public Health faculty, 62 Zemlyanoy Val St., bld.1., Moscow, Russian Federation 109004, tel. +7-926-231-38-29, e-mail: gemostasis@mail.ru¹
Andreeva M.D. — Candidate of Medical Science, doctoral candidate of the Department of Obstetrics and Gynaecology of Public Health faculty, 62 Zemlyanoy Val St., bld.1., Moscow, Russian Federation 109004, tel. +7-918-388-61-11, e-mail: gemostasis@mail.ru¹
Makatsariya A.D. — D.Med.Sc., Professor, corresponding member of RAMS, Head of the Department of Obstetrics and Gynaecology of Public Health faculty, 62 Zemlyanoy Val St., bld.1., Moscow, Russian Federation 109004, tel.+7-903-728-08-97, e-mail: gemostasis@mail.ru¹
At the present timethrombotic thrombocytopenic purpura (TTP), hemolytic-uremic syndrome, heparin induced thrombocytopenia and HELLP syndrome are refered to thrombotic microangiopathy.One of the major triggers for the emergence of thrombotic microangiopathy is pregnancy. This fact opens great prospects for studying the pathogenesis of thrombotic microangiopathy in the context of physiological changes in hemostasis during pregnancy. At the same time, the discovery of the molecular mechanisms of thrombotic microangiopathy, allows new insights on the pathogenesis of thrombotic complications associated with pregnancy, as well as the pathogenesis of the so-called placental obstetric complications, including severe preeclampsia.
Key words: thrombotic microangiopathy, hemostasis, hemolytic anemia, pregnancy, HELLP syndrome.
Понятие о тромботической микроангиопатии, ТТП, ГУС
Тромботическая тромбоцитопеническая пурпура(ТТП) в настоящее время рассматривается как одно из наиболее тяжелых состояний, ассоциированных с микрососудистым тромбозом. Тромботическая микроангиопатия морфологически проявляется утолщением стенок сосудов микроциркуляторного русла (преимущественно капилляров и артериол), отеком и слущиванием эндотелиальных клеток от базальной мембраны, образованием тромбоцитарных сгустков и частичной или полной обструкцией просвета пораженного сосуда, при этом периваскулярное воспаление не характерно, а тромбы состоят почти исключительно из тромбоцитов. Обструкция просвета сосудов приводит к развитию ишемии и инфарктов органов. Характерным признаком тромботической микроангиопатии является тромбоцитопения и гемолитическая анемия, что связано с потреблением и разрушением тромбоцитов и эритроцитов в микроциркуляторном русле [1].
Частота возникновения ТТП точно не известна. По данным Toroketal. (1995), в период с 1968 по 1991 год заболеваемость ТТП в США составляла 3,7 случаев на 100 000 [2]. По необъяснимым причинам с 1970-80 гг. наблюдается неуклонный рост заболеваемости ТТП.
Клинические проявления тромботической микроангиопатии зависят от локализации повреждения микрососудов и, следовательно, от вовлечения в патологический процесс различных органов. Так, ТТП характеризуется пентадой симптомов: тромбоцитопения, микроангиопатическая анемия, лихорадка, поражение почек и неврологическая симптоматика. Неврологические проявления ТТП крайне разнообразны и варьируют от небольших нарушений поведения и затуманенности сознания до выраженных сенсорно-моторных нарушений, афазии, судорог и комы. Для ГУС также характерна тромбоцитопения и микроангиопатическая гемолитическая анемия, но с преимущественным поражением почек. Таким образом, при ТТП преобладают признаки поражения головного мозга, тогда как при ГУС в патологический процесс в основном вовлекаются почки. Кроме того, при ТТП могут наблюдаться боли в животе, панкреатит, гематурия, нарушения сердечного ритма, нарушения зрения. Все эти симптомы обусловлены нарушением микроциркуляции в различных тканях и органах, включая коронарные сосуды, сетчатку, сосуды, кровоснабжающие желудочно-кишечный тракт. Интересно отметить, что в последние несколько лет в значительном проценте случаев (5-10%) ТТП манифестирует под маской острого панкреатита. Развитие развернутой картины ДВС-синдрома, тяжелая почечная, дыхательная, печеночная недостаточность обычно для ТТП не характерны.
ГУС в типичных случаях характерен для детского возраста, в то время как ТТП развивается у взрослых преимущественно в возрасте 40 лет. Однако существует и другая форма ГУС, развивающаяся у взрослых и клинически во многом неотличимая от ТТП. Кроме того, лишь у 40% пациентов с ТТП выявляется классическая пентада симптомов. В тоже время неврологическая симптоматика при ТТП бывает выражена в 78% случаев, а при ГУС — у трети пациентов [3]. При ТТП поражение ЦНС наиболее часто проявляется развитием транзиторных ишемических атак и инсульта. Хотя ТТП является достаточно редкой причиной острой ишемии головного мозга, в этом случае очень важно вовремя поставить правильный диагноз, так как принципы терапии ТТП и сосудистых заболеваний головного мозга значительно различаются.
Признаки поражения почек при ТТП выявляются в 60% случаев [4]. При этом исход поражения почек зависит не от вида патологии (ТТП или ГУС), а определяется прежде всего ранним началом адекватной терапии. Кроме того, при семейной форме заболевания у одного и того же пациента в разное время могут выявляться как эпизоды ГУС, так и ТТП. В связи с этим отдифференцировать ГУС и ТТП, основываясь на клинических данных, часто бывает невозможным. Поэтому подход к классификации ГУС и ТТП был изменен. В настоящее время, основываясь на единстве патологических процессов, в основе которых лежит тромботическая микроангиопатия, ГУС и ТТП объединены понятие ГУС/ТТП.
После внедрения терапии свежезамороженной плазмы и значительного снижения летальности у больных ТТП удалось проследить дальнейшую судьбу этих пациентов, и стало очевидным, что этиология ТТП характеризуется значительным разнообразием как и дальнейшее течение этого заболевания. В настоящее время выделяют наследственную (семейную, врожденную) форму ТТП, которая носит название синдрома Апшоу-Шульмана и обусловлена генетическим дефектом протеазы vWF — ADAMTS-13, и приобретенную форму ТТП, обусловленную формированием антител к ADAMTS-13 или ее ингибитора. Мутации в гене ADAMTS 13 вызывают значительное снижение уровней этого фермента в плазме крови или выраженное нарушение его активности. При тяжелом генетически обусловленном дефиците ADAMTS 13 эпизоды ТТП могут начаться с раннего детства, однако у ряда больных заболевание долго может себя не проявлять вплоть до воздействия какого-либо сильного провоцирующего фактора. Например, триггером для развития первого эпизода ТТП у таких больных может стать беременность. Кроме того, стимулом к развитию острого эпизода ТТП у больных со сниженной активностью ТТП в плазме крови могут стать различные инфекционные заболевания и септические состояния, сопровождающиеся массивным выбросом провоспалительных цитокинов, а также прием оральных контрацептивов, так как содержащиеся в них эстрогены стимулируют выброс ультравысокомолекулярных мультимеров vWF из эндотелиоцитов. У ряда больных с выраженным наследственным дефицитом ADAMTS 13 (активность ADAMTS 13 в плазме крови менее 5-10%) ТТП принимает хроническое рецидивирующее течение с рождения, а ведущим синдромом становится прогрессирующая почечная недостаточность. При редкой врожденной форме ТТП рецидивы могут возникать каждые 3-4 недели. Такую форму заболевания часто называют хронической рецидивирующей ТТП.
У двух третей больных с относительно более распространенной приобретенной формой ТТП в случае успешной терапии повторные эпизоды не возникают, тогда как у трети больных развиваются рецидивы [4]. Когда именно разовьется рецидив, предсказать невозможно. Период ремиссии может длиться от нескольких дней до десятков лет, однако наиболее часто рецидив развивается в течение года после первого эпизода ТТП. Триггером к развитию рецидива могут служить беременность, хирургическое вмешательство, инфекция, вакцинация.
В настоящее время принята следующая классификация тромботических микроангиопатий (табл. 1).
Таблица 1.
Патологические процессы, ассоциированные с тромбоцитопенией и микроангиопатическим гемолизом
| Тромботическая микроангиопатия: |
| Тромботическая тромбоцитопеническая пурпура (ТТП): дефицит активности протеазы фактора фон Виллебранда (vWF) ADAMTS 13 — семейная (врожденная, хроническая рецидивирующая, синдром Апшоу- Шульмана) (дефект гена ADAMTS 13, постоянное снижение активности ADAMTS 13 в плазме крови до 5-10%) — приобретенная (спорадическая) (ингибиторы ADAMTS 13 или аутоантитела IgG к ADAMTS 13, аутоантитела выявляются у 44-94%) (рецидивирующая в трети случаев) Гемолитико-уремический синдром (ГУС): Типичная (эпидемическая) форма: шига-токсин ассоциированный ГУС у детей — семейная/наследственная/врожденная/хроническая рецидивирующая форма (дефект фактора Н, компонента комплемента С3) — приобретенная/спорадическая (антитела к компонентам комплемента) Пароксизмальная ночная гемоглобинурия |
Молекулярные основы патогенеза ТТП/ГУС.Moakeetal. в 1982 году впервые выявили аномальные мультимерные комплексы vWF у пациентов с ТТП и высказали предположение о возможной роли vWF в патогенезе ТТП [5]. Характерным признаком ТТП является дефицит плазменной протеазы, расщепляющей мультимеры vWF— ADAMTS 13 (adisintegrinandmetalloproteasewithtrombospondintype 1 motifs— дизинтегрин и металлопротеаза с последовательностями тромбоспондина 1 типа). При семейных формах ТТП наблюдается наследственный дефект этого фермента, в то время как приобретенные формы ТТП характеризуются наличием антител-ингибиторов vWF-протеазы [6].
Данные исследования Furlanetal. (1998) свидетельствуют об отсутствии дефицита vWF-расщепляющей металлопротеазы при наследственных и спорадических формах ГУС, что позволяет отдифферецировать ГУС от ТТП и что часто бывает невозможно сделать на основании клинической картины [7]. В то же время дефицит ADAMTS 13 помимо ТТП может выявляться и при других патологических состояниях, ассоциированных с тромбозами (воспалительные заболевания, цирроз печени, онкологические заболевания). Крометого, Loirat et al. (2001)описали 5 атипичных случаев ГУС у новорожденных, рецидивировавших от 2 до 15 раз за время наблюдения длительностью от 2 до 14 лет; при этом был выявлен абсолютный дефицит vWF-протеазы [8]. У одного и того же пациента с семейной формой заболевания во время различных эпизодов заболевания могут выявляться как признаки ГУС, так и ТТП. Кроме того, у пациентов с тромботической микроангиопатией, обусловленной метастатическим поражение, в отличие от классической ТТП, выявляется нормальная активность vWF-протеазы. Такие противоречивые данные свидетельствуют о сложности и часто невозможности дифференциальной диагностики ГУС и ТТП.
Фактор Виллебранда представляет собой высокомолекулярный мультимер, образующийся при полимеризации мономерных субъединиц с молекулярной массой 225 кДа в эндотелиальных клетках и мегакариоцитах, и накапливающийся в тельцах Weibel-Palade в эндотелиальных клетках и а-гранулах тромбоцитов. Эти ультравысокомолекулярные мультимеры vWF (ULVWF) секретируются активированными эндотелиоцитами наподобие «лент». В норме эти «ленты» высокомолекуляных комплексов vWF сразу же после экспрессии на плазматической мембране подвергаются распаду на фрагменты с Мг 189, 176 и 140 кДа под действием плазматической металлопротеазы ADAMTS 13 и, следовательно, в циркулирующей крови не обнаруживаются [3]. Физиологическая роль мультимера vWF заключается в обеспечении адгезии тромбоцитов к субэндотелиальному матриксу в условиях повреждения сосуда и гемодинамического стресса. Низкомолекулярные фрагменты vWF, циркулирующие в системном кровотоке, обладают слабой способностью к связыванию с тромбоцитами и не проявляют гемостатическую активность. В то время как аффинность отдельных субъединиц vWF к тромбоцитам чрезвычайно мала, мультимеры vWF обеспечивают одновременно множество участков связывания с рецепторами Ib тромбоцитов, что позволяет значительно увеличить силу взаимодействия vWF-тромбоцит. Так, аффинность высокомолекулярной формы vWF к тромбоцитам в 10 раз превышает таковую у отдельных субъединиц vWF[9]. Мультимерные «ленты» ULVWF могут фиксироваться на поверхности мембран эндотелиальных клеток при помощи Р-селектина, который секретируется из телец Weibel-Palade одновременно с ULVWF. В результате в условиях относительного или абсолютного дефицита ADAMTS 13 микрососуды оказываются перекрыты гигантскими ультравысокомолекулярными vWF, на которых оседает все возрастающее количество тромбоцитов, образую блокирующие микрососудистое русло тромбоцитарные тромбы. Одними из факторов, которые стимулируют выброс ULVWF из эндотелиальных клеток являются провоспалительные цитокины TNF-альфа и ИЛ-6. В связи с этим состояния, сопровождающиеся активацией процессов системного воспаления, в том числе такие осложнения беременности, как преэклампсия, могут стать стимулом к развитию тромботической микроангиопатии (рис. 1).
У пациентов с ТТП, в отличие от здоровых людей, в плазме выявляются мультимолекулярные комплексы vWF. Мультимерные комплексы vWF в большей степени активируют агрегацию тромбоцитов, чем нормальные фрагменты vWF, что свидетельствует о патогенетической роли мультимеров vWF в развитии тромботических осложнений [3].
В норме у здоровых людей активность ADAMTS 13 варьирует в значительных пределах от 50 до 170%. Cнижение активности vWF-протеазы ниже нормы (менее 50%) наблюдается в течение третьего триместра беременности, при циррозе печени, диссеминированных опухолях и воспалительных заболеваниях. У плодов и новорожденных в крови мультимеры vWF присутствуют постоянно и исчезают только через несколько месяцев жизни. Это связано с тем, что способность к физиологическому расщеплению vWF у новорожденного низкая и формируется постепенно течение первых месяцев жизни. Таким образом, существует гипотеза о том, что vWF-протеаза является негативным белком острой фазы воспаления. Предполагается, что только выраженный дефицит vWF-протеазы может рассматриваться в качестве маркера ТТП.
У пациентов, переживших ТТП, мультимерные комплексы vWF обнаруживаются лишь в острую фазу заболевания и не обнаруживаются в кровотоке после выздоровления. Возможно, при массивном повреждении эндотелия происходит значительный выброс vWF из гранул; при этом возникает относительная недостаточность металлопротеазы. Однако у пациентов, страдающих рецидивирующей формой ТТП, мультимеры vWF в кровотоке выявляются постоянно: как в острую фазу заболевания, так и в период ремиссии. Такая рецидивирующая форма заболевания чаще является наследственной и обусловлена отсутствием или дефицитом протеазы ADAMTS 13. Так, у большинства пациентов с семейной формой ТТП активность ADAMTS 13 в плазме крови составляет 5-10%, в то время как у большинства пациентов с приобретенной идиопатической ТТП подобное снижение активности ADAMTS 13 выявляется только в период рецидивов. [10] Так, абсолютный дефицит ADAMTS 13 был выявлен у двух братьев с рецидивирующей ТТП, в то время как у их родителей обнаружили снижение активности металлопротеазы на 50%. Ремиссия достигалась после применения свежезамороженной плазмы, что сопровождалось нормализацией активности vWF-расщепляющей протеазы. У обоих пациентов наблюдалась длительная ремиссия, несмотря на снижение активности металлопротеазы более чем на 80% через 20 дней после проведения курса терапии плазмой [11].
Данные исследований свидетельствуют о наличии дефицита vWF-расщепляющей металлопротеазы при различных формах ТТП [7]. В случае ненаследственных форм дефицит протеазы обусловлен наличием специфических антител — ингибиторов ADAMTS 13, которые появляются транзиторно и количество которых значительно уменьшается в период ремиссии. По данным Furlanetal. (2000), в результате спленэктомии, произведенной у пациента с ТТП, обусловленной наличием ингибитора металлопротеазы, через год после первого эпизода ТТП наблюдалось исчезновение аутоантител к протеазе, нормализация уровня тромбоцитов и гемоглобина [12].
В отличие от сериновых протеаз у металлопротеазы vWF в норме не обнаруживается плазменный ингибитор. Если для большинства металлопротеаз период полужизни измеряется секундами и минутами, для vWF-протеазы этот показатель составляет 2-4 дня [13]. Поэтому у пациентов с рецидивирующей ТТП и наследственным дефектом vWF-протеазы при применении плазмы, содержащей vWF-протеазу, может быть достигнута ремиссия заболевания. При дефиците vWF, обусловленной наличием ингибитора, целью плазмафереза является удаление патогенных IgG; возможно также применение иммунносупрессивных препаратов (глюкортикоидов, винкристина). Ингибитор vWF-протеазы вновь появляется в крови через 3 месяца после лечения.
Интересно, что в процессе острой фазы ТТП выявляется увеличение концентрации низкомолекулярных мультимеров vWF и уменьшение содержания высокомолекулярных комплексов vWF, что свидетельствует об активации протеолитического расщепления молекулы vWF. Чувствительность vWF к протеолизу повышается под действием гемодинамического стресса. При этом наблюдаются конформационные изменения молекулы vWF. Линейная конформация молекулы переходит в глобулярную, в результате участок 842Тир-843 Мет становится более доступным для воздействия плазменной металлопротеазы [14]. Существует предположение о том, что в острую фазу ТТП вследствие сужения сосудов создаются условия для возникновения гемодинамического стресса, что стимулирует расщепление мультимеров vWF. Образовавшиеся фрагменты vWF обладают повышенной способностью связываться с активированными тромбоцитами и, таким образом, могут способствовать прогрессированию патологического процесса. По данным Remuzzietal. (1996), в результате биллатеральной нефрэктомии у пациента с ГУС, резистентным к терапии свежезамороженной плазмой, наблюдалась клиническая и гематологическая ремиссия на фоне нормализации процессов фрагментации vWF [15]. Успех подобной терапии в данном случае может быть обусловлен устранением органов, где наблюдалось набольшее повреждение сосудов микроциркуляторного русла и создавались условия для активации гемодинамического стресса.
Рисунок 1.
Механизм расщепление ультравысокомолекулярных мультимеров vWF под действием ADAMTS 13
Активированные эндотелиоциты секретируют из телец Weibel-Palade «ленты» ультравысокомолекулярных мультимеров vWF (ULVWF), которые могут фиксироваться к поверхности эндотелиальных клеток при помощи Р-селектина, который одновременно с vWF секретируется из телец Weibel-Palade. Мономер vWF включает три домена: А1, А2 и А3. Домен А2 содержит участок Тир842-843Мет, который расщепляется под действием протеолитической активности ADAMTS 13. Немедленно после секреции ULVWF на поверхность эндотелиоцитов происходит адгезия тромбоцитов за счет присоединения тромбоцитарного гликопротеина Iba к домену А1. В результате такого взаимодействия происходит конформационная перестройка мономера vWF, за счет которой домен А2 и содержащаяся в его составе пептидная связь Тир842-843Мет становится более доступной для взаимодействия с ADAMTS 13. При помощи CUB-домена ADAMTS 13 соединяется с доменом А3 мономера vWF и расщепляется связь Тир842-843Мет в соседнем домене А2. CUB — карбокситерминальный домен ADAMTS 13, МР — металлопротеиназный домен ADAMTS 13. Мелкие фрагменты vWF, образующиеся после расщепления ULVWF по действием ADAMTS 13 и циркулирующие в крови, неспособны вызывать адгезию и агрегацию тромбоцитов.
В патогенезе ГУС/ТТП важнейшую роль играет развитие иммунного повреждения, что подтверждают многочисленные экспериментальные данные. Так, Leung в 1988году выделили из плазмы пациентов с ГУС/ТТП комплемент-зависимые антитела, способные повреждать эндотелиальные клетки. Так, плазма больных ГУС/ТТП, содержащая антиэндотелиальные антитела, способна активировать агрегацию тромбоцитов. При биопсии почек выявлены депозиты иммунных комплексов, содержащих IgM и IgG. Данные исследований invitro свидетельствуют об активации апоптоза культуры эндотелиальных клеток при их инкубации с сывороткой пациентов с ГУС/ТТП в присутствии комплемента. Нередко, ГУС/ТТП такие осложняет аутоиммунные заболевания, как СКВ и АФС [16]. Активизация лейкоцитов и тромбоцитов сопровождается увеличением продукции C3bBb-конвертазы, которая превращает компонент комплемента С3 в активную форму С3b. Впервые снижение уровня С3b было описано в 1980 году Monnens при ГУС, ассоциированном с диареей. На сегодняшний день депозиты иммунных комплексов, содержащие С3, и уменьшение уровня С3b в плазме выявлены у пациентов с различными формами ГУС/ТТП (ассоциированных с диареей, ГУС/ТТП взрослых), что отражает усиленное потребление компонентов комплемента в микроциркуляторном русле. В свою очередь активация системы комплемента способствует прогрессированию эндотелиальной дисфункции, процессов системного воспаления и микроангиопатии вследствие дальнейшей активации эндотелий-лейкоцитарных взаимодействий, агрегации тромбоцитов и непосредственного повреждения эндотелия под действием мембран-атакующего комплекса С5b-9 [17].
Еще в 1942 году MarkAltschule сделал вывод о том, что отложению тромбоцитарных агрегатов предшествует активация эндотелия. В свою очередь это приводит к прогрессирующему вовлечению тромбоцитов в патологический процесс. По данным Mitraetal. (1997), сыворотка пациентов с ГУТ/ТТП вызывает апоптоз эндотелиальных клеток микроциркуляторного русла почечной и мозговой ткани, однако не обладает подобным эффектов в отношении эндотелия крупных сосудов [18]. Кроме того, плазма пациентов с ТТП и спорадическим ГУС индуцирует экспрессию маркера апоптоза — Fas-лиганда (CD95) на эндотелиальных клетках почек, мозга, дермы, но не печени и легких. Исследования структуры эндотелиальных клеток с помощью электронной микроскопии при ГУС/ТТП свидетельствуют о наличии признаков апоптоза в эндотелиоцитах. Эти изменения предшествуют образованию тромбоцитарных микротромбов, что свидетельствует о первичности процессов эндотелиального повреждения в патогенезе ГУС/ТТП.
Механизмы генетической предрасположенности к развитию ГУС/ТТП
То, что ТТП/ГУС является редко встречающейся патологией и характеризуется разнообразием клинических проявлений, свидетельствует о наличии определенно приобретенных и/или генетически обусловленных механизмов, обеспечивающих развитие этой патологии. Поэтому молекулярные и генетически исследования являются ключом к разгадке патогенеза ТТП/ГУС.
Большой вклад в изучение патогенеза ТТП внесли Furlan, Tsai и Lia, выделение и описавшие ADAMTS 13. В последующих генетических исследованиях была расшифрована аминокислотная последовательность ADAMTS 13, структура гена, кодирующего этот фермент, а также открыты мутации этого гена, обуславливающие развитие дефицита ADAMTS 13. Эти исследования доказали непосредственную роль дефекта vWF-протеазы в патогенезе семейных форм ТТП.
VWF-протеаза представляет собой протеин молекулярной массой 180 кДа, расщепляющий высокомолекулярные комплексы vWF в позиции 842 Тир-843 Мет. ADAMTS 13 относится к семейству цинк-зависимых протеаз. Ген ADAMTS 13 локализуется в хромосоме 9q34. Ген vWF-протеазы состоит из 29 экзонов и кодирует полипептидный предшественник ADAMTS 13 [19]. Ген ADAMTS 13 экспрессируется синусоидными эндотелиоцитами печени, а также в плаценте, скелетной мускулатуре, опухолевых клетках. Металлопротеаза является кальций- и цинк-зависимой и ингибируется в присутствии хелатообразующих соединений (ЭДТА). Активация ADAMTS 13 происходит под действием гемодинамического стресса.
ADAMTS 13 включает в свой состав сигнальный пептид (S), пропепетид (Р), металлопротеазный домен, дизинтегриновый домен (dis), 8 тромбоспондиновых домена типа 1, домен с высоким содержанием цистеина (cys), 2 домена cub[19, 20] (рис. 2).
Рисунок 2.
Структура ADAMTS 13
Генетические исследования свидетельствуют о гетерогенности мутаций гена ADAMTS 13. На сегодня известно 75 видов мутаций гена ADAMTS 13, которые могут обуславливать дефицит vWF-протеазы различной степени выраженности. Так, выраженный дефицит ADAMTS 13 развивается только при гомозиготной или двух гетерозиготных мутациях гена, тогда как при гетерезиготной форме активность протеазы снижается на 50%. В связи с тем, что дефицит ADAMTS 13 может обуславливать формирование субклинической формы ТТП, распространенность ТТП может быть гораздо больше, чем предполагалось ранее. Диагностирование мутации ADAMTS 13 при наличии субклинической ТТП позволит выделить пациентов из группы риска развития ТТП. У таких пациентов с целью профилактики ТТП возможно применение свежезамороженной плазмы при инфекциях, хирургических вмешательствах и других стрессовых ситуациях, способных спровоцировать развитие системного воспалительного ответа и ТТП. Furlan et al. (2003) установили, что для обеспечения деградации мультимеров vWF и предотвращения спонтанной активации тромбоцитов и развития тромбозов достаточной оказывается даже 5%-ная активность vWF-протеазы [13]. Так, точечная мутация, приводящая к замене Pro475Ser в vWF-протеазе, обуславливает снижение активности этого фермента до 5% и выявляется у 5% популяции японцев [21]. Недодиагностированными могут быть также и приобретенные формы ТТП, т.к. аутоантитела к vWF-протеазы выявляются только в острую фазу заболевания.
Причина, по которой у одних пациентов с выраженным дефицитом vWF-протеазы клинические проявления развиваются в первые годы жизни, в то время как другие пациенты могут в течение долгих лет не иметь никаких симптомов заболевания, остается неизвестной. Не до конца понятно также почему, у пациентов, перенесших первый эпизод ТТП, появляется склонность к хроническому рецидивирующему течению заболевания. Интересно, что у двух женщин с наследственным дефектом vWF-протеазы первый эпизод ТТП развился во время беременности. У этих женщин в последствие наблюдались неоднократные рецидивы заболевания. В то же время их родные братья, возраст которых на момент обследования составлял, соответственно, 27 и 44 года и у которых также наблюдался выраженный дефицит vWF-протеазы, никогда не страдали ТТП [22].
Остается также неясным, почему у ряда пациентов с ТТП значительного снижения активности ADAMTS 13 выявлено не было. По данным регистра ТТП/ГУС Оклахомы, у 16 из 48 с идиопатической формой ТТП был выявлен значительный дефицит активности ADAMTS 13, тогда как у 32 пациентов активность металлопротеазы была снижена лишь умеренно [23]. При этом между этими двумя группами не было выявлено разницы в лабораторных, клинических показателях, ответе на лечение и исходах заболевания, за исключением более выраженной почечной недостаточности и большей частоте рецидивов у больных с выраженным дефицитом активности ADAMTS 13. По данным Raifeetal. (2001), приблизительно у 40% пациентов с ТТП обнаруживается нормальный уровень vWF-протеазы [6]. В связи с этим на сегодняшний день выделяют идиопатическую форму ТТП с тяжелым дефицитом ADAMTS 13 и с субнормальным уровнем vWF-протеазы. Антитела IgG (преимущественно антитела выявляются у 44-94% пациентов с приобретенной формой заболевания. Их уровень обычно возрастает в острый период или во время рецидива ТТП, тогда как в период ремиссии антитела к ADAMTS 13 в плазме крови у таких больных могут не выявляться. Постоянное обнаружение антител более характерно для больных с частыми рецидивами заболевания, для которых также характерно выявление выраженного дефицита ADAMTS 13. Причинами такого транзиторного выявления антител к ADAMTS 13 может быть, с одной стороны, недостаточная чувствительность доступных в настоящее время диагностических методик, а с другой, может объясняться дефектами иммунной регуляции, на фоне которых возможно возникновение интермиттирующего дефицита ADAMTS 13 под действием различных провоцирующих факторов (беременность, инфекционные заболевания).
Необходимо также исследовать возможность генетической предрасположенности к развитию аутоиммунной ТТП. Так, Studt et al. (2004) описали двух девочек-близнецов с ТТП, у которых были выявлены антитела к ADAMTS 13 [24].
Данные последних исследований свидетельствуют о важной роли системы тромбомодулин/протеин С в патогенезе ТТП/ГУС. У таких пациентов выявляется снижение уровня протеинов S и C. Интересно, что, по данным Raifeetal. (2001), в европейской популяции частота мутации фактора VLeiden при тромботической микроангиопатии в 12 раз превышает таковую у контрольной группы [6]. Причем, такое повышение частоты мутации Лейдена выявляется только у пациентов с нормальной активностью ADAMTS 13. Эти данные свидетельствуют о важной роли генетических тромбофилий в патогенезе тромботической микроангиопатии. Это гипотезу подтверждают также случаи развития ТТП/ГУС у пациентов с приобретенными аномалиями системы гемостаза (при антифосфолидном синдроме). Так, антифосфолипидные антитела препятствуют инактивации фактора Va под действием протеина С, что, возможно, отражает единый патогенетический механизм развития тромботической микроангиопатии при АФС и при мутации FVLeiden.
Как при ГУС, так и ТТП выявляется снижение активности фибринолиза. Одним из механизмов такого явления может быть отсутствие активации фибринолиза с связи с дефицитом активности системы тромбомодулин/протеин С [25]. Активность фибринолической системы зависит от содержания тромбомодулина, которое неодинаково в различных органах. Интересно, что более низкий уровень экспрессии томбодулина наблюдается в почках и головном мозге, что возможно обуславливает преимущественное вовлечение этих органов в патологический процесс при ТТП/ГУС.
Важно отметить, что лишь у небольшого процента людей с генетическими дефектами системы гемостаза наблюдается развитие ТТП/ГУС, что свидетельствует о мультифакториальном характере этого патологического процесса.
Лабораторная диагностика ГУС/ТТП
Amorosi и Ultmann проанализировали 271 случай ТТП в период с 1925 по 1964 год. Эффективного лечения ТТП в то время не существовало, и смертность достигала 90%.
Rudolfi и Bell проанализировали еще 375 случаев в период с 1964 по 1980 год. В это время терапия свежезамороженной плазмой стала активно внедряться в клиническую практику, и смертность среди пациентов с ТТП снизилась до 54%. Подозрения на ТТП требует незамедлительной терапии. Понятно, что дожидаться развития всех характерных признаков ТТП нецелесообразно. Это привело к изменению критериев диагностики ТТП, которые теперь включали тромбоцитопению и микроангипатическую анемию. При проведении рандомизированного клинического испытания, включавшего 102 пациентов в период с 1982 по 1989 год, по сравнению эффективности применения свежезамороженной плазмы или обменного переливания плазмы в качестве единственных критериев ТТП были окончательно установлены тромбоцитопения и микроангиопатическая анемия. В связи со все более успешной терапией ТТП развитие неврологической симптоматики, почечной недостаточности, лихорадки наблюдается в редких случаях. Так, по данным Rocketal. (1991), в группе пациентов, у которых применялся плазмаферез с заменным переливанием плазмы, летальный исход наблюдался только в 4% случаев [27].
Таким образом, типичными лабораторными проявлениями ГУТ/ТТП является тромбоцитопения и гемолитическая анемия [22]. В большинстве случаев выявляется тяжелая тромбоцитопения ( 9 /мл). Время жизни тромбоцитов укорочено, что свидетельствует об их ускоренном разрушении в микроциркуляторном русле. В крови могут обнаруживаться предшественники тромбоцитов, что является признаком вторичной активации тромбоцитопоэза. Заболевание характеризуется тяжелой анемией. В 99% случаев концентрация гемоглобина ниже 10 мг/дл, а в 40% — менее 6,5 мг/дл.
Характерно увеличение содержания ЛДГ в сыворотке, что обусловлено активацией гемолиза, а также является признаком тканевой ишемии. Другими признаками гемолиза и перераздражения эритроцитарного ростка служат повышение билирубина (преимущественно непрямого), количества свободного гемоглобина и ретикулоцитов в периферической крови. Характерными признаками микроангиопатической природы гемолиза является обнаружение фрагментов эритроцитов — шистоцитов и отрицательная реакция Кумбса (за исключением ГУС, ассоциированного с S. pneumoniae). Причиной образования шистоцитов является резкое сужение сосудов, создающих условия для гемодинамического стресса, обуславливающего фрагментацию эритроцитов.
На начальных стадиях при ТТП в коагулограмме изменений обычно не выявляется. При прогрессировании патологического процесса и развития значительного некроза тканей вторично развивается ДВС-синдром. Гиперактивация процессов коагуляции в этом случае связана со значительной экспозицией тканевого фактора на поврежденных клетках различных тканей и связыванием с ним фактора VIIa. Лабораторно выявляется повышение уровней D-димера, удлинение АЧТВ и протромбинового времени, снижение уровней фибриногена [28].
Диагностические подходы, используемые при тромботической микроангиопатии, описаны в табл. 2.
Таблица 2.
Диагностические подходы, используемые при тромботической микроангиопатии