Триперекись ацетона что это
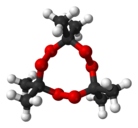
C 9 H 18 O 6 (тример)
C 12 H 24 O 8 (тетрамер)
222,24 г / моль (тример)
91 ° C (тример)
17 384 фут / с
3,29 миль в секунду
СОДЕРЖАНИЕ
История
Работа над этой методологией и над различными полученными продуктами была дополнительно исследована в середине 20 века Миласом и Голубовичем.
Химия
Продукт, полученный с использованием соляной кислоты, считается более стабильным, чем продукт, полученный с использованием серной кислоты. Известно, что следы серной кислоты, захваченные внутри образовавшихся кристаллов пероксида ацетона, приводят к нестабильности. Фактически, захваченная серная кислота может вызывать детонацию при температурах до 50 ° C (122 ° F), это наиболее вероятный механизм случайных взрывов пероксида ацетона, которые происходят во время сушки на нагретых поверхностях.
Трипероксид триацетона образуется в 2-пропаноле при длительном стоянии на воздухе.
Для анализа следов ТАТФ можно использовать несколько методов, включая газовую хроматографию / масс-спектрометрию (ГХ / МС), высокоэффективную жидкостную хроматографию / масс-спектрометрию (ВЭЖХ / МС) и ВЭЖХ с дериватизацией после колонки.
Пероксид ацетона растворим в толуоле, хлороформе, ацетоне, дихлорметане и метаноле. Перекристаллизация первичных взрывчатых веществ может давать большие кристаллы, которые самопроизвольно взрываются из-за внутренней деформации.
Промышленное использование
Перекись ацетона используется в качестве отбеливателя муки для отбеливания и «зрелой» муки.
Использование в самодельных взрывных устройствах
Избыточное давление ударной волны ТАТФ составляет 70% от давления ТНТ, импульс положительной фазы составляет 55% от эквивалента ТНТ. ТАТФ при 0,4 г / см 3 имеет примерно одну треть бризантности TNT (1,2 г / см 3 ), измеренной с помощью теста Гесса.
В Европейском Союзе приняты законодательные меры по ограничению продажи концентрированной перекиси водорода до 12% и выше.
Пищевая добавка Е 929: изготовление и распространение карается Уголовным кодексом
Перекись ацетона, как и все пероксиды, обладает высокими отбеливающими и окислительными свойствами.
Вещество зарегистрировано в качестве пищевой добавки для улучшения муки и хлеба.
Опасность при работе с взрывоопасным продуктом заставило исключить его из разрешающих документов.
Название продукта
Перекись ацетона — официальное наименование добавки. В европейской кодификации продукт зарегистрирован под номером Е 929 (Е–929).
Международное название — Acetone Peroxide.
Тип вещества

Вещество представляет собой органический пероксид.
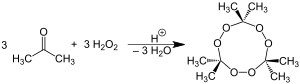
Получают продукт в процессе взаимодействия ацетона с концентрированным пероксидом водорода. Реакция протекает в присутствии минеральной одноосновной кислоты: серной (чаще всего), азотной, соляной. Молекула содержит обычно 2 или 3 пероксидные группы. Легче получить триперекись ацетона, но и она будет содержать димер в качестве примеси.
Свойства
| Показатель | Стандартные значения |
| Цвет | белый |
| Состав | перекись ацетона, эмпирическая формула C6H12O4 |
| Внешний вид | мелкодисперсный порошок, после длительного хранения — кристаллы правильной формы |
| Запах | резкий характерный |
| Вкус | без вкуса |
| Содержание основного вещества | 96% |
| Растворимость | хорошо в эфире, бензоле, ацетоне, уксусной кислоте. Нерастворим в воде |
| Плотность вещества | 1,3 г/см³ |
| Другие | не гигроскопична; при обычных условиях хранения не разлагается; обладает повышенной летучестью, при комнатной температуре испаряется в течение 2 часов; при нагревании с раствором серной кислоты распадается до ацетона и перекиси водорода; устойчива в кислотных и щелочных растворах; не корродирует металлы (исключение — свинец); проявляет окислительные свойства; плавится при температуре 97ºC. Взрывоопасна! |
Упаковка
Добавка Е 929 — взрывчатое вещество, относится к категории опасных грузов. Расфасовка продукта должна осуществляться в тару, устойчивую к вибрации, изменению температуры, давления и влажности. Обычно с этой целью используют металлические барабаны или бочки.
Применение
Добавка E 929 запрещена в производстве пищевых продуктов. Несколько лет назад перекись ацетона применялась некоторыми странами (например, Канадой) для отбеливания и улучшения качества хлебопекарной муки.

В настоящее время перекись ацетона не имеет промышленного применения ни в одной стране мира.
Ограниченно продукт разрешено использовать в химической отрасли при синтезе полимеров. Добавка Е 929 выступает катализатором свободнорадикальной полимеризации.
Благодаря простоте получения и доступности компонентов перекись ацетона нередко используют химики-любители для изготовления петард в домашних условиях.
Следует знать! В России производство, хранение, распространение перекиси ацетона, как и других взрывчатых веществ, запрещено и карается ст. 222, 223.1 УК.
Польза и вред
Исследования влияния добавки E 929 на здоровье человека при попадании вещества внутрь не проводили.

Работа с веществом без специальных навыков может иметь трагические последствия. Перекись ацетона отличается высокой взрывчатой силой: 5500 кДж/кг (это почти на 20% выше того же показателя для тринитротолуола, входящего в состав динамита).
Сухой порошок может сдетонировать при легком нагреве (например, при сушке на батарее отопления) или от искры статического электричества, образующего на одежде.
В расплавленном виде перекись ацетона чувствительная к трению: для сильного взрыва достаточно поскрести вещество ногтем.
Альгинат калия (Е402) редко используется в пищевой промышленности, в основном его применяют в косметологии.
На данный момент силикат цинка запрещено использовать в производстве пищевых продуктов. С чем это связано, читайте в нашей статье.
В каких сферах применяется карбамид? Об этом мы рассказали здесь.
Основные производители

В России небольшие объемы продукта китайского производства строго для химической промышленности предлагает компания «ЮгТехКом» (город Краснодар).
Пероксид ацетона
Пероксид ацетона или перекись ацетона — инициирующее взрывчатое вещество, впервые полученное Рихардом Вольфенштейном в 1895 году.




История
Первые эксперименты по получению пероксидов ацетона были проведены Вольфенштейном в 1895 году, когда он изучал действие пероксида водорода на кониин в ацетоновом растворе, полагая, что ацетон и пероксид водорода не взаимодействуют. Вольфенштейн обнаружил, что из смеси равных объёмов ацетона и 10%-го пероксида водорода выпадают кристаллы, которые он охарактеризовал как тримерный пероксид ацетона (триперекись ацетона 2). Также он заметил, что реакция происходит быстрее при добавлении малых количеств фосфорной кислоты.
В 1899 году Адольф Байер и Виктор Виллигер синтезировали также димерный пероксид ацетона (диперекись ацетона 1). В 1933 году Лекок наблюдал процесс деполимеризации трипероксида ацетона при определении его молекулярной массы методом криоскопии, а также при плавлении. В 1947 году изучалось влияние кислот на образование пероксидов ацетона, в частности, было замечено, что серная, соляная, фосфорная и азотная кислоты значительно ускоряют окисление ацетона пероксидом водорода, а в присутствии органических кислот (уксусной, бензойной) образования продукта не происходит.
К настоящему времени получены пероксиды ацетона четырёх структур.
Получение
Димерный пероксид ацетона (диперекись ацетона, 1) получают с выходом 94 % при обработке ацетона 86%-ным пероксидом водорода в ацетонитриле в присутствии серной кислоты при пониженной температуре. Другим способом синтеза диперекиси ацетона является реакция ацетона с персульфатом калия в разбавленной серной кислоте. Тримерный пероксид ацетона (триперекись ацетона, 2) образуется в данных реакциях как примесь. Для препаративного получения данного продукта применяют реакцию ацетона с эквивалентным количеством 50%-ной перекиси водорода и 0,25 эквивалентами серной кислоты. Триперекись ацетона можно очистить низкотемпературной перекристаллизацией из пентана. При этом она кристаллизуется в виде длинных плоских призмовидных кристаллов.
Пероксиды 3 и 4 могут быть получены в данных реакциях при отсутствии минеральной кислоты. Например, смесь ацетона и 50%-ной перекиси водорода при перемешивании в течение трёх часов при 0 °С даёт исключительно 2,2-бис(гидроперокси)пропан 3. Увеличение времени реакции приводит к образованию продукта 4.
Физические свойства
Трипероксид ацетона легко воспламеняется :
Он растворим в этаноле (0,15 г / 100 г при +17 °С), диэтиловом эфире (5,5), петролейном эфире (7,35), ацетоне (9,15), сероуглероде (9,97), пиридине (15,4), бензоле (18,0), трихлорэтилене (22,7), четырёххлористом углероде (24,8), хлороформе (42,5), но нерастворим в воде.
Химические свойства
При нагревании с разбавленной серной кислотой пероксид ацетона количественно гидролизуется с образованием ацетона и пероксида водорода:
Миллиграммовые количества дипероксида и трипероксида ацетона в течение 15 минут разлагаются сильными кислотами (например, серной кислотой или метансульфокислотой). Поскольку реакция экзотермична, действие сильных кислот на граммовые количества вызывает детонацию. Также трипероксид ацетона эффективно разрушается хлоридом олова(II).
При получении с использованием метансульфокислоты, хлорной или серной кислоты трипероксид ацетона самопроизвольно превращается в дипероксид ацетона. Однако при использовании хлорида олова(IV), соляной или азотной кислоты он остаётся стабильным.
Использование в качестве взрывчатого вещества
В военных целях пероксид ацетона не используется из-за высокой летучести и чувствительности, однако, c 1980-x годов применяется в террористических целях как инициирующее или основное взрывчатое вещество. Также существуют упоминания о применении пероксида ацетона в диверсионной практике советских разведчиков первой половины 20 века как импровизированного взрывчатого вещества, которое можно легко сделать из подручных химикатов:
«Мало кому из людей «мирных профессий» известно, что самые банальные «химикалии» могут стать иногда грозными разрушителями. Ацетон продаётся в аптеках для удаления с ногтей старого лака. Перекись водорода — для корректуры природного цвета женских волос. Соляная кислота идёт на балансирование желудка и для пайки металлов. Но не рекомендуется смешивать вместе эти три вещества. Получающийся от смеси белый порошок является сильнейшей взрывчаткой».
Использование террористами связано с простотой синтеза, а также с тем, что в молекуле данного вещества отсутствует азот, что делает невозможным определение взрывающего устройства стандартными устройствами, отвечающими на азот. Трипероксид ацетона обладает примерно такой же взрывной силой, как тротил. Кроме того, он весьма чувствителен к нагреванию и удару и может воспламеняться под действием открытого пламени и электрического разряда, что делает сам процесс создания взрывающих устройств опасным (по этой причине трипероксид ацетона получил название «Мать Сатаны»).
The Times сообщает, что через несколько дней после теракта в Манчестере (теракт произошёл в ночь на 23 мая 2017 года) в открытом доступе в социальной сети Facebook и на YouTube находились пошаговые инструкции по изготовлению взрывных устройств на основе пероксида ацетона, вещества, которое использовал Абеди для совершения теракта.
Сообщается, что данное вещество детонирует даже при содержании воды до 25 %. К удару перекись ацетона чуть менее чувствительна, чем азид свинца. По бризантности она превосходит азид свинца и гремучую ртуть.
При взрыве пероксида ацетона происходит резкое образование большого объёма газов: из его одной молекулы образуются три молекулы ацетона и одна молекула озона. Приводят также и другое уравнение разложения:
Скорость детонации трипероксида ацетона составляет 5300 м/с при плотности 1,2 г/см³ и около 1430 м/с при 0,47 г/см³. В диапазоне плотностей от 0,35 до 1,2 г/см³ эта зависимость линейна и подчиняется уравнению
.
Теплота взрыва составляет 2803 кДж/кг, что составляет 67 % от тротилового эквивалента (4.19 МДж/кг)
Использование в качестве пищевой добавки
Пероксид ацетона является пищевой добавкой, которой присвоено обозначение E929. Он улучшает качество мучных изделий. Однако, по состоянию на 2017 год пероксид ацетона практически не используется с этой целью, вместо него применяются другие улучшители.
Обнаружение
Трипероксид и дипероксид ацетона можно обнаружить или проанализировать методом тонкослойной хроматографии на силикагеле (элюент: толуол, Rf 0,57 и 0,66 соответственно, проявка 1 % дифениламина в концентрированной серной кислоте). Подобраны также условия для анализа газовой хроматографией и масс-спектрометрией.
Триперекись ацетона что это
Что такое перекись ацетона?
Строение молекулы перекиси водорода
Перекись водорода (3% раствор)
Цистерна с перекисью водорода
Перекись водорода проявляет окислительные свойства. Некоторые горючие органические материалы (например, бумага, солома, метанол) при контакте с крепкой перекисью водорода могут воспламеняться. От действия 30% раствора перекиси водорода кожа и волосы человека становятся белыми. Разбавленные водные растворы перекиси водорода гораздо более стабильны. Трехпроцентная перекись водорода продается в аптеках как антисептик.
Другие неорганические перекиси также проявляют окислительные свойства, многие из них довольно неустойчивы и легко отщепляют кислород.
Однако, некоторые неорганические перекиси достаточно стабильны. Например, перекись натрия Na2O2 образуется при горении натрия на воздухе. Данное вещество плавится без разложения при 675°C. Более того: при нагревании оксида натрия Na2O на воздухе образуется пероксид Na2O2.
Если в перекиси водорода Н-О-О-Н заместить один или оба атома водорода на органический радикал R, то мы получим органические гидроперекиси R-О-О-Н и перекиси R-О-О-R соответственно.
Органические гидроперекиси
Органические перекиси
Органические перекиси неустойчивы и легко разлагаются, иногда разложение происходит со взрывом. Например, перекись ацетона и перекись бензоила при нагревании взрываются.
Молекулы органических перекисей способны распадаться, образуя свободные радикалы. Некоторые перекиси используют в промышленности как инициаторы радикальной полимеризации (перекись бензоила, перекись метилэтилкетона).
Органические пероксопроизводные очень разнообразны, в частности, существуют перекиси, которые являются производными карбоновых кислот RC(O)OOH (пероксокислоты или надкислоты), сложных эфиров RC(O)OOR, альдегидов.
Пероксокислоты (надкислоты)
Пероксопроизводные сложных эфиров
Диперекись и триперекись ацетона
В большинстве случаев при осаждении из водных растворов образуется триперекись ацетона, однако, нельзя исключить, что она не содержит примеси диперекиси. Диперекись ацетона получить гораздо сложнее, чем триперекись: для этого необходимо проводить синтез в строго определенных условиях (методика получения диперекиси изложена в приложении ко второй части статьи, однако она дается в основном для ознакомления).
Есть также сообщение о получении тетраперекиси ацетона (ссылка), однако относиться к таким статьям следует с большой осторожностью: много подобных открытий было со временем опровергнуто.
Перекись ацетона представляет собой белое кристаллическое вещество. Практически нерастворима в воде, растворима в ацетоне, эфире. Температура плавления триперекиси 97 °C, диперекиси 132 °C. Даже при комнатной температуре перекись ацетона легко сублимируется.
С другой стороны, перекись ацетона окружена своеобразным ореолом таинственности, в результате находится немало молодых людей, которые хотят познакомиться с этим веществом поближе, не всегда осознавая опасности.
C 9 H 18 O 6 (тример)
C 12 H 24 O 8 (тетрамер)
222,24 г / моль (тример)
91 ° C (тример)
17 384 фут / с
3,29 миль в секунду
СОДЕРЖАНИЕ
История
Работа над этой методологией и над различными полученными продуктами была дополнительно исследована в середине 20 века Миласом и Голубовичем.
Химия
Продукт, полученный с использованием соляной кислоты, считается более стабильным, чем продукт, полученный с использованием серной кислоты. Известно, что следы серной кислоты, захваченные внутри образовавшихся кристаллов пероксида ацетона, приводят к нестабильности. Фактически, захваченная серная кислота может вызывать детонацию при температурах до 50 ° C (122 ° F), это наиболее вероятный механизм случайных взрывов пероксида ацетона, которые происходят во время сушки на нагретых поверхностях.
Трипероксид триацетона образуется в 2-пропаноле при длительном стоянии на воздухе.
Для анализа следов ТАТФ можно использовать несколько методов, включая газовую хроматографию / масс-спектрометрию (ГХ / МС), высокоэффективную жидкостную хроматографию / масс-спектрометрию (ВЭЖХ / МС) и ВЭЖХ с дериватизацией после колонки.
Пероксид ацетона растворим в толуоле, хлороформе, ацетоне, дихлорметане и метаноле. Перекристаллизация первичных взрывчатых веществ может давать большие кристаллы, которые самопроизвольно взрываются из-за внутренней деформации.
Промышленное использование
Перекись ацетона используется в качестве отбеливателя муки для отбеливания и «зрелой» муки.
Использование в самодельных взрывных устройствах
Избыточное давление ударной волны ТАТФ составляет 70% от давления ТНТ, импульс положительной фазы составляет 55% от эквивалента ТНТ. ТАТФ при 0,4 г / см 3 имеет примерно одну треть бризантности TNT (1,2 г / см 3 ), измеренной с помощью теста Гесса.
В Европейском Союзе приняты законодательные меры по ограничению продажи концентрированной перекиси водорода до 12% и выше.



 Альгинат калия (Е402) редко используется в пищевой промышленности, в основном его применяют в косметологии.
Альгинат калия (Е402) редко используется в пищевой промышленности, в основном его применяют в косметологии.
