Трикуспидальная регургитация что это при беременности не определяется
Регургитация на трехстворчатом клапане
Трехстворчатая регургитация — это утечка крови в обратном направлении через трехстворчатый клапан каждый раз во время сокращения правого желудочка. Трехстворчатый клапан находится в отверстии между правым предсердием и правым желудочком.
Трехстворчатый клапан открывается, пропуская кровь из правого предсердия в правый желудочек, и закрывается при сокращении правого желудочка, выталкивающего кровь в легкие. Если трехстворчатый клапан смыкается не полностью, часть крови проникает назад в правое предсердие — так называемая регургитация.
Недостаточность трехстворчатого клапана может быть первичной и вторичной (наиболее распространенная).
Причины
Симптомы
Диагностика
Диагноз основывается на анамнезе, результатах медицинского осмотра, и результатах обследования. С целью уточнения диагноза врач может назначить следующие виды обследования:
Лечение
Легкая степень недостаточности трехстворчатого клапана практически не требует лечения. Однако заболевание, ставшее ее причиной, например, эмфизема, легочная гипертензия, стеноз легочного ствола или заболевания левой половины сердца могут потребовать лечения. Также необходимо лечение мерцательной аритмии и сердечной недостаточности.
Лечение зависит от причины и симптомов болезни, тяжести течения, а также наличия сопутствующих заболеваний и медикаментозной терапии, получаемой по сопутствующей патологии. С учетом этого врач может назначить:
Структурно-функциональные изменения сердца при беременности у женщин с сердечно-сосудистыми заболеваниями

У здоровой женщины при нормально протекающей беременности структурно-функциональные изменения сердца носят адаптивный характер, выражены незначительно и полностью нормализуются после родов.
Abstract. In a healthy woman with a normal pregnancy, structural and functional changes in the heart are adaptive in nature, are slight and are completely normalized after childbirth. A pregnant woman with heart diseases has reduced adaptive capacity, therefore, at any stage of pregnancy, pathological changes can occur that complicate its course and lead to adverse outcomes. In addition, any pregnancy may develop new heart diseases, which can be fatal. That is why an echocardiographic assessment of structural and functional changes in the heart is necessary both during normal pregnancy and in the background of concomitant cardiovascular diseases. For citation: Arakelyants A. A., Morozova T. E., Barabanova E. A., Samokhina E. O. Structural and functional heart features in pregnancy with concomitant cardiovascular diseases // Lechaschy Vrach. 2021; 7 (24): 18-23. DOI: 10.51793/OS.2021.24.7.004
Резюме. У здоровой женщины при нормально протекающей беременности структурно-функциональные изменения сердца носят адаптивный характер, выражены незначительно и полностью нормализуются после родов. У беременной с теми или иными заболеваниями сердца адаптационные возможности снижены, поэтому на любом этапе беременности могут возникать патологические изменения, осложняющие ее течение и приводящие к неблагоприятным исходам. Кроме того, при любой беременности возможно развитие новых заболеваний сердца, которые могут быть фатальными. Вот почему эхокардиографическая оценка структурно-функциональных изменений сердца является необходимой как при нормальной беременности, так и на фоне сопутствующих сердечно-сосудистых заболеваний.
Важное значение эхокардиографии (ЭхоКГ) в обследовании беременных для выявления структурно-функциональных изменений сердца сегодня не вызывает сомнений, а ее место определено рядом современных клинических рекомендаций. Так, в 2018 г. были опубликованы пересмотренные рекомендации Европейского общества кардиологов (ESC) по ведению пациенток с сердечно-сосудистыми заболеваниями (ССЗ) во время беременности [1], в которых подтверждены, а также уточнены основные положения по применению ЭхоКГ в этой группе женщин. Чуть раньше были утверждены российские национальные рекомендации «Диагностика и лечение сердечно-сосудистых заболеваний при беременности» [2], обобщившие отечественные и наиболее значимые зарубежные клинические рекомендации за 2011-2017 гг. Кроме того, в последние годы вышли системные обзоры и метаанализы, посвященные внутрисердечной гемодинамике, ремоделированию сердца, сердечно-сосудистой патологии у беременных, в той или иной мере рассматривающие вопросы, связанные с анализом и интерпретацией данных, получаемых при ЭхоКГ. В связи с этим целью данной статьи является рассмотрение ключевых моментов, знание которых необходимо врачам так называемой «мультидисциплинарной команды» (кардиолог, акушер-гинеколог, анестезиолог-реаниматолог и другие привлекаемые специалисты) для оценки состояния сердца при планировании, во время и после беременности.
Определение сердечно-сосудистого риска при планировании беременности
На сегодня, по данным статистики здравоохранения и исходя из клинической практики, установлено, что в целом сердечно-сосудистая патология выявляется не менее чем у 10% беременных и стойко занимает второе, после анемии, место среди экстрагенитальной патологии [2, 3]. Это артериальная гипертония (АГ), врожденные и приобретенные пороки сердца (ВПС и ППС соответственно), нарушения ритма сердца, кардиомиопатии и некоторые другие заболевания. Характер болезни и функциональное состояние сердца определяют течение беременности, риск осложнений, а иногда и противопоказания для беременности. В связи с этим при планировании беременности целесообразна оценка сердечно-сосудистого материнского риска.
Определение риска у женщин детородного возраста с ССЗ следует проводить по модифицированной классификации Всемирной организации здравоохранения (ВОЗ) (табл. 1) [1]. Наряду с этим риск следует уточнить по наличию предикторов осложнений, значение которых было доказано в исследованиях CARPREG, ZAHARA и ROPAC. Данные предикторы риска осложнений у матери с кардиоваскулярной патологией изложены в табл. 2.
Как видно из приведенных таблиц, и классификация ВОЗ, и перечень предикторов осложнений в значительной степени базируются на выявляемых и рассчитываемых при ЭхоКГ структурно-морфологических признаках поражения сердца и аорты, дисфункции желудочков, давления в легочной артерии. Так, например, при болезнях аорты (в эту группу включают бикуспидальный аортальный клапан, синдромы Марфана, Элерса–Данлоса и другие) при отсутствии ее дилатации материнский риск считают низким, но его оценивают как очень высокий при дилатации свыше 45-50 мм в зависимости от патологии. По совокупности признаков, указывающих на возможность диссекции аорты, беременность противопоказана. Такое же значение имеют количественные ЭхоКГ-показатели, такие как фракция выброса левого желудочка (ФВЛЖ), площадь клапанного отверстия.
Риск оценивают не только перед первой, но и каждой последующей беременностью. Необходимость переоценки понятна, так как состояние сердца может измениться и во время наступившей беременности, и после нее в силу разных обстоятельств.
Структурно-функциональные изменения сердца при нормально протекающей беременности
Первое ЭхоКГ-обследование беременной обычно проводят при сроке 12 недель и в последующих триместрах повторяют по мере необходимости при наличии показаний [2].
Во время беременности у здоровой женщины объем жидкости увеличивается на 40-100%, а объем циркулирующей крови – на 30-50%, что неизбежно приводит к увеличению преднагрузки [4]. Первые изменения можно определить при ЭхоКГ уже на 5-й неделе гестации, когда определяется увеличение ударного объема, сердечного выброса в среднем на 20%. К 20-й неделе гестации сдвиги увеличиваются, и прирост этих показателей может быть на 30–50% выше по сравнению с начальными. К концу I триместра отчетливо регистрируется увеличение размеров левого предсердия, к концу II триместра – возможно увеличение размеров и объемов левого желудочка, которые постепенно увеличиваются вплоть до родов [5]. В III триместре увеличивается индекс сферичности ЛЖ. При сравнении показателей в наибольшей степени увеличиваются объемы ЛЖ – на 30-50%, в меньшей степени его размеры – в среднем на 11% [5]. При этом они не выходят за пределы общепринятой нормы.
В эти же сроки описывается «физиологическая гипертрофия беременных» (pregnancy-induced hypertrophy), при которой увеличивается толщина стенок ЛЖ и масса миокарда. Максимальная масса миокарда определяется в III триместре беременности. Общий прирост массы миокарда иногда составляет до 70-80% по отношению к исходной [6, 7]. Важно, что нарушений функции сердца при этом не возникает.
В I триместре допплерография может выявлять увеличение скорости раннего диастолического наполнения (Ve) и снижение скорости кровотока в систолу предсердий (Va) трансмитрального диастолического потока. В конце II и III триместре возрастает вклад сокращения левого предсердия в наполнение левого желудочка, что отражается в увеличении скорости Va и, соответственно, относительном снижении отношения E/A. Удлиняется время изоволюметрического сокращения (IVRT) и время замедления потока (DT), но время ускорения (AT) остается стабильным [7]. В I триместре немного нарастает скорость систолического и одновременно снижается скорость диастолического кровотока в легочных венах. Важно, что эти изменения происходят у беременных с нормальным АД или незначительно повышенным диастолическим АД вследствие экспрессии фетальных генов, физиологических гормональных сдвигов. Описано снижение систолической продольной деформации базальных, срединных и апикальных сегментов левого желудочка и систолической деформации правого желудочка, которые выявляются при более углубленном исследовании с использованием режимов strain, strain-rate. Вместе с этим никаких существенных изменений радиальной и циркулярной деформации желудочков не регистрируют [8]. Следует отметить, что снижение это незначительно, кратковременно, не сопровождается какими-либо клиническими симптомами и самопроизвольно проходит без лечения.
Систолическое давление в легочной артерии увеличивается иногда до 40 мм рт. ст. Немного, на 2-3 мм, увеличивается размер корня аорты. Возможно появление митральной и трикуспидальной регургитации 1-2 степени [1].
Все эти изменения обратимы. Полная нормализация отмечается к 3-6 месяцам после родоразрешения. Описаны наблюдения, в которых восстановление регистрировалось только через 1 год.
Сердечная гемодинамика при многоплодной беременности
Сердечная гемодинамика при одноплодной и многоплодной беременности имеет ряд отличий. Это связано с более высокими показателями уровней периферического сосудистого сопротивления артериальному кровотоку в плодово-плацентарной циркуляции, что можно рассматривать как адаптационную реакцию в условиях ее повышенного функционального напряжения при многоплодии. Если в I триместре беременности показатели маточно-плацентарной гемодинамики при многоплодной и одноплодной беременностях существенно не различаются, то в дальнейшем происходит интенсивное снижение сосудистой резистентности кровотока в маточных артериях, что приводит к изменению гемодинамических показателей, которые в большей степени выражены при многоплодной беременности. Так, масса ЛЖ при беременности увеличивается примерно на 50% из-за увеличения конечно-диастолического и конечно-систолического его размера.
При многоплодной беременности объем циркулирующей крови стремительно нарастает во II-III триместрах беременности и к 34-й неделе увеличивается на 50-70% от исходных значений. Подобные изменения ведут к значительному увеличению работы сердца, при этом ударный объем сердца увеличивается более чем на 30%, частота сердечных сокращений возрастает на 15-20%, а общее периферическое сопротивление уменьшается примерно на 25%.
Беременные с артериальной гипертензией
Выделяют следующие клинические варианты АГ при беременности:
Определение или уточнение поражения сердца как органа-мишени при АГ, то есть выявление гипертрофии ЛЖ в совокупности с оценкой систолической и диастолической функции миокарда, являются первоочередными задачами ЭхоКГ при ведении больных с АГ и необходимы для получения дополнительной информации о прогнозе и риске. При выявлении гипертрофии необходимо проводить дифференциальный диагноз с физиологической гипертрофией миокарда (pregnancy-induced hypertrophy), которая выявляется со II триместра, и эта гипертрофия носит, как правило, концентрический характер. Кроме того, данные ряда исследований демонстрируют, что во время беременности, осложненной гипертонией, масса миокарда левого желудочка и относительная толщина стенок увеличиваются больше, чем во время нормотензивной беременности [9].
Перипартальная кардиомиопатия
Заболевание, которое возникает исключительно во время беременности или в послеродовом периоде (в интервале между последними месяцами беременности и сроком до 5 месяцев после родов). Данные о ее частоте противоречивы: от 1 случая на 3000-4000 беременностей до 1 случая на 15 000 родов [10], что, возможно, свидетельствует о трудностях диагностики. Данную патологию подозревают во всех случаях, когда у беременной появляются признаки сердечной недостаточности, нарушения ритма сердца, а также если состояние после родов медленно нормализуется. Риск возникновения перипартальной кардиомиопатии увеличен у женщин старше 30 лет при многоплодной беременности, преэклампсии, у больных с бронхиальной астмой, анемией.
ЭхоКГ имеет приоритетное значение в выявлении перипартальной кардиомиопатии. Диагноз устанавливают на основании совокупности клинических и ЭхоКГ-критериев [10, 11]:
При сниженной фракции выброса ( 2 ), то независимо от наличия симптомов нужно обсуждать возможность оперативного вмешательства до беременности, так как степень дилатации может увеличиваться и есть риск ее диссекции. Риск расслоения стенки аорты выше при синдроме Марфана, Элерса–Данлоса.
Женщинам с расширением корня аорты свыше 40 мм, дилатацией восходящей аорты рекомендовано проводить ЭхоКГ каждые 4-8 недель и через 6 месяцев после родов [17]. Нарастание размера во время беременности считают фактором риска диссекции аорты. Пациенткам с диаметром аорты более 45 мм, с синдромом Марфана, у которых диаметр аорты составляет 40-45 мм, острой или хронической расслаивающей аневризмой аорты целесообразно оперативное родоразрешение.
Заключение
Таким образом, ЭхоКГ-исследование является необходимым для оценки структурно-функционального состояния сердца во время беременности, особенно у женщин с сердечно-сосудистой патологией в анамнезе. Кратность обследования и алгоритм индивидуальны и зависят от тяжести сопутствующей патологии [18]. Правильная интерпретация полученных ЭхоКГ-изменений позволяет врачу сделать вывод о нормальном либо патологическом воздействии на сердце происходящих изменений в организме женщины. Проведение ЭхоКГ является обязательным для оценки материнского риска, определения показаний/противопоказаний к вынашиванию беременности, а также способа родоразрешения.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва, Россия
Структурно-функциональные изменения сердца при беременности у женщин с сердечно-сосудистыми заболеваниями/ А. А. Аракелянц, Т. Е. Морозова, Е. А. Барабанова, Е. О. Самохина
Для цитирования: Аракелянц А. А., Морозова Т. Е., Барабанова Е. А., Самохина Е. О. Структурно-функциональные изменения сердца при беременности у женщин с сердечно-сосудистыми заболеваниями // Лечащий Врач. 2021; 7 (24): 18-23. DOI: 10.51793/OS.2021.24.7.004
Теги: женщины, беременные, сердечно-сосудистые заболевания
ЭхоКГ и трикуспидальный клапан
Стеноз трехстворчатого клапана на ЭхоКГ
При проведении ЭхоКГ не следует упускать из виду патологию трехстворчатого клапана (ТК). Известно, что ревматический стеноз ТК подлежит хирургическому лечению. До проведения эхокардиографии приходилось оперировать таких больных только для того, что впоследствии была обнаружена данная патология и диагноз сопутствующего ревматического стеноза трикуспидального клапана не был поставлен до операции! Конструктивно трехстворчатый клапан аналогичен митральному:
Результаты эхосигнала в M-режиме и 2-D на эхокардиографии аналогичны митральному стеноза:
При ревматическом заболевании створки толстые, а их кончики сросшиеся. У карциноидного поражения кончики обычно отдельные и подвижные. При тяжелой степени трикуспидального стеноза расширены правое предсердие и нижняя полая вена.
Результаты допплерография аналогичны митральному стенозу. Транстрикуспидальный кровоток лучше всего измерять с помощью импульсной допплерографии в апикальной 4-камерной проекции с объемом пробы в правом желудочке непосредственно под трехстворчатым клапаном. При диастоле увеличивается скорость кровотока. Оценка тяжести редко требуется в клинической практике, но проводится по тем же принципам, что и для митрального стеноза (градиент диастолического давления и площадь клапана). Тяжелый трикуспидальный стеноз обычно связан с пиковым градиентом 3–10 мм рт.ст. и средним градиентом> 5 мм рт.ст. С площадью клапана ≤1,0 см2. Уравнение полупериода давления, используемое для определения митрального стеноза, является эмпирическим, и константа не должна применяться к трикуспидальному стенозу.
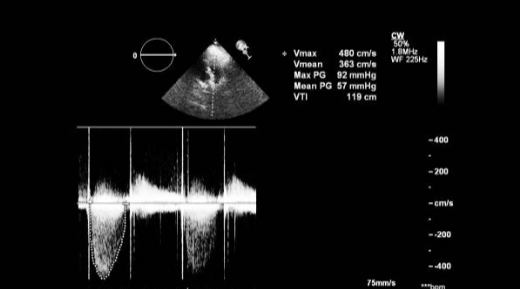
Регургитация на трикуспидальном клапане (TР)
Наиболее частые вторичные причины
Основные причины трикуспидальной регургитации, выявляемой на ЭхоКГ
Эхокардиографическая оценка тяжести TР лучше всего достигается с помощью допплера, как и с помощью МРТ. Более тяжелая трикуспидальная регургитация связана с широкой струей высокой интенсивности, заполняющей правое предсердие и связанный ретроградный систолический поток в полой вене и печеночной вене.
Трикуспидальная регургитация что это при беременности не определяется
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ СЕРДЦА, ТЕЧЕНИЕ БЕРЕМЕННОСТИ, КЛИНИЧЕСКИЕ СЛУЧАИ СОЧЕТАНИЯ КАРДИАЛЬНОЙ ПАТОЛОГИИ ПЛОДА С АНОМАЛИЯМИ ДРУГИХ ОРГАНОВ
Сердечная патология является одной из основных причин детской смертности и находится на втором месте среди причин младенческой смертности. Частота составляет 8 случаев на 1000 новорожденных [1, 2].
Неблагоприятный прогноз для жизни представляют сложные врожденные пороки сердца (ВПС). Под термином «сложный» понимают такие сердечные аномалии, как гипоплазированные камеры сердца, атрезии клапанов, аномальное отхождение магистральных сосудов, единственный желудочек, то есть изменения в сердце, при которых невозможно выполнить полную хирургическую коррекцию [3].
Критические пороки сердца, требующие хирургического вмешательства в ранний неонатальный период, составляют 25 % от всех врожденных сердечных аномалий. В первую неделю умирает 29 % новорожденных, к концу первого года жизни – 87 % [4].
Первое ультразвуковое скрининговое обследование (11–13 недель) является важным осмотром. В случае обнаружения увеличения толщины воротникового пространства, отклонения сердечной оси, рекомендуется расширенное обследование сердца (фетальная эхокардиография). При рутинном ультразвуковом исследовании лишь в 40 % выявляются пороки сердца у плодов, при том что детальный осмотр позволяет выявлять до 90 % сердечных пороков внутриутробно. Для своевременного выявления врожденных пороков сердца необходимо детально обследовать сердце плода ультразвуковым методом при втором скрининговом обследовании (18–22 недели) [5, 6].
Применяя фетальную эхокардиографию, возможно определить структуру порока и спрогнозировать исход для плода [7]. Особенно это касается сложных пороков сердца, так как имеет место позднее выявление патологии, при осмотре неонатологом в родильном доме или после выписки домой [8].
Данная тема является актуальной. Врачи пренатальной диагностики встречаются с трудностями точного определения структуры сердечных пороков, что связано с большой вариабельностью кардиальной аномалии у плодов.
Задачей врачей-гинекологов является правильная тактика ведения беременной после установки диагноза, так как своевременная хирургическая помощь спасает жизни детей и влияет на качество дальнейшей жизни.
Цель исследования: проанализировать течение беременности при выявлении кардиальной патологии у плодов, определить точность внутриутробной диагностики, описать случаи сочетания сердечных пороков с патологией развития других органов плода.
Материалы и методы исследования
В центре диагностики матери и плода «Family» г. Бишкек с января 2019 г. по ноябрь 2020 г. было осмотрено 48 беременных женщин с пороками сердца плода, требующими хирургической коррекции после рождения. Всем новорожденным было проведено эхокардиографическое обследование после родов врачами-кардиологами для уточнения структуры пороков. В случаях прерывания беременности, для подтверждения диагноза проводилось патологоанатомическое вскрытие.
Осмотр беременных выполнялся на ультразвуковых аппаратах General Electric (GE) Voluson E8 и E10, c использованием программы fetal heart. Также использовалась программа STIC (постобработка снимков, полученных в режиме объемного сканирования), основным являлся двумерный режим с цветовым и импульсным доплеровским картированием. У всех пациентов было получено информированное согласие на участие в нашем исследовании. Результаты были обработаны путем вычисления относительных величин (в %).
Результаты исследования и их обсуждение
Среди 48 плодов с ВПС сложные пороки сердца были в 40 случаях (83,3 %). Из общего количества умерли после родов 23 ребенка (47,9 %). Прервали беременность 3 женщины (6,2 %), в двух случаях проводилось патологоанатомическое вскрытие плодов. Третья беременная после заключения медицинской комиссии прервала беременность в сроке 31 неделя, в связи с плохим прогнозом для жизни ребенка. Диагноз был подтвержден методом эхокардиографии.
Из факторов риска, по анализам обменных карт, острые респираторные вирусные инфекции (ОРВИ) до 12 недели перенесли 14 женщин (29,1 %), ОРВИ во втором триместре перенесли 4 женщины (8,3 %). Анемия легкой степени имела место в 12 случаях (25,0 %), хроническая ревматическая болезнь сердца у матери – один случай (2,0 %). Многоплодные беременности как фактор риска в нашем случае встречались в двух случаях (4,1 %), обе дихориальные, диамниотические двойни.
Количество плодов мужского пола составило – 31 (64,5 %), женского 17 (35,4 %). Маловесными (вес менее 2600 г.) родились 9 детей (18,7 %), из них 8 имели сочетание порока сердца с ненормальным развитием других органов, в одном случае порок сердца был изолированным.
При ультразвуковом исследовании фетоплацентарное нарушение кровотока 1 степени выявлено у одной беременной (2,0 %), задержка внутриутробного развития у 4 (8,3 %), маловодие у 2 (4,1 %), многоводие у 5 (10,4 %), причем избыточное количество вод во всех случаях сочеталось с множественными пороками развития.
Сложности при ультразвуковом осмотре вызывали неправильное положение плода, большой срок гестации (после 35 недель), многоводие, маловодие. Необходимо отметить, что технология STIC информативна при осмотрах четырехкамерной проекции сердца (пороки атривентрикулярных клапанов, гипоплазии желудочков, дефекты межжелудочковой перегородки). Для осмотра выходных трактов желудочков, особенно при повороте оси сердца, осмотр в двумерном режиме является предпочтительным. Также для осмотра органов других систем маловодие и неудобное положение плода являются помехами для трехмерного ультразвука.
Структура выявленных пороков оказалась многообразна. Нами были диагностированы: у 5 плодов (10,4 %) двойное отхождение сосудов от правого желудочка, аномалия Эбштейна – 1 (2,0 %), транспозиция магистральных сосудов – 3 (6,2 %), стеноз легочной артерии – 7 (14,5 %), изолированный перимембранозный дефект межжелудочковой перегородки – 3 (6,2 %), декстрапозиция аорты с дефектом межжелудочковой перегородки – 5 (10,4 %), атрезия легочной артерии – 4 (8,3 %), атриовентрикулярный канал –5 (10,4 %), тетрада Фалло – 6 (12,5 %), перерыв дуги аорты – 1 (2,0 %), атрезия трикуспидального клапана – 1 (2,0 %), атрезия митрального клапана – 4 (8,3 %), из них в двух случаях аортальный клапан был атрезирован, также в двух случаях имелось двойное отхождение сосудов от правого желудочка. Коарктация аорты составила один случай (2,0 %), единственный желудочек – 2 (4,1 %).
После рождения вскрытие проводилось в одном случае – ребенку с аномалией Эбштейна, который умер в родильном доме на вторые сутки. Согласно заключению патологоанатома, причиной смерти стала острая сердечная недостаточность, дилатация полостей сердца, острый венозный застой внутренних органов.
В двух случаях единственного желудочка диагностика оказалась затруднительной как внутриутробно, так и после родов. В первом случае трикуспидальный клапан был атрезирован и полость правого желудочка практически отсутствовала, также имелся единый сосуд, исходящий из функционально единого желудочка. После родов рекомендовалась компьютерная томография для уточнения диагноза. При телефонном разговоре с матерью мы узнали, что в возрасте 10 месяцев ребенок еще не прошел полного обследования, но в развитии значительно отставал, не мог переворачиваться и самостоятельно не сидел.
Во втором случае мы диагностировали правосформированное, праворасположенное сердце в сочетании с единым атриовентрикулярным клапаном, двойным отхождением сосудов от правого желудочка, ребенок умер в первый месяц жизни.
Среди плодов с кардиальной патологией в 6 случаях (12,5 %) было сочетание с хромосомными аберрациями и генетическим заболеванием: синдромом Дауна – 4 случая, синдромом Ди Джорджи – один случай; также наблюдался один случай редкой генетической патологии (синдром Холта – Орама, наследственное заболевание, сочетание порока сердца с отсутствием первого пальца на кистях обеих рук до аплазии лучевой кости).
После родов успешно прооперированы были двое детей с тетрадой Фалло, также двое детей со стенозом клапана легочной артерии. Один ребенок с диагнозом двойного отхождения сосудов от правого желудочка благополучно оперирован в Турции. К сожалению, в случаях транспозиции магистральных сосудов и единственного желудочка детям было отказано в проведении оперативного лечения как местными, так и зарубежными хирургами в связи с высоким риском смерти сразу после операции.
Приводим наблюдение о несовпадении нашего диагноза с эхокардиографическим заключением после родов. В нашем центре при плановом обследовании на 30 неделе беременности был установлен диагноз коарктации аорты с дефектом межжелудочковой перегородки. В родильном доме при проведении эхокардиографии был выявлен только дефект мышечной перегородки, коарктация была исключена. Ребенок умер через 2 недели после родов, от вскрытия родители отказались. Мы пришли к выводу, что портативные ультразвуковые аппараты, на которых обследуют детей в родильных домах, могут вызывать сложности визуализации и неполную диагностику, что связано с менее четким изображением, чем на стационарном оборудовании.
По данным литературы, внутриутробная диагностика пороков сердца возможна с 13 недели беременности, в частности таких сложных для выявления ВПС, как атрезия легочной артерии [9]. В нашем центре плод с атрезией легочной артерии и дефектом межжелудочковой перегородки был выявлен в 18 недель беременности. Данная беременность была прервана в связи с неблагоприятным прогнозом для жизни. Патологоанатомическое вскрытие подтвердило диагноз. По нашему мнению, 18 неделя беременности (второе скрининговое обследование) является наиболее ранним сроком для точного определения структуры порока. Связано это с тем, что магистральные сосуды сердца плода плохо видны в сроки первого скринингового обследования, что может приводить к неточной диагностике.
Из 48 случаев с ВПС 16 плодов (33,3 %) имели множественные пороки развития, причем такие изменения, как гидроцефалия, укорочение трубчатых костей, выявлялись на сроках после 30 недель. А случаи атрезии ануса были обнаружены только при рождении детей. Таким образом, выявление любых изменений в сердце является поводом для обязательного повторного ультразвукового обследования в сроки 25–30 недель (таблица).
Сочетание врожденных пороков сердца с аномалиями других органов
Название порока сердца
Сочетание ВПС с патологией других органов
Сроки выявления ВПС (неделя беременности), исход
1. Перимембранозный дефект межжелудочковой перегородки
- сегодня церковный праздник что можно делать и что нельзя делать в этот день
- У кролика растут зубы что делать
_575x.gif)
.gif)