rhd отр что это резус
Расшифровка анализа на группу крови и резус-фактор
Для определения группы крови и резуса-фактора лаборатории уже более века используют систему AB0. Обновлять эту схему нет необходимости, так как новых разновидностей открыто не было. Значение определяют по агглютиногенам – особым белкам крови.
Процесс агглютинации, когда происходит склеивание эритроцитов с определенными антигенами в биоматериале, показывает, к какой группе относятся клетки – второй, третьей или четвертой. Если вариация не выявлена, речь идет о нулевом (первом) типе.
| Результат на группу | Расшифровка |
|---|---|
| 0 (I) – первая | Агглютиногенов в эритроцитах нет, но А и В есть в плазме. |
| A (II) – вторая | Наличие агглютиногена А в эритроцитах, а в плазме только В. |
| B (III) – третья | Агглютиноген В в эритроцитах, в плазме – А. |
| AB (IV) – четвертая | А и В агглютиногены есть только в эритроцитах, в плазме нет. |
Результат на резус-фактор либо положительный (Rh+), либо отрицательный (Rh-).
Убедиться или узнать свою группу и резус нужно перед операцией, в период планирования беременности или уже по факту, а также это важно для доноров.
Расшифровка анализа на резус у беременных
Исследование крови у женщины в положении и у плода нужно, чтобы избежать резус-конфликта, если показания у будущих родителей разные. Анализ выявляет ген RHD, который кодирует суб-фенотипический D-антиген.
При отрицательном результате акушеры назначают повторную контрольную пересдачу на сроке 25 недель. Если итог положительный, будущей маме вводят антирезусный иммуноглобулин.
Результаты исследования помогут избежать осложнений при вынашивании, минимизируют риски прерывания беременности и ранних родов. Если вовремя выявить конфликт групп и принять меры, беременность можно сохранить.
Насколько точен результат на группу крови
Вероятность ошибки практически равна нулю. Показатели не меняются со временем. Такое возможно только в одном случае – после пересадки органов. Если вы знали, что у вас одна вариация, а анализ показал другую, вероятно, ошибка была сделана в роддоме при вашем рождении. Но для верности стоит пересдать анализ.
Определение группы крови и резус принадлежности
Крайне важное значение для клинической практики имеет определение антигенов эритроцитов – идентификация группы крови и резус-фактора. Группа крови человека определяется наличием на поверхности эритроцита антигенов и является индивидуальным признаком. Эритроцитарные поверхностные антигены эритроцитов определяет фенотип эритроцитов или группу крови человека.
В настоящее время известно более 200 антигенов эритроцитов, поэтому группа крови может отличаться в зависимости от количества используемых антисывороток для идентификации антигенов на поверхности эритроцитов. Эритроцитарные антигены, идентифицированные в популяции в 1% случаев, считаются редкими.
Основной системой идентификации групп крови является система АВО, в которой группа крови характеризуется наличием на поверхности эритроцитов антигенов А, В, АВ или их отсутствием (О), т.е. четыре группы крови. В некоторых руководствах встречается дополнительная маркировка групп крови: О (I); А(II); В (III) и АВ (IV).
Выявление в 1901 г. эритроцитарных антигенов положило начало изучению допустимости смешивания эритроцитов разных групп, т.е. совместимости гемотрансфузий. В крови (сыворотке) каждого индивидуума циркулируют антитела (называемые так же агглютинины), активные в отношении чужеродных антигенов. Взаимодействие антиген-антитело приводит к агглютинации (слипанию) и разрушению эритроцитов. В крови индивидуумов с группой крови А циркулируют антитела против антигенов В. Индивидуумы с группой крови В имеют антитела, против антигенов А. При группе крови О в сыворотке определяются антитела анти-А, анти-В, тогда как при группе крови АВ ни антитела А, ни антитела В в сыворотке не определяются.
Таким образом, индивидуумы с группой крови АВ являются универсальными реципиентами иногрупной крови.
Индивидуумы с группой крови О, эритроциты которых не имеют на поверхности ни А, ни В антигенов, являются универсальными донорами.
Антитела к эритроцитарным антигенам А или В являются генетически детерминированными, в соответствии с группой крови эритроцитов, тогда как антитела к другим поверхностным антигенам эритроцитов являются приобретенными. Пациенты, получающие трансфузии, со временем накапливают антитела, что может осложнять подбор требуемой группы крови. Для таких пациентов важно выполнять типирование группы крови с оценкой возможно большего спектра антител сыворотки.
Группа крови оценка совместимости
Для оценки совместимости групп крови и возможности трансфузий необходимо исследование реакции антител сыворотки донора и эритроцитов реципиента, а также эритроцитов донора и антител сыворотки реципиента.
При совместимости групп крови смешивание эритроцитов и сыворотки не приводит к изменению состава и окраски реакционной капли.
При несовместимости групп смешивание эритроцитов донора и сыворотки пациента вызывает реакцию агглютинации – образование в капле неоднородностей в виде слипшихся эритроцитов, точечно насыщающих поле реакции.
Резус-фактором (Rh) называют антиген D, который может располагаться на поверхности эритроцитов. Наличие или отсутствие этого антигена на поверхности эритроцитов индивидуума определяет такую характеристику группы крови, как резус положительная или резус отрицательная (Rh+ или Rh–). Примерно 85% популяции людей имеют резус-положительную группу крови (Rh+).
В отличие от антител к антигенам АВ, антитела к антигену D не присутствуют в крови. При контакте крови резус-положительной группы с резус-отрицательной, происходит сенсибилизация и синтез анти-резусных антител. Такая реакция развивается, например, при беременности Rh– матери Rh+ плодом. Выход фетальных клеток во время родов в кровоток матери активизирует синтез антирезусных антител. В случае пересечения антирезусными антителами плацентарного барьера и попадания в кровь плода, развивается гемолитическая желтуха новорожденного, обусловленная разрушением эритроцитов.
Определение резус фактора необходимо для каждого индивидуума в дополнение к определению группы крови. Отмечено, что выраженность структуры эритроцитарного антигена различна у здоровых людей и тем более у иммуноскомпроментированных больных, беременных женщин.
В настоящее время определение групп крови, резус фактора, продукции антиэритроцитарных антител выполняется в автоматическом режиме стандартизированными методами, позволяющими одномоментно проводить как типирование групп крови, определение продукции антител, так и совместимости возможных трансфузий. Визуальное отображение полученной карты для каждого пациента может быть востребовано в течение всей жизни пациента, она хранится в базе данных лаборатории.
Показания к исследованию: Любое стационарное лечение, беременность.
Условия взятия и хранения образца
Для исследования используется венозную кровь, взятую с ЭДТА или без консервантов. Взятие крови производится натощак, или не менее чем через 8 ч после последнего приема пищи. Образец крови может храниться при температуре от 4–8 °С не более 24 ч.
Группа крови системы АВО:
При выявлении подтипов (слабых вариантов) групповых антигенов результат выдается с соответствующим комментарием, например, «выявлен ослабленный вариант А2, необходим индивидуальный подбор компонентов крови».
При выявлении слабых и вариантных подтипов антигена D выдается комментарий: «выявлен слабый резус-антиген, рекомендуется при необходимости выполнять трансфузию резус-отрицательных компонентов крови».
Rhd отр что это резус
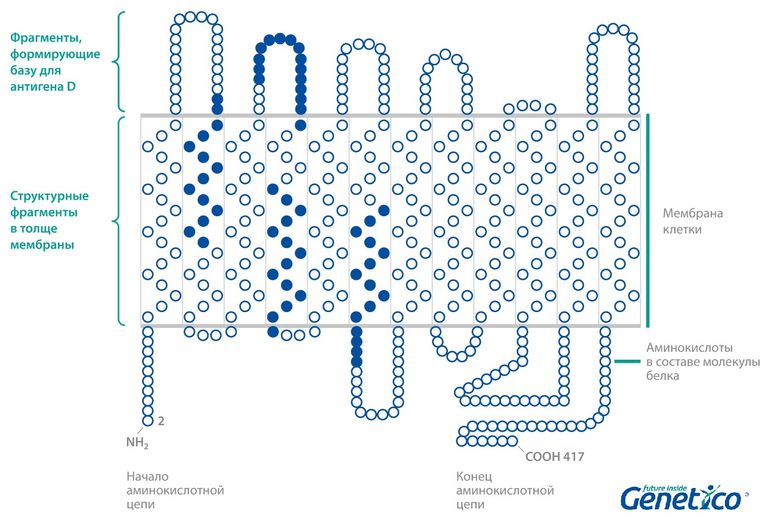
В этой статье мы расскажем о редких вариантах гена RHD и особенностях оценки риска возникновения резус-конфликта. Гены RHD и RhCE у человека работают вместе: они кодируют белки, которые формируют в мембране комплекс, образовывающий базу для антигенов D (резус-фактор), C, c, E, e. Эти белки представляют собой как бы нитки, прошивающие мембрану петлями: их небольшие фрагменты торчат из мембраны, а основная часть находится в ее толще. То есть какие-то аминокислоты белка выполняют строительную функцию – держат белок в мембране, а другие основную – формируют площадку для антигена.
Если гена RHD нет из-за делеции этого участка хромосомы, то и белка на мембране нет. В таком случается получается истинный Rh- фенотип. Однако в редких случаях ген RHD не полностью отсутствует, а несет в себе мутацию. Тогда структура соответствующего белка может нарушаться и приводить не к полному отсутствию антигена D, а к разным промежуточным состояниям. Например, мутации, приводящие к изменению в тех частях белка, которые находятся в толще мембраны, могут влиять на способность белка держаться на поверхности клетки: то есть и ген RHD на месте, и белок нормально синтезируется, однако он с трудом встраивается в мембрану и потому его может быть настолько мало на поверхностях клеток, что иммунная система человека будет их замечать, а вот биохимические методы анализ на резус-фактор – не будут. В случае такого рода мутаций в гене RDH генотип называется Weak D или DEL вместо Rh-. Также при мутациях, затрагивающих выступающие из мембраны участки, антиген D будет неполноценным, так как площадка для его формирования будет неполная или не совсем верная, что тоже может привести к ложным результатам при биохимическом анализе крови. Такой генотип носит название Partial D.
Почему все это важно? Дело в том, что чаще всего статус резус-фактора определяют биохимически по анализу крови. Это значит, что в лаборатории есть антитела к антигену D, эти антитела капают на специально подготовленный препарат крови и смотрят, насколько сильно будет светиться специфическая метка. Если она светится слабо или сигнала нет совсем – это означает, что антителам не с чем было связываться, то есть антигена D на поверхности клеток в анализируемой крови не было. Для обычной ситуации – присутствие или отсутствие гена RHD – этот способ прекрасно работает, но он не позволяет отличить Rh+ гомо- и гетерозигот, поэтому его используют как скрининговый – простой и недорогой метод для первичного обследования. Однако в случае частичной делеции RHD или различных мутаций он срабатывает неправильно. При проверке работы четырех разных наборов реагентов для биохимического анализа крови на резус на 500 образцах для 2% образцов были получены неоднозначные результаты. После генетического тестирования оказалось, что именно эти образцы имели генотип Partial D или Weak D.
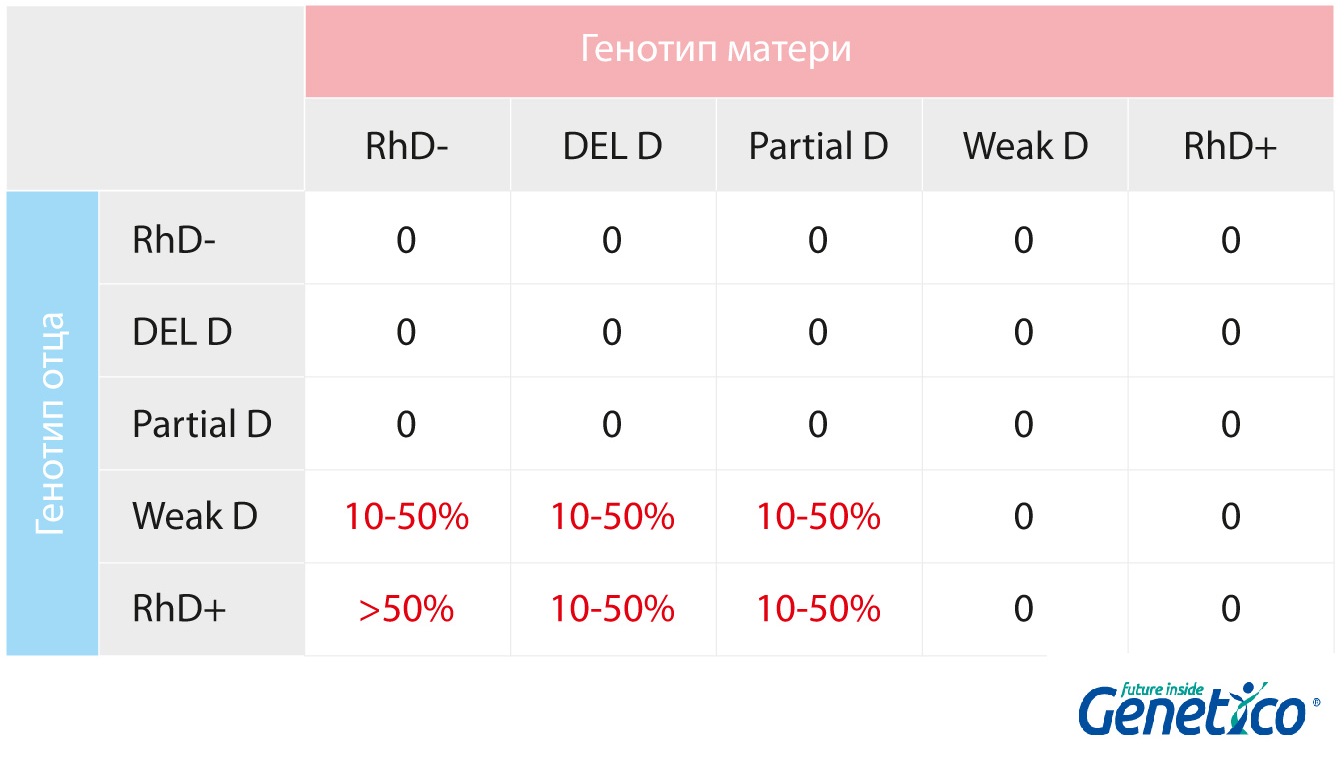
Примерные оценки вероятности развития резус-конфликта при разных сочетаниях генотипов родителей:
Опасность неправильного определения резус-статуса в сложных ситуациях заключается в том, что пара не будет подозревать о рисках, пока не возникнет опасная для жизни и здоровья малыша ситуация. Важно понимать, что главной проблемой при резус-конфликте является то, что организм матери не знаком с антигеном D как с нормальным, «своим», поэтому клетки, отмеченные этим антигеном, начинают отторгаться. При этом иммунная система может познакомиться с этим антигеном как со «своим» даже если этого антигена на поверхности клеток совсем немного, настолько немного, что биохимические методы ставят статус Rh-. В таком случае тревога о возможности развития резус-конфликта у женщины с таким неверным биохимическим анализом будет ложной. С другой стороны, если такой неверный результат будет выдан будущему отцу, то это может привести к развитию резус-конфликта, так как несмотря на биохимически отрицательный резус, ген RHD у отца присутствует и антиген D на поверхности клеток тоже есть. Таким образом, наиболее точный результат получается в результате генетического анализа гена RHD и гена RHCE, методом MLPA. Он позволит идентифицировать наличие/отсутствие гена RHD у будущих родителей, идентифицировать особые состояния этого гена, выявить гомо/гетерозиготность каждого партнера по этим показателям и более эффективно оценить не только вероятность развития резус-конфликта, но и целесообразность различных превентивных или терапевтических мер по устранению этого осложнения при беременности.
Важно помнить, что эти необычные ситуации все же редкость, и в большинстве случаев простой биохимический анализ крови дает верный результат. То есть после него резус-положительные женщины чаще всего спокойно беременеют вне зависимости от генотипа мужа по гену RHD, у резус-отрицательных женщин с резус-отрицательным партнером в большинстве случаев также нет проблем, а резус-отрицательные будущие мамы с резус-положительным отцом отправляются на дополнительные анализы для оценки рисков. Однако, к сожалению, вероятность несовпадения биохимического результата и истинного фенотипа, хоть и мала, но присутствует и может привести к катастрофическим для семьи результатам. Самое безопасное решение – узнать свой генотип по этим генам, который позволит совершенно точно узнать о том, есть ли повод для беспокойства.
Rhd отр что это резус
Генетический маркер, используемый для определения резус-фактора плода по фетальной ДНК. Анализ выполняется только с 10-й недели беременности при отрицательном резус-факторе беременной женщины.
Выявление наличия/отсутствия 7-го и 10-го экзонов гена RHD; генотипирование гена RHD по фетальной ДНК.
Fetal RHD genotyping test.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь беременной женщины с серологическим отрицательным резус-фактором с 10-й недели беременности.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Общая информация об исследовании
С точки зрения иммунологии беременность на всём протяжении рассматривается как процесс смены этапных иммунных конфликтов. В основном эти конфликты являются нормальными физиологическими процессами и не только не оказывают патологического воздействия на организм матери и плода, но и помогают нормальному течению беременности. С их помощью реализуются такие этапы беременности, как имплантация плода, формирование гормонального фона беременности и, конечно, сами роды. Кроме того, существует ряд патологических конфликтов, которые могут существенно осложнять течение нормальной беременности, иногда приводя к летальному исходу. Одним из них является резус-конфликт между матерью и плодом.
В настоящее время существует два основных метода определения резус-фактора. Первый метод – серологический – подразумевает выявление антигена D на поверхности эритроцитов с помощью специфических антител. Он подходит для широкого рутинного обследования. К существенным ограничениям этого метода относятся: 1) необходимость наличия для исследования живых эритроцитов, что делает невозможным использование его в пренатальной диагностике резус-фактора плода; 2) наличие мутации внутри гена RHD либо изменение уровня его экспрессии. В данных случаях серологическое исследование может дать ложноотрицательный результат (Rh- при наличии гена RHD), так как диагностические антитела не смогут связаться с поврежденными или отсутствующими молекулами антигена D.
С учетом того что концентрация фетальной ДНК в крови матери крайне низкая, а также с учетом возможности наличия серологического ложноотрицательного резус-фактора у матери и наличия мутаций в гене RHD генотипирование резус-фактора плода проводят, исследуя ряд показателей: 1) наличие/отсутствие не менее двух фрагментов (7-й и 10-й экзоны) гена RHD; 2) с учетом сигнала от геномной ДНК матери.
Для чего используется исследование?
Когда назначается исследование?
C 10-й недели беременности.
Что означают результаты?
В процессе исследования формируется четыре типа заключения.
1. Отсутствие обоих фрагментов гена RHD в исследуемом материале на фоне достаточного количества сигнала геномной ДНК. В этом случае констатируется отрицательный резус-фактор плода у резус-отрицательной матери. Данное состояние не требует терапевтической коррекции.
2. Наличие обоих фрагментов гена RHD в исследуемом материале на фоне высокого количества сигнала геномной ДНК. В этом случае констатируется положительный резус-фактор плода у резус-отрицательной матери. Данное состояние может вызывать резус-конфликт (особенно при повторных беременностях) и требует терапевтической коррекции. Следует отметить, что у матери должен быть серологически подтвержденный отрицательный резус.
3. Наличие обоих фрагментов гена RHD в исследуемом материале на фоне равного количества сигнала геномной ДНК. В этом случае констатируется, возможно, положительный генетически резус-фактор у матери, резус-фактор плода идентифицировать не представляется возможным.
4. Наличие слабого сигнала обоих фрагментов гена RHD в исследуемом материале на фоне слабого сигнала геномной ДНК. В этом случае констатируется сомнительный результат. Наличие слабого сигнала геномной ДНК, независимо от сигнала с обоих фрагментов гена RHD, либо наличие одного из двух фрагментов гена RHD в исследуемом материале на фоне высокого количества сигнала геномной ДНК указывает на недостоверный результат. Во всех этих случаях требуется проведение повторного исследования.
Что может влиять на результат?
Данное исследование должно проводиться при каждой беременности у резус-отрицательной матери.
Кто назначает исследование?
Акушер-гинеколог, терапевт, гематолог, врач ОВП.
Rhd отр что это резус
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Молекулярно-серологические характеристики типов слабого антигена D системы резус
Журнал: Терапевтический архив. 2016;88(7): 78-83
Головкина Л. Л., Стремоухова А. Г., Пушкина Т. Д., Каландаров Р. С., Атрощенко Г. В., Васильева М. Н., Сурин В. Л., Саломашкина В. В., Пшеничникова О. С., Митерев Г. Ю., Паровичникова Е. Н., Савченко В. Г. Молекулярно-серологические характеристики типов слабого антигена D системы резус. Терапевтический архив. 2016;88(7):78-83.
Golovkina L L, Stremoukhova A G, Pushkina T D, Kalandarov R S, Atroshchenko G V, Vasilyeva M N, Surin V L, Salomashkina V V, Pshenichnikova O S, Miterev G Yu, Parovichnikova E N, Savchenko V G. Molecular serological characteristics of weak D antigen types of the Rhesus system. Terapevticheskii Arkhiv. 2016;88(7):78-83.
https://doi.org/10.17116/terarkh201688778-83
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Резюме Цель исследования. Оценка распространенности типов слабого антигена D (weak D) системы резус у россиян и возможности выявления этих типов серологическими методами. Материалы и методы. Исследовали эритроциты и ДНК людей с ослабленной экспрессией антигена D с помощью реакции агглютинации эритроцитов в солевой среде (2 метода); реакции агглютинации в гелевых колонках с IgM+IgG анти-D-антителами, непрямого антиглобулинового теста с IgG анти-D-антителами (2 метода); полимеразной цепной реакции для установления типа weak D. Результаты. В 2014—2015 гг. резус-фенотип определен у 5100 человек. Ослабление агглютинабельных свойств эритроцитов выявлено у 102 (2%) обследованных. Генотипирование для идентификации вариантов антигена weak D проведено у 63 обследованных, выявлено 6 типов weak D. Наиболее частыми оказались типы weak D type 3 (n=31; или 49,2%) и weak D type 1 (n=18; или 28,6%), в том числе в одном случае weak D type 1.1 (1,6%). Остальные 4 типа антигена weak D имели следующие частоты: weak D type 2 — 14,3% (n=9), weak D type 15 — 4,8% (n=3), weak D type 4.2 (DAR) (n=1) и weak D type 6 (n=1) — по 1,6% каждый. Наиболее чувствительным серологическим методом идентификации антигена weak D был антиглобулиновый тест в гелевых колонках, содержащих антиглобулиновую сыворотку. В 2 образцах эритроцитов с фенотипами Ccdee и ccdEe наличие weak D type 15 установлено только молекулярным методом. Заключение. Серологическими методами слабый антиген D выявлен в 96,8% случаев. Особое внимание при проверке на наличие weak D следует уделять людям с D-отрицательным фенотипом, имеющим антигены С или Е. Наши исследования, проведенные впервые в России, позволят улучшить иммунологическое обеспечение безопасности трансфузий пациентам сред, содержащих эритроциты.
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ПЦР — полимеразная цепная реакция
ССЭ — среды, содержащие эритроциты
OD — оптическая единица
Среди выявленных в настоящее время 35 антигенных систем эритроцитов самой полиморфной является система резус. Она включает 59 антигенов. Биосинтез антигенов системы резус кодируется двумя генами — RHD и RHCE, расположенными на коротком плече 1-й хромосомы (1p36.11) [1]. Эти два гена имеют высокую степень гомологии — 93,8%, касающуюся всех интронов и кодирующих экзонов [2]. Гены расположены близко друг к другу, но в обратной ориентации: <RHCE(5′->3′)-(3′ 
Сведения о силе и времени появления агглютинации с эритроцитами разных типов weak D суммированы в табл. 2, чувствительность серологических методов при определении типов weak D — в табл. 3.


Агглютинация эритроцитов weak D type 1 с цоликлоном анти-D-супер класса IgM на плоскости (метод № 1) идентифицирована в 55,6% случаев (см. табл. 2, 3), формировалась, как правило, к 3-й минуте и была мелкой. В реакции солевой агглютинации (метод № 2) положительный результат получен уже в 83,3% случаев, разведение анти-D IgM антител колебалось от 1:2 до 1:32. Таким образом, дополнительная инкубация тестируемых эритроцитов с полными анти-D-антителами в течение 1 ч способствовала лучшему склеиванию эритроцитов. В методе № 3 положительный результат на 1+ и 3+ получен в 66,7% случаев. Применение непрямого антиглобулинового метода в классической постановке (метод № 4) повышало выявляемость weak D type 1 до 94,1%, а в гелевых картах (метод № 5) — до 100%.
Мелкая агглютинация эритроцитов weak D type 2 с анти-D Цоликлоном класса IgM (метод № 1) формировалась к 5-й минуте наблюдения только у 1 из 9 обследованных лиц, частота выявления составила 11,1% (см. табл. 2, 3). В реакции солевой агглютинации (метод № 2) положительный результат получен в 77,8% случаев, разведение анти-D IgM антител колебалось от 1:8 до 1:32. В гелевых картах (метод № 3) реакцию на 1+ —2+ наблюдали у 4 (44,4%) из 9 человек. Методы, основанные на непрямом антиглобулиновом тесте, были более чувствительными. Непрямая проба Кумбса в классической постановке (метод № 4) позволяла идентифицировать антиген weak D type 2 в 88,9% случаев, а в гелевых картах LISS/COOMBS (метод № 5) — в 100% случаев.
Генотипирование позволило выявить weak D type 3 у 31 человека, из которых у 30 (96,8%) наблюдали формирование на плоскости мелкой агглютинации в основном ко 2—3-й минуте (метод № 1). В реакции солевой агглютинации разведение анти-D моноклонального реагента колебалось от 1:16 до 1:1024, в гелевых картах сила реакции составляла от 3+ до 4+. Отдельно дадим характеристику одного образца эритроцитов: моноклональные анти-D-антитела IgM класса не агглютинировали эритроциты на плоскости, разведение антител в методе 2 составило 1:2, в гелевых картах сила реакции была на 1+. Методы с применением неполных анти-D-антител (методы № 4 и № 5) позволяли выявить антиген weak D в 100% случаев, сила реакции в геле составляла от 3+ до 4+ (см. табл. 2, 3).
Серологические методы успешно выявляли экспрессию weak D type 4.2 (DAR) и weak D type 6 (см. табл. 2). Экспрессию weak D type 15 удалось выявить на эритроцитах только одного образца и только с помощью непрямого антиглобулинового теста в классическом исполнении (метод № 4) и гелевых колонках (метод № 5) (см. табл. 2), а с эритроцитами еще двух образцов все серологические методы показали отрицательный результат. Поскольку фенотип эритроцитов у этих людей определен как Ccdee и ccdEe, решено выполнить генетическое исследование, при котором и установлено наличие weak D type 15.
Таким образом, самыми эффективными серологическими методами выявления антигенов weak D являются те, что основаны на непрямом антиглобулиновом тесте, выполняемом в гелевых колонках. Однако и эти методики не позволяют идентифицировать некоторые типы слабого D, например некоторые варианты weak D type 15. Мы описали новый методический подход к выявлению таких типов weak D, основанный на применении отдельных неполных моноклональных антител, а не их смеси [22].
Обсуждение
Современные молекулярные методы исследования позволяют идентифицировать редкие аллели генов RHD, продукты которых выявляются серологическими методами как слабый антиген D — weak D. При очень слабой выраженности антигена weak D вследствие крайне малого количества антигенных детерминант на эритроците серологические методы для его выявления неэффективны. В проведенных нами исследованиях в большинстве случаев weak D выявляли всеми 5 серологическими методами. При этом во всех случаях отмечали появление более мелкой агглютинации и увеличение времени реакции (до 1—3 мин вместо 0—5 с) по сравнению с контролем, а в реакции агглютинации в солевой среде — снижение титра реакции на 4—10 ступеней по сравнению с положительным контролем. В целом наиболее эффективным методом выявления weak D остается непрямая проба Кумбса, особенно при использовании гелевых колонок с антиглобулиновой сывороткой. Так, только в этом тесте выявлены weak D type 15 (1 случай), weak D type 1 (1 случай), weak D type 2 (1 случай). В проведенных исследованиях скорость реакции в непрямой пробе Кумбса с эритроцитами weak D type 3 (в большинстве случаев 1 мин) оказалась выше, чем с эритроцитами weak D type 1 и weak D type 2 (чаще всего 2 мин), что можно объяснить разным количеством антигенных детерминант на эритроцитах. В 2 случаях антиген weak D type 15 серологически не выявлялся ни одним методом, и этот тип антигена D идентифицирован только молекулярным методом. Таким образом, в настоящее время в иммуногематологической практике нет серологического метода и реактивов, которые обеспечивали бы определение всех без исключения типов weak D. Только молекулярно-генетическое исследование гарантирует выявление всех этих вариантов. Наша работа является продолжением исследований, начатых еще в прошлом столетии Т.М. Пискуновой. Именно она в 70-х годах XX века первой провела работу по изучению серологических свойств эритроцитов с weak D [23, 24] и отметила их разную агглютинабельность.
Трансфузиологическая стратегия. Определение типов антигена weak D зависит от чувствительности типирующих реактивов и применяемых методик. В большинстве стран реципиентов относят к D+ и переливают D±эритроциты, если эритроциты потенциальных реципиентов агглютинируются двумя сериями анти-D-реактивов класса IgM. Но такие реактивы не агглютинируют эритроциты с парциальным антигеном DVI. Больным с антигеном DVI переливают эритроциты от D-отрицательных доноров для устранения риска анти-D-аллоиммунизации.
F. Wagner и соавт. [16] предложили свой алгоритм выявления типов антигена weak D и соответствующую трансфузионную тактику для реципиентов. По их мнению, следует принимать во внимание распространенность типов weak D в популяции и качественные изменения их антигенных структур, т. е. оценивать риск анти-D-аллоиммунизации. D±эритроциты следует переливать больным со слабым D, имеющим на своих эритроцитах схожую или более высокую плотность антигенов, чем у людей с weak D type 2. Таким образом, пороговое значение плотности антигенных детерминант D составит около 400 на 1 эритроцит. Этот показатель является и пороговым значением чувствительности для анти-D-антител класса IgM, применяемых в реакции солевой агглютинации в пробирках или в гелевых картах. Авторы предлагают использовать эритроциты с weak D type 2 для контроля качества реактивов анти-D, применяемых для фенотипирования, что реализовано на практике специалистами из США. У представителей европеоидной расы чаще выявляют слабый антиген D тип 1, тип 2 и тип 3 — в 97% случаев [12]. Плотность антигена D при этих вариантах превышает пороговое значение 400 антигенов на один эритроцит. Поэтому таким реципиентам в 97% случаев для переливания будут ССЭ от резус-положительных доноров [20]. Если для идентификации антигена D необходима постановка непрямого антиглобулинового теста, значит его плотность на клетке ниже пороговой, и таким пациентам следует переливать эритроциты от D-отрицательных доноров. Число таких больных составит около 3%.
Стратегия по отношению к донорам компонентов крови иная: все потенциально иммуногенные D+ образцы эритроцитов следует относить к резус-положительным. Для выявления слабых вариантов антигена D у доноров следует применять высокочувствительные методики, основанные на непрямом антиглобулиновом тесте, и реактивы на основе IgG-антител [25].
Суммируя перечисленное, трансфузионную стратегию можно сформулировать следующим образом: если слабый антиген D можно идентифицировать с помощью реактивов с анти-D-антителами класса IgM любым методом без применения непрямого антиглобулинового теста, то больному можно переливать эритроциты от резус-положительного донора. Однако в практической работе российских иммуногематологов такой подход зарубежных коллег представляется не совсем оправданным, так как одними серологическими методами нельзя установить причину ослабления экспрессии антигена D. Эритроциты с парциальными антигенами D также могут иметь пониженную агглютинационную активность с анти-D-антителами класса IgM, а больные с такими вариантами антигена D будут подвержены риску анти-D-аллоиммунизации при переливании резус-положительных эритроцитов [26]. Только результаты молекулярных методов исследования (генотипирование) позволяют однозначно выявить причину ослабления экспрессии антигена D. Тип слабого антигена D важно идентифицировать еще и потому, что люди с weak D type 7 и weak D type 4.2 подвержены риску анти-D-аллоиммунизации, несмотря на большую плотность антигенных детерминант на эритроцитах, и им необходимы для переливания эритроциты от D-отрицательных доноров. Применение генотипирования особенно важно в тех популяциях, в которых распространенность подобных типов слабого антигена D высока. В России нами впервые проводится работа по выявлению частоты типов слабого антигена D в российской популяции.