rautella ornithinjlytica пролиферация что значит
Дисбактериоз кишечника с определением антагонистической активности пробиотиков
Микробиологическое исследование, позволяющее оценить качественный и количественный состав облигатных, условно-патогенных и патогенных бактерий и дрожжевых грибов в кале, а также определить наличие антагонистической активности основных пробиотиков в отношении выявленных микроорганизмов.
Для чего используется этот анализ?
Когда назначается анализ?
Дисбиоз кишечника, определение пробиотиков-антагонистов.
Синонимы английские
Intestinal dysbiosis, antagonistic activity of probiotics, Intestinal dysbacteriosis.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Основной способ диагностики дисбактериоза – это микробиологический метод, при котором производят качественную и количественную оценку облигатных, условно-патогенных и патогенных микроорганизмов в кале. На основании результатов исследования делают вывод о дефиците облигатных микроорганизмов или об избыточном росте условно-патогенных или патогенных бактерий. Детальный лабораторный анализ – основа для эффективного лечения дисбактериоза.
Микробиологическое исследование – это один из наиболее специфических и чувствительных методов исследования, применяемых при диагностике дисбактериоза. Следует, однако, помнить, что бактериологический состав кала (он используется в качестве биоматериала) несколько отличается от бактериологического состава слизистой оболочки кишки. Кроме того, результат теста может зависеть от многих других факторов, таких как недавнее употребление антибактериальных препаратов, продуктов, богатых пробиотиками, или слабительных средств.
Результат анализа оценивают с учетом дополнительным лабораторных и инструментальных данных.
Для чего используется исследование?
Когда назначается исследование?
КИШЕЧНЫЙ ДИСБАКТЕРИОЗ
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Нормальная микробная флора кишечника
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
Клинические особенности дисбактериоза
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Основным симптомом псевдомембранозного колита является обильная водянистая диарея, началу которой предшествовало назначение антибиотиков. Затем появляются схваткообразные боли в животе, повышается температура тела, в крови нарастает лейкоцитоз. Эндоскопическая картина псевдомембранозного колита характеризуется наличием бляшковидных, лентовидных и сплошных «мембран», мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишок. Слизистая оболочка отечная, но не изъязвлена. При гистологическом исследовании обнаруживают субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов. На стадии образования псевдомембран под поверхностным эпителием слизистой оболочки возникают экссудативные инфильтраты. Эпителиальный слой приподнимается и местами отсутствует; оголенные места слизистой оболочки прикрыты лишь слущенным эпителием. На поздних стадиях болезни эти участки могут занимать большие сегменты кишки.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
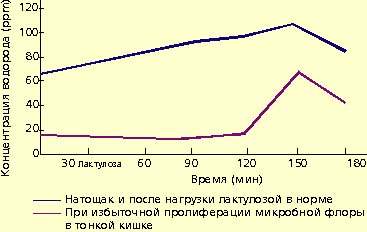 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
 |
Лечение
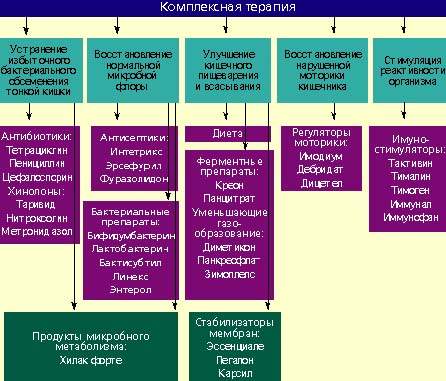
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Избыточный бактериальный рост в кишечнике: патогенетические особенности и лечебные подходы
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
В желудочно–кишечном тракте человека обитает множество бактерий, которые, по сути, являются симбионтами своего «хозяина». Как это ни парадоксально звучит, организм «хозяина» так же нуждается в микробных обитателях, как и они в его поддержке.
Основная часть микроорганизмов поступает в просвет желудочно–кишечного тракта из ротоглотки и с пищей.
В составе нормальной микрофлоры желудочно–кишечного тракта выделено более 400 видов непатогенных аэробных и факультативно анаэробных бактерий.
Состав микрофлоры неодинаков на всем протяжении желудочно–кишечного тракта. В верхнем и среднем отделах тонкой кишки популяция микроорганизмов сравнительно небольшая (в начале тощей кишки их содержание не более 100 микроорганизмов на 1 мл содержимого) и включает преимущественно грамположительные факультативные аэробы, небольшое количество анаэробов, дрожжей и грибов.
По мере приближения к илеоцекальному клапану состав микролоры начинает все более походить на популяцию толстой кишки. В дистальном отделе подвздошной кишки содержание микробов составляет 10 5 –10 8 /г кишечного содержимого.
Наибольшее содержание микроорганизмов наблюдается в толстой кишке. Здесь их концентрация достигает 10 10 –10 11 и более на 1 г содержимого.
В толстой кишке обитает основная масса анаэробных микроорганизмов. «Главную популяцию» (около 70%) составляют анаэробы – бифидобактерии и бактероиды. В качестве «сопутствующей популяции» выступают лактобациллы, кишечная палочка, энтерококки.
Бактерии, населяющие просвет желудочно–кишечного тракта, выполняют ряд функций, имеющих весьма важное значение для организма «хозяина».
Микробная популяция играет важнейшую роль во внутрипросветном пищеварении, в частности, участвует в переваривании пищевых волокон (целлюлозы), ферментативном расщеплении белков, высокомолекулярных углеводов, жиров и в процессе метаболизма вырабатывает ряд полезных для организма веществ.
Главный представитель анаэробной кишечной микрофлоры – бифидобактерии – синтезируют аминокислоты, белки, витамины В1, В2, В6, В12, викасол, никотиновую и фолиевую кислоты. Выдвинуто предположение, что некоторые вещества, вырабатываемые бифидобактериями, обладают антиоксидантными свойствами и способствуют снижению риска заболеваемости раком толстой кишки.
Среди аэробных микроорганизмов важнейшая роль в метаболических процессах принадлежит кишечной палочке, обладающей большим спектром функциональных свойств. E.coli вырабатывает несколько витаминов (тиамин, рибофлавин, пиридоксин, витамины В12, К, никотиновую, фолиевую, пантотеновую кислоты), участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот, и, опосредованно влияет на всасывание железа и кальция.
Образующиеся под влиянием микрофоры продукты метаболизма белка (индол, фенол, скатол) оказывают регулирующее воздействие на перистальтическую активность кишечника.
В последнее время интенсивно изучается роль кишечной микрофлоры в формировании иммунологической реактивности и иммунологической толерантности организма.
Представители нормальной кишечной микрофлоры вырабатывают вещества с антибактериальной активностью (такие как бактериокины и короткоцепочечные жирные кислоты, лактоферрин, лизоцим), которые предотвращают внедрение патогенных микроорганизмов и подавляют избыточное размножение условно–патогенной флоры. Кишечные палочки, энтерококки, бифидобактерии и лактобациллы обладают наиболее выраженными антагонистическими свойствами в отношении патогенных штаммов.
Продуктами метаболизма молочнокислых бактерий (бифидобактерий, лактобацилл) и бактероидов являются молочная, уксусная, янтарная, муравьиная кислоты. Это обеспечивает поддержание показателя рН внутрикишечного содержимого на уровне 4,0–3,8, благодаря чему тормозится рост и размножение патогенных и гнилостных микроорганизмов в ЖКТ.
Ограниченные первоначально представления о «местной» защитной роли кишечных микроорганизмов существенно расширились за последние годы. Микробиологами и иммунологами подчеркивается важность непрерывного «общения» оганизма «хозяина» со своими симбионтами. Путем контакта с микробной популяцией через слизистую оболочку и постоянного проникновения небольшого количества бактерий, их антигенов и продуктов метаболизма в кровоток поддерживается необходимая напряженность иммунитета, в том числе, вероятно, поддерживается «тонус» противоопухолевой защиты.
Микрофлора желудочно–кишечного тракта активно участвует в химических превращениях многих веществ эндогенного и экзогенного происхождения, в частности, лекарств. В процессе кишечно–печеночной циркуляции вещества, поступающие из просвета кишечника в печень, подвергаются конъюгации с глюкуронатом, сульфатом и другими молекулярными остатками, и многие из них затем вновь выделяются с желчью. В просвете кишечника под действием ферментов кишечной микрофлоры они подвергаются деконъюгации и другим изменениям, после чего вновь всасываются и возвращаются в печень по воротной вене.
Механизмы поддержания нормального «микробного равновесия» в просвете желудочно–кишечного тракта и сдерживания микробного роста включают защитные факторы слизистой оболочки (бактерицидные свойства соляной кислоты желудка, выработка слизи и антител, главным образом, принадлежащих к классам иммуноглобулинов А и М), а также нормальную перистальтическую активность кишечника, в процессе которой часть бактерий регулярно удаляется во внешнюю среду. Целостность щеточной каёмки энтероцитов также выступает как важное звено защиты, поскольку выполняет роль «бактериального фильтра», препятствующего контакту бактерий с клетками слизистой оболочки.
Количественный и качественный состав кишечной микрофлоры может изменяться под воздействием различных факторов эндогенного или экзогенного происхождения. Однако это изменение следует рассматривать как вторичное по отношению к первопричинному фактору.
Избыточный бактериальный рост в кишечнике (в англоязычной литературе – bacterial overgrowth) – обусловлен нарушением качественного и количественного состава микробного биоценоза кишечника, размножением условно–патогенных бактерий в количестве, не свойственном здоровому человеку. Нельзя забывать, что избыточный бактериальный рост в кишечнике и связанные с ним клинические проявления представляет собой не самостоятельную нозологическую форму, а синдром.
Устаревший термин «дисбактериоз» использовать не совсем корректно, поскольку это название не в полной мере отражает сущность развивающихся нарушений.
С точки зрения микробиологии, избыточный бактериальный рост проявляется значительным уменьшением количества анаэробных представителей (особенно бифидобактерий), увеличением общего количества функционально неполноценных кишечных палочек («лактозо»–, «маннит»–, «индолоотрицательных»), содержанием гемолитических форм E.coli, созданием условий для размножения кандид.
Фоном для развития синдрома избыточного бактериального роста служат различные состояния, сопровождающиеся нарушением переваривания пищи, пассажа внутрипросветного содержимого; изменением иммунологической реактивности организма, ятрогенные воздействия на микрофлору кишечника.
При различных состояниях, сопровождающихся нарушением переваривания и всасывания пищи (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия, энтериты), невсосавшиеся питательные вещества служат питательной средой для избыточного размножения бактерий.
Нарушение пассажа внутрипросветного содержимого наблюдается при формировании межкишечных свищей, оперативных вмешательствах с формированием «слепых петель» кишечника, развитии дивертикулов, нарушении двигательной активности кишечника (запоры или поносы), кишечной непроходимости (обструктивной или паралитической). В этих условиях также создаются благоприятные условия для нарушения «бактериального равновесия».
При анацидных состояниях и иммунодефицитах утрачивается регулирующее влияние со стороны организма на поддержание состава кишечной микрофлоры.
Применение антибиотиков, кортикостероидов, цитостатиков, особенно у ослабленных и пожилых пациентов, сопровождаются вмешательством во взаимоотношения микрофлоры и макроорганизма.
Пожалуй, в качестве единственной самостоятельной нозологической формы избыточного бактериального роста в кишечнике выступает псевдомембранозный колит, который обусловлен избыточным размножением Clostridium difficile – облигатно–анаэробной грамположительной спорообразующей бактерии, обладающей природной устойчивостью к большинству широко применяемых антибиотиков. Популяция C.difficile в составе нормальной микрофлоры кишечника составляет примерно 0,01–0,001%; она существенно возрастает (до 15–40%) при приеме антибиотиков, угнетающих рост штаммов кишечной флоры, которые в норме подавляют жизнедеятельность C.difficile (в первую очередь, клиндамицина, ампициллина, цефалоспоринов).
Синдром избыточного бактериального роста характеризуется различными клиническими проявлениями, «наслаивающимися» на проявления основного заболевания.
Избыточное размножение бактерий в тонкой кишке является дополнительным фактором, поддерживающим воспаление слизистой оболочки, снижающим продукцию ферментов (в наибольшей степени – лактазы) и усугубляющим нарушение переваривания и всасывания. Эти изменения обусловливают развитие таких симптомов, как коликообразные боли в околопупочной области, метеоризм, диарея, похудание.
При преимущественном вовлечении в процесс толстой кишки пациенты предъявляют жалобы на неоформленный стул, метеоризм, ноющие боли в животе.
Выраженные нарушения равновесия в составе кишечной микрофлоры могут сопровождаться признаками гиповитаминоза В12, В1, В2, В3 (РР). У пациента выявляются трещины в углах рта, глоссит, хейлит, поражения кожи (дерматит, нейродермит), железо– и В12–дефицитная анемия. Поскольку микрофлора кишечника служит важным источником викасола, могут наблюдаться нарушения свертывания крови. В ряде случаев в результате нарушения обмена желчных кислот развиваются симптомы гипокальциемии (онемение губ, пальцев, остеопороз). Ряд авторов связывает нарушения обмена холестерина с нарушением «микробного баланса» желудочно–кишечного тракта.
Диагностика синдрома избыточного бактериального роста подразумевает анализ картины основного заболевания, с выявлением возможной причины нарушения микробного биоценоза кишечника. Проводится дополнительное обследование, которое может включать эндоскопическое, рентгенологическое исследование кишечника для выявления нарушений анатомического строения, оценки перистальтики желудочно–кишечного тракта; биопсию тонкой кишки – для установления диагноза энтерита, энтеропатии, диагностики ферментопатий (к сожалению, возможности проведения этого исследования в нашей стране ограничены) и др. Мало доступными на сегодняшний день, но точными методами диагностики избыточного бактериального роста являются аспирация содержимого тонкой кишки с немедленным посевом аспирата на питательную среду, а также неинвазивный дыхательный водородный тест с лактулозой. Посев кала, ранее использовавшийся в нашей стране как метод оценки микробного биоценоза кишечника, признан неинформативным, поскольку даже при максимальном приближении к правилам проведения микробиологических исследований может дать представление лишь о микробном составе дистального отдела толстой кишки.
Перед тем как непосредственно приступить к лечению синдрома избыточного бактериального роста, необходимо определить причину развития нарушений микробного биоценоза и, по возможности, устранить влияние данного фактора. Например, назначить пациенту противовоспалительную, заместительную ферментную терапию, использовать возможности по нормализации перистальтической активности кишечника.
Изменение характера питания позволяет воздействовать на микрофлору физиологическим путем. Однако диетические предписания необходимо давать с учетом основного заболевания. В любом случае, при избыточном бактериальном росте в кишечнике показано ограничение потребления легкоусвояемых углеводов и исключение потребления молока (особенно пресного). При отсутствии противопоказаний целесообразно потребление овощей, фруктов и ягод, обладающих бактерицидным действием (редька, редис, лук, чеснок, хрен, морковь, малина, клубника, земляника, черника, абрикосы, яблоки, черноплодная рябина, сок граната, гвоздика, корица, лавровый лист).
Устаревший подход «санировать – и вновь заселить кишечник» не соответствует современным представлениям о патогенезе избыточного бактериального роста.
Однако при тяжелых формах избыточного бактериального роста в кишечнике показана антибактериальная терапия (назначение метронидазола по 400 мг 3 раза в день в течение недели; при неэффективности метронидазола к лечению целесообразно добавить тетрациклин по 250 мг 4 раза в день в течение 2 недель). Антибиотики резерва – ципрофлоксацин (по 500 мг 2 раза в день) и ванкомицин (по 125 мг 4 раза в день). Лечение псевдомембранозного колита проводится по определенным схемам и не рассматривается в данной статье вследствие обособленности этого заболевания.
В ряде случаев для подавления условно-патогенных микроорганизмов используются бактериофаги (стафилококковый и коли–протейный) по 50 мл 2 раза в день за час до еды в течение 3–4 дней, проводится 2–3 курса с 3–дневным перерывом.
Не менее важным и, зачастую, основным направлением лечения является воссоздание условий, благоприятных для восстановления нормальной микрофлоры. Лекарственные препараты, обладающие подобными свойствами, носят название пробиотиков.
Некоторое время назад в качестве пробиотиков особенно широко использовались биологические препараты для перорального приема, содержащие в своем составе бифидобактерии, лактобациллы, кишечные палочки с полезными сойствами. Необходимо учитывать, что микробы, вводимые в составе лекарственных препаратов, сами по себе надолго не приживаются в кишечнике и элиминируются спустя 2–3 недели. Основой лечебного действия подобных препаратов является их способность временно поддерживать ферментативную активность и защитные свойства (колициногенность) собственной микрофлоры кишечника. Ниже охарактеризованы некоторые из наиболее известных препаратов.
«Колибактерин» содержит взвесь живых бактерий штамма E.coli M–17, обладающего антагонизмом по отношению к условно–патогенной и патогенной микрофлоре. Назначают по 6–10 доз в 1–2 приема за 40 мин до еды в течение 3–4 недель.
«Бифидумбактерин» содержит штамм бифидобактерий, устойчивых к антибиотикам. Назначают по 5–10 доз в сутки в 1–2 приема в течение 2–3 недель. «Бифидумбактерин» наиболее благоприятно действует при наличии у пациента запоров.
«Бификол» – сочетание совместно выращенных культур E.coli M–17 и бифидумбактерий. В сутки назначают 6–10 доз.
«Лактобактерин» приготовлен из молочнокислых бактерий. Микробы, входящие в состав этого препарата характеризуются высокой устойчивостью к антибиотикам. Лактобактерии эффетивно угнетают рост протея, гемолитических штаммов стафилококка и поддерживают рост популяции E.coli. Применяют по 3–6 доз в сутки. Лечебной и профилактической активностью обладают также молочные продукты, содержащие культуру молочнокислых бактерий, аналогичную входящей в состав «Лактобактерина» – ацидофильный дрожжевой творог и ацидофильное молоко, а также биомасса ацидофильных лактобактерий, носящая название «Наринэ».
В настоящее время широко применяется препарат «Энтерол», содержащий в составе лиофилизированные лечебные дрожжи Saccharomyces boulardii, обладающие природной устойчивостью к антибиотикам. S. boulardii не колонизируют пищеварительный тракт и элиминируются с калом в течение нескольких дней после завершения курса терапии. Они вырабатывают белки, препятствующие связыванию патогенных микроорганизмов и их токсинов со слизистой оболочкой кишечника; стимулируют защитные свойства слизистой оболочки.
Благоприятные условия для размножения бифидобактерий создает дисахарид лактулоза, обладающий также слабительными и аммонийсвязывающими свойствами. Он служит питательной средой для размножения молочнокислых бактерий и источником выработки ими молочной кислоты, снижающей рН кишечного содержимого. К существенным недостаткам лактулозы относятся нередко развивающиеся вздутие живота и диарея с потерей электролитов (поэтому назначение лактулозы предпочтительно пациентам, страдающим запором). Лактулоза противопоказана при галактоземии. Доза сиропа лактулозы для взрослых варьирует от 15 до 45 мл в сутки (в 2–3 приема).
Существует и другой, совершенно оригинальный, подход к нормализации среды в просвете кишечника, что способствует восстановлению нормальной популяции его «обитателей». Данное направление фармакологической коррекции избыточного бактериального роста представлено препаратом «Хилак–форте».
Препарат «Хилак–форте» представляет собой стерильный концентрат биологически активных веществ, вырабатываемых нормальной микрофлорой кишечника (как грамположительной, так и грамотрицательной). Среди них – молочная кислота и короткоцепочечные летучие жирные кислоты (обладающие антибактериальными свойствами в отношении условно–патогенной и патогенной флоры), молочно–солевой буфер, лактоза, аминокислоты. Всего в одной капле концентрата содержатся продукты биосинтеза 100 миллиардов кишечных бактерий.
«Хилак–форте» позволяет создать благоприятные условия для размножения молочно–кислых бактерий (за счет снижения рН, восстановления водно–электролитного баланса в просвете кишечника и подавления конкурентной флоры). Интересно, что действие препарата не ограничивается влиянием на бактериальный состав, отмечено, что «Хилак–форте» также стимулирует регенерацию эпителия слизистой оболочки кишечника.
«Хилак–форте» показан при самых разнообразных состояниях, сопровождающихся нарушением «микробного баланса»: нарушениях мальдигестии и мальабсорбции различного происхождения, нарушении перистальтической активности кишечника, в периоде выздоровления после острых инфекционных энетроколитов и т.д. Назначение «Хилак–форте» целесообразно во время лечения антибиотиками и некоторое время после их отмены для профилактики нарушений в составе кишечной микрофлоры.
«Хилак–форте» характеризуется высокой эффективностью и хорошей переносимостью. Противопоказаний к назначению препарата и побочных действий не выявлено. его можно назначать не только взрослым, но и детям грудного возраста.
«Хилак–форте» принимают внутрь до или во время еды, разбавив небольшим количеством жидкости (не щелочной реакции!).
Начальная доза для взрослых составляет по 40–60 капель 3 раза в день; для детей – по 20–40 капель 3 раза в день; для детей грудного возраста – по 15–30 капель 3 раза в день. По мере клинического улучшения доза может быть уменьшена наполовину.
«Хилак–форте» нельзя принимать в одно время суток с антацидными препаратами и адсорбентами, поскольку антациды нейтрализуют, а адсорбенты – снижают биодоступность кислот, входящих в состав препарата.
Диагностируя у пациента синдром избыточного бактериального роста, необходимо понимать главное в коррекции этого состояния – не агрессивно вмешиваться в микробный биценоз, а «протянуть руку помощи» микробам, обеспечивающим наше здоровье и благополучие.
1. Вудли М., Уэлан А., ред. Терапевтический справочник Вашингтонского университета. Пер. с англ. – М.: Практика, 1995г.
2. Гребенев А.Л., Мягкова Л.П. Болезни кишечника. – М.: Медицина, 1994 г.
3. Денисов И.Н., Кулаков В.И., Хаитов Р.М., гл. ред. Клинические рекомендации для практикующих врачей, основанные на доказательной медицине. – М.: ГЭОТАР–МЕД, 2001г.
4. Ивашкин В.Т., Комаров Ф.И., Рапопорт С.И., ред. Краткое руководство по гастроэнтерологии. – М.: Издательский дом «М–Вести», 2001 г.
5. Котельников Г.П., Яковлев О.Г., ред. Практическая гериатрия: Руководство для врачей. – Самара: Самарский Дом печати, 1995г.
