продолжительность жизни при атрофическом гастрите
Что надо знать об атрофическом гастрите?
Атрофический гастрит или более правильное медицинское название атрофия слизистой оболочки желудка – это необратимый процесс, при котором происходит гибель клеток слизистой желудка, вырабатывающих желудочных сок и соляную кислоту. К атрофии, также относится постепенное замещение клеток желудка соединительной тканью и клетками, сходными по строению с клетками слизистой оболочки кишечника.
Атрофия слизистой оболочки желудка – это опасное для здоровья состояние, так как с течением времени и, особенно, при наличии дополнительных факторов риска, она может привести к развитию рака желудка.
Причины атрофического гастрита

Хронический гастрит – это распространенное заболевание (выявляется до 30% населения в различных популяциях), имеющее хроническое и рецидивирующее течение, проявляющееся воспалением слизистой оболочки желудка и подтвержденное морфологическим исследованием.
Причинами развития хронического гастрита являются:
То есть, в большинстве случаев атрофия слизистой желудка является результатом наиболее часто встречающегося (80%) хронического гастрита, вызванного хеликобактерной инфекцией, или аутоиммунного гастрита, который встречается в 1-2% случаев. В данной статье подробно рассмотрена атрофия, связанная с этими двумя причинами.
Что происходит с клетками слизистой оболочки при атрофии?
Атрофия слизистой оболочки желудка затрагивает верхний слой и собственную пластинку желудка и является почти необратимым процессом, который можно замедлить, если устранить причины воспаления.
Слизистая желудка находится под действием агрессивной среды, поэтому ее клетки полностью обновляются каждые три дня. Воспалительный процесс, развивающийся вследствие влияния внешних факторов, например, бактериальная инфекция или внутренних причин, например, реакция иммунной системы, нарушает процесс обновления (регенерации) клеток слизистой желудка, в том числе и клеток желез желудка, вырабатывающих желудочный сок. В результате клетки желез желудка погибают и замещаются клетками соединительной ткани, а также клетками по строению схожими с клетками кишечника.
Этот процесс можно диагностировать с помощью гистологического исследования образцов слизистой желудка. Если выявлено только уменьшение количества клеток желудочных желез, то говорят только об атрофии слизистой оболочки желудка. Если же в исследуемом образце будут обнаружены клетки кишечника, то устанавливается диагноз атрофия с кишечной метаплазией. Метаплазия – это появление клеток, нетипичных для данного органа.
Как правильно диагностировать атрофию слизистой желудка?

Диагноз устанавливается врачом-морфологом после проведения гистологического исследования. На основании данного исследования подбирается лечение и определяется периодичность обследований для своевременного выявления онкологического процесса.
Также для оценки выраженности атрофии используется определение активности секреторной функции желудка по лабораторному анализу крови – Гастропанель (ссылка).
Диагностику хеликобактерной инфекции проводят с помощью исследования биоптатов и 13 С-уреазного дыхательного теста.
При аутоиммунном гастрите проводятся лабораторная диагностика анализа крови на определение антител к клеткам желудка и к внутреннему фактору Кастла.
Атрофический гастрит, связанный с хеликобактерной инфекцией
После инфицирования бактерией Helicobacter Pylory, в слизистой желудка развивается воспаление и хронический неатрофический гастрит. Железы желудка в начале заболевания вырабатывают достаточное количество желудочного сока. При отсутствии лечения, воспаление становится более активным и распространяется на все отделы желудка, приводя к атрофии слизистой) и частичному замещению клеток желудка кишечными клетками (кишечная метаплазия).
Симптомы

Лечение
Эрадикация (уничтожение) Helicobacter Pylory является первым этапом лечения при данном варианте атрофического гастрита.
Аутоиммунный атрофический гастрит
При данном типе хронического гастрита клетки желудка повреждаются антителами, которые вырабатывает собственная иммунная система. При этом развивается хроническое воспаление, приводящее к атрофии желез желудка и снижению выработки соляной кислоты и внутреннего фактора Кастла, обеспечивающего усвоение витамина B12. Значительное снижение выработки внутреннего фактора Кастла может вызывать анемию В12-дефицитную анемию (пернициозную анемию) – заболевание, для которого характерно нарушение кроветворения.
Симптомы
Симптомы аутоиммунного атрофического гастрита схожи с симптомами, атрофии, вызванной хеликобактерной инфекцией.
Дополнительно развивается анемия, часто аутоиммунному гастриту могут сопутствовать другие аутоиммунные заболевания.
Лечение
Специфического лечения при аутоиммунном гастрите нет, лечение кортикостероидами используется только в исключительных случаях.
Питание при атрофии слизистой
Специфической диеты при атрофическом гастрите не существует, питание должно быть регулярным, сбалансированным с учетом индивидуальной переносимости. Также рекомендуется сократить в рационе питания: грубую клетчатку, рафинированные сахара, избыток соли, насыщенные жиры, алкоголь, а также консерванты и стабилизаторы.
Прогноз и факторы риска при атрофическом гастрите
В зависимости от уменьшения количества желез в слизистой оболочке желудка выделяют три степени атрофии:
Наибольший риск рака желудка имеют пациенты с тяжелой атрофией, кишечной метаплазией, а в особенности с наличием дисплазии.
Дополнительными факторами риска рака желудка являются:
При наличии атрофии наиболее актуальным является профилактика рака желудка, для чего профессор Мехтиев, главный врач центра Эксперт рекомендует регулярное наблюдение у гастроэнтеролога, который следит за симптомами и определяет периодичность выполнения ФГДС (гастроскопии) с расширенной гистологией и Гастропанели.
Получить консультацию гастроэнтеролога, специализирующегося на ведении пациентов с атрофическим гастритом, можно в Гастроэнтерологическом центре Эксперт. ФГДС (гастроскопия) в ГЦ Эксперт выполняется опытными специалистами с помощью видеоэндоскопической системы, оснащенной технологией виртуальной хромоэндоскопии i-Scan, что повышает точность забора образцов слизистой для гистологического исследования.
Особенности атрофических и дисрегенераторных изменений слизистой оболочки желудка у больных хроническим атрофическим гастритом различных возрастных групп
Клиника госпитальной терапии Военно-медицинской академии имени С.М. Кирова
Интерес исследователей к раннему раку желудка в значительной мере обусловлен тем, что он является своеобразной «переходной» формой между предраковыми изменениями слизистой оболочки желудка и развитым раком желудка, и его изучение позволяет точнее понять морфогенез опухоли и обосновать методы своевременной диагностики и профилактики [8].
Как показали исследования P. Correa, формирование интестинального рака желудка закономерно протекает через ряд последовательных дискретных морфологических стадий: неатрофический гастрит, атрофический гастрит, метаплазия эпителия кишечного типа, прогрессирующая дисплазия и рак insitu, завершающийся инвазивным раком (каскад Корреа). Указанный процесс охватывает обычно период от 20 до 30 лет [11].
Диагноз заболевания верифицировали на основании характерных жалоб, анамнеза, результатов объективного обследования, данных лабораторных и инструментальных исследований. Решающими в постановке окончательного диагноза были данные эзофагогастродуоденоскопии и морфологического исследования слизистой оболочки желудка.
В процессе эндоскопического исследования визуально оценивали наличие, выраженность, распространенность и локализацию воспалительной реакции, очагов атрофии. При воспалительных изменениях слизистой оболочки желудка наблюдали пятнистую гиперемию, отек, подслизистые кровоизлияния, гиперплазию складок. При атрофическом процессе наблюдали бледность, истонченность, повышенную ранимость, сглаженность слизистой оболочки в теле и антральном отделе желудка, просвечивание сосудов.
Прицельные биоптаты слизистой оболочки желудка, полученные при эндоскопическом исследовании, фиксировали в 10% растворе нейтрального формалина, обезвоживали, заливали в парафин, срезы толщиной в 5 мкм окрашивали гематоксилином и эозином и методом ШИК-реакции. Патоморфологические изменения слизистой оболочки желудка оценивали в соответствии с международной классификацией хронического гастрита (Dixon M. Et al., 1996). Оценку выраженности атрофического процесса, кишечной метаплазии и клеточной инфильтрации стромы слизистой оболочки проводили в соответствии с дополнениями к Сиднейской классификации.
Результаты. В работах различных авторов [3, 9, 10] неоднократно указывалась ценность эндоскопического метода исследования в возможности выполнения биопсии с последующим гистологическим исследованием полученного материала. Диагноз “хронический гастрит” должен быть исключительно клинико-морфологическим, а при постановке окончательного диагноза необходимо, прежде всего, ориентироваться на результаты гистологического анализа, поскольку данные эндоскопического и морфологического исследований нередко могут не совпадать. Однако часто в повседневной клинической практике врачи ориентируются только на данные эндоскопического исследования.
В нашем исследовании также проводился анализ эндоскопических и морфологических признаков атрофии слизистой оболочки желудка.
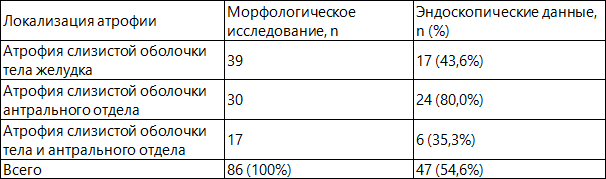
Данные по выявлению атрофических изменений слизистой оболочки желудка, полученные в процессе эндоскопического исследования, в сравнении с морфологическими данными представлены в табл. 1.
Таблица 1. Сравнительная оценка морфологических и эндоскопических данных в диагностике атрофии слизистой оболочки желудка.
Согласно полученным данным, можно утверждать, что при диагностике атрофических изменений слизистой оболочки желудка у больных хроническим гастритом в процессе эндоскопического исследования и морфологического анализа их результаты совпадают лишь в 54,6% случаев. Примерно у половины больных атрофические изменения слизистой оболочки желудка, выявленные морфологическим методом, остаются недоступными для адекватной эндоскопической оценки, что обосновывает необходимость гистологической верификации «гастритического» процесса.
Атрофический гастрит: что мы понимаем под этим состоянием. Современные подходы к диагностике и лечению
В клинической практике мы довольно часто сталкиваемся с диагнозом » атрофический гастрит «. Однако до сих пор остается много вопросов относительно того, является ли он самостоятельным заболеванием или исходом других форм гастритов? Равнозначны ли понятия атрофический гастрит и аутоиммунный атрофический и гипоацидный гастрит? Что на самом деле скрывается за этим диагнозом? Какие методы помогут подтвердить диагноз и как лечить таких пациентов? На эти и другие вопросы мы постараемся ответить в данной статье.
Важность проблемы определяется тем, что желудок является начальным звеном пищеварительного конвейера, и нарушение его функции незамедлительно сказывается на состоянии других органов пищеварения, вызывая сбой в работе тонкой и толстой кишки, поджелудочной железы, печени и приводя к увеличению содержания патогенных бактерий в кишечнике. Хронический атрофический гастрит относят к предраковым состояниям желудка, на фоне данного заболевания часто развиваются такие предраковые изменения, как кишечная метаплазия и дисплазия эпителия слизистой желудка, а также гиперпролиферация эпителия слизистой желудка, способствующая развитию опухолей [1].
Хронический гастрит (ХГ) занимает центральное место среди заболеваний желудка. И не только потому, что он является наиболее распространенным заболеванием пищеварительной системы. Более существенно то, что ХГ, почти как правило, предшествует или сопутствует таким серьезным по течению и прогнозу болезням, как язва и рак желудка. В основе ХГ лежат воспалительные, дисрегенераторные, дистрофические и атрофические процессы в слизистой оболочке желудка, приводящие, в конечном счете, к ее функциональной недостаточности.
В 1990 г. в Сиднее (Австралия) была принята новая классификация гастритов, получившая названия Сиднейской системы, согласно которой диагноз гастрита должен формулироваться на основании 4-х признаков заболевания:
Более поздняя Хьюстоновская классификация внесла в Сиднейскую систему важные дополнения, в соответствии с которыми различают:
Распространенность атрофического гастрита
Большинство исследователей придерживается мнения, что ХГ страдает более 1/3 взрослого населения, однако из них к врачам обращается всего лишь 10-15%. Хеликобактерный гастрит преобладает и составляет 80-90% всех гастритов, аутоиммунный сотавляет всего лишь 10%. Истинная распространенность атрофии слизистой оболочки (СО) желудка неизвестна, но если рассматривать его, как проявление аутоиммунного и исход длительно текущего хеликобактерного гастрита, его распространенность может достигать 50-60%!
Причины и патогенез атрофического гастрита
Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter pylori (Н. pylori) и аутоиммунный гастрит, который встречается довольно редко [2].
Атрофический гастрит, ассоциированный с Н. pylori
С Н. pylori связывают возникновение подавляющего большинства атрофических гастритов. Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Аутоиммунный хронический атрофический гастрит
Данный тип хронического гастрита связан с образованием аутоантител (к париеталным клеткам и внутреннему фактору Кастла). Антитела связываются с микроворсинками париетальных клеток и делают невозможным соединение витамина В12 с внутренним фактором Касла. Считается, что выработка антител к H+K+-АТФазе париетальных клеток является одной из причин ахлоргидрии. Повреждение антителами собственных (фундальных) желез приводит к их потере. При этом в теле и дне желудка развивается прогрессивная атрофия главных и париетальных клеток с недостаточностью внутреннего фактора Кастла, что может приводить к пернициозной анемии.
Аутоиммунный гастрит часто сочетается с другой аутоиммунной патологией и нередко развивается в рамках так называемого аутоиммунного полигландулярного синдрома [3].
Гистологические изменения при аутоиммунном атрофическом гастрите зависят от фазы заболевания:
Условно в желудке различают 4 отдела:
Таким образом, на фоне существования десятков причин и морфофункциональных вариантов атрофии, диагноз «хронический атрофический гастрит» является лишь собирательным понятием, который совершенно не отражает реальную картину структурной организации желудка и физиологию желудочной секреции.
Неизменным следствием атрофии СО является функциональная недостаточность желудка, что определяет довольно широкую гамму клинических проявлений.
Основными функциями желудка являются:
Поэтому неизменным спутником гипоацидных состояний, а также длительного приема ингибиторов протонной помпы (омепразол) является дисбактериоз.
Из-за выраженного снижения функциональной активности желудка, при атрофическом гастрите ведущим является синдром диспепсии, в отличие от гиперацидного гастрита, где преобладает болевой синдром.
Гастроскопия является ведущим методом диагностики атрофического гастрита. Она выявляет истончение слизистой, которая приобретает бледно-сероватый цвет, размер ее складок уменьшается, выраженность сосудистого рисунка увеличивается.
При атрофическом гастрите участки истонченной слизистой могут чередоваться с участками кишечной метаплазии, которая может быть более или менее выраженной, и иметь различную распространенность. Кишечная метаплазия традиционно рассматривалась, как предраковое изменение слизистой оболочки желудка.
Атрофия выражается в уменьшении толщины СО, толщины зоны слизистого эпителия и глубины желез. Наряду с этим атрофия может проявляться и в разрежении желез. Морфологическое исследование является одним из ключевых и достоверных методов выявления атрофических, воспалительных и деструктивных изменений в СО фундального и антрального отдела желудка, но при условии выполнения качественной морфологической диагностики (Good Morphological Practice) [4].
Для выявления дисплазии и метаплазии можно прибегнуть к методу хромографии, когда измененные участки окрашиваются специальным индикатором в соответствующий цвет.
УЗИ является дополнительным методом диагностики при атрофическом гастрите и в основном нацелено на выявление сопутствующей патологии поджелудочной железы, желчного пузыря, печени и т.д. УЗИ-признаки атрофического гастрита далеко не всегда выявляются, при выраженном патологическом процессе можно увидеть уменьшение размеров желудка и «сглаживание» его поверхности (уменьшение высоты желудочных складок).
Функциональное исследование желудка включает:
Материал для исследования может быть получен при зондировании или при гастроскопии.
Суточная рН-метрия является «золотым стандартом» оценки секреторной функции желудка при атрофическом гастрите. Ее проведение необходимо для определения тактики лечения пациента, прогноза и контроля эффективности терапии. Как правило, атрофический гастрит сопровождается пониженной кислотностью. Среднесуточная рН может колебаться от 3 до 6.
Лабораторные маркеры атрофического гастрита
Антипариетальные антитела направлены против микросомальных компонентов париетальных клеток желудка. Тест положителен у 95% пациентов с пернициозной анемией, хотя специфичность теста низкая. Антитела к париетальным клеткам присутствуют у 25-30% пациентов с аутоиммунным тиреоидитом.
При определении антител к внутреннему фактору следует не допускать введения витамина В12 в течение 48 часов перед взятием образца. Антитела к внутреннему фактору могут присутствовать у 3-6% людей с гипертироидизмом или инсулинозависимым диабетом.
Для аутоиммунного хронического гастрита характерно повышение уровня гастрина. Необходимо проведение дифференциальной диагностики с гастриномой (синдром Золлингера-Эллисона).
Диагностика инфекции Helicobacter pylori
«Золотым стандартом» достоверности признано морфологическое исследование биоптатов.
Принципы медикаментозной терапии атрофического гастрита
Если лечение гиперацидных состояний на сегодняшний день достигло больших успехов, то в терапии гипоацидного атрофического гастрита и по сей день много «белых пятен». Практикующий врач, каждый раз сталкиваясь с атрофией СО желудка, оказывается перед непростым выбором: назначать или не назначать антацидные и антисекреторные препараты, проводить ли полноценный курс эрадикации и т.д.
Давайте попробуем разобраться во всех тонкостях лечения атрофического гастрита и наметить алгоритм действия.
К сожалению, устранить аутоиммунные механизмы поражения СО желудка на сегодняшний день практически невозможно, вопрос о назначении глюкокортикостероидов встает только тогда, когда гастрит сопровождает пернициозная анемия. В остальных случаях побочные эффекты ГКС будут преобладать над клинической эффективностью.
Эрадикационная терапия при атрофическом гастрите имеет важную особенность: прежде чем решить вопрос о выборе антисекреторного препарата, необходимо провести суточную рН-метрию. При рН менее 6, несмотря на пониженную секрецию, назначаются ингибиторы протоновой помпы (ИПП). И лишь при анацидном состоянии (рН≥6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Данные в отношении возможности обратного развития атрофии и кишечной метаплазии после эрадикации инфекции противоречивы. Считается, что эффективная эрадикация H. pylori даже на этапе атрофии приводит к прерыванию каскада патологических реакций в слизистой оболочке желудка и может рассматриваться, как профилактика развития рака желудка. В пользу эрадикации H. pylori у пациентов с атрофическим гастритом свидетельствует целый ряд работ, результаты которых доказывают, что эрадикация инфекции сопровождается нормализацией регенераторных процессов в слизистой оболочке желудка.
Препараты заместительной терапии
Заместительная терапия включает в себя назначение препаратов соляной кислоты и ферментов желудочного сока.
Препарат обычно переносится без побочных явлений, в отдельных случаях отмечаются легкая тошнота, изжога.
Под действием Абомина® осуществляется протеолиз белков пищи до уровня полипептидов и частично аминокислот. Препарат может применяться не только при хроническом атрофическом гастрите, но и при острых нарушениях пищеварительной функции (острый гастрит, гастроэнтерит). Безопасен и может применяться даже у детей грудного возраста.
Прием Абомина® в значительной степени улучшает клиническую картину заболевания (уменьшается тяжесть в эпигастрии, тошнота, отрыжка, диарея), приводит к нормализации лабораторных показателей (в анализах кала уменьшается количество непереваренных мышечных волокон, клетчатки).
При развитии у пациента В12-дефицитной анемии, заместительная терапия должна включать парентеральное введение витамина В12.
В настоящее время существует большое количество лекарственных препаратов, которые «теоретически» должны оказать стимулирующее действие на париетальные клетки. Однако в реальной клинической практике эффективноть большинства из них весьма низкая, а продолжительность действия короткая.
Следует все же упомянуть о некоторых методах стимулирующей терапии:
К этой группе можно отнести солкосерил, довольно эффективный препарат, однако его назначение более оправдано при эрозивном гастрите и язвенной болезни.
Цизаприд, домперидон и другие прокинетики в случаях ослабления тонуса и перистальтики желудка, гастродуоденального рефлюкса и снижения тонуса нижнего пищеводного сфинктера.
В период ремиссии атрофического гастрита главным принципом лечения является стимулирующая и заместительная терапия, которая назначается с целью компенсации секреторной недостаточности.
Атрофический гастрит: прогнозы и перспективы
Под атрофическим гастритом понимают прогрессирующий воспалительный процесс слизистой оболочки желудка, характеризующийся утратой желудочных желез. Клинико-морфологической особенностью атрофического гастрита являются уменьшение числа специализированных гландулоцитов, обеспечивающих секреторную функцию желудка, и замещение их клетками более простыми, в том числе вырабатывающими слизь. Обширная атрофия слизистой оболочки тела желудка, как правило, ассоциируется с гипосекрецией соляной кислоты и нарушением выработки пепсиногена.

Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter pylori (Н. pylori) и аутоиммунный гастрит. Причем, с Н. pylori связывают возникновение подавляющего большинства атрофических гастритов.
Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Атрофический гастрит клинически, как правило, в течение длительного времени ничем себя не проявляет, поэтому диагноз хронического гастрита, скорее, морфологический, нежели клинический. Основным методом диагностики атрофического гастрита является эндоскопическое исследование. При эндоскопии производят осмотр пищевода, желудка, двенадцатиперстной кишки. При выраженной атрофии слизистая оболочка желудка имеет характерные отличия в сравнении с таковой при, например, поверхностном гастрите.
Окончательный диагноз позволяет установить морфологический анализ биоптатов слизистой оболочки желудка, взятых во время эндоскопии. Морфологически атрофия определяется уменьшением числа функционирующих специализированных клеток желудка. Доказано, что при Н. pylori-ассоциированном гастрите процессы атрофии чаще возникают при инфицировании определенными штаммами (Cag A+ и Vac A+) Н. pylori. Одним из морфологических признаков атрофического гастрита является кишечная метаплазия, которая традиционно рассматривалась как предраковое изменение слизистой оболочки желудка.
Другие методы исследования – рентгенография желудка, ультразвуковое исследование брюшной полости и компьютерная томография – в плане диагностики атрофического гастрита неинформативны.
Чего нужно опасаться при атрофическом гастрите? Каков прогноз болезни?
Гипотетически наличие атрофического гастрита при естественном течении может иметь два сценария. Первый – длительно существующий хронический гастрит приводит к значительному уменьшению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант – в результате длительного хронического персистирующего воспаления в слизистой оболочке желудка, характерного для Н. pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем – к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим.
По определению ВОЗ, под дисплазией понимают такие клеточные изменения, при которых часть эпителия замещена клетками с различной степенью атипии. В международной классификации эпителиальных неоплазий пищеварительного тракта (2000) дисплазия – это неоплазия, другими словами – опухоль.
Итак, атрофический гастрит может трансформироваться в рак желудка. Наибольшую опасность в плане развития рака представляет атрофический гастрит с пониженной кислотообразующей функцией желудка (частота возникновения рака – до 13%). Среди известных в настоящее время молекулярных механизмов, лежащих в основе наследственной предрасположенности к раку желудка, выделены: индукция экспрессии TGF-β1, частичный полиморфизм кластера гена IL-1 (IL-1β).
В результате развития атрофии слизистой оболочки желудка снижается ее противоопухолевая защита, создаются условия для активного воздействия канцерогенов. При возникновении тяжелой атрофии эпителия тела желудка риск развития рака желудка повышается в 5 раз в сравнении с таковым при неатрофическом гастрите.
Бактерии Н. pylori относят к биологическим канцерогенам в отношении рака желудка. Большинство исследователей считают, что Н. pylori – это основной этиологический фактор развития хронического гастрита, который является обязательным звеном в каскаде процессов, приводящих к раку желудка. На основании анализа результатов многоцентровых исследований Международное агенство по изучению рака при ВОЗ еще в 1994 году рекомендовало считать инфекцию Н. pylori абсолютным канцерогеном для человека.
В настоящее время рак желудка рассматривается как конечный результат длительного многоступенчатого и многофакторного процесса, в котором клеточные изменения слизистой оболочки желудка обусловлены нарушениями микроокружения. Этот процесс называют именем описавшего его автора – каскадом Корреа (1995). Он включает хронический гастрит, кишечную метаплазию, дисплазию и рак. Н. рylori-ассоциированный желудочный канцерогенез – многоэтапный процесс, характеризующийся развитием хронического гастрита – первой ступени в эволюционном каскаде. Последующие изменения приводят к формированию атрофии, тонкокишечной (I и II типы) и толстокишечной (III тип) метаплазий и дисплазии желудочного эпителия, в итоге – к аденокарциноме желудка. Именно атрофический гастрит занимает срединное положение в цепи вышеперечисленных изменений на пути к раку желудка.
Как избежать трансформации атрофического гастрита в рак желудка?
Ответ на данный вопрос состоит из равных по значимости частей: как можно раннее выявление предраковых изменений, их адекватное лечение и предупреждение (профилактика) проявления последних.
При наблюдении больных хроническим гастритом важно уловить тот момент, когда возникает и начинает прогрессировать атрофия слизистой оболочки желудка, причем желательно это проводить простым информативным и неинвазивным способом.
Своевременное выявление атрофии слизистой оболочки желудка – первый диагностический этап выявления риска по раку желудка.
Многочисленные исследования последних лет показали, что очаги полной и неполной кишечной метаплазии слизистой оболочки желудка нельзя расценивать в качестве достоверного маркера повышенного риска развития рака желудка. Исследования свидетельствуют, что значительно важнее оценка не типа метаплазии, а ее объема. Так, при большом объеме метаплазии, превышающем 20% поверхности желудочного эпителия, создаются реальные условия для развития дисплазии с последующим образованием аденокарциномы желудка. Следовательно, риск развития рака желудка повышается при тяжелой атрофии желудочного эпителия, характеризующейся обширными очагами кишечной метаплазии.
Как же на практике определить площадь такого поражения? Следует помнить, что данные изменения происходят на клеточном уровне, и при обычной эндоскопии их распознать невозможно. Доступным и эффективным способом диагностики метапластических изменений в слизистой оболочке желудка является метод хромогастроскопии – прижизненная окраска слизистой желудка красителем (чаще метиленовым синим), проводимая во время эндоскопического исследования. Данная методика основана на поглощении красителя очагами кишечной метаплазии, что позволяет оценить их размеры, выполнить прицельную биопсию для гистологического анализа биоптата слизистой и выявить возможную дисплазию или метаплазию.
Вместе с тем морфологическая диагностика атрофического гастрита сопряжена с рядом трудностей. Сложность постановки диагноза атрофии морфологическим методом обусловлена тем, что на ранних стадиях процесс никогда не бывает диффузным, следовательно, результаты гастробиопсии могут способствовать гипер- и гиподиагностике. При воспалении может изменяться микроскопическая картина и неадекватно оцениваться проявления атрофического гастрита из-за ложного вывода о потере желез. Высока и субъективность методики. Все это заставляет искать другие надежные пути тестирования атрофических изменений слизистой оболочки желудка.
Разработан ряд малоинвазивных гематологических тестов (тестовая панель Biohit), позволяющих избежать ошибок диагностики, дать совокупную оценку состояния слизистой оболочки желудка, степени ее атрофии и потери нормальных желез и клеток в антральном отделе и теле желудка.
Во время проведения эндоскопического исследования обязательно должна проводиться детекция на наличие Н. pylori. При этом наиболее целесообразным следует признать уреазный или гистологический методы (из гастробиоптатов) исследования.
Определение уровня сывороточного пепсиногена (S-PGІ) или соотношения содержания пепсиногена I к пепсиногену II (PGI/PGII) – неэндоскопический метод диагностики атрофического гастрита с поражением тела желудка. С увеличением степени атрофии слизистой оболочки тела желудка (потеря нормальных кислотообразующих желез) уровни S-PGI и PGI/PGII постепенно снижаются. Определение уровня гастрина в сыворотке крови, преимущественно гастрита-17 (S-G-17), может быть использовано в качестве индикатора морфологического состояния слизистой оболочки антрального отдела желудка. То есть снижение S-G-17 является биохимическим маркером атрофического гастрита с поражением антрального отдела желудка (потеря антральных G-клеток).
Снижение уровней S-G-17 и S-PGI можно рассматривать как результат прогрессирующего атрофического гастрита с потерей нормальных желез и клеток слизитой оболочки тела и антрального отдела желудка. G-17 практически полностью синтезируются и секретируются G-клетками антрального отдела желудка. Эти клетки являются компонентами нормальных антральных желез, в случае прогрессирования атрофического гастрита их количество уменьшается на фоне поражения антральных желез и появления кишечной метаплазии. При Н. pylori-ассоциированном гастрите имеется тенденция к возрастанию серологических уровней G-17 и PGI. Низкая внутрижелудочная кислотность способствует увеличению серологического уровня G-17, и наоборот.
Перманентная длительная гипо- или ахлоргидрия приводят к чрезвычайно высоким уровням G-17 в крови. Особенно часто это наблюдается при пониженной кислотности (атрофический гастрит с поражением тела желудка) в сочетании с сохраненной слизистой оболочкой антрального отдела. Такая клиническая картина наиболее характерна для аутоиммунного атрофического гастрита. Если в антральном отделе имеются сопутствующие признаки атрофии слизистой оболочки (мультифокальный атрофический гастрит), тогда содержание S-G-17 не возрастает, и тестовая панель показывает низкие значения уровней S-PGI и S-G-17.
Совокупная точность тестовой панели в диагностике атрофического гастрита – около 80% (при сопоставлении с результатами эндоскопии и биопсии). Данная тестовая панель является малоинвазивной альтернативой первоначального обследования пациентов с подозрением на желудочную атрофию и дисплазию. Она позволяет надежно выявлять пациентов с различными формами гастрита, определять локализацию и этиологию патологического процесса, оценивать вероятность развития рака желудка и выстраивать дальнейшую тактику ведения больного.
Учитывая связь возникновения атрофии желудочного эпителия и кишечной метаплазии с инфекцией Н. pylori, становится очевидным выбор метода лечения и профилактики дальнейшего прогрессирования процесса. Методом выбора является антихеликобактерная терапия.
В 2002 году японские исследователи убедительно доказали возможность регрессии метапластических изменений слизистой оболочки желудка после успешного уничтожения бактерий Н. pylori. С помощью хромоскопии им удалось установить, что в течение пяти лет после проведения успешной антихеликобактерной терапии размеры очагов кишечной метаплазии уменьшились почти в 2 раза в сравнении с исходными. В последующих исследованиях подтвердилась целесообразность такого терапевтического подхода.
В настоящее время не вызывает сомнений необходимость проведения антихеликобактерной терапии пациентам с атрофическим гастритом. Предварительные данные нескольких многоцентровых исследований по мониторингу Н. pylori-ассоциированного предрака и рака желудка свидетельствуют в пользу реверсии воспаления слизистой оболочки желудка и связанных с ней атрофии, кишечной метаплазии и генетической нестабильности. В связи с этим в идеале пациентам с Н. pylori-позитивным хроническим атрофическим гастритом необходимо проводить эрадикационную терапию, а при отсутствии эффекта – исследование с целью выявления маркеров генетической нестабильности и тщательный мониторинг.
Данная рекомендация нашла отражение в международных рекомендациях по диагностике и лечению заболеваний, ассоциированных с Н. pylori – Маастрихтском консенсусе 3 (2005). Для уничтожения бактерий Н. pylori, как и в Маастрихтском консенсусе 2 (2000), рекомендованы трех- и четырехкомпонентные схемы антибактериальных препаратов в сочетании с ингибиторами протонной помпы (ИПП) в стандартных дозах: ИПП + кларитромицин + амоксициллин и ИПП + тетрациклин + метронидазол (фуразолидон) + коллоидный висмут.
Вместе с тем следует помнить, что полное восстановление структуры слизистой оболочки при тяжелой атрофии до нормы требует длительного времени, и в ряде случаев, по всей видимости, это не возможно. В случаях, когда предопухолевые процессы не подвергаются обратному развитию либо прогрессируют, необходимо применять более радикальные методы лечения, используя арсенал современных эндоскопических операций, вплоть до резекции слизистой оболочки желудка.
Главная цель первичной профилактики атрофического гастрита – своевременное и эффективное лечение поверхностного хеликобактерного гастрита. Для этого используют стандартные схемы антихеликобактерной терапии, в соответствии с рекомендациями Маастрихтских консенсусов 2 (2000) и 3 (2005). Важным моментом является последующий контроль за успешностью этой терапии. Контроль необходимо проводить с использованием неинвазивных методов (дыхательного уреазного или стул-теста). При неудачной эрадикации проводить повторные курсы лечения.
Кроме того, доказано, что, придерживаясь здорового режима питания, можно снизить онкологический риск (прогрессирование атрофии), что подтверждено в исследованиях, проведенных в ряде стран. Рекомендуется избегать употребления консервированных, маринованных и копченых продуктов, отказаться от курения и употребления крепких спиртных напитков (особенно в сочетании с жирной, жареной, копченой и соленой пищей), исключить переедание. Необходимо контролировать массу тела, выполнять активные физические нагрузки, употреблять больше свежих овощей (в том числе лук и чеснок), фруктов и натуральных соков, витаминов А, С, b-каротина, зелени, круп грубого помола, молочных продуктов. В некоторых развитых странах Европы и США внедрение здорового образа жизни привело к снижению заболеваемости раком желудка в несколько раз, сегодня это заболевание в этих странах считается редким, составляя лишь 3% среди злокачественных новообразований.
Мониторирование – постоянное наблюдение с периодическим повторным обследованием – абсолютно обязательно для пациентов с атрофическим гастритом
Итак, в настоящее время очевидна необходимость особого внимания к атрофическому гастриту. Комплексное применение современных методов исследования – эндоскопического, морфологического, гематологического (тестовой панели) и других – способствует его точной диагностике.
Использование эффективных методов лечения и профилактики атрофического гастрита, устранение условий, которые способствуют его развитию, представляют сегодня реальную возможность улучшить прогноз этого заболевания, устранить риск развития рака желудка.
Литература
1. Е.Г. Бурдина, Е.М. Майорова, Е.В. Григорьева, И.И.Тимофеева, О.Н. Минушкин // Гастрин-17 и пепсиноген І в оценке состояния слизистой оболочки желудка // Российский медицинский журнал, 2006, №2, с. 9-11.
2. Х. Ваананен, М. Ваухконен, Т. Хэлске, И. Каариянен, М. Расмуссен, Х. Тунтури-Хихнала, Дж. Коскенпато, М. Сотка, М. Турунен, Р. Сандстрем, М.Ристиканкаре, А. Юссила, П. Сиппонен // Неэндоскопическая диагностика атрофического гастрита на основании анализа крови: корреляция между результатами гистологического исследования желудка и уровнями гастрина-17 и пепсиногена І в сыворотке // Клинические перспективы гастроэнтерологии, гепатологии, 2003, № 4, с. 26-32.
3. В.Д. Пасечников, С.З. Чуков, С.М. Котелевец / Профилактика рака желудка на основе эрадикационной терапии предопухолевых заболеваний // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2003, № 4, с. 11-19.
4. А.А. Шептулин, В.А. Киприанис / Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт – 3» // Российский журнал гастроэнтерологии гепатологии колопроктологии, 2006, № 2, с. 88-91.
5. Kim N., Lim S. H., Lee K.H. et al. Long-term effects of Helicobacter pylori eradication on intestinal metaplasia in patients with duodenal and behign gastric ulcers Dig. Dis. Sci. – 2000. – Vol. 45. – 1754-1762.
6. Malfertheiner P., Megraud F., O’Morain C. еt al. Current concepts in the management of Helicobacter pylori infection – The Maastricht 2 Concensus Report // Aliment. Pharmacol. Ther. – 2002. – Vol. 16. – P. 167-180.
СТАТТІ ЗА ТЕМОЮ
Синдром подразненого кишечнику (СПК) – хронічне захворювання, що уражає у середньому близько 10-12% населення світу, найбільш поширене на півдні Америки та найменше – у Південно-Східній Азії. СПК є доброякісним функціональним розладом, який не пов’язаний зі збільшенням смертності і не трансформується у серйозне захворювання, однак значно знижує якість життя пацієнтів.
На рак шлунка припадає близько 6% онкологічних захворювань у всьому світі, він є п’ятою за частотою злоякісною пухлиною і третьою провідною причиною смерті, пов’язаної з раком. Незважаючи на те що протягом останніх 15 років спостерігається стійке зниження рівня захворюваності та смертності від раку шлунка внаслідок зменшення поширеності Helicobacter pylori та покращення дієтичних звичок, абсолютна частота захворюваності продовжує зростати через старіння населення світу.
У статті розглянуті патогенетичні механізми виникнення дуоденогастрального рефлюксу (ДГР), дуоденогастроезофагеального рефлюксу (ДГЕР), їх ролі у виникненні жовчного рефлюкс-гастриту, рефлюкс-езофагіту. Принциповими засадами формування жовчного рефлюксу є неспроможність сфінктерного апарату, антродуоденальна дисмоторика, ліквідація природного антирефлюксного бар’єру. Факторами ризику розвитку первинного ДГР вважають дисфункцію жовчного міхура і дуоденальну дисмоторику.