продолжительность жизни после тэла
Тромбоэмболия лёгочной артерии
Диагностика
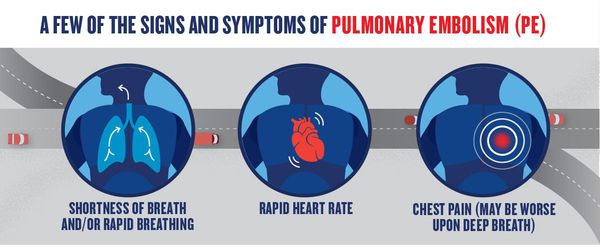
Клинические проявления ТЭЛА зависят от локализации эмболов, степени нарушения лёгочного кровотока и сопутствующих заболеваний. Клинические признаки, хотя и не специфичны, дают основание заподозрить заболевание и ориентировочно судить о локализации поражения. При эмболии дистальных ветвей лёгочных артерий у большинства больных появляются симптомы инфарктной пневмонии: резкие “плевральные” боли в груди, связанные с дыханием, одышка, кашель со скудной мокротой, лихорадка. Кровохарканье наблюдается лишь в 1/3 случаев. При объективном обследовании выявляются влажные хрипы, шум трения плевры. Слудует учитывать, во-первых, что у 60% больных инфарктная пневмония не развивается (и тогда симптомы отсутствуют), а во-вторых, на формирование инфаркта необходимо 2-3 дня после эмболии. При наличии сопутствующей патологии сердечно-сосудистой системы дистальная эмболия может проявляться коллапсом и симптомами правожелудочковой недостаточности. При массивной ТЭЛА эмболы локализуются в лёгочном стволе или главных лёгочных артериях. Она обычно проявляется симптомами острой сердечно-лёгочной недостаточности: коллапсом, выраженной одышкой, тахикардией, болью за грудиной. В случае выключения из кровообращения более 60% артериального русла лёгких, появляются увеличение печени, набухание шейных вен. При подозрении на ТЭЛА обязательны исследования: – электрокардиография – эхокардиография – рентгенография грудной клетки – перфузионная (перфузионно-вентиляцонная) сцинтиграфия лёгких или спиральная компьютерная томография или ангиопульмононография – ультразвуковое исследование магистральных вен ног.
На ЭКГ наиболее типичными признаками являются появление Q в III отведении, глубокого S в I отведении и отрицательного Т в III отведении (синдром МакГинн-Уайт), а также блокада правой ножки пучка Гиса. Возможно появление отрицательных симметричных зубцов Т в отведениях V1-3(4); подъём ST в III, aVF, aVR и V1-3(4); смещение переходной зоны к левым грудным отведениям. Только у трети пациен- тов на ЭКГ отмечаются признаки перегрузки правых отделов сердца. У 20% больных с ТЭЛА изменения на ЭКГ отсутствуют.
На рентгенограмме можно выявить расширение верхней полой вены, увеличение правых отделов сердца, выбухание конуса лёгочной артерии, высокое стояние купола диафрагмы на стороне поражения, дисковидные ателектазы, плевральный выпот, – однако все эти симптомы малоспецифичны. Единственным характерным для ТЭЛА является симптом Вестермарка: расширение корня лёгкого и обеднение лёгочного рисунка в зоне поражения, но он наблюдается лишь в 5% случаев. Тем не менее, данные рентгенографии имеют значение для исключения пневмонии, пневмоторакса, инфаркта миокарда, перикардита.
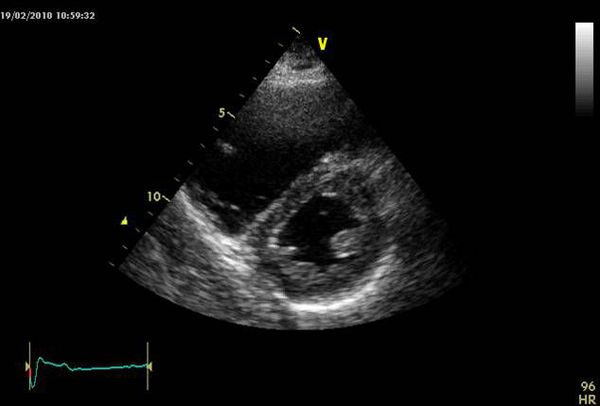
Эхокардиография может подтвердить диагноз ТЭЛА и дифференцировать её с другими острыми заболеваниями сердца. На эхокардиограмме выявляются гипокинезия и дилатация правого желудочка; парадоксальное движение межжелудочковой перегородки; трику- спидальная регургитация; отсутствие или уменьшение респираторного спадения нижней полой вены; дилатация лёгочной артерии; признаки лёгочной гипертензии.
Сцинтиграфия информативна в 87% случаев. Она демонстрирует дефекты перфузии эмболического генеза – с чёткой очерченностью, треугольной формой и расположением, соответствующим зоне кровоснабжения поражённого сосуда (доля, сегмент). При окклюзии мелких ветвей лёгочной артерии диагностическая ценность снижается.
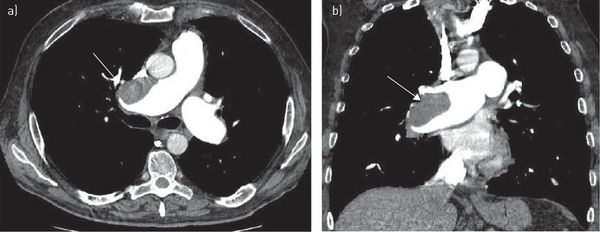
Мультиспиральная КТ с контрастированием сосудов позволяет визуализировать тромбы в лёгочной артерии, а также изменения лёгких, обусловленные другими заболеваниями, проявляющимися дефектами перфузии или наполнения. Чувствительность этого метода высока при локализации эмболов в крупных лёгочных артериях и существенно снижается при поражении субсегментарных и более мелких артерий.
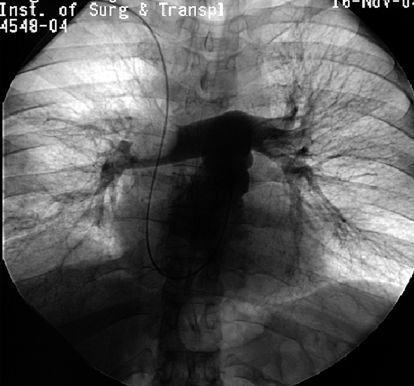
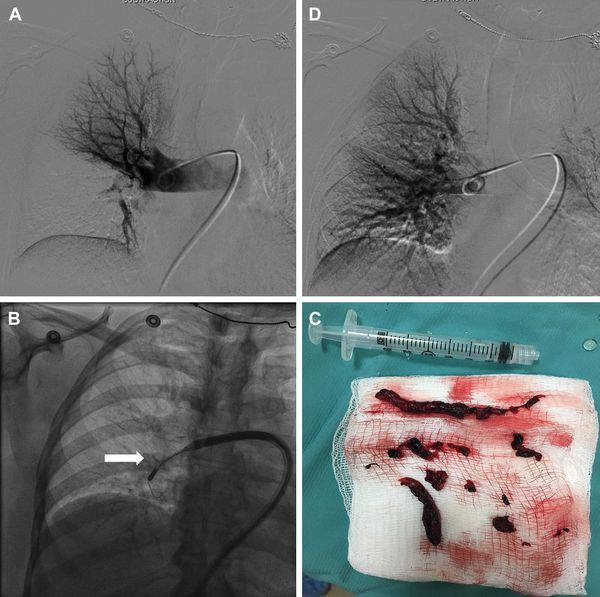
Ангиопульмонография признаётся “золотым стандартом” в диагностике ТЭЛА. Признаками эмболии при данном исследовании служат: ампутация сосуда или дефект наполнения в его просвете. Лабораторный метод определения Д-димера используется для исключения ТЭЛА. Нормальный его уровень в плазме позволяет с точностью до 90% отвергнуть предположение о наличии ТЭЛА у больных с низкой или средней клинической вероятностью. Диагноз ТЭЛА устанавливают путём анализа результатов клинического, инструментального и лабораторного исследований. Тем не менее, при жизни диагноз правильно устанавливается только у 34% больных. В то же время, в 9% случаев имеет место её гипердиагностика.
Что такое тромбоэмболия легочной артерии (ТЭЛА)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Гринберг М. В., кардиолога со стажем в 32 года.
Определение болезни. Причины заболевания
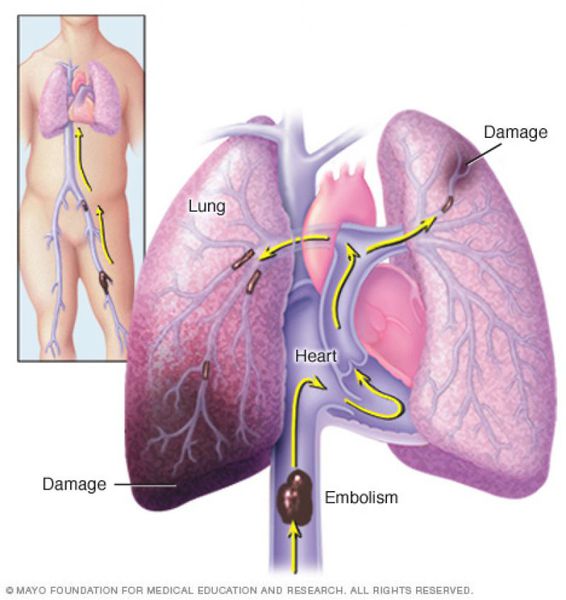
Тромбоэмболия лёгочной артерии (ТЭЛА) — это закупорка лёгочных артерий тромбами различной природы, чаще всего образующихся в крупных венах нижних конечностей или малого таза.
Факторами риска тромбоэмболии лёгочной артерии являются патологические состояния, при которых имеется нарушенный возврат венозной крови, повреждение эндотелия или эндотелиальная дисфункция и гиперкоагуляционные нарушения.
В результате тромбоэмболии лёгочных артерий прекращается кровоснабжение лёгочной ткани, развивается некроз (отмирание тканей), возникает инфаркт-пневмония, дыхательная недостаточность. Увеличивается нагрузка на правые отделы сердца, развивается правожелудочковая недостаточность кровообращения: цианоз (посинение кожи), отёки на нижних конечностях, асцит (скопление жидкости в брюшной полости). Заболевание может развиваться остро или постепенно, в течение нескольких часов или дней. В тяжёлых случаях развитие ТЭЛА происходит стремительно и может привести к резкому ухудшению состояния и гибели больного.
Каждый год от ТЭЛА умирает 0,1% населения земного шара. По частоте смертельных исходов заболевание уступает только ИБС (ишемической болезни сердца) и инсульту. Больных ТЭЛА умирает больше, чем больных СПИДом, раком молочной, предстательной желез и пострадавших в дорожно-траспортных проишествиях вместе взятых. Большинству больным (90%), умершим от ТЭЛА, вовремя не был установлен правильный диагноз, и не было проведено необходимое лечение. ТЭЛА часто возникает там, где её не ожидают — у больных некардиологическими заболеваниями (травмы, роды), осложняя их течение. Смертность при ТЭЛА достигает 30%. При своевременном оптимальном лечении смертность может быть снижена до 2-8%. [2]
Симптомы ТЭЛА зависят от величины тромбов, внезапности или постепенного появления симптомов, длительности заболевания. Течение может быть очень разным — от бессимптомного до быстро прогрессирующего, вплоть до внезапной смерти.
ТЭЛА — болезнь-призрак, которая носит маски других заболеваний сердца или лёгких. Клиника может быть инфарктоподобная, напоминать бронхиальную астму, острую пневмонию. Иногда первым проявлением болезни является правожелудочковая недостаточность кровообращения. Главное отличие — внезапное начало при отсутствии других видимых причин нарастания одышки.
Этиология
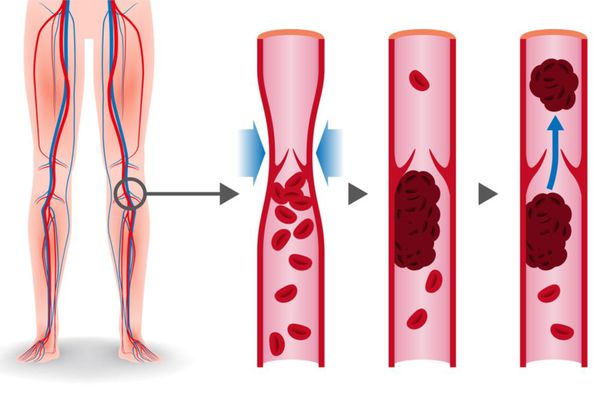
ТЭЛА развивается, как правило, в результате тромбоза глубоких вен, который развивается обычно за 3-5 дней до начала заболевания, особенно при отсутствии антикоагулянтной терапии.
Факторы риска тромбоэмболии лёгочной артерии
При диагностике учитывают наличие факторов риска тромбоэмболии. Наиболее значимые из них: перелом шейки бедра или конечности, протезирование бедренного или коленного сустава, большая операция, травма или поражение мозга.
К опасным (но не столь сильно) факторам относят: артроскопию коленного сустава, центральный венозный катетер, химиотерапию, хроническую сердечную недостаточность, гормонзаместительную терапию, злокачественные опухоли, пероральные контрацептивы, инсульт, беременность, роды, послеродовой период, тромбофилию. При злокачественных новообразованиях частота венозной тромбоэмболии составляет 15% и является второй по значимости причиной смерти этой группы больных. Химиотерапевтическое лечение увеличивает риск венозной тромбоэмболии на 47%. Ничем не спровоцированная венозная тромбоэмболия может быть ранним проявлением злокачественного новообразования, которое диагностируется в течение года у 10% пациентов эпизода ТЭЛА. [2]
К наиболее безопасным, но всё же имеющим риск, факторам относят все состояния, сопряжённые с длительной иммобилизацией (неподвижностью) — длительный (более трёх суток) постельный режим, авиаперелёты, пожилой возраст, варикозное расширение вен, лапароскопические вмешательства. [3]
Некоторые факторы риска — общие с тромбозами артериального русла. Это те же факторы риска осложнений атеросклероза и гипертонической болезни: курение, ожирение, малоподвижный образ жизни, а также сахарный диабет, гиперхолестеринемия, психологический стресс, низкий уровень употребления овощей, фруктов, рыбы, низкий уровень физической активности.
Чем больше возраст больного, тем более вероятно развитие заболевания.
Наконец, сегодня доказано существование генетической предрасположенности к ТЭЛА. Гетерозиготная форма полиморфизма V фактора увеличивает риск исходных венозных тромбоэмболий в три раза, а гомозиготная форма — в 15-20 раз.
К наиболее значимым факторам риска, способствующим развитию агрессивной тромбофилии, относятся антифосфолипидный синдром с повышением антикардиолипиновых антител и дефицит естественных антикоагулянтов: протеина С, протеина S и антитромбина III.
Симптомы тромбоэмболии легочной артерии
Симптомы заболевания разнообразны. Не существует ни одного симптома, при наличии которого можно было точно сказать, поставить диагноз ТЭЛА.
К признакам ТЭЛА относятся загрудинные инфарктоподобные боли, одышка, кашель, кровохарканье, артериальная гипотония, цианоз, синкопальные состояния (обмороки), что также может встречаться и при других различных заболеваниях.
Часто диагноз ставится после исключения острого инфаркта миокарда. Характерной особенностью одышки при ТЭЛА является возникновение её без связи с внешними причинами. Например, больной отмечает, что не может подняться на второй этаж, хотя накануне делал это без усилий. При поражении мелких ветвей лёгочной артерии симптоматика в самом начале может быть стёртой, неспецифичной. Лишь на 3-5 день появляются признаки инфаркта лёгкого: боли в грудной клетке; кашель; кровохарканье; появление плеврального выпота (скопление жидкости во внутренней полости тела). Лихорадочный синдром наблюдается в период от 2 до 12 дней.
Полный комплекс симптомов встречается лишь у каждого седьмого больного, однако 1-2 признака встречаются у всех пациентов. При поражении мелких ветвей лёгочной артерии диагноз, как правило, выставляется лишь на этапе образования инфаркта лёгкого, то есть через 3-5 суток. Иногда больные с хронической ТЭЛА длительное время наблюдаются у пульмонолога, в то время как своевременная диагностика и лечение позволяют уменьшить одышку, улучшить качество жизни и прогноз.
Поэтому с целью минимизации затрат на диагностику разработаны шкалы для определения вероятности заболевания. Эти шкалы считаются практически равноценными, но Женевская модель оказалась более приемлемой для амбулаторных пациентов, а шкала P.S.Wells — для стационарных. Они очень просты в использовании, включают в себя как основные причины (тромбоз глубоких вен, новообразования в анамнезе), так и клинические симптомы.
Параллельно с диагностикой ТЭЛА врач должен определить источник тромбоза, и это довольно трудная задача, так как образование тромбов в венах нижних конечностей часто протекает бессимптомно.
Патогенез тромбоэмболии легочной артерии
В основе патогенеза лежит механизм венозного тромбоза. Тромбы в венах образуются вследствие снижения скорости венозного кровотока из-за выключения пассивного сокращения венозной стенки при отсутствии мышечных сокращений, варикозном расширении вен, сдавлении их объёмными образованиями. На сегодняшний день врачи не могут поставить диагноз расширение вен малого таза (у 40% больных). Венозный тромбоз может развиваться при:
Тромбы могут быть обнаружены с помощью ультразвука. Опасными являются те, которые прикреплены к стенке сосуда и двигаются в просвете. Они могут оторваться и с током крови переместиться в лёгочную артерию. [1]
Гемодинамические последствия тромбоза проявляются при поражении свыше 30-50% объёма лёгочного русла. Эмболизация сосудов лёгких приводит к повышению сопротивления в сосудах малого круга кровообращения, повышению нагрузки на правый желудочек, формированию острой правожелудочковой недостаточности. Однако тяжесть поражения сосудистого русла определяется не только и не столько объёмом тромбоза артерий, сколько гиперактивацией нейрогуморальных систем, повышенным выбросом серотонина, тромбоксана, гистамина, что приводит к вазоконстрикции (сужению просвета кровеносных сосудов) и резкому повышению давления в лёгочной артерии. Страдает перенос кислорода, появляется гиперкапния (увеличивается уровень содержания углекислого газа в крови). Правый желудочек дилятируется (расширяется), возникает трикуспидальная недостаточность, нарушение коронарного кровотока. Снижается сердечный выброс, что приводит к уменьшению наполнения левого желудочка с развитием его диастолической дисфункции. Развивающаяся при этом системная гипотензия (снижение артериального давления) может сопровождаться обмороком, коллапсом, кардиогенным шоком, вплоть до клинической смерти.
Возможная временная стабилизация артериального давления создает иллюзию гемодинамической стабильности пациента. Однако через 24-48 часов развивается вторая волна падения артериального давления, причиной которой являются повторные тромбоэмболии, продолжающийся тромбоз вследствие недостаточной антикоагулянтной терапии. Системная гипоксия и недостаточность коронарной перфузии (прохождения крови) обусловливают возникновение порочного круга, приводящего к прогрессированию правожелудочковой недостаточности кровообращения.
Эмболы небольшого размера не ухудшают общего состояния, могут проявляться кровохарканьем, ограниченными инфаркт-пневмониями. [5]
Классификация и стадии развития тромбоэмболии легочной артерии
Существует несколько классификаций ТЭЛА: по остроте процесса, по объёму поражённого русла и по скорости развития, но все они сложны при клиническом применении.
По объёму поражённого сосудистого русла различают следующие виды ТЭЛА:
Клиническое течение ТЭЛА бывает острейшим («молниеносным»), острым, подострым (затяжным) и хроническим рецидивирующим. Как правило, скорость течения заболевания связана с объёмом тромбирования ветвей лёгочных артерий.
По степени тяжести выделяют тяжёлую (регистрируется у 16-35%), среднетяжёлую (у 45-57%) и лёгкую форму (у 15-27%) развития заболевания.
Большее значение для определения прогноза больных с ТЭЛА имеет стратификация риска по современным шкалам (PESI, sPESI), включающий 11 клинических показателей. На основании этого индекса пациент относится к одному из пяти классов (I-V), в которых 30-дневная летальность варьирует от 1 до 25%.
Осложнения тромбоэмболии легочной артерии
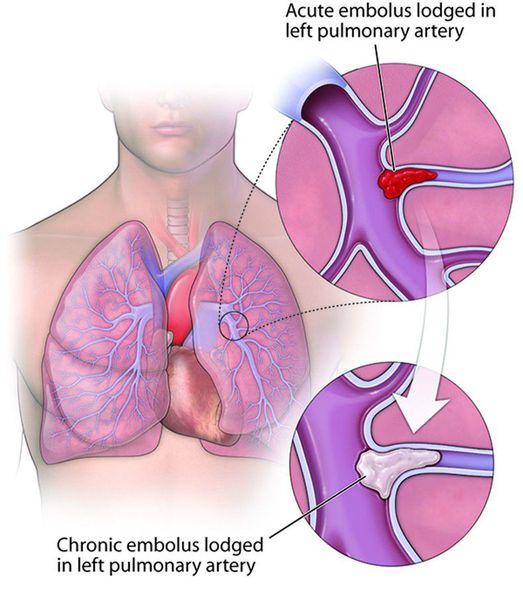
Острая ТЭЛА может служить причиной остановки сердца и внезапной смерти. При постепенном развитии возникает хроническая тромбоэмболическая лёгочная гипертензия, прогрессирующая правожелудочковая недостаточность кровообращения.
Хроническая тромбоэмболическая лёгочная гипертензия (ХТЭЛГ) — форма заболевания, при которой происходит тромботическая обструкция мелких и средних ветвей лёгочной артерии, вследствие чего повышается давление в лёгочной артерии и увеличивается нагрузка на правые отделы сердца (предсердие и желудочек).
ХТЭЛГ — уникальная форма заболевания, потому что может быть потенциально излечима хирургическими и терапевтическими методами. Диагноз устанавливается на основании данных катетеризации лёгочной артерии: повышения давления в лёгочной артерии выше 25 мм рт. ст., повышения лёгочного сосудистого сопротивления выше 2 ЕД Вуда, выявления эмболов в лёгочных артериях на фоне продолжительной антикоагулянтной терапии более 3-5 месяцев.
Тяжёлым осложнением ХТЭЛГ является прогрессирующая правожелудочковая недостаточность кровообращения. Характерным является слабость, сердцебиение, снижение переносимости нагрузок, появление отёков на нижних конечностях, накопление жидкости в брюшной полости (асцит), грудной клетке (гидроторакс), сердечной сумке (гидроперикард). При этом одышка в горизонтальном положении отсутствует, застоя крови в лёгких нет. Часто именно с такими симптомами пациент впервые попадает к кардиологу. Данные о других причинах болезни отсутствуют. Длительная декомпенсация кровообращения вызывает дистрофию внутренних органов, белковое голодание, снижение массы тела. Прогноз чаще всего неблагоприятный, возможна временная стабилизация состояния на фоне медикаментозной терапии, но резервы сердца быстро исчерпываются, отёки прогрессируют, продолжительность жизни редко превышает 2 года.
Диагностика тромбоэмболии легочной артерии
Методы диагностики ТЭЛА, применяемые к конкретным больным, зависят прежде всего от определения вероятности заболевания, тяжести состояния пациента и возможностей лечебных учреждений.
Для диагностики ТЭЛА используется следующий алгоритм:
Оценка клинической вероятности
При оценке вероятности ТЭЛА учитывают следующие факторы: операция или перелом в предшествующий месяц, злокачественная опухоль, возраст старше 65 лет, кровохарканье, боль в нижней конечности с одной стороны, высокая частота сердечных сокращений.
Анализы для диагностики ТЭЛА
Метод определения D-димера доказал свою высокую значимость при подозрении на ТЭЛА. Однако тест не является абсолютно специфичным, так как повышенные результаты встречаются и при отсутствии тромбоза, например, у беременных, пожилых людей, при фибрилляции предсердий, злокачественных новообразованиях. Поэтому пациентам с высокой вероятностью заболевания это исследование не показано. Однако при низкой вероятности тест достаточно информативен для исключения тромбообразования в сосудистом русле.
В случаях подозрения и при доказанности ТЭЛА дополнительными лабораторными исследованиями являются сердечные маркеры:
Компьютерная томография
Компьютерная томография грудной клетки с контрастированием сосудов — высокодоказательный метод диагностики тромбоэмболии лёгочной артерии. Позволяет визуализировать как крупные, так и мелкие ветви лёгочной артерии.
При невозможности выполнения КТ грудной клетки (беременность, непереносимость йодсодержащих контрастных веществ и т.д.) возможно выполнение планарной вентиляционно-перфузионной (V/Q) сцинтиграфии лёгких. Этот метод может быть рекомендован многим категориям больных, однако на сегодняшний день он остаётся малодоступным.
Зондирование правых отделов сердца и ангиопульмонография является наиболее информативным в настоящее время методом. С его помощью можно точно определить как факт эмболии, так и объём поражения. [6]
К сожалению, не все клиники оснащены изотопными и ангиографическими лабораториями. Но выполнение скрининговых методик при первичном обращении пациента — ЭКГ, обзорная рентгенография грудной клетки, УЗИ сердца, УЗДГ вен нижних конечностей — позволяет направить больного на МСКТ (многосрезовую спиральную компьютерную томографию) и дальнейшее обследование.
ЭКГ при ТЭЛА
На первом месте по своей диагностической значимости среди инструментальных методов обследования находится электрокардиография, которая должна выполняться всем пациентам. Патологические изменения на ЭКГ — остро возникшая перегрузка правого предсердия и желудочка, сложные нарушения ритма, признаки недостаточности коронарного кровотока — позволяют заподозрить заболевание и выбрать правильную тактику, определяя тяжесть прогноза.
Оценка размеров и функции правого желудочка, степени трикуспидальной недостаточности по ЭХОКГ позволяет получить важную информацию о состоянии кровотока, давлении в лёгочной артерии, исключает другие причины тяжёлого состояния пациента, такие как тампонада перикарда, диссекцию (рассечение) аорты и другие. Однако это не всегда выполнимо в связи с узким ультразвуковым окном, ожирением пациента, невозможностью организовать круглосуточную службу УЗИ, часто с отсутствием чрезпищеводного датчика.
УЗИ при ТЭЛА
Для определения тромбоза глубоких вен высокую чувствительность и специфичность имеет УЗИ вен нижних конечностей, которое для скрининга может проводиться в четырёх точках: паховых и подколенных областях с обеих сторон. Увеличение зоны исследования повышает диагностическую ценность метода.
Лечение тромбоэмболии легочной артерии
Основная цель лечения при тромбоэмболии лёгочной артерии — сохранение жизни больного и профилактика формирования хронической лёгочной гипертензии. В первую очередь для этого необходимо остановить процесс тромбообразования в лёгочной артерии, который, как уже говорилось выше, происходит не одномоментно, а в течение нескольких часов или дней.
Методы лечения ТЭЛА в острую фазу:
Подбор схем приёма препаратов при системном тромболизисе проводит врач, они могут отличаться в зависимости от состояния пациента.
Хирургические процедуры
Для лечения ТЭЛА высокого риска при массивном тромбозе показано восстановление проходимости закупоренных артерий — хирургическая тромбэктомия, так как это приводит к нормализации гемодинамики.
Для определения стратегии лечения и риска смерти в настоящее время предпочтительными шкалами в ранний период ТЭЛА являются шкалы PESI и sPESI, но только при лечении ТЭЛА низкого риска и у пациентов со стабильной гемодинамикой.
Продолжительность жизни после тэла
ВТЭ — венозная тромбоэмболия
ИМТ — индекс массы тела
ЛА — легочная артерия
ТГВ — тромбоз глубоких вен
ТЭЛА — тромбоэмболия легочной артерии
ЧСС — частота сердечных сокращений
Несмотря на активный поиск, ведущийся терапевтами, фармакологами, гемостазиологами на протяжении последних десятилетий во всем мире, тромбоэмболия легочной артерии (ТЭЛА) является одной из самых драматических ургентных ситуаций, занимая третье место среди причин смерти от сердечно-сосудистых заболеваний [1—4]. Результаты крупных патолого-анатомических исследований свидетельствуют о наличии ТЭЛА в 9—28% (в среднем 13%) случаев летальных исходов, наступивших как в стационарах, так и в домашних условиях [5—7]. К сожалению, этот показатель не претерпел существенных изменений на протяжении последних 60 лет [8, 9].
Проблема правильного установления диагноза и своевременного начала антикоагулянтной терапии связана с отсутствием надежных предикторов развития заболевания и часто с его бессимптомным течением. Это обусловливает высокий процент как гипо-, так и гипердиагностики. Прижизненно ТЭЛА не распознается приблизительно в 84% случаев (80—93%) [10—12].
На протяжении длительного времени возраст рассматривался в качестве независимого фактора развития (ФР) развития ТЭЛА [13, 14]. Исследователи объясняли увеличение риска развития ТЭЛА у пожилых пациентов необратимыми анатомическими изменениями венозной системы, приводящими к замедлению кровотока и увеличению свертываемости крови, что подтверждалось мнением о прямо пропорциональной зависимости летальности от возраста [15]. Это обстоятельство объясняет причину активного исследования клинической картины, диагностических подходов и мер профилактики ТЭЛА у лиц старших возрастных групп. Пациентов моложе 40 лет относили в группу низкого риска развития ТЭЛА и в большинстве случаев им не рекомендовали профилактическую антикоагулянтную терапию даже перед хирургическим вмешательством [16, 17].
Однако проведенные в последнее время исследования ставят под сомнение возраст в качестве независимого ФР развития ТЭЛА, объясняя рост заболеваемости увеличением количества сопутствующей патологии.
Целью настоящего исследования явилось изучение ФР, особенностей клинического течения фатальной ТЭЛА у лиц молодого возраста.
Материалы и методы
Проведен ретроспективный анализ историй болезни 32 пациентов (все мужчины), умерших от ТЭЛА в разных лечебных учреждениях Москвы в период с 2002 по 2010 г. Средний возраст умерших составил 39 лет (от 18 до 50 лет) (табл. 1).
Из 32 больных 13 (41%) до развития ТЭЛА находились в кардиологических отделениях (табл. 2). 
Кроме того, 10 (41%) больных из 31 до развития ТЭЛА находились на лечении по поводу неопластических процессов в различных отделениях онкологического профиля (радиологическом, химиотерапевтическом). Характеристика основной патологии и проводимого лечения представлена в табл. 3.
Причиной госпитализации большинства больных в хирургические отделения была сосудистая патология. Тромбофлебиты глубоких вен нижних конечностей диагностированы у 4 (16%) больных, из них в одном случае был установлен острый илеофеморальный тромбоз. Причиной госпитализации 1 (4%) пациента была плановая операция по поводу спаечной болезни тонкой кишки.
В травматологическом отделении до развития ТЭЛА находились 4 (16%) пациента. Причиной госпитализации 50% из них явились множественные переломы конечностей вследствие дорожно-транспортных происшествий.
Средний срок нахождения на стационарном лечении до развития ТЭЛА составил 23±4 дня (от 122 дней до 4 ч).
Результаты
Ретроспективный анализ выявил, что все больные имели как минимум два ФР развития ТЭЛА (табл. 4). 
Наибольшим удельным весом (54%) среди ФР обладал длительный (более 5 дней) постельный режим, обусловленный хирургическим вмешательством или тяжелым основным заболеванием (перенесенная травма, злокачественная опухоль).
Анализ вредных привычек выявил, что 17 (53%) пациентов являлись курильщиками. Среди них 5 (15%) курили более 1 пачки сигарет в сутки в течение более 10 лет.
Характер онкологической патологии, явившейся причиной госпитализации, указан в табл. 3. Дополнительно к этому онкологические заболевания в анамнезе имелись у 4 больных: радикальная операция в связи с раком желудка у 2 (6%) больных, раком почки — у 1 (3%), базалиома кожи — у 1 (3%).
Ожирение диагностировано у 9 больных, причем у 5 (15%) ожирение III степени (индекс массы тела — ИМТ 28,5±5 кг/м2), у 4 (12,5%) IV степени (ИМТ 30,1±4 кг/м2). На этом фоне сахарный диабет был диагностирован у 5 (16%) пациентов, у одного больного выявлено нарушение толерантности к глюкозе.
Травма явилась ФР развития венозной тромбоэмболии (ВТЭ) в 4 (12,5%) случаях. Переломы длинных трубчатых костей (бедренной, большеберцовой) диагностированы у 2 (7%) больных. Политравма (с множественными переломами костей конечностей, позвоночника, ушибом головного мозга, гематомами мягких тканей — туловища) как результат дорожно-транспортного происшествия явилась ФР развития заболевания у 2 (7%) человек.
Анализ в целях выявления тромбофилии выполнен 18 (54%) больным. Тромбофилические состояния выявлены у 3 (9%): мутация гена протромбина G20210А у 1 (3%), мутация гена ингибитора активатора плазминогена G4/G5 у 1 (3%), гипергомоцистеинемия у 1 (3%).
Источником ТЭЛА во всех случаях явились глубокие вены нижних конечностей. При этом прижизненно тромбоз диагностирован у 25 (75%) человек. В 2 (6%) случаях первичный тромбоэмбол локализовался непосредственно в нижней полой вене, в 6 (18%) — в илеофеморальном сегменте, в 9 (27%) — в бедренной вене, в 8 (24%) — в различных сегментах глубоких вен голеней.
Чаще всего первичный тромбоз глубоких вен (ТГВ) нижних конечностей проявлялся в течение 5—7 дней после госпитализации — у 15 (45%) из 32 больных. В эти сроки был диагностирован ТГВ голеней у 6 (18%) человек, илеофеморальный тромбоз — у 5 (15%), тромбоз нижней полой вены — у 2 (6%), бедренной вены — у 2 (6%). В период 9—11 сут нахождения в стационаре ТГВ голеней был диагностирован у 2 (6%) человек и илеофеморальный тромбоз — у 1 (3%). Существенно позже происходило образование тромба в бедренной вене, который был диагностирован на 13—14-е сутки пребывания в стационаре у 6 (18%) больных, на 15—17-е сутки — у 1 (3%).
У 4 пациентов первичный источник тромбообразования был выявлен постмортально. Во всех случаях он был локализован в илеофеморальном сегменте. В 3 (9%) случаях первичный источник тромбоза не установлен даже при тщательном патолого-анатомическом исследовании.
Флотирующие тромбы диагностированы у 11 (33%) больных.
Ретроспективный анализ выявил, что в 15 (45%) случаях ТЭЛА дебютировала симптомами нарушения сознания — от кратковременной потери сознания у 9 (27%) человек до развития коматозного состояния у 6 (18%).
Наиболее типичной жалобой в большинстве случаев являлась одышка, которая была отмечена у всех больных, причем из 32 пациентов у 21 (63%) она носила характер удушья. Жалобы на учащенное сердцебиение предъявляли 28 (84%) больных, холодный, липкий пот отмечали 8 (24%) пациентов.
Физическое обследование выявило следующие признаки. Бледность кожных покровов при осмотре врачи зафиксировали в 15 (45%) случаях, акроцианоз — в 10 (30%), диффузный цианоз — в 7 (21%), набухание шейных вен — в 5 (15%). У 15 (45%) человек осмотр выявил отеки нижних конечностей, в том числе несимметричные у 9 (27%).
У большинства больных в дебюте заболевания отмечалась одышка (средняя частота дыханий составила 28±6 в минуту).
Отставание одной половины грудной клетки при дыхании выявлено у 5 (15%) больных, локальное притупление перкуторного звука — у 6 (18%), ослабленное везикулярное дыхание выслушивалось у 5 (15%) пациентов, влажные хрипы в легких — у 6 (18%), шум трения плевры — у 10 (30%).
Характерными симптомами поражения сердечно-сосудистой системы были тахикардия и артериальная гипотония. Средняя частота сердечных сокращений (ЧСС) достигала 111±17 в 1 мин.
Среднее систолическое артериальное давление (АД) составило 78±11 мм рт.ст. Лишь в 2 (6%) случаях систолическое АД оставалось в пределах нормы. Снижение диастолического АД менее 60 мм рт.ст. зафиксировано у 24 (72%) человек, при этом средний уровень диастолического АД составил 54±9 мм рт.ст.
Ретроспективный анализ электрокардиограммы (ЭКГ) выявил следующие признаки. Пароксизм фибрилляции предсердий зафиксирован у 3 (9%) больных. В большинстве случаев наблюдалась тахикардия (средняя ЧСС 125±25 в 1 мин). Блокада правой ножки пучка Гиса отмечена в 6 (19%) случаях. Подъем сегмента ST в отведениях AVR, AVF, V1-3 — у 3 (9%), признаки P-pulmonale — у 4 (12%), глубокий отрицательный зубец Т в V1—V3 — у 4 (12%).
При рентгенографии легких признаки инфильтрации легочной ткани выявлены в 11 (34%) случаях, наличие плеврального выпота — в 9 (28%).
Сцинтиграфия легких была выполнена 9 больным. Она выявила единичные дефекты перфузии в 4 (12,5%) случаях и множественные в 5 (15%). Из них «четкие» дефекты перфузии треугольной формы наблюдались в 7 (22%) из 32 случаев.
У 5 (15%) человек выполнена ангиопульмонография, выявившая в 2 случаях крупные дефекты наполнения в правой и левой легочной артерии — ЛА (окклюзию левой, субокклюзию правой ЛА). У 1 больного диагностирована окклюзия левой ЛА.
Множественные дефекты наполнения в сегментарных артериях верхней доли левого легкого визуализировались в 1 случае. У 1 (3%) больного не обнаружено прямых признаков ТЭЛА, однако визуализировалось существенное расширение легочного ствола, правой и левой ЛА.
Прижизненно диагноз ТЭЛА был установлен в 19 (59%) случаях. В связи с установлением массивного объема поражения у 2 (6,2%) больных проводилась тромболитическая терапия, в остальных случаях пациенты получали гепарин (9, или 28,1%) либо подкожное введение низкомолекулярных гепаринов (8, или 25%).
По данным патолого-анатомического исследования, у 27 (84%) больных выявлена эмболия ствола или главных ветвей ЛА, у 4 (12%) — эмболия долевых и сегментарных артерий. В 1 случае причиной летального исхода послужил тромбоз мелких ветвей ЛА.
Признаки инфаркт-пневмонии выявлены у 8 (25%) пациентов.
Обсуждение
Проведенный анализ ФР развития фатальной ТЭЛА у лиц молодого возраста выявил отсутствие случаев идиопатической тромбоэмболии. Каждый больной имел как минимум два ФР. Согласно последним исследованиям большие хирургические операции, тяжелые травмы, переломы нижних конечностей (костей голени, бедренной кости), протезирование тазобедренных или коленных суставов относят к «сильно предрасполагающим факторам» развития ТЭЛА с относительным риском более 10 [18, 19].
Химиотерапия, хроническая сердечная или дыхательная недостаточность, злокачественные новообразования, наследственные тромбофилии — это предрасполагающие факторы средней силы (относительный риск 2—9). Впервые взаимосвязь между злокачественными опухолями и ВТЭ открыта A. Trousseau у больных со скрыто протекающим раком. С патогенетических позиций это объяснимо склонностью онкологических больных к тромбофилии вследствие продукции веществ с прокоагулянтными свойствами, в частности тканевого фактора и ракового прокоагулянта. Клинически явные ТЭЛА развиваются у 10% больных раком и служат второй по частоте причиной смерти. В то же время примерно 20% больных с симптомами ТГВ имеют установленный до этого онкологический диагноз. У 75% больных, страдающих ВТЭ и раком, диагноз онкологического заболевания установлен к моменту сосудистой катастрофы. Однако ТЭЛА может предшествовать диагностике злокачественной опухоли за месяцы и даже годы. Наиболее часто тромботические осложнения развиваются при раке легких, поджелудочной железы, колоректальном раке, раке простаты и почек [15, 20, 21].
Хроническая сердечная недостаточность имелась приблизительно у 1 /3 больных. Обычно угрожающую жизни ТЭЛА связывают с массивной эмболией, определяемой как обструкция 50% легочных сосудов или окклюзия 2 долевых артерий и более. Однако массивная ТЭЛА ответственна лишь за 50% смертельных исходов, остальные приходятся на субмассивные и повторные эмболии. Таким образом, исходы ТЭЛА определяются не только размерами тромбов и площадью окклюзированного сосудистого русла, но также сопутствующими заболеваниями [22]. Показано, что массивные эмболии у больных с хорошим сердечно-легочным резервом компенсации и субмассивные эмболии у больных с предсуществующими сердечно-легочными заболеваниями манифестируют одинаковыми гемодинамическими изменениями и имеют сравнимые исходы [23]. Таким образом, с целью прогнозирования исхода ТЭЛА целесообразно в совокупности рассматривать размер эмболов и функциональное состояние сердца и легких.
Постельный режим и ожирение относятся экспертами к предрасполагающим факторам слабой силы.
Особого внимания заслуживает широкое распространение среди больных с фатальной ТЭЛА привычки табакокурения. Российская Федерация относится к странам с очень высокой распространенностью потребления табачных изделий. Фармакологическое действие никотина разнообразно. Предрасположенность курильщиков к ВТЭ прежде всего объясняется увеличением факторов свертываемости крови.
Поиск ФР должен проводиться не только с диагностической целью (их выявление важно при сборе анамнеза и учитывается при оценке клинической вероятности диагноза), но и для подбора адекватных профилактических мер.
Венозный тромбоз любой локализации может осложниться развитием ТЭЛА. Наиболее эмболоопасной его локализацией является бассейн нижней полой вены, с которым связано около 90% всех ТЭЛА [24]. Во всех случаях нашего исследования первичный источник тромбообразования локализовался в системе нижней полой вены. Чаще всего первичный тромб находился в илеокавальном сегменте или в проксимальных отделах вен нижних конечностей (подколенно-бедренный сегмент). Согласно данным литературы, подобная локализация венозного тромбоза осложняется ТЭЛА в 50% случаев. Венозный тромбоз с локализацией в дистальных отделах глубоких вен нижних конечностей (голень) осложняется ТЭЛА от 1 до 5% [25]. В нашем исследовании первичный источник тромбообразования данной локализации встречался приблизительно в 1 /4 случаев.
В нескольких случаях патолого-анатомическое исследование не выявило первичного источника тромбообразования. Согласно проведенным исследованиям признаки ТГВ обнаруживают в среднем в 70% ТЭЛА, в остальных случаях, когда тромб в венах не обнаруживается, эксперты полагают, что он оторвался полностью и весь попал в легкие [26].
Наиболее опасными для развития ТЭЛА являются флотирующие тромбы, имеющие точку фиксации в дистальном отделе венозного русла. Остальная его часть расположена свободно и на всем протяжении не связана со стенками вены, причем их протяженность может достигать 20 см. Флотирующий тромб обычно формируется в венах меньшего калибра, и процесс тромбообразования распространяется проксимально в более крупные: из глубоких вен голени — в подколенную вену, затем в глубокую и общую бедренную вены, из внутренней — в общую подвздошную, из общей подвздошной — в нижнюю полую вену. В нашем исследовании частота флотирующих тромбов превысила 30%.
Первичный источник тромбообразования был выявлен благодаря использованию ультразвуковых методов диагностики у 75% больных. Согласно данным литературы, флеботромбозы бессимптомны в 50% случаев [3, 6]. Развитие клинической картины ТГВ зависит от протяженности тромбоза, степени окклюзии и наличия воспаления. Большинство клинически явных венозных тромбозов начинается с ТГВ голени, но клиническая картина появляется только при распространении тромбоза на проксимальные вены [11].
В 90% случаев подозрение на ТЭЛА основывается на таких симптомах, как одышка, боли в грудной клетке, потеря сознания, появляющихся изолированно или в различных сочетаниях [27]. Потеря сознания — нечастая, но клинически важная манифестация ТЭЛА, так как отражает критическое падение гемодинамики. В наиболее тяжелых случаях отмечается артериальная гипотония вплоть до развития шока. Плевральные боли (в сочетании с одышкой или самостоятельные) — один из самых частых симптомов ТЭЛА. Обычно они появляются при дистальных эмболиях и связаны с раздражением листков плевры вследствие кровоизлияния в альвеолы, которое иногда сопровождается кровохарканьем (синдром инфаркта легкого) [12].
Изолированная внезапная одышка характерна для более центральных эмболий, при которых нарушения гемодинамики выражены в гораздо большей степени, чем при синдроме инфаркта легкого. Она может сопровождаться напоминающими стенокардию загрудинными болями, которые являются отражением ишемии правого желудочка. Изредка единственным проявлением ТЭЛА может стать нарастающая в течение нескольких недель одышка. В этих случаях диагноз ставится путем исключения других классических причин прогрессирующей одышки. При развитии ТЭЛА на фоне сердечной недостаточности или легочных заболеваний единственным проявлением может оказаться усиление одышки [17, 21].
Отсутствие таких наиболее часто встречающихся при ТЭЛА симптомов, как боль в грудной клетке, одышка и тахикардия, ставят диагноз ТЭЛА под сомнение [16].
Клиническая картина у большинства больных в нашем исследовании соответствовала массивной острой ТЭЛА. Вследствие тяжелых расстройств центральной и легочной гемодинамики состояние больных резко ухудшалось: нарастала одышка, достигающая приступов удушья, развивались обмороки вследствие гипоксемии и низкого сердечного выброса. У большинства больных наблюдались снижение АД и коллапс. Данные физического обследования отражали сниженный сердечный выброс — резко выраженную тахикардию, артериальную гипотонию; при осмотре обращали внимание холодные конечности. Ни в одном случае не отмечено жалоб на кровохарканье или боль.
Электрокардиография является наиболее доступным методом исследования. В нашей работе были выявлены характерные нарушения ритма, проводимости, вольтажа желудочковых комплексом и процесса реполяризации, признаки перегрузки правых отделов сердца. Указанные изменения ЭКГ встречаются всего в 15—40% случаев и чаще наблюдаются при закупорке просвета ЛА на 50% или более [28]. ЭКГ остается нормальной более чем в 27% случаев ТЭЛА. Фоновые заболевания сердца могут давать изменения ЭКГ, сходные с таковыми при ТЭЛА, еще больше снижая специфичность метода [29].
Признаки плеврального выпота выявлены в нашем исследовании рентгенологическим методом в 28% случаев. Согласно данным литературы, плевральный выпот определяется в 51% случаев ТЭЛА при рентгенографическом исследовании, в 57% — при компьютерной томографии и в 70% — при трансторакальном УЗИ [30—32].
Однако частота развития плеврального выпота при ТЭЛА недооценивается: объем выпота зачастую настолько мал, что не распознается при обычной рентгенографии грудной клетки.
К сожалению, эхокардиография была выполнена не всем больным. Однако все проведенные исследования подтвердили высокую легочную гипертензию.
Обычно единственным проявлением ТЭЛА при обструкции до 25% легочного сосудистого русла служит артериальная гипоксемия. При увеличении объема эмболии до 25—30% к артериальной гипоксемии присоединяется повышение давления в ЛА. При обструкции 50% сосудистого ложа давление в ЛА достигает 40 мм рт.ст. — максимальное давление, которое способен генерировать здоровый правый желудочек. Для поддержания кровотока при массивной или рецидивирующей ТЭЛА с поражением 75% бассейна ЛА требуется повышение давления более 40 мм рт.ст.; такая ТЭЛА сопровождается развитием правожелудочковой недостаточности и шока [33].
У больных с анамнезом, отягощенным заболеваниями сердечно-сосудистой и дыхательной систем, не существует жесткой зависимости между уровнем давления в ЛА и степенью обструкции [34, 35]. Гуморальные факторы (фактор активации тромбоцитов, серотонин, катехоламины, аденозиндифосфат и др.), высвобождающиеся в момент эмболии из входящих в состав тромба тромбоцитов, вызывают выраженный спазм сосудов. Даже при развитии небольшой по объему эмболии у больных, до развития ТЭЛА страдавших тяжелыми сердечно-легочными заболеваниями, характерна высокая легочная гипертония.
Заключение
ТЭЛА осложняет течение многих заболеваний терапевтического профиля у пациентов разного возраста.
Проведенный анализ ФР развития фатальной ТЭЛА у лиц молодого возраста выявил отсутствие случаев идиопатической тромбоэмболии. Каждый больной имел как минимум два ФР. Особого внимания заслуживает широкое распространение у больных с фатальной ТЭЛА привычки табакокурения. Поиск ФР должен проводиться не только с диагностической целью (их выявление важно при сборе анамнеза и учитывается при оценке клинической вероятности диагноза), но и для подбора адекватных профилактических мер.
Остро развивающаяся распространенная обструкция легочного сосудистого русла с поражением преимущественно главных артерий у большинства больных приводила к правожелудочковой недостаточности и внезапной смерти.
Антикоагулянтную профилактику тромбозов должны получать все госпитализированные больные с застойной сердечной недостаточностью, тяжелыми заболеваниями дыхательной системы, нуждающиеся в длительном постельном режиме, а также при наличии одного или нескольких дополнительных ФР: имеющееся онкологическое заболевание, сепсис, воспалительные заболевания кишечника, острое неврологическое заболевание, эпизоды ВТЭ в анамнезе.