продолжительность жизни клеток человека
Тело человека полностью обновляется каждые семь лет
Познай себя; люби себя; будь честен с собой. Эти старые истины много лет воспевали художники, музыканты и философы, от Жан-Поль Сартра до Боба Дилана. Но как познать себя, если ты постоянно меняешься? Человеческое тело пребывает в постоянном движении: теряет и наращивает кожу, обновляет легкие, выращивает новые волосы.
По мнению ученых, тело заменяет себя полностью новым набором клеток каждые семь-десять лет, а некоторые наши важнейшие части организма обновляются еще быстрее.
Некоторые из вас могут подумать: «Что ж, это объясняет, почему мои жена/брат/отец ведут себя как маленькие дети». Другие могут подумать, что новые клетки могу быть ключом к долгой жизни. К сожалению, все намного сложнее.
Омоложение тела
В начале 50-х годов ученые обнаружили силу омоложения организма за счет — серьезно — внедрения в объекты радиоактивных атомов и наблюдения за их движений. Они выяснили, что в среднем 98% атомов в теле — небольших частиц материи, которые образуют молекулы и клетки тела — заменяются каждый год. Большинство новых атомов принимаются вместе с воздухом, которым мы дышим, едой, которую едим, и жидкостью, которую пьем.
Фрисен обнаружил, что клетки тела по большей части заменяют себя каждые 7-10 лет. Другими словами, старые клетки умирают и заменяются новыми в течение этого промежутка времени. Процесс обновления клеток происходит быстрее в некоторых частях тела, но полное омоложение от пальцев ног до головы занимает порядка десяти лет.
Это объясняет, почему чешуйки нашей кожи отваливаются, ногти растут, а волосы выпадают. Но если мы постоянно наполняемся новыми клетками, почему тело стареет? Разве новые клетки не должны действовать как укол ботокса? Когда речь заходит о старении, оказывается, что секрет его заключается не в наших клетках, а в клеточной ДНК.
Продолжительность жизни клеток
Тело обновляется разными методами. Время работы клеток в определенных участках тела зависит от того, что от них требуется. Красные кровяные клетки, например, живут в течение четырех месяцев, поскольку от них требуется прохождение трудного пути через кровеносную систему и доставка кислорода к тканям всего тела.
А вот сколько живут другие клетки.
Несмотря на всю эту постоянную регенерацию, люди, которые хотят жить вечно, не должны прекращать поисков источника молодости. Дело в том, что мы продолжаем стареть и постепенно умираем. Фрисен и другие считают, что это может быть из-за мутаций ДНК, которые ухудшаются, переходя к новым клеткам с течением времени.
Есть также ряд клеток, которые никогда не оставляют нас и могут способствовать процессу старения, или по крайней мере распаду организма с течением времени. Хотя роговица глаза может восстанавливаться всего за один день, линза и другие области глаза не меняются. То же самое с нейронами в коре головного мозга — наружного слоя мозга, который отвечает за память, мышление, язык, внимание и сознание — они остаются с нами от рождения до смерти. Поскольку они не заменяются, потеря этих клеток приводит к серьезным недугам. Есть и хорошая новость: другие области мозга, обонятельная луковица, которая отвечает за запах, и гиппокамп, отвечающий за обучение, могут и обновляются.
Берегите себя. Уже родился первый человек, который будет жить вечно.
Сколько вам лет?
Юрий Фролов
По материалам журнала «New Scientist» (Великобритания)
«Наука и жизнь» №7, 2007
Не торопитесь отвечать на этот простой, как кажется, вопрос, потому что за вас на него ответил шведский невролог Йонас Фрисен: каждому взрослому человеку в среднем пятнадцать с половиной лет. Если по паспорту вам, например, шестьдесят, то хрусталики ваших глаз в среднем на 22 недели старше, мозг примерно ваш ровесник, а вот вашей коже всего две недели от роду.
Из одной научно-популярной книги в другую кочует утверждение: наше тело почти полностью обновляется за семь лет. Старые клетки постепенно отмирают, их места занимают новые.
Клетки действительно обновляются, но откуда взялась мифическая цифра «семь», никто толком не знает. Для некоторых клеток срок обновления установлен более или менее точно, а именно: 150 дней для клеток крови, за постепенным замещением которых можно проследить после переливания крови, и две недели для клеток кожи, которые появляются в ее глубинных слоях, постепенно мигрируют на поверхность, отмирают и отшелушиваются.
Опыты по измерению продолжительности жизни клеток ведутся уже около полувека, но только на крысах и мышах. Животным вводят через шприц или дают в пище меченые (радиоактивные) нуклеотиды — строительные блоки ДНК. Новые клетки встраивают в свой генетический материал эти метки. Их количество в разных тканях и органах можно измерить и рассчитать долю клеток, которые появились на свет за время, прошедшее после введения радиоактивной ДНК.
Разумеется, к человеку такой метод неприменим. Пытались определять возраст клеток человека по длине теломер — конечных участков хромосом. Теломеры (см. «Наука и жизнь» № 12, 2001 г.) укорачиваются при каждом делении клетки. Но выработать на этой основе надежный способ определения возраста клетки не удалось, тем более что некоторые клетки, как выяснилось, способны «отращивать» теломеры после деления.
Шведский исследователь Йонас Фрисен решил воспользоваться методом археологов и историков, умеющих определять возраст предметов, содержащих органику, по углероду-14 ( 14 С). Этот редкий и слабо радиоактивный изотоп углерода постоянно образуется в стратосфере, где космические лучи выбивают из ядер атомов азота по одному протону. Постепенно (период полураспада 5730 лет) 14 С снова превращается в азот. Растения в процессе фотосинтеза поглощают из атмосферы 14 С и встраивают его в молекулы сахаров. Животные поедают растения, и потому все живые существа содержат немного этого изотопа. Примерно один из триллиона атомов углерода в вашем теле — это углерод-14 на месте обычного углерода-12. Когда организм гибнет, он перестает получать новый 14 С, а тот, что уже накоплен за время жизни, постепенно распадается. Этот распад, идущий с известной скоростью, и позволяет определить, как давно живая материя стала мертвой. Например, когда срубили дерево, из которого сделана доисторическая лодка, или когда забили теленка, чтобы из его шкуры изготовить пергамент для рукописи. Однако из-за крайне малых количеств изотопа и медленности его распада метод годится только для больших промежутков времени.
Насколько опасен распад радиоактивного углерода в организме? В теле человека весом 75 килограммов около 300 триллионов триллионов (3•10 26 ) атомов углерода, из них всего 350 триллионов (3,5•10 14 ) — углерода 14 С. Если не считать минеральную составляющую (в основном это кости) и принять, что по остальным тканям тела 14 С распределен равномерно, то в каждой клетке в среднем всего 11 атомов 14 С. ДНК по весу составляет около 1% клеток. Изотоп 14 С распадается так редко, что если взять отдельную выбранную наугад клетку, то в составе ее ДНК один атом 14 С распадется раз в 18 000 лет (мы берем именно тот 14 С, который входит в ДНК, так как изменения в составе этой молекулы могут быть важными для здоровья организма и его потомства). Если считать, что вы проживете 70 лет, то шансы на то, что какая-то конкретная отдельная клетка вашего тела когда-либо испытает «атомный взрыв» одного атома углерода в своей ДНК, составляют 1 против 260.
При своем появлении клетка получает набор хромосом, которые остаются с ней всю ее жизнь. Поэтому содержание 14 С в ДНК прямо пропорционально его содержанию в атмосфере в то время, когда данная клетка появилась, минус небольшое количество, исчезнувшее в результате естественного распада. Анализы проводятся методом атомной масс-спектрометрии.
В 2005 году Фрисен и его сотрудники опубликовали предварительные результаты анализов клеток людей, живших во времена пика 14 С. Как и следовало ожидать, короче всего срок жизни клеток, непосредственно соприкасающихся с внешней средой, — клеток эпидермиса кожи (две недели, как мы об этом упоминали) и клеток эпителия кишечника, постоянно истираемых проходящими пищевыми массами (5 дней). Красные кровяные тельца, по Фрисену, живут 150 дней. Мышечные клетки межреберных мышц у людей 37–40 лет, как оказалось, в среднем имеют возраст 15,1 года, а клетки кишечника (кроме эпителия) — 15,9 года.
Фрисена как невролога больше всего, разумеется, интересует головной мозг. Из исследований, проведенных на животных, а также на одном пациенте, умиравшем от рака и согласившемся на введение ему в мозг слабо радиоактивного изотопа, известно, что после рождения новые нейроны возникают только в двух областях — в гиппокампе и вокруг желудочков мозга.
Пока новым методом измерен возраст лишь немногих участков головного мозга. По данным Фрисена, клетки мозжечка моложе самого человека в среднем на 2,9 года. Мозжечок, как известно, отвечает за координацию движений, а она постепенно улучшается с возрастом у ребенка, поэтому можно предположить, что примерно к трем годам мозжечок формируется окончательно. Кора головного мозга имеет тот же возраст, что сам человек, то есть на протяжении жизни в ней не появляются новые нейроны. Остальные отделы мозга еще только изучаются.
Измерение возраста отдельных тканей и органов проводится не из любопытства. Зная скорость оборота клеток, мы, возможно, научимся лечить катаракту, ожирение и некоторые нервные болезни. В 2004 году исследователи из Колумбийского университета (США) обнаружили, что при депрессии в гиппокампе возникает слишком мало новых нейронов, а некоторые лекарства от депрессии стимулируют этот процесс. Болезнь Альцгеймера также связывают с недостаточным нейрогенезом в гиппокампе. При болезни Паркинсона, насколько известно, отмирание старых клеток не уравновешивается появлением новых.
Знание о том, как часто у людей возникают новые жировые клетки, поможет лечить ожирение. Пока никто не знает, связана ли эта болезнь с увеличением числа или размеров жировых клеток. Знание частоты появления новых клеток печени и поджелудочной железы позволит создать новые методы диагностики и лечения рака печени и диабета.
Весьма актуален вопрос о возрасте мышечных клеток сердца. Специалисты считают, что отмирающие клетки заменяются фиброзной соединительной тканью, поэтому сердечная мышца со временем слабеет. Но точных данных нет. Фрисен и его группа сейчас работают над определением возраста сердца.
Американцы научились измерять возраст хрусталика глаза. Его центральная часть формируется из прозрачных клеток на шестой неделе жизни эмбриона и остается на всю жизнь. Но по периферии хрусталика постоянно добавляются новые клетки, делая хрусталик более толстым и менее гибким, что сказывается на его способности фокусировать изображение. Изучив этот процесс, мы, возможно, найдем способы оттянуть начало катаракты на пять лет — считает Брюс Буххольц из Ливерморской национальной лаборатории (США), где проводятся масс-спектрометрические измерения образцов, поставляемых из Калифорнийского университета и лаборатории Фрисена.
Но если многие «детали» нашего организма постоянно обновляются и в результате оказываются значительно моложе самого их обладателя, то возникают некоторые вопросы. Например, если верхнему слою кожи всего две недели, почему она не остается всю жизнь гладкой и розовой, как у двухнедельного младенца? Если мышцам примерно 15 лет, почему 60-летняя женщина менее ловка и подвижна, чем 15-летняя девочка? Причина — в митохондриальной ДНК. Она накапливает повреждения быстрее, чем ДНК клеточного ядра. Именно поэтому кожа со временем стареет: мутации в митохондриях приводят к ухудшению качества ее важного составного материала, коллагена.
Разные органы и ткани человека обновляются с разной скоростью, и потому можно сказать, что имеют разный возраст.
Наивные Т-клетки — ключ к долголетию
Наивные Т-клетки — ключ к долголетию
Автор
Редактор
Статья на конкурс «био/мол/текст»: Наивные Т-лимфоциты могут поведать о том, что вы хотели бы скрыть. Впервые было осуществлено секвенирование профиля Т-клеточных рецепторов периферической крови человека. Успехи в развитии технологий секвенирования нового поколения дают возможность проследить за динамикой колебаний численности и разнообразия наивных Т-клеток по мере старения организма. Вместе с этими знаниями появляется ответ на вопрос, почему женщины живут дольше мужчин, и приходит мысль о том, что увеличить продолжительность жизни можно, используя собственные Т-клетки. «Иммунологические часы» несложно обмануть, пойдя на хитрость.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Всегда ли можно дать сорокалетнему мужчине его сорок? А пятидесятилетнему? А скольким тридцатилетним женщинам вы бы не дали двадцати? Определять возраст человека по внешней составляющей не самая лёгкая задача. Однако, людям, перешагнувшим определённый порог, различный для мужчин и женщин, когда репродуктивная функция начинает стремительно угасать, становится сложнее скрывать свой возраст.
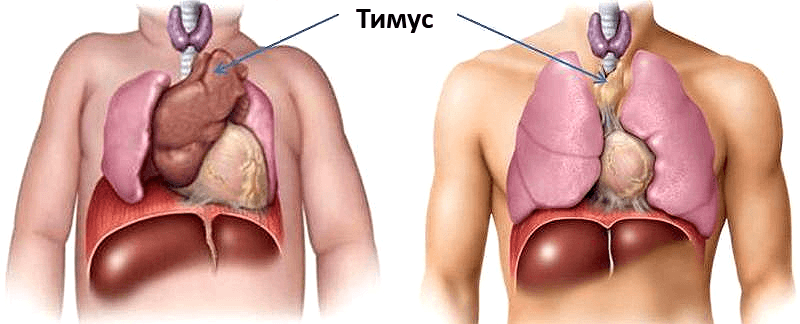
Для внутренних процессов человеческого организма характерны совершенно иные темпы изменений. «Возрастной порог» нашей иммунной системы расположен гораздо ближе к детству, чем к старости. Уже с первого года жизни в тимусе ребёнка начинают происходить драматические изменения: функциональная ткань органа заменяется на соединительную, уменьшаясь каждый год на 3% до 35–45 лет, а после 45 — на 1% (рис. 1). В 70 лет соединительная ткань занимает 90% тимуса [1]. Наиболее активно тимус функционирует в пренатальный период и до наступления половой зрелости. За это время происходит наработка максимальных возможностей Т-клеточного иммунитета, что будет во многом определять эффективность иммунного ответа человека на протяжении всей его жизни.
Рисунок 1. Сравнение размеров тимуса у новорождённого (а) и взрослого (б). К 50 годам тимус уменьшается в 5-7 раз по сравнению с первоначальным размером. Рисунок с сайта my.bpcc.edu.
Тимус — военная база иммунной системы
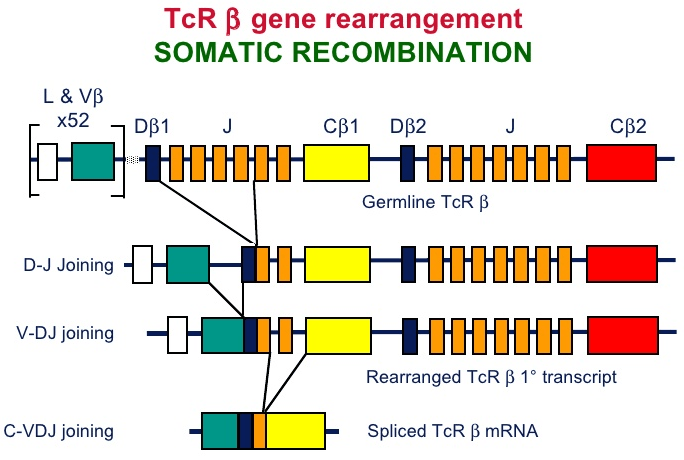
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус. В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2). Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3). Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 10 5 возможных вариантов на каждые 10 6 Т-клеток [2]. В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов. Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR. Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента. Рисунок с сайта Slideshare.
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя). б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном. С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену. Рисунок с сайта Genomemedicine.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне. Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз. Но это разнообразие остаётся константным только некоторое время.
Мы теряем наших бойцов!
По результатам последних исследований [2], доля наивных Т-клеток как в CD4 + (Т-хелперы) так и в CD8 + (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50–80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия. Авторы исследования [2] создали новый подход к использованию технологии секвенирования нового поколения компании Illumina для получения наиболее точных индивидуальных профилей репертуара TCR у людей различных возрастных групп. Было показано, что разнообразие TCR в периферической крови человека коррелирует с процентным содержанием в ней наивных Т-клеток и почти линейно уменьшается с возрастом — примерно на 5 × 10 3 вариантов TCR в год. Наивные Т-клетки сосуществуют в крови с Т-клетками памяти, клоны которых образуются в результате пролиферации наивных Т-клеток, повстречавших «свой» антиген. Размножившиеся клоны с каждым годом занимают всё большую долю доступного для пролиферации пространства в крови, это отражается на численности наивных Т-клеток, так как общее количество Т-клеток в крови человека относительно стабильно.
* — Но не стоит забывать, что кроме популяций в периферической крови, у человека есть гораздо более мощная локальная армия Т-лимфоцитов «на местах»: «Т-лимфоциты: путешественники и домоседы» [4]. — Ред.
Общее разнообразие TCR определяется количеством редких клонов в пуле Т-клеток, поэтому отсутствие возрастных изменений в разнообразии наиболее многочисленных Т-клеточных клонов указывает на то, что клоны наивных Т-клеток теряются с возрастом. Это связано с тем, что клоны наивных Т-клеток обычно малочисленны, поэтому вероятность того, что ни одна клетка данного клона не сможет поделиться или погибнет в результате каких-то случайных событий гораздо выше, чем для клонов с большим числом клеток.
Старики с высоким разнообразием TCR
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4 + периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ [2].
Долгая, но бездетная жизнь
Рисунок 4. Придворные евнухи в Китае. Некоторые евнухи жили более ста лет. Рисунок с сайта Lacasamundo.
Исследование о придворных евнухах династии Чозунь в Корее 2012 года [6] показало, что продолжительность жизни евнухов составляла на 15–20 лет больше, чем продолжительность жизни мужчин с нормальной репродуктивной функцией, живущих в тех же условиях (рис. 4). Возможно, их продолжительность жизни увеличивалась именно благодаря отсутствию инволюции тимуса под влиянием половых гомонов, а следовательно благодаря большему разнообразию TCR наивных Т-клеток. В пользу этой гипотезы можно привести данные о том, что у женщин производство тимусом наивных Т-клеток происходит более эффективно, чем у мужчин, и уменьшение их содержания в периферической крови у женщин выражено в меньшей степени, чем у мужской части населения [7]. Возможно, лучшая работа иммунной системы у женщин связана с тем, что во время беременности иммунитет женщины необходимо «обуздать», сделав его толерантным к фактически чужеродному телу — плоду, что требует участия сложных регуляторных путей. Высокая точность регуляции иммунного ответа очень важна, так как ошибка приведёт к потере потомства. К этим рассуждениям можно прибавить и тот факт, что у женщин с наступлением менопаузы яичники перестают вырабатывать эстрогены, а у мужчин выработка половых гормонов не прекращается. Это объясняет большую продолжительность жизни у женщин, чем у мужчин, характерную для любых национальностей. В Европе и США женщины живут дольше мужчин на 4,5–5 лет, в России — на 13 [6].
Мальчик, которому сделают орхеэктомию (удаление яичек), может быть, и получит дополнительные 10–15 лет жизни, вместе с тем лишившись возможности иметь детей и получив набор других не совсем приятных последствий. Существуют менее радикальные решения, основанные на приёме определённых препаратов, способствующих восстановлению функции тимуса. Одно из таких веществ — грелин, этот гормон вырабатывается слизистой оболочкой желудка и вызывает чувство голода, действуя на центры гипоталамуса. Оказалось, что грелин участвует в Т-клеточном сигналлинге, способен снижать связанное с возрастными изменениями воспаление, способствует восстановлению структуры тимуса и стимуляции его функций. Ряд цитокинов и факторов роста (интерлейкины 7 и 22, фактор роста кератиноцитов) являются потенциальными кандидатами для решения проблемы восстановления функции тимуса у взрослых людей. Интерлейкины обеспечивают дифференцировку и выживание тимоцитов. Фактор роста кератиноцитов необходим для пролиферации и дифференцировки функциональных тканей тимуса, его использование вызывает пролиферацию тимоцитов и увеличивает размеры органа. Возможно также использование веществ, блокирующих выработку стероидных гормонов, таких как аналоги гонадотропин-релизинг гормона, например, люпрона. Люпрон действует на гипофиз, блокируя рецепторы к гонадотропин-релизинг гормону, из-за чего уменьшается выработка лютеинизирующего и фолликуло-стимулирующего гормонов, что ведёт к снижению продукции эстрогена и тестостерона. И всё же, все вышеперечисленные вещества имеют неоднозначное воздействие на организм, и пока ещё нет данных о долгосрочных последствиях их приёма, поэтому их назначают только в случае восстановления после химиотерапии или при ВИЧ-инфекции, когда стимуляция работы тимуса необходима для реконституции иммунной системы [1].
Хранение наивных Т-клеток — полезная инвестиция в будущее
Есть ли иной способ продлить мужскую жизнь? Авторов статьи [2] посетила смелая идея решения этой проблемы. Кроме того, что редко встречающиеся клоны наивных Т-клеток в результате случайных событий теряются с возрастом, они, как и все клетки организма, могут поделиться лишь ограниченное количество раз (примерно 50 — лимит Хейфлика), что обусловлено укорочением теломерных участков хромосом после каждой репликации ядерной ДНК, а делятся наивные Т-клетки раз в 1–2 года. Значит примерно к 70 годам основная часть Т-клеток выйдет из строя. Решение есть — можно запасать наивные Т-клетки! У молодых людей в возрасте до 15–20 лет, когда процессы формирования основного пула наивных Т-клеток уже заканчиваются, нужно брать образцы крови в таком объёме, чтобы количества наивных Т-клеток в них хватило для полного восстановления их пула уже в пожилом возрасте, и заморозить. Очень важно, чтобы забор произошёл именно в этот промежуток времени. Если брать кровь у более взрослых людей, количества циркулирующих наивных Т-клеток просто не хватит для полной реставрации их пула в будущем. Конечно же, такой подход будет эффективен и для женского пола. Эти образцы крови будут не только средством продления жизни, но ещё и подстраховкой в случае аутоиммунных заболеваний или рака, они помогут восстановить иммунную систему после химиотерапии. Создание подобных банков с замороженными образцами крови стало бы ключевым событием в становлении абсолютно новых подходов к лечению заболеваний иммунной системы. Например, СПИД можно было бы вылечить введением в здоровые размороженные Т-клетки заразившегося СПИДом мутации по гену мембранного рецептора CCR5 (CD195), люди с такой мутацией обладают природной резистентностью к ВИЧ [8], и их пересадкой больному, предварительно прошедшему курс химиотерапии.
Итоги
Как бы молодо не выглядел человек, параметры его иммунной системы будут объективно отражать возраст. Такие параметры как количество наивных Т-клеток и разнообразие TCR практически линейно снижаются по мере старения. Если вы являетесь счастливым обладателем повышенного разнообразия TCR, можете надеяться на несколько бонусных лет жизни. В будущем человечество ожидают новые дерзкие подходы к увеличению продолжительности жизни с использованием собственных наивных Т-лимфоцитов, собранных и замороженных много лет назад.