применение азотной кислоты в жизни человека
Применение азотной кислоты в жизни
Кислоты применяются в современном мире повсеместно, и азотная кислота — не исключение. Медицина, пищевая промышленность, машиностроение и многие другие отрасли не обходятся без них. В этой статье мы расскажем, что представляет собой азотная кислота и где ее используют чаще всего
Азотная кислота: описание, получение, применение
Азотная кислота представляет собой бесцветную жидкость, иногда желтоватого оттенка, который может появиться при воздействии на нее теплой температуры (выделяется оксид азота). Она хранится в герметичной посуде, поскольку вступает в бурную реакцию с кислородом. При этом жидкость начинает сильно дымиться (если концентрация кислоты составляет от 86 до 95% — цвет дыма белый, если более 95% — красный).
Азотная кислота вступает в реакцию с большинством металлов, превращая их в оксиды и нитраты. Она также хорошо растворяется в воде.
Как получить азотную кислоту
Формула данного реактива известна нам еще со времен школы. HNО3 получают в результате нескольких этапов:
Применение
Азотная кислота широко используется в различных сферах:
Кислоты в Беларуси применяются активно, поскольку многие процессы без их участия попросту невозможны. Важно помнить, что они являются опасными и едкими веществами, поэтому при работе с реактивами необходимо соблюдать технику безопасности.
Азотная кислота: химические свойства и применение
Смешивается с водой во всех соотношениях, при этом почти полностью диссоциирует на ионы и образует азеотропную смесь. При нагревании и на свету начинает разлагаться на оксид азота и воду, приобретая при этом бурую окраску. Чем выше температура и концентрация реагента, тем быстрее идет разложение.
Разбавленный реагент взаимодействует с щелочноземельными металлами, цинком и железом с окислением до аммиачной селитры или аммиака. С другими металлами и неметаллами проявляет взаимодействие с образованием оксида азота.
Смесь одного объема азотной кислоты с тремя объемами соляной называется «царской водкой». Это соединение способно растворять металлы, в том числе платину и золото. Его сильные окислительные свойства обусловлены образующимися хлоридом нитрозила и атомарным хлором.
Где применяется азотная кислота?
Этот реагент является одним из наиболее востребованных во многих отраслях промышленности. В частности, он используется для производства комбинированных и азотных удобрений (аммиачной, натриевой, калиевой и кальциевой селитры, нитрофоски, нитрофоса), взрывчатых веществ (тринитротолуола и пр.), ракетной техники, различных сернокислых солей и органических красителей.
В цветной и черной металлургии применяется для травления и растворения металлов, разделения серебра и золота. В органическом синтезе широко используют соединение серной и концентрированной азотной кислоты – «нитрующей смеси».
Также материал применяют для изготовления полупродуктов для получения искусственных красителей и других химикатов, в химической и полиграфической промышленностях. Он используется и при гальванизации, хромировании и никелировании деталей, в электротехнической и молочной отраслях.
Где приобрести?
Мы реализуем высококачественные химпрепараты по самым выгодным ценам. Убедитесь в этом: просто нажмите на кнопку «заказать» рядом с фотографией товара и введите ваши контакты. Мы свяжемся с вами в ближайшее время для уточнения деталей.
Азотная кислота применение, свойства, характеристики.
Что такое азотная кислота?
Химические свойства азотной кислоты
Бурно протекают реакции данного химиката с веществами из группы органических соединений. Зачастую эти взаимодействия сопровождаются воспламенением, как в случаях с аминами, скипидаром и прочей органикой.
Как реагирует азотная кислота с металлами
Химические реакции с этой группой элементов также протекают достаточно бурно. Вследствие этих взаимодействий образуются соли азотной кислоты – нитраты, а также выделяется некоторое количество воды и оксиды азота. Реакции протекают достаточно бурно, в некоторых случаях напоминая кипение.
Аналогично ведёт себя данный реактив при контакте с оксидами большинства металлов. Щелочноземельные и щелочные соли азотной кислоты также называют селитрами. Селитры – это обширная номенклатура соединений (среди которых встречается одна, образованная не металлом аммонием) с широчайшей областью их применения в хозяйственных целях.
Азотная кислота не реагирует с группой, так называемых, инертных (или благородных) металлов – с платиной, иридием, золотом, серебром и прочими. Однако свойства азотной кислоты предусматривают возможность получения различных смесей, которые способны легко растворять благородные металлы. Такова, например, царская водка, смесь азотной и соляной кислоты в пропорции 1 к 3-м.
Азотная кислота. Физические свойства
Смешивается также с другими неорганическими кислотами. К упомянутой несколько выше царской водке назовём также меланж – смесь азотной и серной кислот в пропорции 9 к 1-му. Меланж – это сильный окислитель, применяемый для обработки ракетного топлива и в прочих отраслях производственной деятельности.
Химическая активность вещества существенно повлияла на его физические свойства. Что выразилось в том, что внешне данная жидкость, находясь в любой открытой ёмкости, выделяет множественные испарения, похожие на дым. По этой причине в тех хозяйственных отраслях, где эксплуатируют азотную кислоту, чаще используются её водные растворы различных концентраций.
Азотная кислота. Класс опасности
Повышенная химическая активность данного вещества стала причиной того, что азотная кислота была отнесена к числу опасных химических реактивов. Любое соприкосновение с тканями человеческого организма приводит к существенным химическим ожогам, не заживающим на протяжении длительного времени. Кроме того, очень опасны испарения кислоты, поражающие органы дыхания и слизистые оболочки.
По этой причине, а также вследствие крайней нестабильности азотной кислоты, хранение реактива в складских и производственных условиях допустимо только в герметично закрытой таре. А практическое использование в обязательном порядке должно сопровождаться применением индивидуальных средств защиты и соблюдением правил техники безопасности. А также производственные и складские помещения, в которых может храниться и эксплуатироваться азотная кислота, должны быть оснащены эффективными вентиляционными системами.
Получение азотной кислоты
Существует несколько способов синтеза этого химического вещества производственными методами, однако в наши дни наиболее распространённым и наиболее прогрессивным является технология, основанная на методе Оствальда. Она предусматривает использование аммиака в качестве сырья, и его окисление в присутствии платино-родиевых катализирующих компонентов.
Технология многоступенчатая. На первом этапе получают окись азота, в дальнейшем преобразующуюся в диоксид азота. А на следующих стадиях при продолжении окисления и насыщении водой, получают водные растворы азотной кислоты, концентрация которых может лежать в интервале от 45% до 58%.
Виды азотной кислоты
Полученный вышеописанным методом водный раствор азотной кислоты далее может быть подвержен различным обрабатывающим мероприятиям, целью которых является получение различных видов продукта. Эти виды характеризует наличие особенных свойств, и подразделяют их следующим образом:
Азотная кислота ХЧ – это водный раствор, концентрация которого предусматривает наличие 65% кислоты. Считается химически чистым веществом, в дальнейшем поступает в различные отрасли хозяйственной деятельности, а также используется в лабораторно-исследовательских работах и прочих производственных направлениях.
Азотная кислота ТЕХ – водно-кислотная смесь с концентрацией кислоты порядка 56%.
Азотная кислота ОСЧ – это водный раствор, концентрация которого около 70%. Считается особо чистой кислотой, и имеет широчайшую область практического использования в хозяйственных целях.
Азотная кислота ЧДА – расшифровывается, как чистая для анализа кислота. Представляет собой водный раствор, концентрация 57%. Чаще эксплуатируется в аналитико-исследовательской деятельности.
Применение азотной кислоты
Данный химикат, по большей части, служит сырьём для производственного синтеза нитратов, которые в дальнейшем используются в самых разнообразных целях. В частности, как минеральные удобрения с повышенным содержанием азота и прочих питательных элементов. Нитраты (или селитры) могут также использоваться при производстве пиротехники, взрывчатых средств и прочей продукции.
А также могут служить сырьём для химической индустрии, фармакологии, используются при выпуске лакокрасочных материалов. Могут быть использованы в качестве присадки к реактивным видам топлива. И востребованы в качестве сырья для синтеза широкой номенклатуры азотных соединений: анилин, алканы, нитроцеллюлоза и так далее.
Интернет-магазин ХимЭлемент предлагает широчайший ассортимент продукции химического производства, в том числе и кислоту азотную. Купить азотную кислоту можно на самых выгодных условиях с доставкой во все регионы Украины.
Азотная кислота
Азотная кислота – важный, но опасный химический реактив
Современная химия насчитывает огромное количество химических реактивов: щелочи, кислоты, реагенты, соли и другие. Среди них кислоты – самая распространенная группа. Кислоты – это сложные водородосодержащие соединения, атомы которых могут замещаться атомами металла. Сфера их применения обширна. Она охватывает многие отрасли производства: химическую, машиностроительную, нефтеперерабатывающую, пищевую, а также медицину, фармакологию, косметологию; широко используется в быту.
Азотная кислота и ее определение

Форма выпуска азотной кислоты зависит от ее концентрации:
— обычная – 65 %, 68 %;
— дымная – 86 % и более. Цвет «дыма» может быть белым, если концентрация составляет от 86 % до 95 %, или красным – свыше 95 %.
В настоящее время производство сильно- или слабоконцентрированной азотной кислоты проходит следующие этапы:
1. процесс каталитического окисления синтетического аммиака;
2. как результат – получение смеси нитрозных газов;
3. впитывания воды;
4. процесс концентрирования азотной кислоты.
Хранение и транспортировка
— каждая тара помечается надписью «Опасно».
Где применяется химический реактив?
Сфера применения азотной кислоты в настоящее время огромна. Она охватывает многие отрасли промышленности, такие как:
— химическую (изготовление взрывчатых веществ, органических красителей, пластмасс, натрия, калия, пластмасс, некоторых видов кислот, искусственного волокна);
— сельскохозяйственную (производство азотных минеральных удобрений или селитры);
— металлургическую (растворение и травление металлов);
— фармакологическую (входит в состав препаратов по удалению кожных образований);
— ювелирное производство (определение чистоты драгоценных металлов и сплавов);
— военную (входит в состав взрывчатых веществ как нитрующий реагент);
— ракетно-космическую (одна из составляющих ракетного топлива);
— медицину (для прижигания бородавок и других кожных образований).
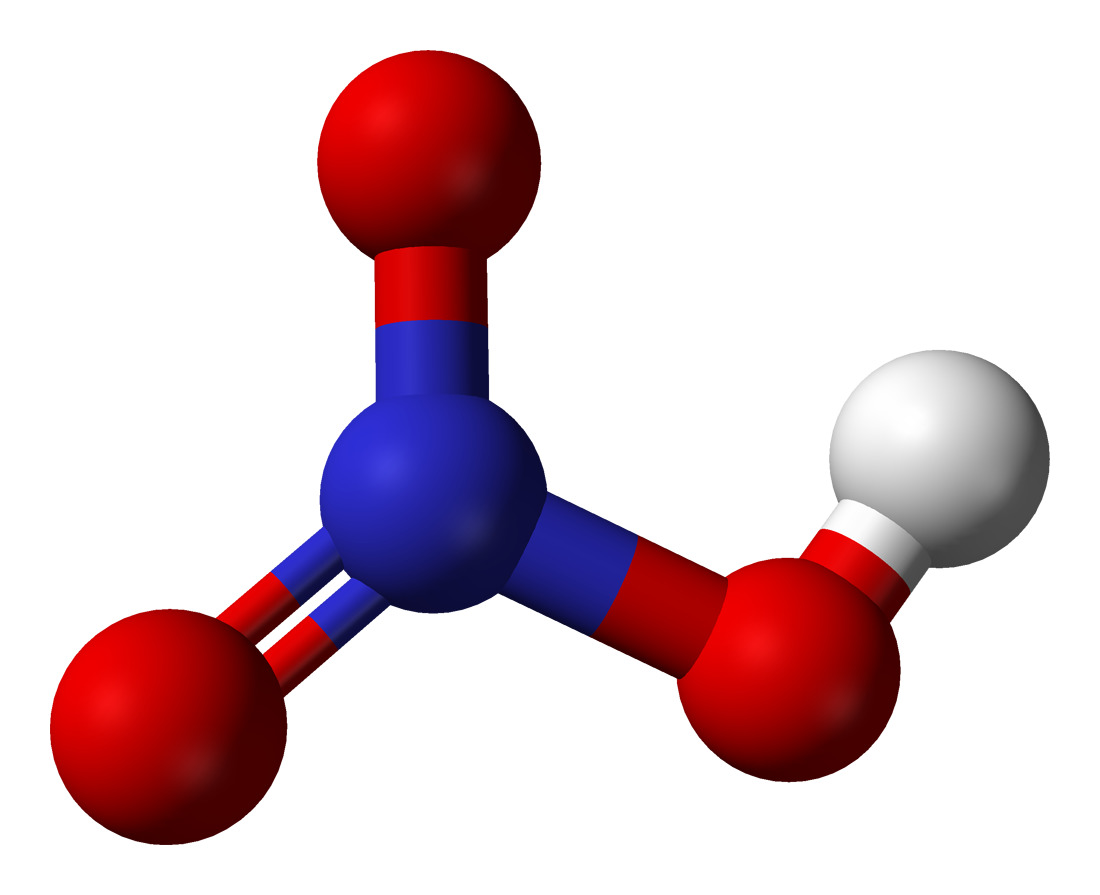
Азотная кислота [HNO3]: структура Льюиса / свойства / применение
Это очень агрессивное и токсичное вещество, которое может вызвать серьезные повреждения кожи при использовании без мер предосторожности. Кислота вступает в реакцию с оксидами, гидроксидами и металлами, такими как серебро, медь и железо, образуя нитратные соли.
Обычно азотная кислота, доступная в магазинах, представляет собой 68-процентный водный раствор. Когда ее концентрация (в воде) превышает 86 процентов, она называется дымящейся азотной кислотой. Она хранится в плотно закрытой емкости в сухом, прохладном и хорошо проветриваемом помещении.
Ниже мы рассмотрим, как производится эта кислота, как она выглядит в молекулярном масштабе, каковы ее химические и физические свойства и где она в основном используется.
Азотная кислота HNO3 свойства
Молярная масса: 63,012 г / моль
Внешний вид: Бесцветная или дымящаяся жидкость желто-красного цвета
Запах: неприятно горький или острый, удушающий
Структура
Поскольку кислород имеет большую тенденцию притягивать к себе общие электроны, чем азот, он несет отрицательный заряд, а атом азота несет положительный заряд.
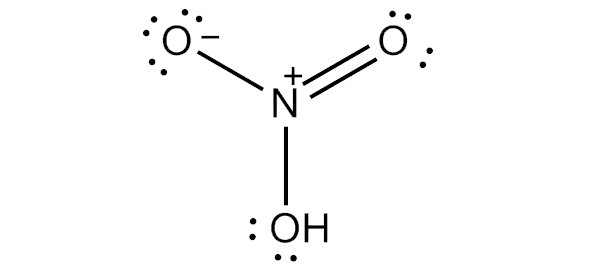
Структура Льюиса
Чтобы нарисовать льюисовскую структуру азотной кислоты, нам нужно подсчитать общее количество валентных электронов в молекуле HNO3.
Это дает нам общее количество валентных электронов (5 + 1 + 18) в одной молекуле HNO3. Поскольку у азота больше валентных электронов, чем у кислорода, мы можем поместить атом азота в центр структуры.
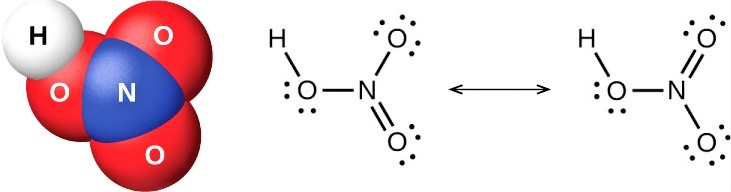
Наконец, нам нужно минимизировать заряды на атомах, чтобы сделать структуру стабильной. Это может быть сделано путем преобразования одинокой пары на одном атоме кислорода в связь. Конечная структура состоит из двух одиночных связей между атомом азота и двумя атомами кислорода, а также двойной связи между атомом азота и оставшимся атомом кислорода.
Есть два правильных способа нарисовать структуру Льюиса HNO3. Таким образом, он имеет две основные формы резонанса. Двунаправленная стрелка на изображении выше указывает на то, что существует более одного способа нарисовать структуру азотной кислоты.
Как она производится?
Для производства HNO3 используются два метода. Первый использует окисление, конденсацию и абсорбцию для синтеза слабой HNO3 с концентрациями от 30 до 70 процентов. Второй метод производит сильную HNO3 (с концентрацией 90 процентов) из слабой HNO3 путем объединения процессов обезвоживания, отбеливания, конденсации и абсорбции.
Производство слабой азотной кислоты
Большая часть азотной кислоты образуется в результате высокотемпературного каталитического окисления аммиака. Это называется процессом Оствальда. Он состоит из трех этапов:
1) Окисление аммиака
Смесь аммиака и воздуха (1:9) окисляется до высокой температуры (750-800 ℃) при прохождении через каталитический преобразователь. Катализатор обычно изготавливается из 90% платины и 10% родиевой сетки. Эта (экзотермическая) реакция приводит к образованию оксида азота и воды в виде пара.
2) Окисление оксида азота
Окись азота, образовавшаяся в предыдущей реакции, окисляется: она некаталитически реагирует с остаточным кислородом с образованием диоксида азота. Это медленная, однородная реакция, которая сильно зависит от давления и температуры. При высоком давлении и низких температурах эта реакция приводит к образованию максимального количества диоксида азота за очень короткое время.
3) Поглощение
В конечной реакции оксид азота поглощается водой. Это дает желаемый продукт (азотную кислоту в разбавленной форме) вместе с оксидом азота. Концентрация HNO 3 зависит от давления, температуры, количества стадий абсорбции, а также от концентрации оксидов азота, поступающих в абсорбер.
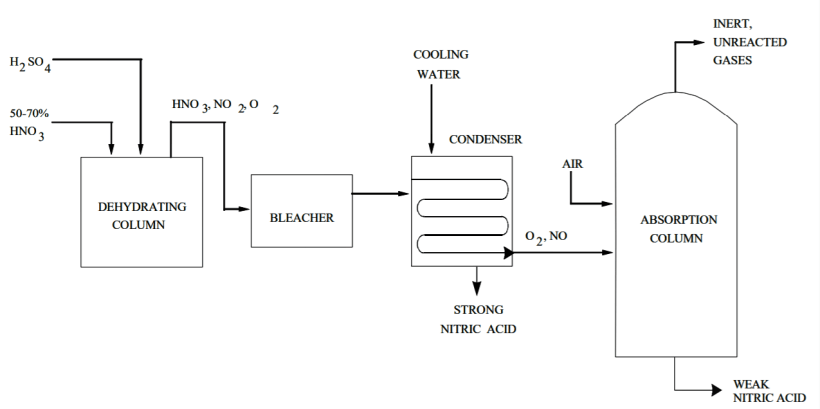
Производство сильной азотной кислоты
Высокопрочная HNO 3 получается путем концентрирования слабой HNO 3 экстрактивной дистилляцией. Дистилляция проводится в присутствии дегидратирующего агента, например 60% серной кислоты.
Процесс протекает следующим образом: сильная серная кислота и слабая азотная кислота попадают в насадочную дегидратирующую колонну при атмосферном давлении. Концентрированная HNO 3 выходит из верхней части колонны в виде 99% пара. Он также состоит из небольшого количества кислорода и оксида азота от диссоциации азотной кислоты.
Кислота проходит через отбеливатель и попадает в систему конденсатора, который отделяет ее от оксида азота и кислорода. Абсорбционная колонна забирает эти побочные продукты и объединяет оксид азота со вспомогательным воздухом для получения диоксида азота. Этот газообразный диоксид азота затем рекуперируется в виде слабой HNO 3, а небольшие непрореагировавшие и инертные газы выбрасываются в атмосферу.
Производство в лаборатории
В лаборатории HNO 3 обычно синтезируется путем термического разложения нитрата меди. Это дает оксид меди, диоксид азота и кислород. Последние два пропускаются через воду для получения азотной кислоты.
А затем реализовать процесс Оствальда
В последние пару десятилетий исследователи разработали электрохимические средства для получения безводной кислоты из концентрированного HNO 3. Этот процесс осуществляется путем регулирования тока электролиза до тех пор, пока не будут получены необходимые продукты.
Свойства
68% раствор HNO 3 имеет температуру кипения 120,5 °C при давлении 1 атм. С другой стороны, чистая HNO 3 кипит при 83 °C. При комнатной температуре эта концентрированная форма выглядит как бесцветная жидкость.
Поскольку азотная кислота имеет свойство разлагаться на открытом воздухе, ее хранят в стеклянных бутылках.
Оксиды азота, образующиеся в результате реакции разложения, полностью или частично растворяются в кислоте, вызывая незначительные изменения давления пара над жидкостью. Когда он остается растворенным, он дает кислотно-желтый цвет или красный при более высоких температурах.
Концентрированная азотная кислота выделяет белые пары при контакте с воздухом, в то время как кислота, растворенная в диоксиде азота, образует красновато-коричневые пары.
По концентрации сильную HNO 3 можно разделить на две группы: красная и белая дымящаяся азотная кислота. Первый содержит 84% азотной кислоты, 13% тетроксида диазота и 1-2% воды. Напротив, белая дымящаяся азотная кислота содержит не более 2% воды и очень небольшое количество растворенного диоксида азота (0,5%).
HNO3 с растворенным оксидом азота
Среди нескольких важных реакций HNO3 можно выделить следующие –
А так как это сильный окислитель, то он бурно реагирует с различными неметаллическими веществами. Продукты таких взрывных реакций зависят от температуры, концентрации кислоты и используемого восстановителя.
Области применения
Химические и физические свойства азотной кислоты делают ее ценным веществом. Она имеет несколько различных применений в различных областях, особенно в химической и фармацевтической промышленности.
Удобрения: Почти 80% производимой азотной кислоты используется для производства удобрений. Точнее, она используется для производства аммиачной селитры (NH 4 NO 3) и кальций-аммиачной селитры, которые находят применение в качестве удобрений.
Красители и пластмассы: Нитрат кальция и аммония используется в некоторых упаковках со льдом/гелем в качестве альтернативы аммиачной селитре. Она также используется для производства химикатов и растворов, которые используются в производстве красителей и пластмасс.
Ракетное топливо: красная и белая дымящаяся азотная кислота используется в жидкостных ракетах в качестве окислителя. Во время Второй мировой войны немецкие военные использовали дымящуюся красную азотную кислоту в нескольких ракетах.
Деревообработка: Очень слабая HNO3 (с концентрацией 10%) используется для искусственного старения древесины сосны и клена. Придает дереву винтажный вид с масляной отделкой.
Другие применения: слегка концентрированный раствор под названием Nital используется для травления металла, чтобы выявить его структуру на микроуровне. Рефлюксная азотная кислота используется в процессах очистки углеродных нанотрубок. В электрохимии HNO3 используется в качестве химического легирующего агента для органических полупроводников.
Вопросы и ответы
Проводит ли HNO3 электричество?
Как и другие сильные кислоты, азотная кислота является хорошим проводником электричества. Исследования показывают, что обработка материала этой кислотой может улучшить его электропроводность до 200 раз.
Растворяет ли HNO3 золото?
Азотная кислота не реагирует с некоторыми драгоценными металлами, такими как металлы платиновой группы и чистое золото. Однако она может растворять некоторые сплавы золота, содержащие менее благородные металлы, такие как серебро и медь. Цветное золото, например, растворяется в азотной кислоте и меняет цвет своей поверхности.
Хотя чистое золото не проявляет никакого эффекта при контакте с азотной кислотой, оно реагирует с царской водкой, смесью азотной и соляной кислот, оптимально в молярном соотношении 1:3. Некоторые ювелирные магазины используют азотную кислоту как дешевое средство для быстрого обнаружения сплавов с низким содержанием золота (менее 14 карат).
Как нейтрализуется HNO 3?
При более высоких концентрациях выделение азотной кислоты может быть весьма значительным, и поэтому необходима хорошая вентиляция. Ее можно нейтрализовать любым неорганическим основанием, например, гидроксидом натрия или известью.
Такие реакции нейтрализации выделяют много тепла. Например, нейтрализация 10% раствора азотной кислоты приведет к повышению температуры на 20 °C, а нейтрализация 70% раствора приведет к повышению температуры на 120 °C, что достаточно для того, чтобы вызвать паровые взрывы.