почему белки называют структурно функциональной основой жизни
Белки как основа жизни



Белки считаются основой жизни, потому что большинство из них являются биологическими катализаторами – ферментами (энзимами), способными ускорять химические превращения в миллионы раз. Поэтому в живых организмах могут протекать такие реакции, которые в неживой природе невозможны. В живой клетке практически нет химических реакций, которые протекали бы без участия белков – ферментов. Именно в белковой молекуле скрыты основные загадки сложного строения, поведения и разнообразия живых существ.
Белок представляет собой линейный полимер, мономерами которого являются аминокислоты, имеющие общую формулу:
Благодаря определённой пространственной ориентации ковалентных химических связей, а также за счёт действия водородных связей цепочка аминокислот закручивается с образованием вторичной структуры белка, которая получила название α-спираль. Между различными участками α-спирали также возникают слабые водородные связи. Эти связи укладывают α-спираль в сложную пространственную структуру, которая называется третичной структурой белка. Иногда в образовании третичной структуры участвует и некоторое количество ковалентных связей. Эта структура строго однозначно определяется порядком соединения аминокислот. Каждой последовательности аминокислот соответствует своя третичная структура со строго определёнными свойствами и функциями белковой молекулы.
Основным свойством всех белковых молекул, определяющим специфику живого, является их способность легко менять свою третичную структуру под действием очень слабых и самых разнообразных внешних воздействий. Такими воздействиями могут быть свет, давление, температура, звук, наличие рядом других молекул, ионов, атомов и т.д. В результате этих воздействий одни водородные связи рвутся, а другие образуются. Молекула меняет свою форму, а следовательно, и функцию. Такие изменения являются обратимыми и называются обратимой денатурацией или конформацией белковых молекул. Именно конформация белков является основой способности живых организмов приспосабливаться к быстро меняющимся условиям окружающей среды, когда изменение условий приводит к изменению работы белковых молекул. Химические реакции и физические процессы, которые не нужны в новых условиях, прекращаются, а нужные реакции и процессы запускаются в действие.
Если воздействие на белки окажется слишком сильным, может произойти необратимая денатурация, когда рвутся или образуются прочные ковалентные связи. Такая денатурация приводит к гибели организма.
Каждый вид организмов представляет собой определённый набор белков, обусловливающих все жизненно важные свойства вида. Чем разнообразней набор белков, тем более сложным и совершенным является организм. В человеческом организме используется более 30 тыс. различных белков. Нормальное содержание белков в клетке составляет 10-20 % сырой массы и 50-80 % сухого вещества.
Помимо основной ферментативной функции белки выполняют и многие другие функции, которые отличают живое вещество от неживого. К таким функциям относится рецепторная функция, состоящая в узнавании специальными белками – рецепторами различных физических и химических факторов среды с последующим изменением внутриклеточных процессов.Двигательная функция осуществляется специальными сократительными белками, к которым, в частности, относятся актин и миозин мышечных волокон. Часть белков выполняют транспортные функции, перемещая нужные вещества в клетку, а отходы – из клетки. Защитную функцию выполняют белки гамма-глобулины, которые связываются с чужеродными молекулами (антигенами), нейтрализуют их и способствуют последующему разложению или выведению из организма. Строительные белки обеспечивают формирование различных клеточных структур с заданными свойствами. Белки могут выполнять и энергетическую функцию. Однако расходование белков в качестве пищи начинается только в предельно критической ситуации, когда заканчиваются основные источники питания: углеводы и жиры.
Возможность беспредельного совершенствования организмов заложена в бесконечном разнообразии структур белковых молекул. Применение математических методов для оценки этого разнообразия показало, что число возможных вариантов строения белков, обусловленное изменением порядка аминокислот, может превышать величину 10 100 (см. об этом подробней в гл.6). Как уже было отмечено (п.1.5), это число в миллиарды раз больше числа атомов во Вселенной.
Представленный анализ строения белковых молекул позволяет без использования понятия жизненной силы объяснить причину необычайно большого разнообразия живых организмов и их сложное поведение, с помощью которого они адаптируются к разнообразным условиям окружающей среды.
Белки- основа жизни
Они служат материалом для построения клеток, тканей и органов, образования ферментов, гормонов, гемоглобина и других особо важных соединений, в том числе обеспечивающих иммунитет к инфекциям. Участвуют в различных этапах усвоения жиров, углеводов, минеральных веществ и витаминов.
Жизнь организма связана с непрерывным расходом и обновлением белков. Для равновесия этих процессов необходимо ежедневное восполнение белковых потерь. В отличие от жиров и углеводов они не накапливаются в резерве и не образуются из других веществ, то есть являются незаменимой частью пищи. Как источник энергии имеют второстепенное значение.
Наиболее богаты белком мясо, рыба, сыр, творог, бобовые. Бедны им почти все овощи, фрукты, ягоды. 10 г белка содержится в съедобной части следующих продуктов:
Белки высокой биологической ценности отличаются сбалансированностью аминокислот, легкой переваримостью и хорошей усвояемостью. К ним относятся белки яиц и молочных продуктов, а также мяса и рыбы, исключая соединительную ткань. Менее качественно полноценны по составу аминокислот растительные белки, некоторые из них труднопереваримы. Они заключены в оболочки из клетчатки, что препятствует действию пищеварительных ферментов, особенно в бобовых, грибах, орехах, крупах из цельных зерен. В бобовых содержатся также вещества, тормозящие действие пищеварительных ферментов.
Усвояемость белков.
Тепловая обработка ускоряет переваривание белков. Длительное разваривание, измельчение, протирание улучшают переваривание и усвоение белков, особенно растительных продуктов. Однако избыточное нагревание может отрицательно влиять на аминокислоты. Поэтому в целях сокращения времени варки каш рационально предварительное замачивание круп.
Для удовлетворения потребности организма в аминокислотах желательны сочетания животных и растительных продуктов, улучшающие сбалансированность аминокислот: молочные продукты с хлебом, крупами, макаронами (молочные каши и супы, запеканки с творогом и др.), мучные изделия с творогом, мясом, рыбой, картофель и овощи с мясом.
Белковая недостаточность.
Белковая недостаточность организма возникает при малом содержании в пище белков или преобладании их низкой биологической ценности. Она бывает при увлечения или самолечении физиологически необоснованными диетами (только растительная пища ограниченного ассортимента, голодание для похудения и т. д.). Значительно чаще белковая недостаточность вызывается различными заболеваниями, в частности органов пищеварения, особенно кишечника.
Повышенный расход или увеличенные потери белка характерны для активного туберкулеза и многих инфекций, злокачественных новообразований, болезней почек (нефротический синдром) и т. д. К белковой недостаточности могут привести неправильно составленные диеты при болезнях почек и печении. Но уменьшить или предотвратить ее при любых заболеваниях может соответствующая диета, обогащенная полноценными белками.
Это очень важно, так как белковая недостаточность ведет к ухудшению функций пищеварительной, эндокринной, кроветворной и других систем организма, атрофии мышц.
Нарушается усвоение других пищевых веществ, витаминов, снижается работоспособность и сопротивляемость к инфекциям, замедляется выздоровление при различных заболеваниях, заживление ран после операций и травм.
Вреден и избыток белка в питании, ведущий к накоплению в организме продуктов белкового обмена, перегрузке ими печени и почек. Он отрицательно влияет на больных атеросклерозом и ишемической болезнью сердца, подагрой.
Суточная потребность в белках.
Белки как структурно-функциональная основа живой материи. Строение белка. Функции различных белков
Автор работы: Пользователь скрыл имя, 12 Ноября 2011 в 16:20, реферат
Краткое описание
Белки (протеины) – высоко молекулярные, азотосодержащие природные органические вещества, молекулы которых построены из аминокислот. Они являются основной структурной и функциональной основой жизнедеятельности всех организмов, они обеспечивают рост, развитие и нормальное протекание всех обменных процессов в организме. Это мускулы, кровь, сердце, кожа, кости… в природе существует примерно 1010 – 1012 различных белков, обеспечивающих жизнедеятельность организмов всех степеней сложности: от вирусов до человека.
Дальневосточный государственный университет.doc
Дальневосточный государственный университет
Институт психологии и социальных наук
Факультет человековедения
Кафедра социальной работы
Белки как структурно-функциональная основа живой материи. Строение белка. Функции различных белков.
Выполнила:
Проверил:
Владивосток
Белки (протеины) – высоко молекулярные, азотосодержащие природные органические вещества, молекулы которых построены из аминокислот. Они являются основной структурной и функциональной основой жизнедеятельности всех организмов, они обеспечивают рост, развитие и нормальное протекание всех обменных процессов в организме. Это мускулы, кровь, сердце, кожа, кости… в природе существует примерно 1010 – 1012 различных белков, обеспечивающих жизнедеятельность организмов всех степеней сложности: от вирусов до человека. Необходимость постоянного обновления белков лежит в основе обмена веществ. Белки также осуществляют энергетические превращения, неразрывно связанные с активными биологическими функциями. Они входят в состав важнейших клеточных структур – органелл. Хотя органеллы содержат и другие вещества, белки особенно важны, они – основные структурообразователи и играют важнейшую роль в выполнении физиологических функций. Например, благодаря организации различного рода белков биологические мембраны, покрывающие клетки, активно перенося в клетку или из нее молекулы и ионы. В частности транспорт катионов создает электрическую поляризацию, необходимую для процессов возбуждения. В двигательных аппаратах – мышечных волокнах – комплексы специфических белков осуществляют сокращение, превращая химическую энергию в механическую работу.
Деятельность белков во многом связана с разными веществами, из которых наибольшее биологическое значение имеют нуклеиновые кислоты. Однако решающим фактором молекулярных механизмов всех активных проявлений жизнедеятельности являются белки. В этом смысле подтверждено и детализировано известное положение Ф. Энгельса о белках, как основе биологической формы движения материи.
В структурном отношении молекулы белков бесконечно разнообразны – жесткость и точность уникальной организации сочетаются в них с гибкостью и пластичностью. Все это создает необозримые функциональные потенции: поэтому белки и явились тем исключительным материалом, который и послужил основой возникновения жизни на земле.
Белок – один из основных продуктов питания, как человека, так и животных. Они служат источником восстановления и обновления цитоплазмы клеток, образования ферментов и гормонов.
Выделяют первичную, вторичную, третичную и четвертичную структуру белков.
Положительные и отрицательно заряженные R-группы аминокислот притягиваются и сближают даже далеко отстоящие друг от друга участки белковой цепи. Сближаются и другие участки белковой молекулы, несущие, например «водоотталкивающие» радикалы.
До сих пор нет единого принципа классификации белков. При делении всех известных белков на группы учитывают их состав (строение), физико-химические свойства (растворимость, щелочность), происхождение и роль в организме.
Физико-химические свойства белков:
Молекулы белка имеют массу от десятков тысяч до 1 миллиона и выше моль, так фермент рибонуклеаза имеет молярную массу 12700 моль, дыхательный пигмент улитки гемоцианин – 6600000 моль.
Элементарный состав большинства белков: 50,6 – 54,5% углерод, 6,5 – 7,3% водород, 21,5 – 23,5% кислород, 15 – 17,6% азот,
0,3 – 2,5% сера. В состав ряда белков входит и фосфор.
Сведения о молекулярной массе и ряде свойств молекул белка можно получить, исследуя их осаждение в ультрацентрифуге, диффузию, вязкость, растворимость и светорассеяние. Все белки с очень большой молярной массой состоят из более мелких частиц – субъединиц.
Растворимые белки это гидрофильные коллоиды, активно связывающие воду, их растворы обладают значительной вязкостью. Их растворимость варьирует не меньше, чем другие их свойства. Одни белки легко растворяются в воде, другие требуют для растворения небольших концентраций солей, третьи переходят в раствор только под воздействием сильных щелочей и т.д.
Молекулы белка не проходят через полупроницаемые мембраны, обладают слабой способностью к диффузии. Это амфотерные электролиты, так как они имеют свободные карбоксильные (кислотные) и аминные (основные) группы.
Белки имеют электрический заряд, изменяющийся в зависимости от структуры белка и реакции среды. В электрическом поле растворенные белки движутся (электрофорез), причем направление и скорость движения неодинаковы для различных белков.
Биологические функции белков:
С белками связано все многообразие функций организма, однако наиболее важными являются:
Перечисленные функции белков являются наиболее важными, но ими не ограничивается значение белков для жизни.
Денатурация белков: под действием ионизирующей радиации, высокой температуры, сильного взбалтывания, экстремальных значений pH, а также ряда органических растворителей, таких как спирт или ацетон, белки изменяют свое естественное состояние. Это нарушение природной структуры белка и называют денатурацией. Подавляющее большинство белков утрачивают при этом биологическую активность, хотя первичная структура их после денатурации не меняется. Дело в том, что в процессе денатурации нарушается вторичная, третичная и четвертичная структуры, обусловленные слабыми взаимодействиями между кислотными остатками, а ковалентные пептидные связи не разрываются. Необратимую денатурацию можно наблюдать при нагревании жидкого и прозрачного белка куриного яйца: он становится плотным и непрозрачным. Денатурация может быть и обратимой. После устранения денатурирующего фактора многие белки способны вернуть естественную форму, т. е. ренатурировать.
Способность белков к обратимому изменению пространственной структуры в ответ на действие физических или химических факторов лежит в основе раздражимости – важнейшего свойства всех живых существ.
Биосинтез белка происходит в результате трансляции в субклеточных частицах – рибосомах, представляющих собой сложный рибонуклеиновый комплекс. Информация о первичной структуре белка «хранится» в соответствующих генах – участках ДНК – в виде последовательности нуклеотидов. В процесс транскрипции эта информация с помощью фермента – ДНК – зависимой РНК – полимеразы – передается на матричную рибонуклеиновую кислоту, которая, соединяясь с рибосомой, служит матрицей для синтеза белка. Выходящие из рибосомы синтезированные полипептидные цепи, самопроизвольно сворачиваясь, принимают присущую данному белку конформацию, а также подвергаются модификации благодаря реакциям различных функциональных групп аминокислотных остатков и расщеплению пептидных связей.
Химический синтез широко применяют для получения пептидов, в т.ч. биологически активных гормонов и их разнообразных аналогов, используемых для изучения взаимосвязи структуры и биологической функции, а также пептидов, несущих антигенные детерминанты различных белков и применяемых для приготовления соответствующих вакцин. Первые химические синтезы белка в 60-е гг. (инсулина овцы и рибонуклеазы S), осуществленные в растворе с помощью тех же методов, которые используют при синтезе пептидов, были связаны с чрезвычайно большими сложностями. В каждом случае требовалось провести сотни химических реакций и окончательный выход белка был очень низок (менее 0,1%), в результате чего полученные препараты не удалось очистить. Позже были синтезированы некоторые химически чистые белки, в частности инсулин человека (П. Зибер и др.) и нейротоксин II из ядра среднеазиатской кобры (В.Т. Иванов). Однако до сих пор химический синтез белка представляет весьма сложную проблему и имеет скорее теоретическое, чем практическое значение. Более перспективны методы генетической инженерии, которые позволяют наладить промышленное получение практически важных белков и пептидов.
Белки – структурно-функциональная основа жизни
Как уже отмечено в сегменте 7, белки представляют полимерные молекулы длиной в 50-100-500 и более мономеров – аминокислот. Имеется 20 разновидностей аминокислот, различных по химическим свойствам их свободных концов – радикалов.
Особо выделим аминокислоты со свободным электрическим зарядом. Так, аспарагиновая и глутаминовая кислоты имеют отрицательный заряд (лишняя –СОО- группа), аргинин, лизин, аспарагин и глутамин – положительный (лишняя –NH+ группа).
Важнейшее свойство белковой молекулы, объясняющее механизм ее функционирования, это – способность обратимо изменять свою третичную структуру (трехмерную форму) в ответ на какое-либо раздражение. Раздражителем чаще всего выступает энергетический разряд от расщепления молекулы АТФ.
Такая обратимая денатурация, или конформационная перестройка, и есть совершаемая молекулой работа. Конформационная перестройка молекулы подобна циклу сжатия и расслабления пружины: при внешнем давлении пружина сжимается и приобретает внутренний запас энергии, а на обратном ходу совершает работу.
В зависимости от структуры белковой молекулы и ее местонахождения совершаемая работа, то есть функция, будет различна. Ниже будет показана роль белков в реализации основных жизненных функции: опорно-двигательной, транспортной, каталитической, защитной, сигнальной.
Обычно называют еще энергетическую функцию белков. Действительно, белки в своей химической структуре несут большой запас энергии. Они могут распадаться на отдельные аминокислоты, которые, в свою очередь, подобно глюкозе окисляются в митохондриях до углекислого газа и воды и отдают энергию на синтез АТФ. Однако этот путь в энергетическом обмене используется как резервный, в тех случаях, когда исчерпаны запасы углеводов и жиров – основных энергоемких субстратов.
Использование белков в энергообмене расточительно для клетки, так как аминокислоты представляют дефицитный продукт, многие из них вообще не могут синтезироваться у животных, а получаются от растительных продуктов (незаменимые аминокислоты).
Белки имеют уникальную структуру, которой дано более высокое предназначение. В этом смысле расщеплять белки для извлечения энергии – все равно, что топить печь ассигнациями.
Кроме того, аминокислоты предварительно необходимо освободить от азота (дезаминировать), чтобы уровнять их с продуктами полураспада глюкозы, а это и дополнительная работа и потеря важнейшего элемента из организма (азот в составе простых соединений выводится с мочой). Таким образом, белки в энергетическом обмене используются в крайних случаях – при голодании, болезни, возрастных метаморфозах.
Основные же функции белков, перечисленные выше и рассматриваемые ниже, значительно более важны и изящны, поскольку в их реализации используется уникальность структуры белка, его неповторимые индивидуальные формы и активные центры.
Белки – структурно-функциональная основа жизни
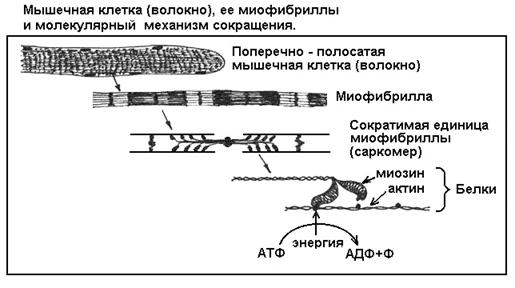
Опора и движение
Главное, что следует вынести из описания мышечной функции, это понимание простой физико-химической сущности движения, которая сводится к изменению объемной формы молекулы белка миозина. Эта форма, или третичная структура, в свою очередь зависит от силы химических связей внутри молекулы.
Транспорт веществ
Рассмотренный случай представляет пассивный транспорт веществ, он не требует затрат энергии. Совершенно особый тип каналов представляют ионные насосы, способные перекачивать ионы против градиента их концентрации. Как следует из самого термина, насосы могут работать только с затратой энергии, и такой способ перемещения веществ называют активным транспортом.
Белковая пора насоса способна расщеплять молекулу АТФ и за счет извлеченной энергии проталкивать ионы против их диффузионной силы. Созданный таким образом наружный избыток ионов возвращается обратно пассивным путем, но несет с собой нужные органические вещества. Так сочетание активного и пассивного транспорта обеспечивает питание клеток. Избыток ионов натрия снаружи клетки используется также для возбуждения электрического тока и проведения нервного возбуждения.
Даже поверхностное рассмотрение механизмов мембранного транспорта веществ показывает, что, как и в случае мышечного сокращения, работа по активному транспорту сводится к обратимой конформационной перестройке молекул белковых пор с преобразованием энергии АТФ. Направленный в обратную сторону пассивный транспорт ионов и питательных веществ представляет простую диффузию, но является следствием предшествующего активного транспорта. Все эти процессы подчиняются в основе известным физико-химическим закономерностям.
Дата добавления: 2016-05-30 ; просмотров: 2172 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ