почему белки называют молекулами жизни
Почему белки называют молекулами жизни
Подробное решение параграф § 11 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов A.M. Углубленный уровень 2019
Вопрос 1. Что такое катализаторы?
Катализаторы — это вещества, изменяющие скорость химической реакции или вызывающие её, но не входящие в состав продуктов реакции.
Вопрос 2. Что такое иммунитет?
Иммунитет — это способ защиты организма от действия различных веществ и организмов, вызывающих деструкцию его клеток и тканей, характеризующийся изменением функциональной активности преимущественно иммуноцитов с целью поддержания гомеостаза внутренней среды.
Вопрос 3. Какие белки вам известны? Каковы их функции?
Кератин, коллаген, эластин — строительная, структурная функция;
Гемоглобин — транспортная ф.;
Актин и миозин — сократительная, двигательная ф.;
Гормоны (инсулин, соматотропин и др.) — регуляторная ф.;
Иммуноглобулины, тромбин, фибриноген и др. — защитная ф.;
Пепсин, каталаза, трипсин — каталитическая ф.
Вопрос 4. Какие функции белков вам известны?
Белки выполняют самые разнообразные функции в клетках: определяют их структуру и форму, изменяют скорость протекания химических реакций, обеспечивают передачу химических сигналов, осуществляют разные виды клеточного движения, а также перенос веществ через мембраны и т. п.
Вопрос 5. Чем объясняется многообразие функций белков?
Многообразие функций белков объясняется разнообразием форм и состава самих белков.
Вопрос 6. Что представляют собой белки — ферменты? Приведите примеры таких белков.
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию.
Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры. Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение. Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Основные свойства ферментов:
специфичность: способность фермента действовать только на специфический субстрат, например, липазы — на жиры;
каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Примеры белков — ферментов: пепсин, каталаза, трипсин, амилаза, протеазы, липазы, глутаматдегидрогеназа, аланинаминотрансфераза (АЛТ), лейцинаминопептидаза (ЛАП), фруктозо — 1,6 — дисфосфат — альдолаза (ФДФ — А) и др.
Вопрос 7. Как реализуется белками защитная функция?
Защитная функция белков в организме заключается в предотвращении проникновения чужеродных веществ, которые могут нанести существенный вред организму. Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами. Связывание их с белками возбудителей подавляет функциональную активность последних и останавливает развитие инфекции. Антитела обладают уникальным свойством: они способны отличать чужеродные белки от собственных белков организма.
Кроме того, в ответ на заражение вирусом клетка вырабатывает специальные белки — интерфероны, которые препятствуют размножению носителя инфекции.
Многие организмы используют для защиты или нападения специфические пептиды и белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. Часто эти вещества обладают ферментативной активностью (холерный токсин, коклюшный токсин) или же они могут нарушать структуру клеточных мембран (белки ядов змей и насекомых).
Вопрос 8. Что вам известно о гормонах? Есть ли среди них вещества белковой природы? Приведите примеры.
Гормоны — мельчайшие элементы, вырабатываемые нашим организмом. Это органические биологически активные вещества, которые вырабатываются собственными железами внутренней секреции организма. Поступая в кровь, связываясь с рецепторами определенных клеток, они регулируют физиологические процессы, обмен веществ.
Белкам — гормонам присуща регуляторная функция. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Например, инсулин регулирует содержание сахара в крови.
Примеры гормонов белковой природы (белки и полипептиды) — гормоны гипоталамуса, гормоны гипофиза (соматотропин, кортикотропин, пролактин, вазопрессин и окситоцин, гонадотропный гормон, полипептидные низкомолекулярные гормоны, адренокортикотропный гормон, кортикотропин (АКТГ)); щитовидной железы (тироксин, кальцитонин); гормон паращитовидных желез; гормоны поджелудочной железы (глюкагон и инсулин); гормон почек (эритропоэтин) и др.
Вопрос 9. Используя доступные информационные источники, подготовьте сообщение о конкретных видах белков, встречающихся в организмах, и выполняемых ими функциях.
Виды белков их функции в организме.
Структурные белки. Влияют на структуру самой клетки, ее форму. Всеми своими свойствами, качествами и даже функциями каждый вид тканей обязан именно структурным белкам. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
Транспортные белки. Транспортные белки обеспечивают транспортировку питательных и других полезных веществ по всему организму. Например, клеточные мембраны пропускают внутрь клетки не все подряд. И даже некоторые полезные вещества туда не могут проникнуть. Транспортные белки имеют способность проникать сквозь мембраны клеток и проносить с собой эти самые вещества. Гемоглобин — переносчик кислорода и других веществ.
Рецепторные белки. Рецепторные белки наряду с транспортными белками обеспечивают проникновение полезных веществ внутрь клеток. Располагаются рецепторные белки на поверхности мембран, то есть снаружи клеток. Они связываются с поступающими к ним питательными веществами и помогают им проникать внутрь. Важность этого вида белка переоценить невозможно, так как без них внутриутробное развитие может происходить совершенно неправильно или даже полностью прекратиться.
Сократительные белки. Человек двигается благодаря сокращению мышечных тканей. Эту способность им обеспечивают сократительные белки. Как отдельные клетки, так и организм в целом приходит в движение при помощи этого вида белков. Например, миозин, актин и др.
Регуляторные белки. Организм человека ведет свою жизнедеятельность благодаря множеству различных биохимических процессов внутри него. Все эти процессы обеспечивают и регулируют регуляторные белки. Одним из них является инсулин, также половые гормоны.
Защитные белки. Находясь в окружающей среде, организм постоянно контактирует с самыми разными веществами, микроорганизмами и так далее, попадает в самые разные условия. Сохранность здоровья в таких случаях обеспечивают иммунные клетки, которые и являются защитными белками. Также к последним относят прокоагулянты, которые обеспечивают нормальную свертываемость крови. Гаммаглобулин, иммуноглобулин — антитела (защита от инфекций).
Ферменты. Еще один вид белков — ферменты. Они отвечают за правильное протекание биохимических реакций внутри клеток во всем организме. За контроль метаболизма отвечают белки — протеазы.
Вопрос 10. Почему белки называют молекулами жизни?
Более 4 млрд. лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоками живых организмов. Своим бесконечным разнообразием всё живое обязано именно уникальным молекулам белка.
Белки — это природные органические соединения, которые обеспечивают все жизненные процессы любого организма. Из белков построены хрусталик глаза и паутина, панцирь черепахи и ядовитые вещества грибов. С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глубинах океана мерцают таинственным светом медузы.
Белковых молекул в живой клетке во много раз больше, чем всех других (кроме воды, разумеется!). Белки считаются основным материалом для «строительства» клеток. Учёные выяснили, что у большинства организмов белки составляют более половины их сухой массы. И разнообразие видов белков очень велико — в одной клетке такого маленького организма, как бактерия Escherichia соli насчитывается около 3 тыс. различных белков.
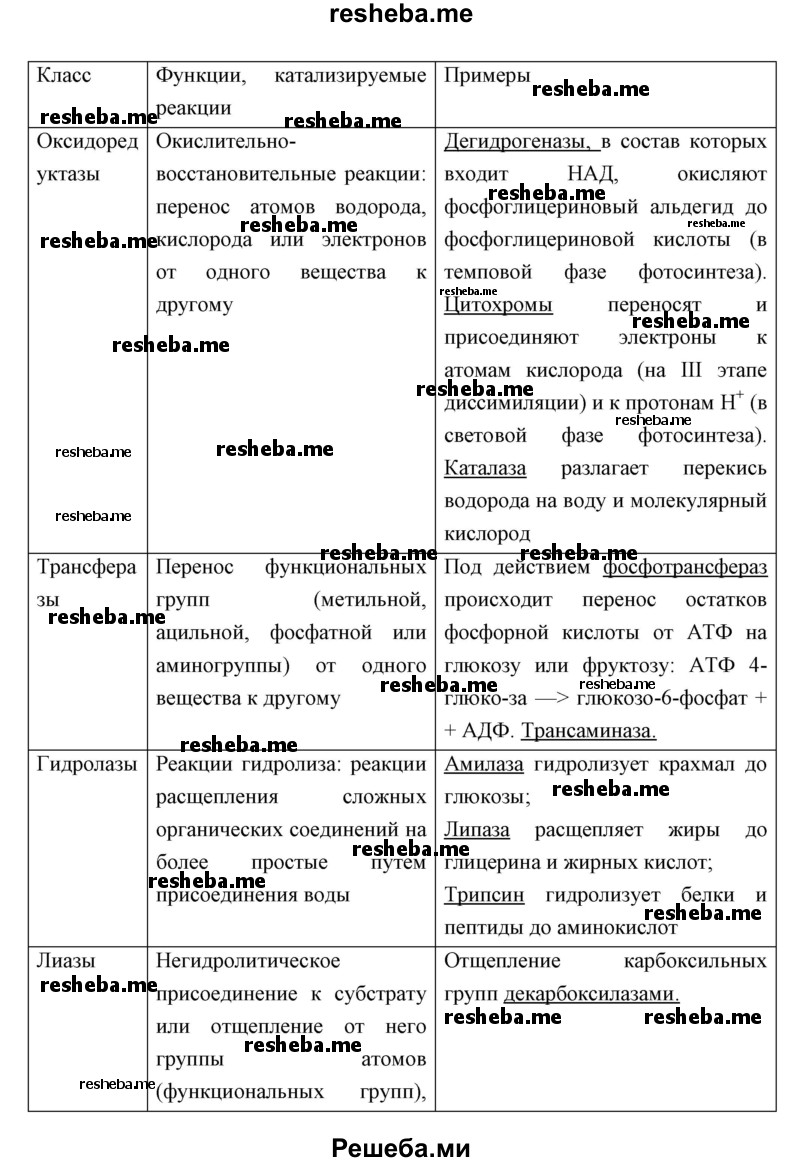
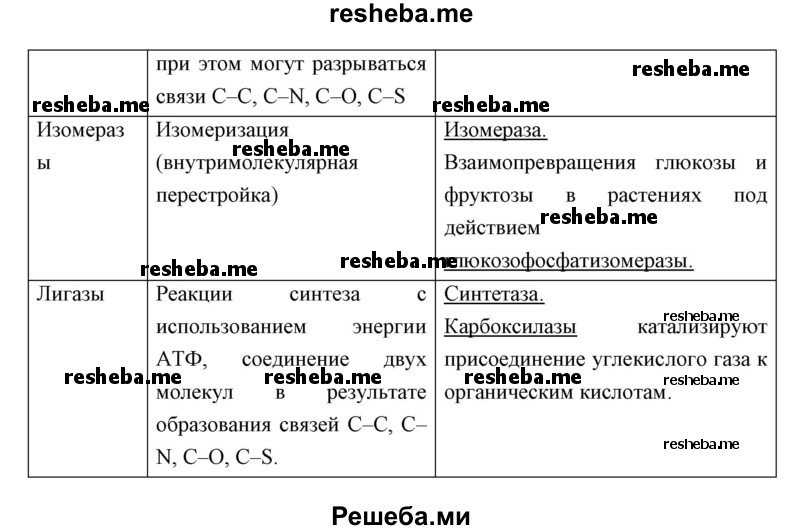
Вопрос 11. Используя дополнительные источники информации, найдите сведения о функциях белков ферментов различных классов. Результат оформите в виде таблицы.
Вопрос 12. Найдите в приведённом тексте ошибки. Укажите номера предложений, в которых сделаны ошибки. Исправьте их.
1) Большое значение в строении и жизнедеятельности организмов имеют белки. 2) Это биополимеры, мономерами которых являются азотистые основания. 3) Белки входят в состав плазматической мембраны. 4) Все белки выполняют в клетке ферментативную функцию. 5) Молекулы белка несут наследственную информацию о признаках организма.6) Молекулы белка входят в состав рибосом.
Ответ. Ошибки сделаны в предложениях под номерами: 2, 4, 5.
2)Это биополимеры, мономерами которых являются аминокислоты, соединенные между собой пептидной связью.
4)Не все белки выполняют в клетке ферментативную функцию. ИЛИ…. Все белки выполняют в клетке различные функции.
5) Молекулы белка не несут наследственную информацию о признаках организма. ИЛИ…Наследственная информация о признаках организма зашифрована в нуклеиновых кислотах.
Вопрос 13. Почему в запасных тканях семян растений (эндосперме, семядолях), даже очень богатых углеводами или жирами, обязательно присутствуют белки?
Семена у растений наиболее надежно обеспечивают их размножение и распространение. В семени содержится необходимый для прорастания зародыша запас питательных веществ. Белки при необходимости используются ими для получения аминокислот и энергии. Белки являются основным строительным материалом клеток. Также белки в сухом состоянии денатурируются значительно медленнее, чем белки оводненные, инактивирование ферментов в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие семена могут выдержать нагревание до гораздо более высоких температур, чем те же споры или семена в увлажненном состоянии.
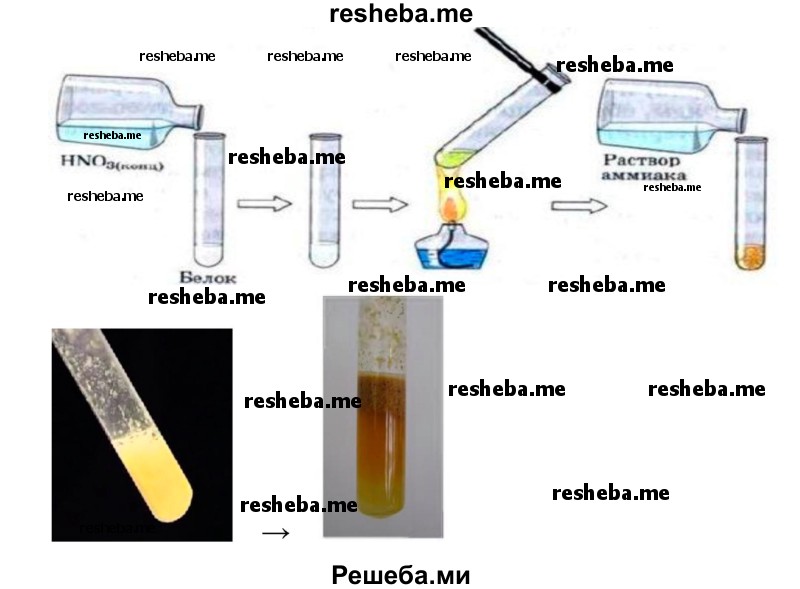
Вопрос 14. ЛАБОРАТОРНАЯ РАБОТА № 4 «Обнаружение белков с помощью качественной реакции»
Цель: показать наличие белков в биологических объектах.
Оборудование: штатив с пробирками, водяная баня, кристаллизатор со льдом, мерный стакан на 50 мл.
Реактивы: куриное яйцо, концентрированная азотная кислота, раствор аммиака, гидроксид натрия, раствор медного купороса, вода.
1. Приготовьте раствор белка.
2. Ксантопротеиновая реакция. В пробирку налейте 2—3 мл раствора белка и добавьте несколько капель азотной кислоты. Соблюдайте технику безопасности при работе с химическими реагентами! Нагрейте содержимое пробирки, при этом образуется жёлтый осадок. Охладите смесь и добавьте раствор аммиака до перехода жёлтой окраски в оранжевую.
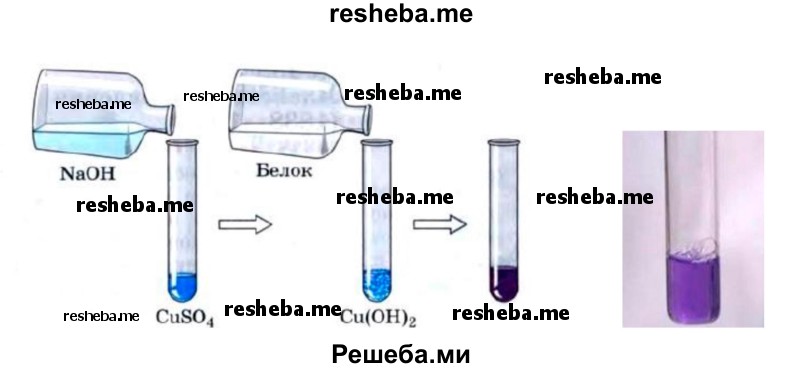
3. Биуретовая реакция. В пробирку налейте 2—3 мл раствора белка и 2—3 мл раствора гидроксида натрия, затем 1—2 мл раствора медного купороса. Появляется фиолетовое окрашивание.
4. Запишите результаты эксперимента и сделайте вывод.
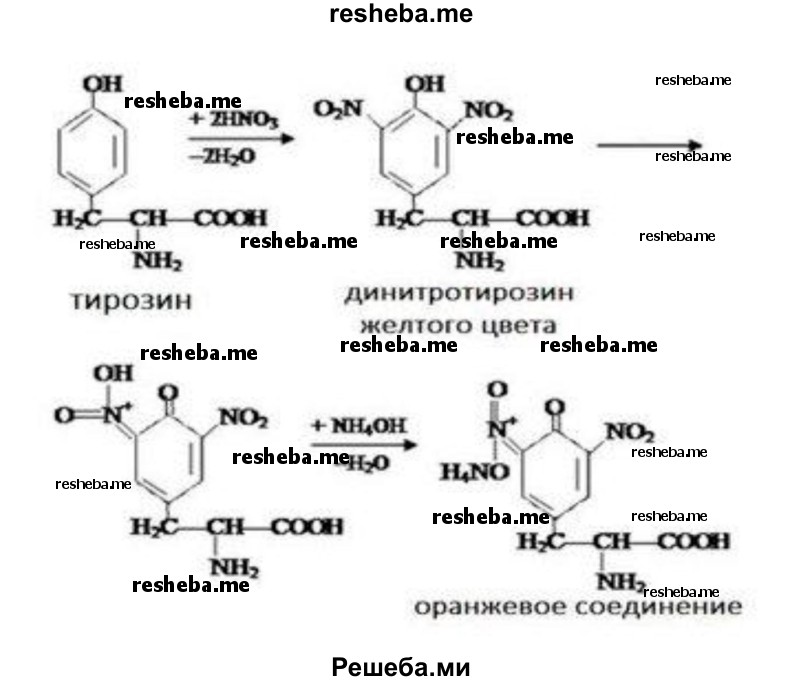
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот — триптофана, фенилаланина, тирозина, содержащих в своем составе ароматическое ядро. Ряд белков при добавлении к ним концентрированной азотной кислоты при нагревании дают желтое окрашивание, которое может переходить в оранжевое в щелочной среде.
Реакция вызвана нитрованием бензольного ядра указанных циклических аминокислот и образованием нитросоединений желтого цвета.
Взаимодействие с концентрированной азотной кислотой — белый осадок, нагревание — появлением желтой окраски, добавление аммиака — появление оранжевой окраски.
Ксантопротеиновую реакцию дают почти все белки. Ксантопротеиновая реакция обуславливает появление желтого окрашивания при попадании концентрированной азотной кислоты на кожу, ногти. Эту реакцию могут давать и более простые ароматические соединения (например, фенолы). Исключение составляют клупеин и сальмин (из группы протаминов) и желатина, в молекуле которых почти полностью отсутствуют ароматические аминокислоты.
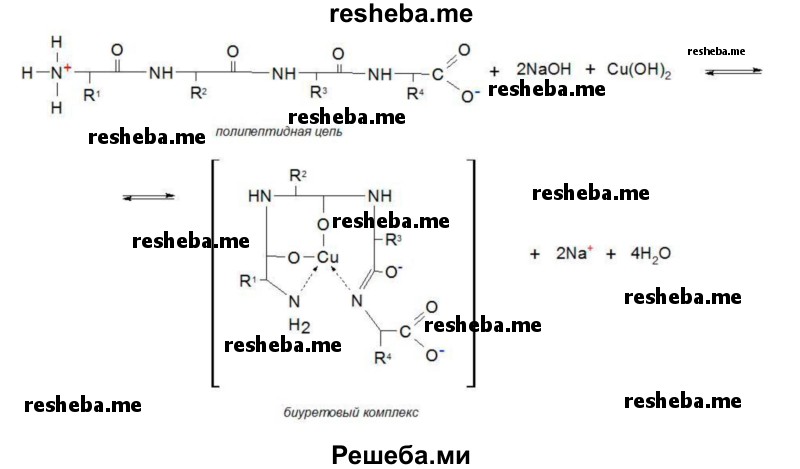
Биуретовая реакция является универсальной на пептидную связь в белках. Вещества, имеющие в своем составе не менее 2 — х пептидных связей дают эту реакцию.
Реакция состоит в том, что в щелочной среде в присутствии сернокислой меди белки и полипептиды дают сине — фиолетовое или красно — фиолетовое окрашивание в зависимости от длины пептида вследствие образования комплексных соединений меди с пептидной группой. Продукты гидролиза белков (пептоны) могут давать розовое, красное окрашивание.
Щелочная среда приводит к появлению отрицательного заряда вследствие диссоциации ОН — группы, благодаря этому кислород взаимодействует с медью с образованием солеобразной связи, а медь в свою очередь с атомами азота связана через дополнительно координационные связи за счет использования их неподеленных электронных пар. Это ведет к образованию стабильного комплекса.
Вывод: Ксантопротеиновая и биуретовая реакции — качественные реакции на белки. С помощью этих реакций можно доказать наличие белков в биологических объектах.
О живой материи. Белки
Более 4 млрд лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоками живых организмов. Своим бесконечным разнообразием всё живое обязано именно уникальным молекулам белка, и иные формы жизни во Вселенной науке пока неизвестны.
Белки, или протеины (от греч. «протос» — «первый»), — это природные органические соединения, которые обеспечивают все жизненные процессы любого организма. Из белков построены хрусталик глаза и паутина, панцирь черепахи и ядовитые вещества грибов. С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глубинах океана мерцают таинственным светом медузы.
Белковых молекул в живой клетке во много раз больше, чем всех других (кроме воды, разумеется!). Учёные выяснили, что у большинства организмов белки составляют более половины их сухой массы. И разнообразие видов белков очень велико — в одной клетке такого маленького организма, как бактерия Escherichia сой’ (см. дополнительный очерк «Объект исследования — прокариоты»), насчитывается около 3 тыс. различных белков.
БИОЛОГИЧЕСКИЕ «БУСЫ»
Молекула белка очень длинная. Химики называют такие молекулы полимерными (от греч. «поли» — «много» и «мерос» — «часть», «доля»). Действительно, длинная молекула полимера состоит из множества маленьких молекул, связанных друг с другом. Так нанизываются на нить бусинки в ожерелье. В полимерах роль нити играют химические связи между бусинками-молекулами.
Секрет белков спрятан в особенностях этих самых бусинок. Большинство полимеров не принимает устойчивой формы в пространстве, уподобляясь тем же бусам, у которых и не может быть пространственной структуры: повесишь их на шею — они примут форму кольца или овала, положишь в коробку — свернутся в клубок неопределённой формы. А теперь представим себе, что некоторые бусинки могут «слипаться» друг с другом. Например, красные притягиваются к жёлтым. Тогда вся цепочка примет определённую форму, обязанную своим существованием «слипа-нию» жёлтых и красных бусинок
Нечто подобное происходит и в белках. Отдельные маленькие молекулы, входящие в состав белка, обладают способностью «слипаться», так как между ними действуют силы притяжения. В результате у любой белковой цепи есть характерная только для неё пространственная структура. Именно она определяет чудесные свойства белков. Без такой структуры они не могли бы выполнять те функции, которые осуществляют в живой клетке.
При длительном кипячении белков в присутствии сильных кислот или щелочей белковые цепи распадаются на составляющие их молекулы, называемые аминокислотами. Аминокислоты — это и есть те «бусинки», из которых состоит белок, и устроены они сравнительно просто.
КАК УСТРОЕНА АМИНОКИСЛОТА
В природе встречаются также аминокислоты, в которых NH^-группа связана с более отдалёнными от карбоксильной группы атомами углерода. Однако для построения белков природа выбрала именно а-аминокислоты. Это обусловлено прежде всего тем, что только а-аминокислоты, соединённые в длинные цепи, способны обеспечить достаточную прочность и устойчивость структуры больших белковых молекул.
Число а-аминокислот, различающихся R-группой, велико. Но чаще других в белках встречается всего 20 разных аминокислот. Их можно рассматривать как алфавит «языка» белковой молекулы. Химики называют эти главные аминокислоты стандартными, основными или нормальными. Условно основные аминокислоты делят на четыре класса.
Для нормальной жизнедеятельности организм нуждается в полном наборе из 20 основных a-Z-аминокислот. Но одни из них могут быть синтезированы в клетках самого организма, а другие — должны поступать в готовом виде из пищевых продуктов. В первом случае аминокислоты называют заменимыми, а во втором — незаменимыми. Набор последних для разных организмов различен. Например, для белой крысы незаменимыми являются 10 аминокислот, а для молочнокислых бактерий — 16. Растения могут самостоятельно синтезировать самые разнообразные аминокислоты, создавать такие, которые не встречаются в белках.
ЧТО ТАКОЕ ПЕПТИД
Полимерная молекула белка образуется при соединении в длинную цепочку бусинок-аминокислот. Они нанизываются на нить химических связей благодаря имеющимся у всех аминокислот амино- и карбоксильной группам, присоединённым к а-атому углерода.
Образующиеся в результате такой реакции соединения называются пеп-тидами; (—СО— NH —группировка в них — это пептидная группа, а связь между атомами углерода и азота — пептидная связь (её ещё называют амидной). Соединяя аминокислоты посредством пептидных связей, можно получить пептиды, состоящие из остатков очень многих аминокислот. Такие соединения получили название полипептиды. Полипептидное строение белковой молекулы доказал в 1902 г. немецкий химик Эмиль Герман Фишер.
Общее число аминокислотных остатков в белковой молекуле изменяется в очень широких пределах. Так, человеческий инсулин состоит из 51 аминокислотного остатка, а лизо-цим молока кормящей матери — из 130. В гемоглобине человека 4 аминокислотные цепочки, каждая из которых построена из примерно 140 аминокислот. Существуют белки, имеющие почти 3 тыс. аминокислотных остатков в единой цепи.
Молекулярные массы белков лежат в диапазоне примерно от 11 тыс. для малых белков, состоящих из 100 аминокислотных остатков, до 1 млн и более для белков с очень длинными полипептидными цепями или для белков, состоящих из нескольких по-липептидных цепей.
Возникает вопрос: как же всё огромное многообразие белков с различными функциями и свойствами может быть создано всего из 20 молекул? А разгадка этого секрета природы проста — каждый белок имеет свой неповторимый аминокислотный состав и уникальный порядок соединения аминокислот, называемый первичной структурой белка.
СПИРАЛИ И СЛОИ
В начале 50-х гг. XX в. американские химики Лайнус Карл Полинг (1901— 1994), награждённый Нобелевской премией за исследования природы химической связи, и Роберт Кори (1897—1971) предположили, что некоторые участки аминокислотной цепочки в белках закручены в спираль. Благодаря совершенствованию экспериментальных методов (структуру белков изучают с помощью рентгеновских лучей) через несколько лет эта гениальная догадка подтвердилась.
Действительно, полипептидные цепи очень часто образуют спираль, закрученную в правую сторону. Это первый, самый низкий уровень пространственной организации белковых цепочек Здесь-то и начинают играть роль слабые взаимодействия «бусинок»-аминокислот: группа С=0 и группа N — H из разных пептидных связей могут образовывать между собой водородную связь. Оказалось, что в открытой Полингом и Кори спирали такая связь образована между группой С=0 каждой г-й аминокислоты и группой N — H ( i + 4)-й аминокислоты, т. е. между собой связаны аминокислотные остатки, отстоящие друг от друга на четыре «бусинки». Эти водородные связи и стабилизируют такую спираль в целом. Она получила название a.-спирали.
Позднее выснилось, что а-спираль — не единственный способ укладки аминокислотных цепочек. Помимо спиралей они образуют ещё и слои. Благодаря всё тем же водородным связям между группами С=0 и N — H друг с другом могут «слипаться» сразу несколько разных фрагментов одной полипептидной цепи. В результате получается целый слой — его назвали ^-слоем.
В большинстве белков а-спирали и р-слои перемежаются всевозможными изгибами и фрагментами цепи без какой-либо определённой структуры. Когда имеют дело с пространственной структурой отдельных участков белка, говорят о вторичной структуре белковой молекулы.
БЕЛОК В ПРОСТРАНСТВЕ
Для того чтобы получить полный «портрет» молекулы белка, знания первичной и вторичной структуры недостаточно. Эти сведения ещё не дают представления ни об объёме, ни о форме молекулы, ни тем более о расположении участков цепи по отношению друг к другу. А ведь все спирали и слои каким-то образом размещены в пространстве. Общая пространственная структура поли-пептидной цепи называется третичной структурой белка.
При образовании третичной структуры белка наконец-то проявляют активность R-группы — боковые цепи аминокислот. Именно благодаря им «слипаются» между собой большинство «бусинок»-аминокислот, придавая цепи определённую форму в пространстве.
В живом организме белки всегда находятся в водной среде. А самое большое число основных аминокислот — восемь — содержат неполярные R-группы. Разумеется, белок стремится надёжно спрятать внутрь своей молекулы неполярные боковые цепи, чтобы ограничить их контакт с водой. Учёные называют это возникновением гидрофобных взаимодействий (см. статью «Мельчайшая единица живого»).
Благодаря гидрофобным взаимодействиям вся полипептидная цепочка принимает определённую форму в пространстве, т. е. образует третичную структуру.
В молекуле белка действуют и другие силы. Часть боковых цепей основных аминокислот заряжена отрицательно, а часть — положительно. Так как отрицательные заряды притягиваются к положительным, соответствующие «бусинки» «слипаются». Электростатические взаимодействия, или, как их называют иначе, солевые мостики, — ещё одна важная сила, стабилизирующая третичную структуру.
У семи основных аминокислот есть полярные боковые цепи. Между ними могут возникать водородные связи, тоже играющие немалую роль в поддержании пространственной структуры белка.
Между двумя аминокислотными остатками цистеина иногда образуются ковалентные связи (— S —S—), которые очень прочно фиксируют расположение разных участков белковой цепи по отношению друг к другу. Такие связи называют дисуль-фидными мостиками. Это самые немногочисленные взаимодействия в белках (в некоторых случаях они вообще отсутствуют), зато по прочности они не имеют равных.
ВЫСШИЙ УРОВЕНЬ ПРОСТРАНСТВЕННОЙ ОРГАНИЗАЦИИ БЕЛКОВ
Молекула белка может состоять не из одной, а из нескольких полипептидных цепей. Каждая такая цепь представляет собой самостоятельную пространственную структуру — субъединицу. Например, белок гемоглобин состоит из четырёх субъединиц, которые образуют единую молекулу, располагаясь в вершинах почти правильного тетраэдра. Субъединицы «прилипают» друг к другу благодаря тем же самым силам, что стабилизируют третичную структуру. Это гидрофобные взаимодействия, солевые мостики и водородные связи.
Если белок состоит из нескольких субъединиц, говорят, что он обладает четвертичной структурой. Такая структура представляет собой высший уровень организации белковой молекулы. В отличие от первых трёх уровней четвертичная структура есть далеко не у всех белков. Приблизительно половина из известных на сегодняшний день белков её не имеют.
ПОЧЕМУ БЕЛКИ БОЯТСЯ ТЕПЛА
Связи, поддерживающие пространственную структуру белка, довольно легко разрушаются. Мы с детства знаем, что при варке яиц прозрачный яичный белок превращается в упругую белую массу, а молоко при скисании загустевает. Происходит это из-за разрушения пространственной структуры белков альбумина в яичном белке и казеина (огглат. caseus — «сыр») в молоке. Такой процесс называется денатурацией. В первом случае её вызывает нагревание, а во втором — значительное увеличение кислотности (в результате жизнедеятельности обитающих в молоке бактерий). При денатурации белок теряет способность выполнять присущие ему в организме функции (отсюда и название процесса: от лат. denaturare — «лишать природных свойств»). Денатурированные белки легче усваиваются организмом, поэтому одной из целей термической обработки пищевых продуктов является денатурация белков.
ЗАЧЕМ НУЖНА ПРОСТРАНСТВЕННАЯ СТРУКТУРА
В природе почти ничего не происходит случайно. Если белок принял определённую форму в пространстве, это должно служить достижению какой-то цели. Действительно, только белок с «правильной» пространственной структурой может обладать определёнными свойствами, т. е. выполнять те функции в организме, которые ему предписаны. А делает он это с помощью всё тех же R-групп аминокислот. Оказывается, боковые цепи не только поддерживают «правильную» форму молекулы белка в пространстве. R-группы могут связывать другие органические и неорганические молекулы, принимать участие в химических реакциях, выступая, например, в роли катализатора.
Часто сама пространственная организация полипептидной цепи как раз’ и нужна для того, чтобы сосредоточить в определённых точках пространства необходимый для выполнения той или иной функции набор боковых цепей. Пожалуй, ни один процесс в живом организме не проходит без участия белков.
В ЧЁМ СЕКРЕТ ФЕРМЕНТОВ
Все химические реакции, протекающие в клетке, происходят благодаря особому классу белков — ферментам. Это белки-катализаторы. У них есть свой секрет, который позволяет им работать гораздо эффективнее других катализаторов, ускоряя реакции в миллиарды раз.
Предположим, что несколько приятелей никак не могут встретиться. Но стоило одному из них пригласить друзей на день рождения, как результат не заставил себя ждать: все оказались в одном месте в назначенное время.
Чтобы встреча состоялась, понадобилось подтолкнуть друзей к контакту. То же самое делает и фермент. В его молекуле есть так называемые центры связывания. В них расположены привлекательные для определённого типа химических соединений (и только для них!) «уютные кресла» — R-группы, связывающие какие-то участки молекул реагирующих веществ. Например, если одна из молекул имеет неполярную группу, в центре связывания находятся гидрофобные боковые цепи. Если же в молекуле есть отрицательный заряд, его будет поджидать в молекуле фермента R-груп па с положительным зарядом.
В результате обе молекулы реагентов связываются с ферментом и оказываются в непосредственной близости друг от друга. Мало того, те их группы, которые должны вступить в химическую реакцию, сориентированы в пространстве нужным для реакции образом. Теперь за дело принимаются боковые цепи фермента, играющие роль катализаторов. В ферменте все «продумано» таким образом, что R-группы-катализаторы тоже расположены вблизи от места событий, которое называют активным центром. А после завершения реакции фермент «отпускает на волю» молекулы-продукты (см. статью «Ферменты — на все руки мастера»).
ОТКУДА БЕРЁТСЯ ИММУНИТЕТ
Белки выполняют в организме множество функций; они, например, защищают клетки от нежелательных вторжений, предохраняют их от повреждений. Специальные белки — антитела обладают способностью распознавать проникшие в клетки бактерии, вирусы, чужеродные полимерные молекулы и нейтрализовывать их.
У высших позвоночных от чужеродных частиц организм защищает иммунная система. Она устроена так, что организм, в который вторглись такие «агрессоры» — антигены, начинает вырабатывать антитела. Молекула антитела прочно связывается с антигеном: у антител, как и у ферментов, тоже есть центры связывания. Боковые цепи аминокислот расположены в центрах таким образом, что антиген, попавший в эту ловушку, уже не сможет вырваться из «железных лап» антитела. После связывания с антителом враг выдворяется за пределы организма.
Можно ввести в организм небольшое количество некоторых полимерных молекул, входящих в состав бактерий или вирусов-возбудителей какой-либо инфекционной болезни.
В организме немедленно появятся соответствующие антитела. Теперь попавший в кровь или лимфу «настоящий» болезнетворный микроб тотчас же подвергнется атаке этих антител, и болезнь будет побеждена. Такой способ борьбы с инфекцией есть не что иное, как нелюбимая многими прививка. Благодаря ей организм приобретает иммунитет к инфекционным болезням.
ДЛЯ ЧЕГО В ГЕМОГЛОБИНЕ ЖЕЛЕЗО
В природе существуют белки, в которых помимо аминокислот содержатся другие химические компоненты, такие, как липиды, сахара, ионы металлов. Обычно эти компоненты играют важную роль при выполнении белком его биологической функции. Так, перенос молекул и ионов из одного органа в другой осуществляют транспортные белки плазмы крови. Белок гемоглобин (от греч. «гема» — «кровь» и лат. globus — «шар», «шарик»), содержащийся в кровяных клетках — эритроцитах (от греч. «эритрос» — «красный» и «китос» — «клетка»), доставляет кислород от лёгких к тканям. В молекуле гемоглобина есть комплекс иона железа Fe 24 » со сложной органической молекулой, называемый гемам. Гемоглобин состоит из четырёх белковых субъединиц, и каждая из них содержит по одному гему.
В связывании кислорода в лёгких принимает участие непосредственно ион железа. Как только к нему хотя бы в одной из субъединиц присоединяется кислород, сам ион тут же чуть-чуть меняет своё расположение в молекуле белка. Движение железа «провоцирует» движение всей аминокислотной цепочки данной субъединицы, которая слегка трансформирует свою третичную структуру.
Другая субъединица, ещё не присоединившая кислород, «чувствует», что произошло с соседкой. Её структура тоже начинает меняться. В итоге вторая субъединица связывает кислород легче, чем первая. Присоединение кислорода к третьей и четвёртой субъединицам происходит с ещё меньшими трудностями. Как видно, субъединицы помогают друг другу в работе. Для этого-то гемоглобину и нужна четвертичная структура. Оксид углерода СО (в просторечии угарный газ) связывается с железом в геме в сотни раз прочнее кислорода. Угарный газ смертельно опасен для человека, поскольку лишает гемоглобин возможности присоединять кислород.
А ЕЩЁ БЕЛКИ.
. Служат питательными веществами. В семенах многих растений (пшеницы, кукурузы, риса и др.) содержатся пищевые белки. К ним относятся также альбумин — основной компонент яичного белка и казеин — главный белок молока. При переваривании в организме человека белковой пищи происходит гидролиз пептидных связей. Белки «разбираются» на отдельные аминокислоты, из которых организм в дальнейшем «строит» новые пептиды или использует для получения энергии. Отсюда и название:
греческое слово «пептос» означает «переваренный». Интересно, что гидролизом пептидной связи управляют тоже белки — ферменты.
. Участвуют в регуляции клеточной и физиологической активности. К подобным белкам относятся многие гормоны (от греч. «гормао» — «побуждаю»), такие, как инсулин, регулирующий обмен глюкозы, и гормон роста.
. Наделяют организм способностью изменять форму и передвигаться. За это отвечают белки актин и миозин, из которых построены мышцы.
. Выполняют опорную и защитную функции, скрепляя биологические структуры и придавая им прочность. Кожа представляет собой почти чистый белок коллаген, а волосы, ногти и перья состоят из прочного нерастворимого белка кератина.
ЧТО ЗАПИСАНО В ГЕНАХ
Последовательность аминокислот в белках кодируется генами, которые хранятся и передаются по наследству с помощью молекул ДНК (см. статьи «Хранитель наследственной информации. ДНК» и «Экспрессия генов»). Пространственную структуру белка задаёт именно порядок расположения аминокислот. Получается, что не только первичная, но и вторичная, третичная и четвертичная структуры белков составляют содержание наследственной информации. Следовательно, и выполняемые белками функции запрограммированы генетически. Громадный перечень этих функций позволяет белкам по праву называться главными молекулами жизни. Поэтому сведения о белках и есть то бесценное сокровище, которое передаётся в природе от поколения к поколению.
Интерес человека к этим органическим соединениям с каждым годом только увеличивается. Сегодня учёные уже расшифровали структуру многих белковых молекул. Они выясняют функции самых разных белков, пытаются определить взаимосвязь функций со структурой. Установление сходства и различий у белков, выполняющих аналогичные функции у разных живых организмов, позволяет глубже проникать в тайны эволюции.
АМИНОКИСЛОТЫ — ПОКАЗАТЕЛИ ВОЗРАСТА
ЗА ЧТО СЕНГЕР ПОЛУЧИЛ НОБЕЛЕВСКИЕ ПРЕМИИ
При гидролизе белков до аминокислот (разрушении пептидной связи водой) теряется информация о последовательности их соединения. Поэтому долгое время считали, что определение первичной структуры белка представляет собой совершенно безнадежную задачу. Но в 50-х гг. XX в. английский биохимик Фредерик Сенгер (родился в 1918 г.) смог расшифровать последовательность аминокислот в полипептидных цепях гормона инсулина. За эту работу, на выполнение которой ушло несколько лет, в 1958 г. Сенгер был удостоен Нобелевской премии по химии (двадцатью годами позже он совместно с У. Гилбертом получил вторую премию за вклад в установление первичной структуры ДНК).
Принципы определения аминокислотной последовательности, впервые сформулированные Сенгером, используются и ныне, правда, со всевозможными вариациями и усовершенствованиями. Процедура установления первичной структуры белка сложна и многоступенчата: в ней около десятка различных стадий. Сначала белок расщепляют до отдельных аминокислот и устанавливают их тип и количество в данном веществе. На следующей стадии длинную белковую молекулу расщепляют уже не полностью, а на фрагменты. Затем в этих фрагментах определяют порядок соединения аминокислот, последовательно отделяя их одну за другой. Расшепление белка на фрагменты проводят несколькими способами, чтобы в разных фрагментах были перекрывающиеся участки. Выяснив порядок расположения аминокислот во всех фрагментах, получают полную информацию о том, как аминокислоты расположены в белке. К концу XX в. созданы специальные приборы, определяющие последовательность аминокислот в молекуле белка в автоматическом режиме — секвенаторы (от англ. sequence — «последовательность»).
МОЛОКО И КИСЛОМОЛОЧНЫЕ ПРОДУКТЫ
Молоко представляет собой коллоидный раствор жира в воде. Под микроскопом хорошо видно, что оно неоднородно: в бесцветном растворе (сыворотке) плавают жировые шарики.
Входящий в состав молока сахар лактоза С^НддО,, изомерен сахарозе. В организме человека под действием фермента лактазы этот сахар расщепляется на моносахариды глюкозу и галактозу, которые легко усваиваются. За счёт этого, например, грудные дети пополняют запасы углеводов. Интересно, что у многих людей (в основном у представителей монголоидной расы) организм в зрелом возрасте утрачивает способность расщеплять лактозу.
Проходя через пищеварительный тракт, лактоза не усваивается, а становится питательной средой для развития различных болезнетворных микроорганизмов, что приводит к общему недомоганию. Именно поэтому народы Дальнего Востока (японцы, китайцы) практически не употребляют в пишу молочные продукты.
с„н„о„ + н,о =лактоза == 4СНзСН(ОН)СООН. молочная (2-гидроксипропановая) кислота
Именно молочная кислота определяет специфический вкус кефира. По мере того как она накапливается в растворе, происходит коагуляция (свёртывание)казеина, который выделяется в свободном виде. Поэтому кефир имеет более густую консистенцию, чем молоко. Молочнокислое сбраживание лактозы сопровождается спиртовым брожением, из-за чего в кисломолочных продуктах, в частности в кефире, есть небольшое количество алкоголя (до 0,03 %). В кисломолочных продуктах содержатся также микроорганизмы, которые подавляют развитие болезнетворных бактерий и тем самым улучшают пишеварение.
Творог тоже получают сквашиванием молока молочнокислыми бактериями. Его главной составной частью является белок казеин.
МЕДНАЯ КРОВЬ
Кроме кальмаров, кислород переносится “голубой кровью” также у десятиногих ракообразных (омары, крабы, креветки). Гемоиианин найден у всех головоногих моллюсков (осьминоги, кальмары, каракатицы), разнообразных улиток, пауков и др. А вот у морских гребешков, устриц и других двустворчатых моллюсков его нет.
Из гемоиианина нетрудно полностью извлечь медь. Аля этого достаточно обработать белок в отсутствие кислорода реактивом, который прочно связывается с ионами одновалентной меди. Таким же способом можно определить содержание меди в гемоиианине. Лишённый этого металла, он теряет способность переносить кислород. Но если потом ввести в раствор белка ионы Си»1′, гемоиианин восстанавливает свою физиологическую активность.
Так было доказано, что в отсутствие кислорода медь гемоиианина находится в степени окисления +1. При избытке же этого газа происходит частичное окисление металла. При этом всегда на одну связанную гемоиианином молекулу кислорода приходится два атома меди. Таким образом, кислород окисляет ровно половину атомов меди. Это ещё одно отличие гемоиианина от значительно более распространённого в животном мире гемоглобина, в котором все атомы железа равноценны и имеют заряд +2 как в свободном состоянии, так и в комплексе с кислородом.