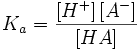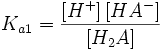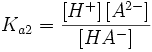pka кислот что это
Разница между рКа и рН
В физической химии pKa и pH являются двумя терминами, связанными с кислотностью системы. Это логарифмические значения. Самый простой способ выразить и сравнить очень большие или очень маленькие суммы
Содержание:
Ключевые области покрыты
1. Что такое рКа
— определение, ценности, отношения
2. Что такое рН
— определение, ценности, отношения
3. В чем разница между рКа и рН
– Сравнение ключевых различий
Ключевые термины: Кислотность, Константа диссоциации кислоты, Основность, pH, pKa
Что такое рКа
Константа диссоциации кислоты этого равновесия равна
[A – ] = Концентрация сопряженного основания
[ЧАС + ] = Концентрация ионов H +
[HA] = концентрация присутствующей кислоты
Тогда значение pKa константы диссоциации кислоты может быть указано, как показано ниже.
Рассматривая значение pKa, мы можем определить, является ли кислота сильной кислотой или слабой кислотой. Если значение рКа высокое, кислота слабая. Это связано с тем, что более высокое значение pKa указывает на то, что Ka является низким. Для того чтобы значение Ка было низким, [ – ][ЧАС + ] значение должно быть ниже, чем значение [HA]. Это означает, что кислота была диссоциирована частично. Но если значение [ – ][ЧАС + ] выше, чем [HA], тогда Ka будет высоким, а pKa будет низким соответственно. Это указывает на то, что это сильная кислота.
Что такое рН
В аналитической химии показатели pH используются для определения конечной точки определенной реакции. Эти индикаторы очень чувствительны к изменениям рН и показывают разные цвета для разных значений рН в водных растворах.
Тем не менее, значение рН является хорошим показателем кислотности или щелочности в водоеме. рН-метры могут быть использованы для измерения рН воды или любого другого раствора.
Разница между рКа и рН
Определение
Индикация кислотности
рКа: pKa указывает, является ли кислота сильной кислотой или слабой кислотой.
pH: pH показывает, является ли система кислотной или щелочной.
Подробности даны
рКа: рКа дает подробную информацию о диссоциации кислоты в водном растворе.
pH: pH дает подробную информацию о концентрации H + ионы в системе.
Ценности
рКа: Если pKa кислоты высокое, это слабая кислота, а если pKa кислоты низкое, это сильная кислота.
pH: Если pH системы высокий, система является щелочной, но если pH низкий, эта система является кислой.
Влияние других параметров
pH: рН зависит от Н + концентрация.
Заключение
Как pKa, так и pH являются очень важными параметрами в лабораторных условиях. Основное различие между pKa и pH заключается в том, что pKa указывает на диссоциацию кислоты, тогда как pH указывает на кислотность или щелочность системы.
Константа кислотности
Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на ион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д.
Содержание
Примеры расчета
(A — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы НА):
Одноосновная кислота
HA = H + + A −
Двухосновная кислота
H2A = H + + HA −
HA − = H + + A 2 −
Следует понимать, что фигурирующая в выражениях концентрация HA — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величина pK
См. также
Полезное
Смотреть что такое «Константа кислотности» в других словарях:
константа кислотности — (константа диссоциации кислоты) – константа равновесия Ка, характеризующая степень переноса протона от кислоты к воде как к растворителю. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
константа кислотности — rūgštingumo konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Rūgšties protolizės pusiausvyros konstanta. atitikmenys: angl. acidity constant vok. Aziditätskonstante, f rus. константа кислотности, f pranc. constante d’acidité … Penkiakalbis aiškinamasis metrologijos terminų žodynas
константа кислотности — rūgštingumo konstanta statusas T sritis chemija apibrėžtis Rūgšties protolizės pusiausvyros konstanta. atitikmenys: angl. acidity constant rus. константа кислотности … Chemijos terminų aiškinamasis žodynas
константа диссоциации кислоты — см. константа кислотности … Химические термины
Уровень кислотности — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
ФУНКЦИИ КИСЛОТНОСТИ — определяют протонирую щую способность р ров к т. Если протонируется нейтральная молекула В, Ф. к. обозначают H0, если анион или катион H или … Химическая энциклопедия
Угольная кислота — Угольная кислота … Википедия
КИСЛОТЫ И ОСНОВАНИЯ — Термины кислоты и основания вполне сформировались в 17 в. Их содержание неоднократно пересматривалось и дополнялось. Этот процесс происходил и происходит в острых столкновениях представителей разных взглядов на природу К. и о. Развитие взглядов… … Химическая энциклопедия
Десорбционные методы ионизации в масс-спектрометрии — Десорбционные методы ионизации в масс спектрометрии группа методов ионизации в масс спектрометрии, для которых процессы десорбции твердого анализируемого вещества и его ионизации практически неотделимы во времени. Наиболее полное развитие… … Википедия
Уравнение Бренстеда — Уравнение Бренстеда уравнение, количественно описывающее зависимость скорости катализируемых кислотами или основаниями реакций от природы кислоты. Впервые предложено в 1924 г. Бренстедом и Педерсеном. Для кислотного катализа уравнение… … Википедия
Константа диссоциации определяется как
где количества в квадратных скобках представляют концентрации веществ в состоянии равновесия.
СОДЕРЖАНИЕ
Теоретические основы
Определения
Бронстед и Лоури обобщили это далее на реакцию протонного обмена:
кислота + основание ⇌ сопряженное основание + сопряженная кислота.
В химии растворов обычно используется H + как сокращение для сольватированного иона водорода, независимо от растворителя. В водном растворе H + обозначает сольватированный ион гидроксония, а не протон.
Обозначение кислоты или основания как «конъюгата» зависит от контекста. Конъюгированная кислота BH + основания B диссоциирует согласно
что является обратным равновесию
Точно так же гидролиз ионов металлов заставляет ионы, такие как [Al (H 2 O) 6 ] 3+, вести себя как слабые кислоты:
Константа равновесия
Константа термодинамического равновесия может быть определена как K ⊖ <\ Displaystyle К ^ <\ ominus>>
получается. Обратите внимание, однако, что все опубликованные значения константы диссоциации относятся к конкретной ионной среде, использованной при их определении, и что разные значения получены в разных условиях, как показано для уксусной кислоты на иллюстрации выше. Когда опубликованные константы относятся к ионной силе, отличной от той, которая требуется для конкретного применения, они могут быть скорректированы с помощью специальной теории ионов (SIT) и других теорий.
Накопительные и ступенчатые константы
Константы ассоциации и диссоциации
С другой стороны, для баз используются константы ассоциации.
Для полипротонных кислот нумерация констант ступенчатой ассоциации обратна нумерации констант диссоциации. Например, для фосфорной кислоты (подробности в # полипротонных кислотах ниже)
Температурная зависимость
Все константы равновесия изменяются с температурой в соответствии с уравнением Ван’та Гоффа.
Стандартное изменение энтальпии реакции само по себе является функцией температуры, согласно закону термохимии Кирхгофа :
Размерность
В биохимии принято указывать значение с размером, например, « K a = 30 мМ», чтобы указать масштаб, миллимолярный (мМ) или микромолярный (мкМ) значений концентрации, используемых для его расчета.
Сильные кислоты и основания
Монопротоновые кислоты
Полипротонные кислоты
Когда разница между последовательными значениями p K меньше примерно четырех, существует перекрытие между диапазоном pH существования разновидностей в равновесии. Чем меньше разница, тем больше перекрытие. Случай с лимонной кислотой показан справа; растворы лимонной кислоты забуферены во всем диапазоне pH от 2,5 до 7,5.
Согласно первому правилу Полинга, последовательные значения p K данной кислоты увеличиваются (p K a2 > p K a1 ). Для оксикислот с более чем одним ионизируемым водородом на одном атоме значения p K a часто увеличиваются примерно на 5 единиц на каждый удаленный протон, как в примере с фосфорной кислотой выше.
Изоэлектрическая точка
Подставьте выражение для [AH] из второго уравнения в первое уравнение.
Основы и основность
Используя рассуждения, аналогичные использовавшимся ранее
K б знак равно [ ЧАС B + ] K ш [ B ] [ ЧАС + ] знак равно K ш K а <\ displaystyle K _ <\ text > = <\ frac <[\ mathrm
Для гидролизованного иона металла K b также можно определить как константу ступенчатой диссоциации
Это величина, обратная константе ассоциации для образования комплекса.
Амфотерные вещества
но также сопряженная кислота карбонат- иона CO 2-
3 в (обратном) равновесии
При pH менее примерно 5 протонируются как карбоксилатная группа, так и аминогруппа. По мере увеличения pH кислота диссоциирует в соответствии с
При высоком pH может иметь место вторая диссоциация.
Таким образом, молекула аминокислоты амфотерная, потому что она может быть протонированной или депротонированной.
Самоионизация воды
Константа равновесия определяется выражением
Для растворов, в которых концентрации растворенных веществ не очень высоки, концентрацию [H 2 O] можно считать постоянной, независимо от растворенных веществ; это выражение затем можно заменить на
Эти данные могут быть подогнаны к параболе с
Из этого уравнения p K w = 14 при 24,87 ° C. При этой температуре ионы водорода и гидроксид-ионы имеют концентрацию 10-7 М.
Кислотность в неводных растворах
Растворитель с большей вероятностью будет способствовать ионизации растворенной молекулы кислоты в следующих случаях:
Значения p K a органических соединений часто получают с использованием апротонных растворителей диметилсульфоксида (ДМСО) и ацетонитрила (ACN).
| Растворитель | Номер донора | Диэлектрическая постоянная |
|---|---|---|
| Ацетонитрил | 14 | 37 |
| Диметилсульфоксид | 30 | 47 |
| Воды | 18 | 78 |
ДМСО широко используется в качестве альтернативы воде, поскольку он имеет более низкую диэлектрическую проницаемость, чем вода, и менее полярен, поэтому легче растворяет неполярные гидрофобные вещества. Он имеет измеряемое значение p K в диапазоне от 1 до 30. Ацетонитрил менее щелочной, чем ДМСО, поэтому в целом кислоты в этом растворителе слабее, а основания сильнее. Некоторые значения p K a при 25 ° C для ацетонитрила (ACN) и диметилсульфоксида (DMSO). показаны в следующих таблицах. Значения для воды включены для сравнения.
В водных растворах гомоконъюгирования не происходит, потому что вода образует более сильные водородные связи с основанием конъюгата, чем кислота.
Смешанные растворители
Универсальная, не зависящая от растворителя шкала для констант диссоциации кислоты не разработана, поскольку не существует известного способа сравнения стандартных состояний двух различных растворителей.
Факторы, влияющие на значения p K a
Термодинамика
Константа равновесия связана со стандартным изменением энергии Гиббса для реакции, поэтому для константы диссоциации кислоты
Обратите внимание, что стандартное изменение свободной энергии для реакции относится к изменениям от реагентов в их стандартных состояниях до продуктов в их стандартных состояниях. Изменение свободной энергии в состоянии равновесия равно нулю, поскольку химические потенциалы реагентов и продуктов равны в состоянии равновесия.
Экспериментальное определение
Общий объем добавленного сильного основания должен быть небольшим по сравнению с начальным объемом раствора титранта, чтобы ионная сила оставалась почти постоянной. Это гарантирует, что p K a останется неизменным во время титрования.
Расчетная кривая титрования для щавелевой кислоты показано на рисунке справа. Щавелевая кислота имеет значения p K a 1,27 и 4,27. Следовательно, буферные области будут центрированы при pH примерно 1,3 и pH 4,3. Буферные области несут информацию, необходимую для получения значений p K a при изменении концентраций кислоты и конъюгированного основания вдоль буферной области.
Калориметрия изотермического титрования (ITC) может использоваться для определения как значения ap K, так и соответствующей стандартной энтальпии диссоциации кислоты. Программное обеспечение для выполнения расчетов поставляется производителями приборов для простых систем.
Микроконстанты
K б знак равно K Терминал + K внутренний <\ displaystyle K _ <\ text > = K _ <\ text
Тем не менее, место протонирования очень важно для биологической функции, поэтому были разработаны математические методы для определения микроконстант.
Когда реагент подвергается двум последовательным реакциям, макроконстанта для комбинированной реакции является произведением микроконстанты для двух стадий. Например, вышеупомянутый цвиттерион цистеина может потерять два протона, один из серы и один из азота, а общая макроконстанта для потери двух протонов является произведением двух констант диссоциации K = K a (-SH) K a (-NH 3 + ). Это также можно записать в терминах логарифмических констант как p K = p K a (-SH) + p K a (-NH 3 + ).
Приложения и значение
Значения для обычных веществ
Кислотность и основность разбавленных растворов кислот и оснований
Мерой силы кислоты или основания, согласно теории Брёнстеда – Лоури является константа кислотности или основности соответственно. Поскольку наиболее распространенным растворителем является вода, измерения проводят обычно в воде. Кислота в воде отдает ей свой протон:
НХ + Н2 O ↔ Н3 O + + X –
Применяя закон действующих масс, получим:
В разбавленных растворах [Н2 O ] = const (=55,5 моль/л), поэтому можно записать
Применяя аналогичный вывод для основания, получим:
Величина Кв называется константой основности и является мерой основности относительно стандарта (в данном случае Н2O ). Аналогично величине pH константы кислотности и основности можно выразить в логарифмической форме:
Константы кислотности и основности связаны соотношением:
где Kw — константа автопротолиза растворителя (для воды — ионное произведение). Принимая во внимание ( 75 ), получаем уравнение ( 76 ) в виде:
pKw=pKa +pKв ( 77)
рКа = 14 – рКв (78)
Константы кислотности слабых кислот, нерастворимых в воде, определяют в других растворителях относительно друг друга, выстраивая таким образом единую шкалу кислотности. Полученные значения рКа носят приблизительный характер и могут быть использованы только для качественных оценок, например, данные таблицы 6-4 по константам кислотности относительно воды некоторых кислот Бренстеда.
Согласно табл. 6-4, в воде кислотами являются HCIO4, СН3СООН, основаниями — С2Н5ОН, С2Н2, NH3, С2Н4, С2Н6; в аммиаке кислоты — HCIO4, СН3СООН, С2Н5ОН, С2Н2, основания — С2Н4 и С2Н6.