phk coronavirus sars cov 2 что это
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Отслеживание вариантов вируса SARS-CoV-2
Все вирусы, включая вирус SARS-CoV-2, являющийся возбудителем коронавирусной болезни COVID-19, со временем претерпевают изменения. Большинство изменений не влияют или практически не влияют на свойства соответствующего вируса. Однако некоторые изменения могут затрагивать и свойства вируса, например его способность к распространению, связанный с этим уровень контагиозности или эффективность вакцин, терапевтических препаратов, средств диагностики или иных медико-санитарных и социальных мер.
ВОЗ совместно с партнерами, экспертными сетями, национальными органами, учреждениями и исследовательскими кругами проводит мониторинг и оценку эволюции вируса SARS-CoV-2 с января 2020 г. Появление в конце 2020 г. новых вариантов вируса, ставших источником повышенного риска для глобального общественного здравоохранения, подтолкнуло к ускоренному проведению классификации отдельных вариантов, вызывающих интерес (ВВИ), и вариантов, вызывающих озабоченность (ВВО), чтобы обеспечить уделение приоритетного внимания глобальному мониторингу и исследованиям и в конечном счете предоставить информацию, полезную для нынешнего ведения борьбы с пандемией COVID-19.
ВОЗ и ее международные сети экспертов ведут мониторинг эволюции вируса, с тем чтобы в случае выявления значимых замен аминокислот в геноме вируса страны и общественность могли быть проинформированы о мерах, которые следует принять для борьбы с новыми вариантами и предупреждения их распространения. Во всем мире действуют и развиваются системы обнаружения сигналов о возможном появлении вариантов, вызывающих озабоченность (ВВО) или интерес (ВВИ), и их оценки с точки зрения риска, который они представляют для здоровья населения во всем мире. Национальные органы могут принять решение о присвоении такого статуса другим вариантам, вызывающим интерес/озабоченность на местном уровне.
Снижение интенсивности распространения вируса посредством проверенных противоэпидемических мероприятий, а также предупреждение интродукции вируса в популяции животных являются важнейшими аспектами глобальной стратегии по сокращению количества мутаций, способных вызвать негативные последствия для здоровья населения.
Текущие стратегии и мероприятия, рекомендованные ВОЗ, остаются эффективными для борьбы с вариантами вируса, выявленными с начала пандемии. Полученные в ряде стран с широким распространением ВВО данные свидетельствуют о том, что противоэпидемические меры и ограничения, включая меры по профилактике инфекций и инфекционному контролю (ПИИК), позволяют эффективно снижать число случаев заболевания COVID-19, госпитализации и смерти. Национальным и местным органам власти настоятельно рекомендуется сохранять и укреплять существующие противоэпидемические меры, а также мероприятия в области ПИИК. Органам власти также рекомендуется укреплять возможности по ведению эпиднадзора и геномного секвенирования и придерживаться систематического подхода для получения репрезентативных данных об интенсивности распространения вариантов SARS-CoV-2 с учетом местных условий, а также для выявления событий, необычных в эпидемиологическом отношении.
Исследование происхождения SARS-CoV-2
Со времен появления первых сообщений о новом виде пневмонии (COVID-19) в городе Ухань, провинции Хубэй, Китай, ведутся серьезные дискуссии о теории происхождении возбудителя — вируса SARS-CoV-2 (также называемого HCoV-19). Инфекции, вызванные SARS-CoV-2, в настоящее время широко распространены, и по состоянию на 11 марта 2020 года было подтверждено 121 564 случая в более чем 110 странах, при этом 4373 случая заболевания оказались смертельными.
SARS-CoV-2 является седьмым коронавирусом, который достоверно вызывает какие-либо заболевания у человека. SARS-CoV, MERSCoV и SARS-CoV-2 ответственны за тяжелые респираторные проявления заболевания, тогда как HKU1, NL63, OC43 и 229E связаны с легкими симптомами. Здесь мы рассмотрим известные данные исследований, которые позволят сделать выводы о происхождении SARS-CoV-2 из сравнительного анализа геномных данных. Мы предлагаем обзор отличительных особенностей генома SARS-CoV-2 и обсуждаем сценарии, при которых данные особенности могли возникнуть. Наши анализы ясно показывают, что SARS-CoV-2 не является искусственной лабораторной конструкцией или целенаправленно управляемым вирусом.
Примечательные особенности генома SARS-CoV-2
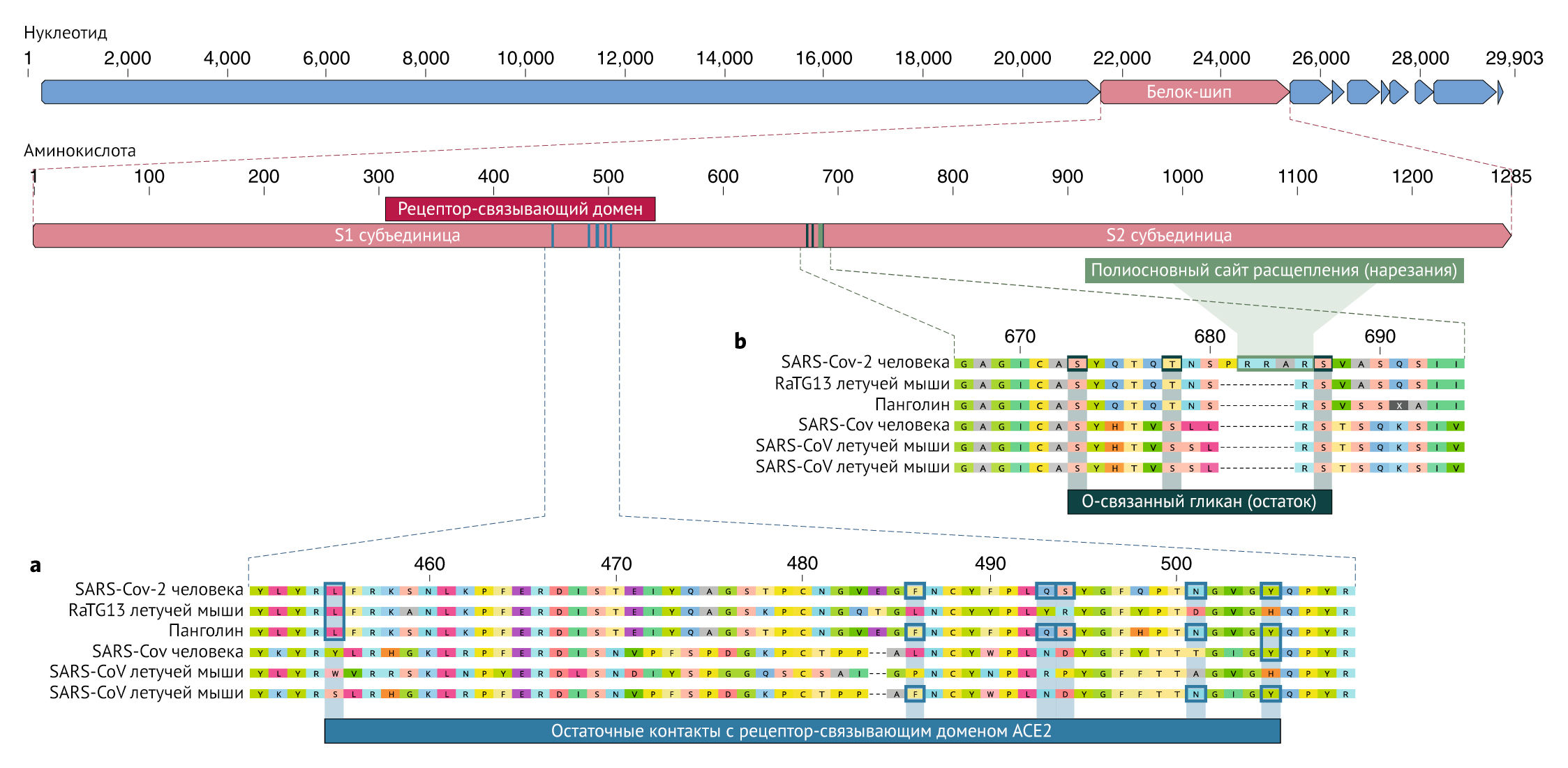
Наше сравнение альфа- и бета-коронавирусов выявляет две заметные геномные особенности SARS-CoV-2:
Мутации в рецептор-связывающем домене SARS-CoV-2
Рецептор-связывающий домен (RBD) в белке шипа является наиболее вариабельной частью генома коронавируса. Было показано, что шесть аминокислот RBD являются критическими для связывания с рецепторами ACE2 и для определения диапазона хозяев для различных SARS-CoV-подобных вирусов с координатами, основанными на SARS-CoV, — это Y442, L472, N479, D480, T487 и Y4911, которые соответствуют L455, F486, Q493, S494, N501 и Y505 в SARS-CoV-27. Пять из этих шести остатков различаются между SARSCoV-2 и SARS-CoV (рис. 1а). На основании структурных исследований и биохимических экспериментов SARS-CoV-2, по-видимому, имеет RBD, который обладает высоким сродством к ACE2 у человека, хорьков, кошек и других видов с высокой гомологией рецепторов.
Хотя приведенный выше анализ предполагает, что SARS-CoV-2 может связывать человеческий ACE2 с более высокой аффинностью, вычислительный анализ предсказывает, что его взаимодействие с рецепторами сложно назвать идеальным, и что последовательность RBD отличается от показанной в SARS-CoV, чтобы быть более «удобной» для связывания с рецептором. Таким образом, высокоаффинное связывание белка шипа SARS-CoV-2 с человеческим ACE2, скорее всего, является результатом естественного отбора на человеческом или подобном человеку рецептору ACE2. Это убедительное доказательство того, что SARS-CoV-2 не является продуктом целенаправленных манипуляций.
Сайт расщепления многоосновного фурина и О-связанные гликаны
Второй примечательной особенностью SARS-CoV-2 является многоосновный сайт расщепления (RRAR) на стыке S1 и S2, двух субъединиц шипа (Рис. 1b). Он позволяет эффективно расщепляться фурином и другими протеазами и играет роль в повышении вирулентности и наличие широкого диапазона выбора организмов-хозяев. Кроме того, ведущий пролин также вставлен в этот сайт в SARS-CoV-2. Таким образом, вставленная последовательность является PRRA (Рис. 1b). Предполагается, что поворот, созданный пролином, приведет к добавлению O-связанных гликанов к S673, T678 и S686, которые фланкируют сайт расщепления и являются уникальными именно для SARS-CoV-2 (Рис. 1b). Подобные сайты многоосновного расщепления не наблюдались ни в каких родственных «бета-коронавирусах линии В», хотя другие бета-коронавирусы человека, включая HKU1 (линия А), имеют эти сайты и предсказывают О-связанные гликаны. Учитывая уровень генетической изменчивости в шипе, вероятно, SARS-CoV-2-подобные вирусы с частичными или полными многоосновными сайтами расщепления будут позже обнаружены и у других видов. Функциональные последствия многоосновного сайта расщепления в SARS CoV-2 неизвестны, и будет важно определить его влияние на трансмиссивность и патогенез заболевания на животных моделях.
Эксперименты с SARS-CoV показали, что вставка сайта расщепления фурином в месте соединения S1-S2 усиливает клеточное слияние, не влияя на уровень проникновения вируса. Кроме того, эффективное расщепление шипа MERS-CoV позволяет MERS, подобным коронавирусам от летучих мышей, инфицировать и клетки человека. В случае вирусов птичьего гриппа быстрая репликация и передача в очень плотных популяциях кур стала результатом приобретения многоосновных сайтов расщепления в белке гемагглютинином (HA), который выполняет функцию, аналогичную функции белка шипа коронавируса. Приобретение многоосновных сайтов расщепления в HA путем вставки или рекомбинации превращает вирусы птичьего гриппа с низкой патогенностью в высокопатогенные формы. Получение многоосновных сайтов расщепления HA также наблюдалось после повторного пассажа в клеточной культуре или через животных. Функция О-связанных гликанов в новом коронавирусе пока неясна, но они могут создавать «муциноподобный домен», который экранирует эпитопы или ключевые остатки белка-шипа SARS-CoV-2. Некоторые вирусы используют муциноподобные домены в качестве щитов гликана, связанных с ускользанием от иммунного ответа. Хотя наличие О-связанного гликозилирования в коронавирусах является лабораторно достоверным фактом, необходимы экспериментальные исследования, чтобы определить, используются ли эти сайты в SARS-CoV-2.
Теории происхождения SARS-CoV-2
Маловероятно, что SARS-CoV-2 появился в результате лабораторных манипуляций с неким родственным SARS-CoV-подобным коронавирусом. Как отмечено выше, RBD SARS-CoV-2 оптимизирован для связывания с человеческим ACE2 с помощью естественного отбора, то есть механизма, отличного от ранее предсказанного. Кроме того, если бы была проведена генетическая манипуляция, вероятно, была бы использована одна из нескольких обратных генетических систем, доступных для бета-коронавирусов. Тем не менее, генетические данные неопровержимо показывают, что SARSCoV-2 не получен из каких-либо ранее использованных вирусных магистралей. Вместо этого мы предлагаем два сценария, которые могут правдоподобно объяснить происхождение SARS-CoV-2:
Сценарий 1:
Естественный отбор у животного-хозяина перед зоонозным переносом
Так как многие ранние случаи COVID-19 были связаны с рынком Хуанань города Ухань, Китай, возможно, что источник инфекции в виде животных присутствовал именно в этом месте. Учитывая сходство SARSCoV-2 с SARS-CoV-подобными коронавирусами летучих мышей, вполне вероятно, что летучие мыши служат резервуарными хозяевами для своего предшественника. Хотя RaTG13, отобранный у летучей мыши Rhinolophus affinis, примерно на 96% идентичен SARS-CoV-2, его шип расходится в RBD, что позволяет предположить, что он не может эффективно связываться с ACE27 человека (Pис. 1a).
Малайские панголины (Manis javanica), незаконно ввезенные в провинцию Гуандун, переносили коронавирусы, похожие на SARSCoV-2. Хотя вирус летучей мыши RaTG13 остается наиболее близким к SARS-CoV-2 по характеру своего генома, некоторые коронавирусы панголина демонстрируют сильное сходство с SARS-CoV-2 в RBD, включая все шесть ключевых сайтов RBD (рис. 1). Это ясно показывает, что связывающий белок SARS-CoV-2, оптимизированный для связывания с человеческим ACE2, является результатом естественного отбора. Ни у бета-коронавирусов летучих мышей, ни у бета-коронавирусов панголина, выделенных и изученных до настоящего времени, нет многоосновных сайтов расщепления. Хотя не было выявлено ни одного коронавируса животных, который был бы достаточно похожим, чтобы быть прямым предшественником SARS-CoV-2. Разнообразие коронавирусов у летучих мышей и других видов подвергается многочисленным исследованиям. Как инсерции, так и делеции могут происходить вблизи S1-S2 соединения коронавирусов, что показывает, что сайт многоосновного расщепления может возникать в результате естественного эволюционного процесса. Для того, чтобы вирус-предшественник приобрел как сайт многоосновного расщепления, так и мутации в связывающем белке, подходящем для связывания с человеческим АСЕ2, животному-хозяину, вероятно, потребуется высокая плотность популяции (чтобы обеспечить эффективный естественный отбор для проведения) и кодирование АСЕ2 гена, похожего на человеческий ортолог.
Сценарий 2:
Естественный отбор, происходящий в организме человека после зоонозного переноса
Вполне возможно, что предок SARS-CoV-2 попал в организм человека, приобретя геномные характеристики, описанные выше, путем адаптации во время передачи от человека к человеку. После того, как эти изменения были получены, они позволили пандемии развиться и создали достаточно большое количество прецедентов, чтобы запустить систему наблюдения, которая и обнаружила новый вирус. Все секвенированные до настоящего времени геномы SARS-CoV-2 имеют генетические признаки, описанные выше, и, таким образом, происходят от общего предка, который также обладал данными признаками. Присутствие в панголинах RBD, очень похожего на SARS-CoV-2, позволяет сделать вывод, что это также было возможно в вирусе, который стал распространяться и на людей. Оценки времени происхождения последнего общего предка SARS-CoV-2, сделанные с использованием текущих данных о вирусе, указывают на появление возбудителя в конце ноября 2019 года – начале декабря 2019 года, что согласуется с самыми ранними ретроспективно подтвержденными случаями. Следовательно, этот сценарий предполагает период нераспознанной передачи у человека между начальным зоонозным событием и приобретением многоосновного сайта расщепления. По сути, эта ситуация характерна для MERS-CoV, для которой все случаи заболевания людей являются результатом повторного распространения вируса с верблюдов-дромадеров, приводящих к спорадическим инфекциям или коротким цепям передачи, которые в конечном итоге проходят без адаптации к дальнейшей устойчивой передаче. Исследования полученных от человека образцов вируса могут дать информацию о том, как именно произошло его распространение и эволюция. Ретроспективные серологические исследования также могут быть информативными, поэтому было проведено несколько подобных исследований, показывающих низкую активность SARSCoV-подобных коронавирусов в некоторых районах Китая. Однако эти исследования не смогли критически ответить на вопрос, были ли воздействия вызваны предшествующими инфекциями SARS-CoV, SARS-CoV-2 или другими SARSCoV-подобными коронавирусами. Дальнейшие серологические исследования должны проводиться для определения степени предшествующего воздействия SARS-CoV-2 на человека.
Сценарий 3:
Мутации в вирусе возникли в результате естественного отбора во время переноса
Фундаментальные исследования, связанные с пассажем SARS-CoV-подобных коронавирусов летучих мышей в клеточных культурах и/или на животных моделях, ведутся в течение многих лет в лабораториях уровня 2 по биобезопасности во всем мире, и имеются документально подтвержденные случаи лабораторных утечек SARS-CoV. Поэтому мы должны изучить возможность непреднамеренного лабораторного высвобождения SARS-CoV-2. Теоретически, возможно, что SARS-CoV-2 приобрел мутации RBD (Рис. 1a) во время адаптации к пассажу в культуре клеток, как это наблюдалось ранее в исследованиях SARS-CoV. Однако обнаружение SARS CoV-подобных коронавирусов у панголинов с почти идентичными RBD обеспечивает гораздо более логичное объяснение того, как SARS-CoV-2 приобретал их посредством рекомбинации или мутации. Приобретение как многоосновного сайта расщепления, так и O-связанных гликанов также противоречит сценариям, основанным на исследованиях в культуре клеток. Новые многоосновные сайты расщепления наблюдались только после длительного прохождения вируса птичьего гриппа с низкой патогенностью in vitro или in vivo. Кроме того, гипотетическая генерация SARS-CoV-2 путем клеточной культуры или пассажа у животных потребовала бы предварительного выделения вируса-предшественника с очень высоким генетическим сходством, которое пока не было описано. Последующее образование многоосновного сайта расщепления потребовало бы повторного пассажа в клеточной культуре или у животных с рецепторами ACE2, сходными с таковыми у людей, но такое исследование также ранее не было проведено. Наконец, генерация О-связанных гликанов также вряд ли произошла из-за пассажа в клеточной культуре, поскольку такие особенности предполагают участие иммунной системы, что невозможно в условиях клеточной культуры.
Заключение и выводы
В разгар глобальной чрезвычайной ситуации в области общественного здравоохранения разумно задаться вопросом о причинах возникновения пандемии. Детальное понимание того, как вирус животных широким шагом перешел через границы видов для столь активного заражения людей, поможет предотвратить будущие случаи зоонозного переноса. Например, если SARS-CoV-2 предварительно адаптирован к другим видам животных, то существует риск его повторного появления. Напротив, если адаптивный процесс произошел у людей, то даже если происходят повторные зоонозные переносы, они вряд ли начнут развиваться без той же серии мутаций. Кроме того, выявление ближайших родственников вируса SARS-CoV-2, циркулирующего у животных, будет в значительной степени способствовать изучению морфологии вируса, вирулентности и разработки тактики эффективной терапии. Действительно, наличие последовательности RaTG13 у летучих мышей помогло выявить ключевые мутации RBD и сайт многоосновного расщепления.
Особенности генома нового коронавируса, описанные в данном исследовании, могут частично объяснить вирулентность и контагиозность SARS-CoV-2 у людей. Хотя данные показывают, что SARSCoV-2 не является целенаправленно управляемым вирусом, в настоящее время невозможно доказать или опровергнуть другие теории его происхождения, описанные здесь. Однако поскольку мы наблюдали все заметные признаки SARS-CoV-2, включая оптимизированный RBD и многоосновный сайт расщепления, в связанных коронавирусах в природе, мы не считаем, что какой-либо искусственный лабораторный сценарий правдоподобен. Большее количество исследований может изменить баланс данных в пользу одной гипотезы по отношению к другой. Получение родственных вирусных последовательностей из животных источников было бы наиболее точным способом выявления вирусного происхождения. Например, будущее наблюдение за промежуточным или полностью сформированным многоосновным сайтом расщепления у вируса, подобного SARS-CoV-2 у животных, могло бы еще больше подкрепить гипотезы естественного отбора. Было бы также полезно получить больше генетических и морфофункциональных данных о SARSCoV-2, включая исследования на животных моделях. Идентификация потенциального промежуточного хозяина SARS-CoV-2, а также определение последовательности вируса в очень ранних случаях были бы весьма информативными. Независимо от точных механизмов, с помощью которых SARSCoV-2 возник в результате естественного отбора, постоянное наблюдение за пневмонией у людей и других животных, несомненно, имеет огромное значение.