pdl1 позитивный что значит
Исследование PD-L1
Для чего определяют PD-L1 и при каких опухолях?
Иммунотерапия является достаточно эффективным инструментом в борьбе с опухолями, особенно на поздних стадиях. Определять наличие PD-L1 в опухолевых клетках нужно заранее, чтобы узнать, будет ли работать терапия моноклональными антителами или нет.
Экспрессию PD-L1 определяют при:
В зависимости от уровня экспрессии PD-L1, результат может быть:
Что такое Т-лимфоциты и как они связаны с PD-L1?
Т-лимфоциты- это специальные клетки, которые уничтожают клетки-мишени (опухолевые, мутированые и др.), регулируют иммунный ответ. В том числе, они формируют иммунную память.
На поверхности Т-лимфоцитов есть белок PD1, который является рецептором.
На поверхности других клеток (как иммунных так и опухолевых) есть специальные молекулы (лиганды), в данном случае они называются PD-L1 и PD-L2. Эти структуры подходят друг к другу как “ключ и замок”.
Когда происходит их взаимодействие, “ключ вошел в замок”, Т-лимфоциты прекращают образовываться, снижается их активность и выживаемость. В ходе чего они перестают осуществлять свои основные функции защиты.
Поэтому этот путь PD1 — PD-L1 очень важен в противоопухолевом, трансплантационном иммунитете, аллергии и различный иммунопатологических состояниях.
Опухолевые клетки научились использовать этот механизм в свою пользу, чтобы обмануть иммунитет. Они “вооружаются” большим количеством PD-L1 и PD-L2, которые связываются с Т-лимфоцитами, тем самым активируют путь “обмана”. В ходе данной реакции иммунитет перестает видеть опухолевые клетки.
Иммунотерапия и PD-L1
В современной онкологии имеется понятие иммунотерапии рака.
В 2014 году были одобрены определенные препараты (моноклональные антитела), которые влияют на данный путь. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету «увидеть» опухоль и уничтожить её. Доказано, что антитела к белкам PD1 и PD-L1 борются с раком путем высвобождения Т-клеток организма. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Как происходит исследование?
Нужно предоставить материал, который может быть биопсийным или операционным, в лабораторию UNIM. После чего он будет исследован методом иммуногистохимии.
Одним из обязательных условий является наличие достаточного материала (не менее 100 опухолевых клеток), чтобы адекватно оценить результат.
В ходе проведения исследования реакция будет оценена компетентным врачом-патоморфологом, после чего будет дан ответ.
Вести науки
Экспрессия PD-L1 связана с худшей выживаемостью при злокачественной мезотелиоме плевры
В настоящее время существует необходимость выявления прогностических биомаркеров для разработки подхода к лечению злокачественной мезотелиомы плевры (ЗМП), основанного на определении риска. Экспрессия лиганд‑1 программируемой гибели клеток (PD-L1) изучалась как прогностический биомаркер в ряде опухолей, учитывая его важную роль в уклонении от противоопухолевого иммунного ответа. В четырех ранее опубликованных анализах было обнаружено, что позитивность PD-L1 является неблагоприятным прогностическим фактором выживания при ЗМП. Это исследование направлено на дальнейшее изучение взаимосвязи между экспрессией PD-L1 в тканях мезотелиомы и результатами выживания.
Были проанализированы клинические данные пациентов ЗМП из одного учреждения в период с 2006 по 2016 год). Позитивность PD-L1 определялась как >1% мембранного окрашивания, независимо от интенсивности.
Были проанализированы данные пятидесяти восьми пациентов. Средний возраст составил 73 года, большинство из них были мужчинами (49, 84%) и имели ECOG между 0 и 2 (46, 79%). Наиболее распространенным гистопатологическим подтипом был эпителиоид (42, 72%), двухфазный подтип (9, 16%) и саркоматоид (7, 12%). Тридцать один пациент (53%) получил лучший поддерживающий уход, а двадцать семь пациентов (47%) получили химиотерапию или комбинированное лечение. Сорок два пациента (72,4%) имели положительную экспрессию PD-L1. Среднее время выживания для группы отрицательного PD-L1 составило 15,5 месяца и 6 месяцев для группы положительного PD-L1. Положительная экспрессия PD-L1 независимо коррелирует с худшим прогнозом (ОР = 2,02, 95%ДИ, 1,005-4,057, p = 0,0844).
Анализ показал более высокий процент пациентов с ЗМП с положительным PD-L1 (> 1%) по сравнению с другими исследованиями. Высокая положительная экспрессия PD-L1 ассоциировалась со статистически значимо более низким средним временем выживания.
Источник: PubMed
Nguyen BH1, Montgomery R2,3, Fadia M2,3, Wang J4, Ali S1,3.
PD-L1 expression associated with worse survival outcome in malignant pleural mesothelioma. // Asia Pac J Clin Oncol. 2018 Feb;14(1):69-73. doi: 10.1111/ajco.12788. Epub 2017 Nov 3.
Диагностика экспрессии PD-L1
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
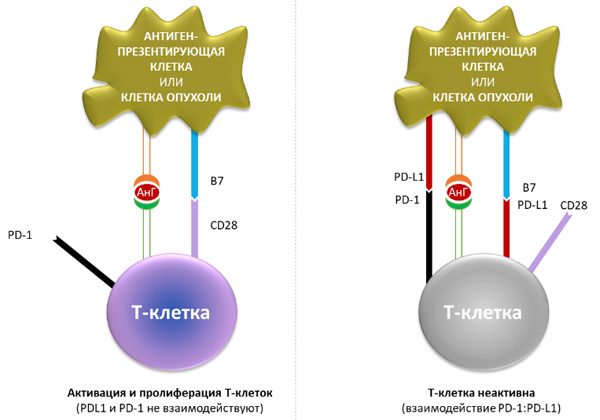
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.
Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
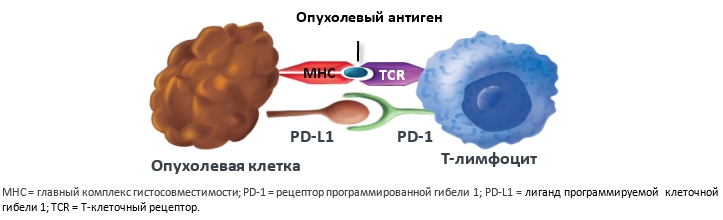
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
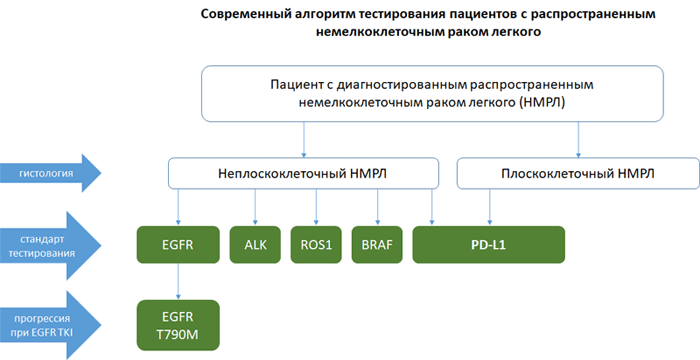
НМРЛ: методы определения экспрессии PD-L1
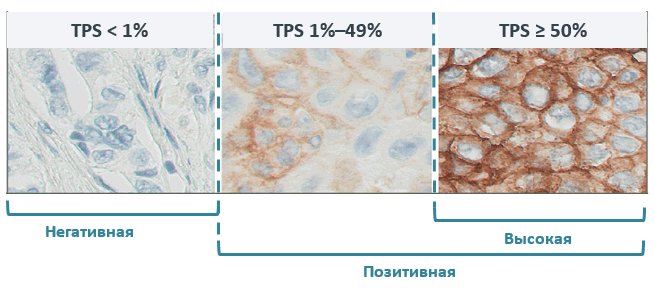
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
Алгоритм тестирования при распространенном НМРЛ
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
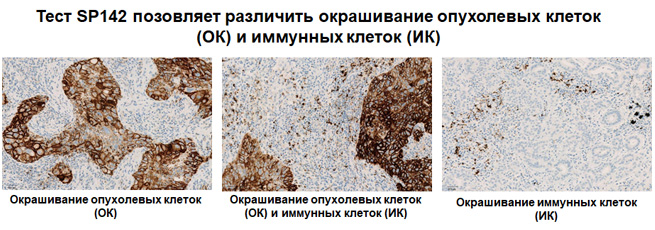
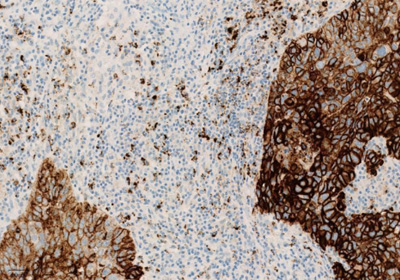
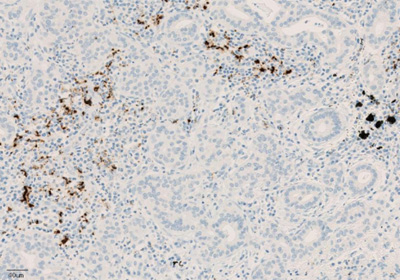
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Pdl1 позитивный что значит
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Кафедра акушерства и гинекологии Волгоградского государственного медицинского университета
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва, Россия
ГУЗ «Рязанский областной клинический онкологический диспансер»
ФГБОУ ВО «Рязанский государственный медицинский университет» Минздрава России, Рязань, Россия
ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Рязань, Россия; ГБУ РО «Областной клинический онкологический диспансер», Рязань, Россия
ГБУ Рязани «Областной клинический онкологический диспансер», Рязань
PD-L1-статус рака молочной железы
Журнал: Архив патологии. 2019;81(2): 3-9
Франк Г. А., Кузнецова О. А., Завалишина Л. Э., Андреева Ю. Ю., Олюшина Е. М., Виноградов И. Ю., Виноградов М. И., Куликов Е. П., Шомова М. В. PD-L1-статус рака молочной железы. Архив патологии. 2019;81(2):3-9.
Frank G A, Kuznetsova O A, Zavalishina L É, Andreeva Yu Yu, Olyushina E M, Vinogradov I Iu, Vinogradov M I, Kulikov E P, Shomova M V. PD-L1 status in breast cancer. Arkhiv Patologii. 2019;81(2):3-9.
https://doi.org/10.17116/patol2019810213
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Цель исследования — исследовать экспрессию PD-L1 в тройной негативной и люминальной В, HER2-негативной карциноме молочной железы и оценка связи PD-L1-статуса опухоли с прогнозом течения заболевания. Материал и методы. У 72 больных раком молочной железы изучен PD-L1-статус первичной опухоли иммуногистохимическим методом. Результаты. Обнаружены различия в частоте встречаемости карцином с экспрессией PD-L1в опухолевых клетках в зависимости от молекулярно-генетического типа: в люминальных B, HER2-негативных опухолях положительный PD-L1-статус выявлен в 4 (14,81%) из 27 случаев и в тройных негативных опухолях в 17 (37,78%) из 45. При анализе опухолей после неоадъювантной терапии позитивный PD-L1-статус опухолевых клеток обнаружен у 1 из 18 пациенток с умеренной остаточной опухолевой нагрузкой и у 6 из 13 с высокой остаточной опухолевой нагрузкой (5,56 и 46,15% соответственно), оцененной по системе RCB. Заключение. Положительный PD-L1-статус в тройном негативном раке определялся более чем в 2 раза чаще, чем в люминальном B, HER2- негативном (37,78 и 14,81%). Выявлена значимая корреляция между высокой остаточной опухолевой нагрузкой и позитивным PD-L1-статусом опухоли.
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Кафедра акушерства и гинекологии Волгоградского государственного медицинского университета
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва, Россия
ГУЗ «Рязанский областной клинический онкологический диспансер»
ФГБОУ ВО «Рязанский государственный медицинский университет» Минздрава России, Рязань, Россия
ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Рязань, Россия; ГБУ РО «Областной клинический онкологический диспансер», Рязань, Россия
ГБУ Рязани «Областной клинический онкологический диспансер», Рязань
Рак молочной железы (РМЖ) в настоящее время является самой распространенной злокачественной опухолью у женского населения (20,9%) и, несмотря на имеющийся прогресс в лечении этого заболевания, продолжает занимать лидирующие позиции среди причин женской смертности от злокачественных новообразований. Во всем мире ежегодно РМЖ диагностируется более чем у 1,7 млн женщин. При этом примерно 25% из них женщины в возрасте до 50 лет и 5% моложе 35 лет. Около 6% пациенток на момент постановки диагноза имеют метастазы, средняя продолжительность жизни таких больных составляет 24 мес, а 5-летняя выживаемость — 21% [1, 2].
В то же время на сегодняшний день возможности морфологической диагностики РМЖ значительно возросли и позволяют получить множество данных, характеризующих биологические свойства опухоли, которые врач-онколог может использовать при оценке прогноза заболевания и выборе лекарственной терапии. В клинической практике принципиальное значение имеет молекулярно-генетический подтип РМЖ, именно он определяет, будет ли опухоль положительно отвечать на ту или иную схему терапии.
В сегодняшней клинической практике широко используется определение молекулярно-генетического подтипа РМЖ с помощью суррогатных иммуногистохимических маркеров, позволяющее выделять следующие биологические подтипы [3, 4]:
— люминальный, А (ER +, HER2-neu-негативный, Ki-67 менее 20%, PgR 20% и более);
— люминальный B, подразделяющийся на HER2-негативный (ER +, HER2-neu-негативный, Ki-67 20% и более, PgR менее 20%) и HER2-позитивный (ER +, HER2-neu — гиперэкспрессия или амплификация, Ki-67 — любой, PgR — любой);
— HER2-neu-позитивный (ER – негативный, HER2-neu — гиперэкспрессия или мплификация, Ki-67 — любой, PgR — негативный);
— тройной негативный, подразделяющийся на небазальный (ER 0, HER2-neu-негативный, Ki-67 — любой, PgR0, CK5/6-негативный) и базальный (ER 0, HER2-neu-негативный, Ki-67 — любой, PgR0, CK5/6-позитивный).
Повышенное внимание к тройному негативному фенотипу обусловлено тем, что этот вариант РМЖ, встречающийся в основном у молодых пациенток, наиболее неблагоприятен по прогнозу в силу агрессивного поведения и ограниченных возможностей фармакотерапии, обусловленных отсутствием в данном фенотипе РМЖ возможных точек приложения для воздействия гормональными и таргетными лекарственными препаратами.
Это обстоятельство диктует необходимость дальнейшего изучения биологических свойств РМЖ, в частности тех, что позволяют опухоли избегать иммунный надзор со стороны организма и, как следствие, прогрессировать и метастазировать, и которые в дальнейшем можно будет использовать в качестве потенциальной мишени для борьбы с опухолью посредством иммунотерапии. Активно ведется поиск новых маркеров РМЖ, уровень экспрессии которых можно будет использовать для прогнозирования течения заболевания и оценки перспективности назначения новых иммунотерапевтических препаратов. Одним из таких маркеров может стать PD-L1, повышенная экспрессия которого является одним из механизмов «обмана» опухолевыми клетками иммунной системы.
Лиганд запрограммированной гибели клеток (PD-L1), он же CD274 и B7-H1 — трансмембранный белок массой 40 кД, кодирующийся геном CD274, располагается на 9-й хромосоме и связывается с клеточным рецептором PD1. Уровень экспрессии этого гена контролируется регуляторным фактором 1 интерферона (IRF1) и STAT1 [1]. Экспрессия PD-L1 выявляется как на опухолевых, так и на иммунных клетках. Коэкспрессия PD-L1 и его рецептора PD-1 является причиной ингибирования пролиферации лимфоцитов, регулируемой рецепторами T-клеток секреции цитокинов [2]. Путь ингибирования PD-1/PD-L1 является ключевым фактором регуляции работы T-лимфоцитов при иммунном ответе, одним из так называемых chekpoint-ингибиторов [5]. В норме он играет критическую роль в предотвращении аутоиммунных реакций и поддержании иммунного гомеостаза [6]. Некоторые опухоли могут экспрессировать белки, подавляющие иммунный ответ, в том числе и PD-L1 [7].
На сегодняшний день существует несколько моноклональных антител анти-PD-L1 для иммуногистохимического определения экспрессии PD-L1, из которых в России зарегистрированы только три: 22C3 («Dako»), SP142, SP263 («Ventana»), для них разработаны протоколы проведения реакции и системы интерпретации результатов для рака легкого, мочевого пузыря и желудка. Выбор моноклонального антитела влияет на результат реакции и интерпретацию результатов PD-L1-статуса опухоли, однако для РМЖ пороговые значения не утверждены.
При интерпретации результатов иммуногистохимического исследования нужно учитывать, что экспрессия PD-L1 отмечается как в эпителии, так и в строме опухоли, может быть мембранной и цитоплазматической и выявляется только в определенных участках опухоли. Предполагается, это связано с тем, что зона экспрессии PD-L1 в атипичных клетках ограничена областью инвазивного фронта опухоли [1,10]. Также необходимо отметить, что PD-L1 может присутствовать не только в раковых, но и в иммунокомпетентных клетках, инфильтрирующих опухоль [1, 8, 9]. Считается, что в данном случае характер экспрессии PD-L1 обусловлен адаптивными процессами и является признаком противоопухолевой иммунной реакции. Учитывая данные обстоятельства, ряд авторов предполагают, что экспрессия PD-L1 в иммунных клетках, инфильтрирующих опухоль, может являться благоприятным прогностическим признаком, и для более полноценной оценки прогноза РМЖ и возможности принятия решения о назначении анти-PD-1/PD-L1-антител при лечении необходимо учитывать уровень экспрессии PD-L1 как в раковых, так и в иммунных клетках микроокружения опухоли [8—11].
Актуальность данного исследования подтверждается тем, что на конгрессе ESMO в 2018 г. доложены первые результаты применения анти-PD-L1-терапии иммуноонкологическим препаратом атезолизумаб при тройном негативном РМЖ [10]. Авторы исследования применили атезолизумаб в комбинации с наб-паклитакселом в первой линии лечения метастатического тройного негативного РМЖ. Их трехфазное исследование проведено на 902 пациентках с метастатическим РМЖ. Средний возраст больных составил 55—56 лет. В исследование включали пациенток с экспрессией PD-L1 более 1%, наличием метастаза в печени без предшествующей химиотерапии. Все пациентки были распределены на две группы в соотношении 1:1. 1-я группа получала 840 мг атезолизумаба в 1-й и 15-й день + 100 мг/м 2 наб-паклитаксела в 1, 8, 15-й день каждые 28 дней до начала прогрессирования. 2-я группа получала то же лечение, только вместо атезолизумаба — плацебо. Медиана наблюдения составила 12,9 мес. По результатам исследования назначение атезолизумаба в первой линии терапии снизило риск прогрессирования или смерти на 38% по сравнению с группой плацебо [12].
Материал и методы
Исследование проведено на операционном материале 72 больных РМЖ, проходивших лечение в клинике РМАНПО и Рязанском областном клиническом онкологическом диспансере. Регресс опухоли молочной железы после проведенного неоадъювантного лечения оценивался по системе RCB. Критерием для отбора стал иммуногистохимический статус опухоли: целенаправленно были выбраны люминальные B, HER2-негативные и тройные негативные карциномы по суррогатной молекулярно-биологической классификации. Часть пациенток (n=31) получали неоадъювантную химиотерапию, согласно рекомендациям RUSSCO и NCCN Guidelines. При анализе данных учитывали следующие факторы: возраст, степень дифференцировки (градация), стадию T, выраженность ответа опухоли на неоадъювантную химиотерапию по системе RCB [13] и Г.А. Лавниковой [14].
Весь операционный материал фиксировали в забуференном нейтральном 10% формалине не более 24 ч. Обезвоживание и обезжиривание проводили при помощи автоматизированных процессоров с изопропиловым спиртом. Пропитку парафином проводили при 60 °C, чтобы не допустить перегревания. На изготовленных с полученных блоков срезах проведена иммуногистохимическая реакция с набором PD-L1 ICH 22C3 pharmDx, (SK006, DAKO) в стейнере Avtosteiner Link 48 («Dako») по стандартному протоколу для данного набора не позднее 24 ч после изготовления парафиновых срезов. Для контроля иммуногистохимических реакций параллельно поставлены реакции на контрольных тканях. С этой целью выбраны клеточные линии, прилагаемые к набору, ткани миндалины и плаценты (рис. 1).

Учитывая объективную сложность оценки уровня экспрессии PD-L1 в опухолях, ее проводили с привлечением трех экспертов, которые независимо друг от друга оценивали процент окрашенных опухолевых клеток, а также пери- и интратуморальных иммунных клеток. В случае возникновения разногласий у экспертов к консенсусу приходили в процессе коллегиального обсуждения, анализируя не только гистологические препараты, но и отсканированные изображения.
Критерием для позитивного статуса опухоли выбрано полное или частичное мембранное окрашивание не менее 1% опухолевых или иммунных клеток, расположенных интратуморально или не далее 1 мм от границы опухоли. Расчеты проводили отдельно для экспрессии PD-L1 в опухолевых и иммунных клетках (рис. 2, 3).


Методика подсчета позитивных клеток
Ткань РМЖ, окрашенную с помощью набора PD-L1 ICH 22C3 pharmDx, (SK006, DAKO), оценивали поэтапно. На первом этапе исключали из подсчета поля некроза и очаги карциномы in situ (рис. 4).


Далее провели подсчет иммунных клеток. Позитивно окрашенный лимфоцит, расположенный не далее 1 мм от границы опухоли (рис. 6),

Стоит отметить особенности выделения оценочных зон в препаратах пациенток, прошедших неоадъювантное лечение. При оценке данного материала зона, занимаемая опухолью, не имеет отношения к первичному ложу опухоли. Подсчет клеток проводили только в той зоне, где остались живые опухолевые клетки (рис. 7).

Результаты и обсуждение
Положительная экспрессия PD-L1 в опухолевых клетках выявлена в 21 (29,17%) из 72 случаев. Обнаружены различия в частоте встречаемости карцином с экспрессией PD-L1 в опухолевых клетках в зависимости от молекулярно-генетического типа: в люминальных B HER2-негативных опухолях положительный PD-L1-статус имели 4 (14,81%) из 27, а в тройных негативных опухолях — 17 (37,78%) из 45. Позитивный статус иммунных клеток наблюдался в 37,04 и 64,44% случаев соответственно (рис. 8, 9).


При исследовании взаимосвязи PD-L1-статуса с возрастом и степенью дифференцировки корреляции не обнаружено. Ожидаемая зависимость статуса от стадии T оказалась статистически незначимой (p=0,635), однако была обнаружена слабая зависимость (критерий Спирмена 0,37) между стадией Т и количеством окрашенных лимфоцитов. Возможно, это стало результатом недостаточно широкой выборки (рис. 10).

При оценке значения PD-L1-статуса опухоли для прогноза течения заболевания пациентов, прошедших неоадъювантное лечение, корреляции при использовании системы Г.А. Лавниковой не получено, и пациенты были разделены на две группы по классу остаточной опухолевой нагрузки RCB: RCB-II и RCB-III (больных со значительной резорбцией опухоли и средней клеточностью менее 10% в исследование не включали). Позитивный статус опухолевых клеток выявлен у 1 из 18 пациенток 1-й группы и 6 из 13 пациенток 2-й группы (5,56 и 46,15% соответственно). Окрашивание не менее 1% иммунных клеток наблюдали в 38,89% случаев RCB-II и в 76,92% RCB-III. Таким образом выявлена значимая корреляция между высокой остаточной опухолевой нагрузкой и позитивным PD-L1-статусом опухоли (p=0,02) (см. таблицу).

Заключение
Положительный PD-L1-статус опухоли определяли в тройном негативном раке почти в 2,5 раза чаще, чем в люминальном B HER2-негативном. Учитывая более агрессивное течение гормонорезистентного РМЖ, можно предположить, что позитивный PD-L1-статус является признаком худшего прогноза течения заболевания. Об этом же свидетельствует факт, что опухоли, плохо отреагировавшие на классические химиотерапевтические схемы, чаще экспрессируют этот маркер. Стоит отметить и связь между стадией Т с позитивно окрашенными иммунными клетками: опухоли с лучшим прогнозом показывают более высокий уровень экспрессии PD-L1, что не противоречит мнению других исследователей [8—11]. Вместе с тем наличие позитивного PD-L1-статуса опухоли открывает возможности для иммунотерапевтических подходов к лечению этих опухолей.
Концепция и дизайн — Г. А.Ф., Л.Э.З., Ю.Ю.А.
Сбор и обработка информации — О.А.К., И.Ю.В., М.В.Ш., Е.М.О.
ИГХ-исследование — О.А.К. Ю.Ю.А.
Написание текста — О.А.К., М.И.В., Ю.Ю.А.
Редактирование — Г. А.Ф., Л.Э.З., Е.П.К.,
Авторы заявляют об отсутствии конфликта интересов.