pd l1 статус опухоли негативный что значит
Диагностика экспрессии PD-L1
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
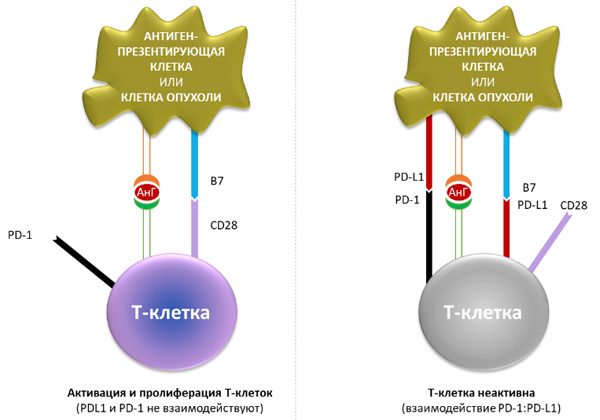
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.
Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
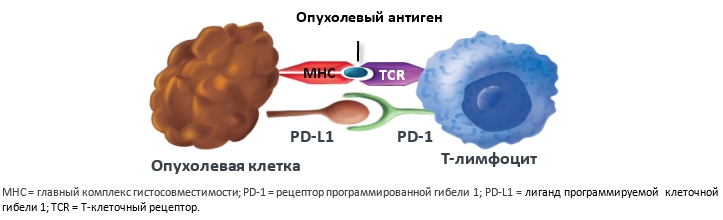
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
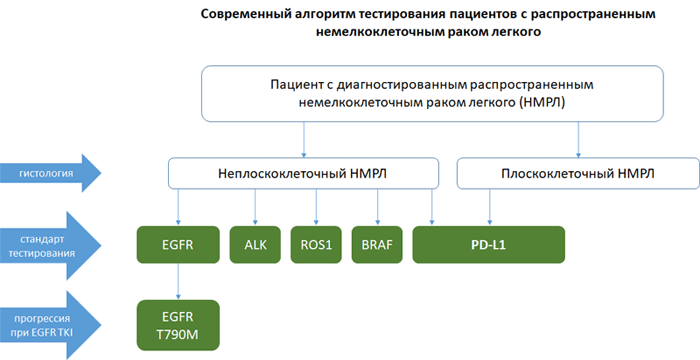
НМРЛ: методы определения экспрессии PD-L1
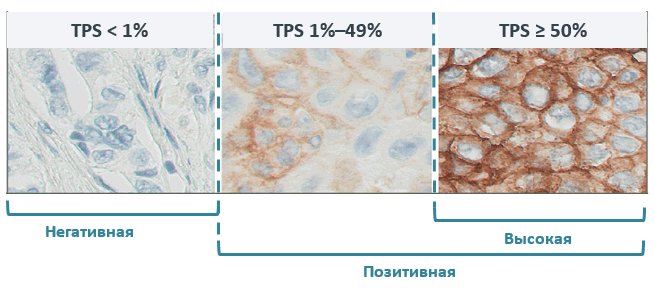
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
Алгоритм тестирования при распространенном НМРЛ
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
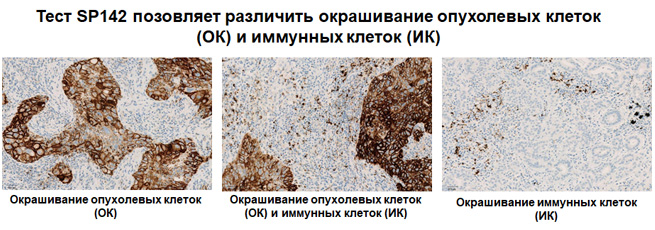
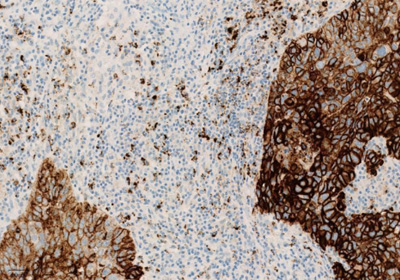
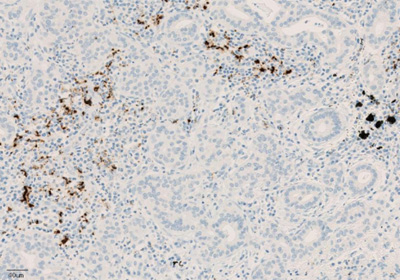
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Исследование PD-L1
Для чего определяют PD-L1 и при каких опухолях?
Иммунотерапия является достаточно эффективным инструментом в борьбе с опухолями, особенно на поздних стадиях. Определять наличие PD-L1 в опухолевых клетках нужно заранее, чтобы узнать, будет ли работать терапия моноклональными антителами или нет.
Экспрессию PD-L1 определяют при:
В зависимости от уровня экспрессии PD-L1, результат может быть:
Что такое Т-лимфоциты и как они связаны с PD-L1?
Т-лимфоциты- это специальные клетки, которые уничтожают клетки-мишени (опухолевые, мутированые и др.), регулируют иммунный ответ. В том числе, они формируют иммунную память.
На поверхности Т-лимфоцитов есть белок PD1, который является рецептором.
На поверхности других клеток (как иммунных так и опухолевых) есть специальные молекулы (лиганды), в данном случае они называются PD-L1 и PD-L2. Эти структуры подходят друг к другу как “ключ и замок”.
Когда происходит их взаимодействие, “ключ вошел в замок”, Т-лимфоциты прекращают образовываться, снижается их активность и выживаемость. В ходе чего они перестают осуществлять свои основные функции защиты.
Поэтому этот путь PD1 — PD-L1 очень важен в противоопухолевом, трансплантационном иммунитете, аллергии и различный иммунопатологических состояниях.
Опухолевые клетки научились использовать этот механизм в свою пользу, чтобы обмануть иммунитет. Они “вооружаются” большим количеством PD-L1 и PD-L2, которые связываются с Т-лимфоцитами, тем самым активируют путь “обмана”. В ходе данной реакции иммунитет перестает видеть опухолевые клетки.
Иммунотерапия и PD-L1
В современной онкологии имеется понятие иммунотерапии рака.
В 2014 году были одобрены определенные препараты (моноклональные антитела), которые влияют на данный путь. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету «увидеть» опухоль и уничтожить её. Доказано, что антитела к белкам PD1 и PD-L1 борются с раком путем высвобождения Т-клеток организма. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Как происходит исследование?
Нужно предоставить материал, который может быть биопсийным или операционным, в лабораторию UNIM. После чего он будет исследован методом иммуногистохимии.
Одним из обязательных условий является наличие достаточного материала (не менее 100 опухолевых клеток), чтобы адекватно оценить результат.
В ходе проведения исследования реакция будет оценена компетентным врачом-патоморфологом, после чего будет дан ответ.
Pd l1 статус опухоли негативный что значит
PD-L1− это химическое вещество, лиганд, экспрессируемый опухолевыми клетками. На поверхности иммунокомпетентных клеток (Т-лимфоцитов) присутствует белок PD-1 (сокр. от Programmed cell Death-1). Когда Т-лимфоцит пытается прикрепиться к раковой клетке, чтобы разрушить ее, протеин PD-1 связывается с имеющимся на ее поверхности лигандом PD-L1. В результате функционирование иммунных клеток ингибируется: тормозится пролиферация, не происходит выделение цитокинов, губительных для злокачественных клеток. Таким образом, раковая опухоль отражает иммунную атаку и продолжает свой дальнейший рост. Оценка уровня экспрессии молекулы PD-L1 рассматривается как потенциальный биомаркер прогноза эффективности и продолжительности лечения злокачественных новообразований.
Лиганд PD-L1, лиганд рецептора программируемой клеточной смерти 1.
Какой биоматериал можно использовать для исследования?
Образец ткани (в парафиновом блоке).
Общая информация об исследовании
В онкологии иммуногистохимическое исследование помогает выявить молекулярные структуры опухолевых клеток, ассоциированные со степенью дифференцировки, способностью их к инвазии и метастазированию, чувствительностью к химиотерапии, иммунотерапии, с особенностями течения и прогнозом заболевания у конкретного пациента; определить источник метастазирования при невыясненном первичном очаге, прогноз опухолевого процесса на дооперационном этапе и коррекцию схемы лечения; выбрать адекватную патогенетическую и таргетную терапию, определить наличие в опухолевых клетках различные точки приложения.
Доказано, что антитела к белкам PD-1 и PD-L1 борются с раком путем высвобождения Т-клеток организма, особого типа иммунных клеток. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Не так давно исследователи обнаружили, что раковые клетки научились использовать эту иммунную защиту для своих собственных целей. Опухолевые клетки разворачивают производство PD-L1-белков, которые распознаются PD-1-рецепторами, ингибируя атаку Т-клеток на опухоли. Больные раком лечатся антителами, блокирующими PD-1-рецепторы или фиксирующимися на обязательном партнере PD-L1, чтобы выключить «противоуничтожающий» сигнал и позволить Т-клеткам атаковать.
Также было обнаружено, что активация PD-1 ингибирует антираковую активность других иммунных клеток, макрофагов, и, когда PD-1 или PD-L1 рецепторы блокируются антителами, это заставляет эти макрофагиальные клетки атаковать рак.
В современной онкологии иммуногистохимическое исследование, в частности определение рецептора PD-L1 в ткани опухоли, играет важнейшую роль, так как при помощи этого онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Заключение о позитивности/негативности опухоли по рецептору PD-L1.
Избыточная экспрессия PD-L1 выявляется в клетках более чем 50% опухолей человека, причем наиболее характерна для следующих новообразований:
— глиобластома и смешанная глиома (в 100% случаев),
— назофарингеальная карцинома (68-100%),
— множественная миелома (93%),
— опухоли мочевого пузыря (28-100%),
— немелкоклеточный рак легкого (35-95%),
— аденокарцинома кишечника (53%),
— гепатоцеллюлярная карцинома (45-93%),
— рак поджелудочной железы (39%),
— злокачественные опухоли желудка и пищевода (42%).
Повышенная экспрессия PD-L1 в опухоли ассоциирована с неблагоприятным прогнозом при различных типах рака, включая рак почки, рак мочевого пузыря, рак пищевода, рак желудка, рак поджелудочной железы, рак печени, рак яичников.
Кто назначает исследование?
Pd l1 статус опухоли негативный что значит
Оценка экспрессии PD-L1 методом ПЦР или методом иммуногистохимии у больных раком легкого: результаты крупнейшего сравнительного исследования CLOVER, проведенного RUSSCO

Оценка экспрессии PD-L1 является «золотым» стандартом диагностики до проведения первой линии терапии ингибиторами контрольных точек у больных распространенным НМРЛ без активирующих мутаций. Также появляются новые данные о значении оценки экспрессии в последовательной терапии.
В настоящее время экспрессия PD-L1 определяется с помощью иммуногистохимического метода. Проблема заключается в том, что для иммуногистохимии могут использоваться различные диагностические антитела (22C3,SP142, SP263), разное оборудование и системы подсчета позитивных клеток. Всё это требует исключительной квалификации патолога, вносит определенную путаницу и усложняет процесс диагностики. Кроме того, учитывая, что экспрессия PD-L1 изучается в иммуногистохимической лаборатории после оценки активирующих мутаций в молекулярно-генетической лаборатории, интервал от поступления блока до получения результата существенно увеличивается.
RUSSCO предложило оптимизировать этот алгоритм, сравнив результаты оценки экспрессии PD-L1 методом ПЦР, которым определяются и активирующие мутации, со стандартными методами иммуногистохимии. Для этого были выбраны парафиновые блоки 500 больных НМРЛ и проведено 1.419 тестирований PD-L1 с помощью ПЦР, иммуногистохимии с клонами 22C3, SP142 и SP263. Каждый блок оценивался всеми методами, затем происходило сравнение результатов – насколько произошло совпадение.
Высокая экспрессия РНК (PD-L1 позитивный тест) была выявлена методом ПЦР у 43% больных, при этом экспрессия PD-L1, оцененная иммунногистохимическими методами, была выявлена у 21-69% пациентов. К сожалению, по числу позитивных PD-L1 случаев ПЦР и иммуногистохимия отличались. Низкая корреляция между ПЦР и всеми иммуногистохимическими клонами была определена в исследовании. Тем не менее, если пациент был PD-L1 негативный по результатам иммуногистохимии, то вероятность негативного теста ПЦР составляла 92-99%. Следовательно, можно предположить, что на первом этапе во время оценки активирующих мутаций в молекулярно-генетической лаборатории проведение дополнительного теста PD-L1 может сократить необходимость в последующем PD-L1 тестировании у половины ПЦР/PD-L1-негативных пациентов. В случае выявления позитивного теста ПЦР/PD-L1 пациенту потребуется дальнейшее иммуногистохимическое исследование. Данная гипотеза требует уточнения в проспективных исследованиях с применением ингибиторов контрольных точек.
Еще одной находкой в исследовании CLOVER было совпадение результатов иммуногистохимии, выполненной с использованием клонов 22C3 и SP263, с критериями оценки для первой линии терапии. Подобные результаты корреляции были показаны и в других исследованиях.
Дальнейший анализ результатов исследования CLOVER с определением чувствительных точек, при которых экспрессия PD-L1 методом ПЦР может совпадать с результатом иммуногистохимии, продолжится.
RUSSCO выражает благодарность и глубочайшую признательность коллективу авторов, которые внесли большой вклад в организацию и проведение исследования!
Источник: Ilya Tsimafeyeu, Evgeny Imyanitov, Larisa Zavalishina, Grigory Raskin, Patrisia Povilaitite, Nikita Savelov, Ekaterina Kharitonova, Alexey Rumyantsev, Inna Pugach, Yulia Andreeva, Alexey Petrov, Georgy Frank, Sergei Tjulandin. Agreement between PDL1 immunohistochemistry assays and polymerase chain reaction in non-small cell lung cancer: CLOVER comparison study. Sci Rep. 2020; 10(1): 3928. Published: 2020 Mar 3.
Pd l1 статус опухоли негативный что значит
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Кафедра акушерства и гинекологии Волгоградского государственного медицинского университета
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Исследование PD-L1-статуса рака молочной железы с использованием моноклонального антитела SP142 и перспективы для определения лечебной тактики
Журнал: Архив патологии. 2019;81(5): 5-10
Франк Г. А., Кузнецова О. А., Завалишина Л. Э., Андреева Ю. Ю., Москвина Л. В. Исследование PD-L1-статуса рака молочной железы с использованием моноклонального антитела SP142 и перспективы для определения лечебной тактики. Архив патологии. 2019;81(5):5-10.
Frank G A, Kuznetsova O A, Zavalishina L É, Andreeva Yu Yu, Moskvina L V. Study of the PD-L1 status in breast cancer, by using the SP142 monoclonal antibody, and the prospects for determining treatment policy. Arkhiv Patologii. 2019;81(5):5-10.
https://doi.org/10.17116/patol2019810515
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Цель исследования — изучить экспрессию PD-L1 в тройном негативном и люминальном B, HER2-негативном раке молочной железы при использовании антитела SP142 и оценить связь PD-L1-статуса с прогнозом для больных. Материал и методы. Исследование проведено на операционном материале (полные срезы), полученном от 72 пациентов. Срезы окрашивали антителом PD-L1 SP142. Результаты. Обнаружили различия в выявляемости позитивного PD-L1-статуса первичной опухоли и регионарного метастаза (первичной опухоли в 26 (36,1%) наблюдениях, метастаза в 18 (47,4%) из 38). У больных, получавших неоадъювантное лечение химиотерапевтическими препаратами, в целом реже определяли положительный PD-L1-статус (25,8% против 53,7%), однако следует отметить, что в случае с более высокой остаточной опухолевой нагрузкой (RCBIII по сравнению с RCBII) чаще выявляли позитивный PD-L1-статус. Выводы. Учитывая полученные данные, следует уточнять статус не только первичного очага, но и клинически значимых метастазов, особенно если в первичной опухоли был получен отрицательный результат. Больные с прогрессированием заболевания на стандартных схемах терапии могут иметь шанс на хороший результат при использовании блокаторов PD-1/PD-L1. При этом связь PD-L1-статуса с остаточной опухолевой нагрузкой может повлиять на выбор лечебной тактики в адъювантном режиме.
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Кафедра акушерства и гинекологии Волгоградского государственного медицинского университета
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Генетические и молекулярные нарушения являются фактором для запуска иммунного ответа организма. Опухолевые клетки характеризуются накоплением множества генетических поломок (неоантигенов) и отсутствием нормального функционирования [1]. Именно накопление неоантигенов является триггерной точкой для запуска иммунного ответа на опухоль посредством их презентации в главном комплексе гистосовместимости I (MCHI) на поверхности клетки и распознавания CD8+ Т-лимфоцитами [2].
Одна из многих молекул, отвечающих за ингибирование таких фаз, как активация лимфоцитов и непосредственное уничтожение опухолевой клетки, — рецептор запрограммированной клеточной гибели 1 (PD-1) и его лиганд PD-L1 [2].
Крупное клиническое исследование Impassion 130 показало прекрасные результаты применения блокаторов PD-L1 (атезолизумаба) при тройном негативном раке молочной железы (ТН РМЖ). PD-L1-позитивными считали карциномы с окрашиванием 1% и более иммунных клеток от площади опухоли. Медианы безрецидивной и общей выживаемости при добавлении чек-поинт-ингибитора к наб-паклитакселу увеличивались на 1,7 и 3,7 мес соответственно. Помимо увеличения средней продолжительности жизни, 2-летняя выживаемость пациентов с метастатическим ТН РМЖ составила 53,5% [3]. Данное обстоятельство диктует необходимость тестирования пациентов для определения статуса PD-L1 и дальнейшего назначения иммунотерапии.
Кроме того, привлекает внимание группа больных с люминальным В, HER2-негативным РМЖ. При прогрессировании процесса на фоне проводимой химио- и гормонотерапии представляется интересным изучить PD-L1-статус для возможного обсуждения предпосылок к иммунотерапии.
Материал и методы
Исследование проведено на операционном материале 72 пациентов с тройным негативным (45 случаев) и люминальным B, HER2-негативным РМЖ (27). Часть больных (n=31) получали неоадъювантное химиотерапевтическое лечение. Пациентов с выраженным опухолевым регрессом в исследование не включали. В 38 случаях выявлены метастазы в регионарных лимфатических узлах. Все образцы ткани были зафиксированы в забуференном 10% растворе формалина в течение 6—72 ч, обезвожены, обезжирены и пропитаны парафином по стандартному протоколу. Гистологическое исследование для уточнения варианта, стадии, градации или остаточной опухолевой нагрузки проводили на срезах, окрашенных гематоксилином и эозином. Определение остаточной опухолевой нагрузки выполняли по системе RCB [4]. Для установления биологического подтипа рака провели иммуногистохимическое исследование в автоматизированном режиме с антителами к ER (clone SP1), PgR (clone 1E2), HER2 (clone 4B5), Ki-67 (clone 30−9) на парафиновых срезах толщиной 4 мкм и cистемой детекции UltraView Universal DAB Detection Kit с использованием стейнера Ventana Bench Marсk Ultra. В 7 случаях отрицательный HER2-статус был подтвержден при помощи гибридизации in situ методом SISH (с набором Inform Her2 Dual ISH DNA Probe Cоctail Assay (Roche-Ventana).
Использовали тестовую систему VENTANA PD-L1 (SP142). Для каждого случая изготовляли срез для негативного контроля. Срез окрашивали по протоколу, аналогичному основному исследованию, однако в качестве первичных антител использовали реагент негативного контроля VENTANA Rabbit Monoclonal Negative Control Ig.
После процесса депарафинизации и демаскировки антигенов кроличьи моноклональные антитела PD-L1 (SP142) в рабочем разведении наносили на подготовленные срезы с блока первичной опухоли и регионарного метастаза. После инкубации с первичным антителом или реагентом негативного контроля применяли систему детекции OptiView DAB IHC Detection Kit с амплификатором OptiView Amplification Kit. Последним этапом проводили докрашивание гематоксилином. Все этапы реакции проводили в автоматизированном режиме на иммуногистохимическом стейнере Ventana Bench Marck Ultra по рекомендованному протоколу производителя реагентов.
В качестве контроля использовали препараты клеточных линий, прилагаемые к набору, и ткань нормальной миндалины как внутрилабораторный позитивный контроль. После проведения реакции ткань миндалины должна была содержать умеренно или сильно окрашенные лимфоциты и макрофаги в герминативных центрах, диффузное окрашивание ретикулярных клеток крипт, неокрашенные лимфоциты в межфолликулярном пространстве и эпителий, покрывающий миндалину. Анализ препаратов РМЖ проводили только при наличии адекватного окрашивания контрольных образцов.
Для оценки PD-L1-статуса всех типов рака применяли методику, рекомендуемую сегодня для оценки ТН РМЖ [5].
На препаратах, окрашенных гематоксилином и эозином, определяли площадь опухоли (TS). При этом TS включает все жизнеспособные клетки инвазивного РМЖ и окружающую их воспалительную инфильтрацию (IS). Очаги карциномы in situ долек и протоков, а также участки некроза исключали из подсчета (рис. 1).

Для оценки экспрессии PD-L1 в регионарных метастазах в соответствии с правилами по интерпретации результатов [5] необходимо отличать воспалительную инфильтрацию, являющуюся частью иммунного ответа опухоли на лечение, и предсуществующую ткань лимфатического узла. Ввиду объективных трудностей в этом процессе за IS принимаются только те лимфоциты, которые непосредственно прилегают к опухолевым клеткам (рис. 2).

Образцы негативного контроля использовали для выявления и дифференцировки таких артефактов, как неспецифическое окрашивание, отложения пигментов (рис. 3).

На срезах, окрашенных антителами к PD-L1, оценивали долю TS, занятую позитивно окрашенными иммунными клетками. Позитивным считается точечное или линейное, темно-коричневое, полное или частичное мембранное окрашивание как одиночных клеток, так и воспалительных инфильтратов (рис. 4).

Позитивный PD-L1-статус опухоль получала при наличии окрашенных иммунных клеток, занимающих 1% и более площади опухоли.
Результаты
Из 72 больных, включенных в исследование, позитивный PD-L1-статус оказался у 30 (41,7%), из них первичной опухоли у 26 (36,1%). Из 38 изученных метастазов позитивный статус отмечен в 18 (47,4%) случаях.
У больных, получавших неоадъювантное лечение химиотерапевтическими препаратами, в целом реже выявляли положительный PD-L1-статус (25,8% против 53,7%; p=0,018) (рис. 5),


В ТН-карциномах позитивный статус встречался чаще, чем в люминальных В, HER2-негативных (46,7% против 33,3%), однако статистической значимости это не достигло (p=0,267). Примерно 2/3 PD-L1-позитивных опухолей (20 случаев; p=0,31) оказались высокой степени злокачественности (G3).
Подробное распределение данных представлено в таблице.

Обсуждение
Полученные результаты показали различный PD-L1-статус первичной опухоли и метастазов. Гетерогенность РМЖ — хорошо известный феномен. К сожалению, не всегда в метастазе оказывается тот же клон опухолевых клеток, который преобладает в первичном очаге [6—8]. В исследовании оказалось 4 случая с отрицательным PD-L1-статусом первичного очага и позитивным статусом метастаза. Помимо этого, у одного из пациентов с позитивным первичным очагом исследованный метастаз оказался негативным. Таким образом, в 6,94% случаев статус первичного очага и метастаза различался. Схожие данные получили Н. Wang и соавт. [9] при исследовании колоректального рака. Они пришли к выводу, что экспрессия PD-L1 в метастатическом колоректальном раке должна рассматриваться как независимый фактор при назначении иммунотерапии.
В настоящее время проведены лишь единичные исследования по оценке связи степени RCB и экспрессии PD-L1. В 2017 г. опубликовано исследование, по данным которого экспрессия PD-L1 в опухолях молочной железы, не достигших полного морфологического регресса (pCR), является неблагоприятным прогностическим фактором для таких пациентов [10]. Наши результаты не противоречат этим данным, так как высокий уровень остаточной опухолевой нагрузки также неблагоприятно влияет на прогноз. В то же время в исследовании американских коллег [11] показано, что позитивный статус PD-L1 материала, полученного до проведения неоадъювантной химиотерапии, является залогом лучшего ответа опухоли на лечение. Однако данное сопоставление не совсем корректно ввиду того, что исследование было проведено на материале, полученном до начала лечения, к тому же на биопсийном, что подразумевает меньший объем исследуемой опухоли.
У больных, получавших неоадъювантное лечение химиотерапевтическими препаратами, реже выявляли положительный PD-L1-статус. Это соответствует данным L. Emens и соавт. [12], проводивших исследование безопасности и эффективности монотерапии атезолизумабом. В их работе у пациентов, получавших терапию первой линии, отмечена лучшая выживаемость, чем второй и последующих: медиана выживаемости в 1-й группе составила 17,6 мес по сравнению с 7,3 мес во 2-й группе. Однако такая закономерность не была выявлена при исследовании рака яичников. По данным S. Mesnage и соавт. [13], экспрессия PD-L1 усиливается под воздействием неоадъювантной химиотерапии.
Самое крупное исследование экспрессии PD-L1 SP142 на полных срезах — IMpassiom130 выполнено на 902 препаратах. Согласно данным L. Emens и соавт. [14], позитивный PD-L1-статус выявляли в 41% случаев. Мы получили схожие данные: в ТН РМЖ количество пациентов с позитивным статусом достигло 46,7%. В отличие от наших коллег в настоящее исследование включили и пациентов с люминальным B, HER2-негативным РМЖ. Безусловно, у таких больных прогноз лучше, чем у пациентов с ТН-раком, однако среди гормонопозитивных карцином также встречаются случаи с быстрым прогрессированием и низкой чувствительностью к проводимой терапии [15]. По нашим результатам, частота встречаемости пациентов, которые потенциально могут ответить на иммунотерапию блокаторами чек-поинт-ингибиторами, в гормонопозитивных раках ниже, однако данный вывод не достиг статистической значимости. В то же время D. Dill и соавт. [16] получили статистически значимые данные на большей выборке. Стоит отметить, что данное исследование выполнено на TMA-матрицах, в результате авторы применили другой метод оценки PD-L1-статуса, учитывающий меньший объем опухоли.
Большинство исследователей [16, 17] сходятся в том, что позитивный PD-L1-статус чаще выявляется у низкодифференцированных раков, однако в нашем исследовании эти данные не получили статистического подтверждения. Вероятнее всего, это связано с малой выборкой.
Заключение
Мы считаем, что очень важен факт различия PD-L1-статуса первичной опухоли и метастаза. Возможно, с учетом полученных данных следует уточнять статус не только первичного очага, но и клинически значимых метастазов, особенно если в первичной опухоли был получен отрицательный результат. Также исследование показало, что больные с люминальным В, HER2-негативным РМЖ с прогрессированием заболевания на стандартных схемах терапии могут иметь шанс на хороший результат при использовании блокаторов чек-поинт-ингибиторов иммунитета. Особый интерес представляют также данные о связи PD-L1-статуса с остаточной опухолевой нагрузкой, которые могут повлиять на выбор лечебной тактики в адъювантном режиме.
Концепция и дизайн — Г. А.Ф., Л.Э.З., Ю.Ю.А.
Сбор и обработка информации — О.А.К., Л.В.М.
ИГХ-исследование — О.А.К., Л.Э.З. Ю.Ю.А.
Написание текста — О.А.К., Л.В.М., Ю.Ю.А.
Редактирование — Г. А.Ф., Л.Э.З., Ю.Ю.А.
Авторы заявляют об отсутствии конфликта интересов
The authors declare no conflict of interest.