острый миелоидный лейкоз прогноз жизни у детей
Острый лейкоз (острая лейкемия)
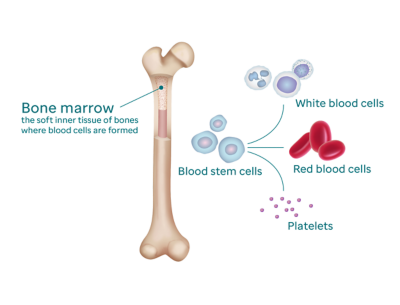
Острым лейкозом называют онкозаболевание крови и кроветворного органа — красного костного мозга, при котором нормальные лейкоциты постепенно вытесняются незрелыми (бластными) клетками, неспособными выполнять свою функцию. В результате у больного развиваются воспаления и кровотечения внутренних органов, которые существенно ухудшают его состояние, резко снижается иммунитет, поражается нервная система. При отсутствии квалифицированной медицинской помощи неизбежно наступает неблагоприятный исход. Заболевание характеризуется высокой агрессивностью: мутировавшие клетки быстро распространяются по организму, а их число растёт с высокой скоростью.
Виды заболевания
Онкогематологи, в зависимости от характера патологии клеток, выделяют две основные разновидности острого лейкоза крови.
Полная классификация острых лейкозов включает множество подвидов, которые различаются по морфологическим, генетическим и другим признакам, требующих специфического лечения.
Симптомы
Первые признаки, по которым можно заподозрить начало заболевания, одинаковы для всех его форм.
По мере роста злокачественных клеток в крови появляются более выраженные симптомы острого лейкоза.
Клинические признаки не дифференцируются в соответствии с классификацией острого лейкоза, поэтому определить форму болезни можно только при помощи лабораторных исследований.
Причины и факторы риска
До сих пор точно не установлены этиологические факторы, которые неизбежно становятся «спусковым крючком» для злокачественной мутации клеток. Однако риски развития острого лейкоза существенно повышаются при:
Стадии
Онкогематологи выделяют следующие стадии острого лейкоза.
Диагностика
Пациенту с симптомами, напоминающими острый лейкоз, назначают:
Лечение
Поскольку в перечень наиболее агрессивных злокачественных онкозаболеваний входит острый лейкоз, лечение должно начаться сразу после постановки диагноза. Пациента помещают в онкогематологический стационар в палату со специальной вентиляцией для удаления патогенной микрофлоры. Основным методом, как правило, является химиотерапия, которая подкрепляется переливанием компонентов крови, дезинтоксикационной терапией, профилактикой инфекций. Схема лечения состоит из основных этапов:
При определённых формах заболевания хороший эффект даёт трансплантация стволовых клеток костного мозга, выполняемая после уничтожения бластов с помощью химиопрепаратов и лучевой терапии.
Первый этап лечения занимает от 4 до 6 недель, в это время пациент получает массированную терапию. На этапе консолидации проводится два или три курса лечения, после чего в течение нескольких лет продолжаются поддерживающие мероприятия, которые необходимы, чтобы исключить рецидивы. Полная ремиссия достигается при уничтожении клона патологических клеток и восстановлении нормального кроветворного процесса.
Прогнозы
Современные методы лечения позволяют перевести в фазу длительной ремиссии до 80% больных, из них до 30% случаев составляет полное выздоровление. Чем раньше обнаружено заболевание, тем более благоприятен прогноз. Тем не менее, даже для пациентов, у которых рак крови диагностирован в терминальной стадии, остаются шансы на излечение.
Профилактика
Чтобы снизить вероятность мутации кроветворных клеток, необходимо придерживаться здорового образа жизни, исключить курение табака, избегать стрессов и депрессивных состояний. Людям с отягощённой наследственностью, подвергавшимся облучению или часто контактирующим с опасными химическими соединениями, в целях профилактики острого лейкоза следует тщательно следить за здоровьем и регулярно консультироваться с онкологом для своевременного обнаружения болезни.
Реабилитация
В перечень клинических рекомендаций при остром лейкозе в период реабилитации входят:
В период восстановления важно выполнять все назначения лечащего врача-онколога, вовремя и полностью проходить рекомендованные лечебные курсы.
Диагностика и лечение острого лейкоза в Москве
Клиника Института ядерной медицины выполняет качественную диагностику острого лейкоза с использованием современных медицинских приборов и оборудования. При подтверждении диагноза квалифицированные онкогематологи проводят надлежащее лечение, отвечающее самым высоким стандартам, принятым в современной мировой практике.
Вопросы и ответы
Острый лейкоз крови: сколько живут с этим заболеванием?
Шансы прожить пять лет и более для детей существенно выше, чем для взрослых и составляют 75-80%. У взрослых этот показатель достигает 30%, но в некоторых клиниках превышает 50%. Длительность жизни зависит от формы заболевания: при остром лимфобластном лейкозе она составляет 2-3 года, а с миелоидной формой пациенты живут, в среднем, около 6 лет.
Как проявляется лейкоз?
Коварство этого заболевания заключается в отсутствии выраженной симптоматики. Пациент ощущает ухудшение своего состояния, однако считает, что причина заключается в усталости, сезонной простуде и т. д. Обнаружить и диагностировать острый лейкоз на ранней стадии болезни могут только онкологи-гематологи, которые используют специфические методики и оборудование.
Можно ли вылечить острый лейкоз?
Как и при любом онкозаболевании, наиболее благоприятны прогнозы при максимально раннем обнаружении острого лейкоза и незамедлительном начале лечения. Возможность выздоровления существует для каждого пациента, независимо от стадии и формы болезни, поэтому необходимо не опускать руки, а обращаться в клинику ИЯМ, где вам окажут квалифицированную помощь на самом высоком современном уровне.
Острый миелоидный лейкоз у детей
Если при ОЛЛ у детей достигнуты значительные успехи в лечении, то результаты лечения ОМЛ остаются недостаточно удовлетворительными. В связи с этим проблема диагностики и лечения ОМЛ у детей является актуальной.
Диагноз ОМЛ устанавливается в более 30% случаев определения бластов в костном мозгу. Бласты должны иметь морфологическую и цитохимическую характеристику одного из FAB вариантов ОМЛ.
Существенным дополнением для диагностики ОМЛ являются иммунофенотипические исследования, уточняющие стандартную морфологическую диагностику и варианты ОМЛ.
Наиболее распространенными и широко применяемыми для подтверждения нелимфоидной природы лейкоза являются антигены CD13 и CD33, несколько реже используется CD65. Оценка этих трех маркеров позволяет подтвердить миелоидную природу опухолевых клеток в 98% случаев ОМЛ у детей.
Клиническая картина ОМЛ достаточно хорошо известна и проявляется следующими синдромами: анемическим, геморрагическим и токсическим, которые характеризуются бледностью кожных покровов, выраженной слабостью, головокружением, снижением аппетита, повышенной утомляемостью, лихорадкой без проявлений катаральных явлений.
Экстрамедуллярные опухолевые поражения чаще проявляются гингивитом и экзофтальмом, в том числе двусторонним; в редких случаях бывают опухолевая инфильтрация мягких тканей, гипертрофия нёбных миндалин, поражение носоглотки и лицевого нерва, а также лейкемиды на коже.
Экстрамедуллярные локализации ОМЛ объединяет термин «гранулоцитарная (миелобластная) саркома», включающая классическую хлорому и непигментированные опухоли.
По данным аутопсии, гранулоцитарная (миелобластная) саркома диагностируется в 3-8% случаев у больных ОМЛ. Она может предшествовать или сочетаться с признаками ОМЛ, характеризующимися бластной инфильтрацией костного мозга и наличием бластов в периферической крови, а также наблюдаться при рецидиве заболевания. Наиболее частой локализацией опухолевого роста является орбита (поражаются орбитальная ткань и внутренние структуры черепа). Бластные клетки чаще представлены М2-типом, имеющими транслокацию t(8;21). Ряд авторов указывают на более плохой прогноз у этих больных, чем при типичном ОМЛ.
Факторы прогноза у больных ОМЛ менее изучены, чем у больных с ОЛЛ. Было проведено большое количество одно- и многофакторных исследований, с помощью которых появилась возможность определения благоприятных и неблагоприятных признаков заболевания для назначения рационального лечения. Факторы, от которых зависит прогноз ОМЛ у детей, разделяют на клинические и лабораторные. К клиническим можно отнести возраст, пол, анамнез, размеры паренхиматозных органов, выраженность геморрагического синдрома, инициальное поражение ЦНС, время наступления ремиссии, количество курсов химиотерапии. Среди лабораторных прогностических факторов выделяют чувствительность бластных клеток к химиопрепаратам in vitro, количество лейкоцитов в анализе периферической крови, FAB-вариант ОМЛ, уровень фибриногена, уровень лактатдегидрогеназы, наличие палочек Ауэра в бластах.
Лечение больных ОМЛ основано на принципе максимального уничтожения лейкозного клона клеток. Основным методом лечения заболевания является полихимиотерапия. В настоящее время существует несколько направлений в лечении ОМЛ, включающих в себя как применение новых цитостатиков, так и увеличение доз уже известных химиопрепаратов. Кроме этих уже достаточно изученных и ставших традиционными методов воздействия на лейкозный процесс существуют экспериментальные подходы с использованием естественных биологически активных препаратов, которые тем или иным способом влияют на процесс кроветворения (все ростковые факторы, интерлейкины). Наряду с цитостатическими агентами также пытаются применять лекарственные препараты, которые обладают мощным моделирующим воздействием на иммунную систему (циклоспорин, антилейкоцитарный иммуноглобулин). Использование ростковых факторов при ОМЛ в настоящее время дискутируется в связи с данными о том, что они могут способствовать пролиферации опухолевого клона клеток. В настоящее время некоторыми исследователями доказывается возможность применения колониестимулирующих факторов (граноцит и др.) у больных с ОМЛ.
При проведении индуктивного и консолидирующего курсов химиотерапии необходима максимальная интенсификация, что приводит к наиболее быстрому достижению полных ремиссий. Следствием такой терапии является аплазия костного мозга, во время которой резко возрастает вероятность возникновения инфекционных и геморрагических осложнений, в связи с чем больные нуждаются в комплексном сопроводительном лечении, включающем в себя заместительную, антибактериальную и дезинтоксикационную терапию.
Одним из путей интенсификации химиотерапии и достижения более длительных ремиссий является увеличение доз цитозинарабинозида (до 3000 мг/м2 каждые 12 часов).
В последнее время появились работы о применении митоксантрона для лечения ОМЛ у детей, особенно у больных с плохим прогнозом (М5, М7, М6, М4 без эозинофилии и inv(16), М2 с лейкоцитозом более 50х109/л) и при рецидиве заболевания. Наиболее эффективной терапией оказалось сочетание высоких доз цитозара, митоксантрона, этопозида. Данная терапия приводит к выраженной миелодепрессии, без которой невозможно достичь полной ремиссии при ОМЛ, особенно у больных с неблагоприятным прогнозом и рецидивами заболевания. Применение митоксантрона (12 мг/м2) у больных с неблагоприятным прогнозом не привело к увеличению числа осложнений при достижении большего количества полных ремиссий у больных с резистентными к терапии формами ОНЛЛ.
Направление лечения, связанное с использованием дифференцирующих агентов, таких как изомеры ретиноевой кислоты, достигло наибольшего результата при терапии острого промиелоцитарного лейкоза (М3). При хромосомной аберрации t(15;17), соответствующей М3 FAB, точка разрыва хромосомы 17 вовлекает ген, соответствующий ядерному рецептору альфаретиноевой кислоты, что дает возможность восстановления пораженного гена и способствует апоптозу опухолевых клеток при сокращении количества эпизодов геморрагических осложнений.
Опыт последних 20 лет показал, что совершенствование технологии сопроводительного лечения, главным образом методов контроля инфекций у больного с индуцированной гранулоцитопенией, и появление методик получения тромбоконцентрата позволили достичь 80% полных ремиссий, несмотря на значительное ужесточение режимов полихимиотерапии. Именно поэтому основными направлениями современных протоколов являются различные варианты интенсификации химиотерапии, которая может осуществляться с помощью ряда вариантов: введение в уже известные протоколы дополнительных цитостатических средств; использование новых цитостатических препаратов в качестве альтернативы изученным, например более активных антрациклинов второго поколения (идарубицина и митоксантрона); цикловая интенсивная химиотерапия на протяжении 1,5-2 лет после достижения ремиссии; модификация стандартных программ химиотерапии на основании кинетических параметров бластных клеток в ходе терапии и характерных особенностей восстановления кроветворения после цитостатического воздействия; применение ростковых факторов для ускорения выхода из постхимиотерапевтической аплазии; раннее применение аутологичной и аллогенной трансплантации костного мозга. Принцип ранней интенсификации в настоящее время является основным в терапии ОМЛ и, по данным многих исследований, имеет преимущество перед стандартным. Он позволяет уменьшить число больных с резистентными формами ОМЛ за счет увеличения мощности цитостатического воздействия на первых, ранних этапах терапии.
В настоящее время доказано, что результаты лечения больных ОМЛ, получавших все этапы полихимиотерапии (индукцию ремиссии и постремиссионную терапию) в полном объеме, значительно выше.
В большинстве протоколов лечения ОМЛ наибольшее распространение получила поддерживающая рекомендуемая BFM- группой терапия, которая состоит из ежедневного приема 6-тиогуанина в дозе 40 мг/м2 в комбинации с подкожным введением цитозинарабинозида (40 мг/м2 х 4) каждые 4 недели. Проводится она сроком до 18 месяцев от начала лечения. Однако с повышением интенсивности постремиссионной терапии длительность поддерживающего лечения сокращается.
Профилактика нейролейкоза состоит из эндолюмбального введения цитозинарабинозида, метотрексата или комбинации этих препаратов с гидрокортизоном, с или без краниального облучения. Ряд авторов считают краниальное облучение больных ОМЛ необходимым компонентом терапии, другие придерживаются мнения, что краниальное облучение необходимо только для детей с первичным поражением нервной системы, а также для больных с вариантом М4, с хромосомными нарушениями inv (16). Предпочтение в проведении краниального облучения высказывают исследователи из группы BFM, которые показали снижение частоты не только нейролейкоза, но и костномозговых рецидивов при ее проведении.
Вопрос о роли аллогенной ТКМ (алло-ТКМ) у детей с ОМЛ в первой клинико-гематологической ремиссии в настоящее время активно дискутируется. Хотя алло-ТКМ является эффективным средством терапии ОМЛ, вопросы наличия донора и токсичности процесса ограничивают ее использование. Ключевым вопросом применения алло-ТКМ у детей с ОМЛ в первой ремиссии является выявление соотношения антилейкозного эффекта, увеличения уровня выживаемости больных с дальнейшим приемлемым качеством жизни.
В настоящее время кандидатами для алло-ТКМ являются пациенты высокой группы риска, имеющие HLA-идентичного донора костного мозга. Проблема аутологичной ТКМ (ауто-ТКМ) или периферических стволовых клеток (ПСК) в настоящее время изучается. В НИИ детской онкологии и гематологии РОНЦ им. Н.Н.Блохина РАМН разработаны протоколы лечения больных, использующие ауто-ТКМ и ПСК у больных ОМЛ с высокой группой риска в первой ремиссии и при рецидивах заболевания. Уже на сегодняшний день получены обнадеживающие результаты лечения.
В связи с тем что ОМЛ представлен группой неоднородных заболеваний, основным планом оптимизации лечения является индивидуализация терапии, дополненная предупреждением риска развития рецидивов, знаниями о биологии отдельных подвариантах ОМЛ.
Новыми препаратами, введенными в лечебные протоколы ОМЛ у детей в последнее десятилетие, являются 2-хлордеоксиаденозин (2-CDA) и флюдарабин. Применение в терапии новых агентов, включая иммунотерапию интерлейкином-2, лимфокинактивированными киллерами (LAK), генерированных из мононуклеарных клеток периферической крови, позволяет надеяться на значительные успехи в лечении ОМЛ в будущем.
В отделении химиотерапии лейкозов НИИ детской онкологии и гематологии, организованном 25 лет назад, проведено лечение 200 больным ОМЛ в возрасте от 1,5 месяца до 16 лет. За последние 10 лет благодаря применению новых подходов к лечению детей с ОМЛ с включением новых химиотерапевтических агентов и ТКМ удалось увеличить выживаемость больных до 50%, что в два раза превышает результаты терапии с использованием программы лечения «7+3» (цитозинарабинозид и рубомицин).
Благодаря внедрению в диагностику и программную терапию ОМЛ новых технологий удалось достичь значительного прогресса в результатах лечения рецидивов ОМЛ у детей.
Острый миелоидный лейкоз (ОМЛ)
Что такое острый миелоидный лейкоз?
На этом изображении показано, как выглядит под микроскопом нормальный, здоровый костный мозг.
На этом изображении показан костный мозг ребенка с острым миелоидным лейкозом.
Существует несколько подвидов ОМЛ. Различать их важно, поскольку прогноз и лечение зависят от конкретного вида лейкоза.
Знание подвида ОМЛ позволяет врачам классифицировать случаи ОМЛ с низким или высоким риском, что обеспечивает возможность выбора наиболее подходящего лечения. Лечение обычно предполагает проведение химиотерапии, и — в некоторых случаях — трансплантации костного мозга. Назначение лечения на основе категории риска (риск-адаптированная терапия) позволило добиться роста выживаемости. Пациентам с формами рака высокого риска может назначаться наиболее агрессивная терапия, в то время как пациентам с заболеванием низкого риска может быть достаточно лечения меньшей интенсивности, при котором возникает меньше побочных эффектов. Для получения дополнительной информации о подвиде ОМЛ обратитесь к вашему лечащему врачу.
Подвиды острого миелоидного лейкоза (ОМЛ) и связанных с ним опухолей у детей (Всемирная организация здравоохранения, 2016 г.):
Признаки и симптомы острого миелоидного лейкоза
Возможные признаки и симптомы ОМЛ:
Диагностика острого миелоидного лейкоза
Для диагностики лейкоза требуется проведение исследований костного мозга. Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно высокое количество незрелых белых клеток крови.
Сначала врач проводит медицинский осмотр и изучает историю болезни пациента. В ходе осмотра врач будет проверять общие показатели здоровья и наличие признаков заболевания — уплотнений и всего, что кажется необычным. Проводится тщательный осмотр глаз, ротовой полости, кожи и ушей. Может быть выполнено обследование нервной системы. При пальпации брюшной полости пациента врач проверяет, не увеличена ли в размере селезенка или печень.
Изучая историю болезни, врач посмотрит, имеются ли какие-либо клинически значимые заболевания или случаи повторяющихся онкозаболеваний в семье, которые могут указывать на то, что рак может быть наследственным. Только в 8–10% случаев рак у детей является наследственным.
Факторы риска возникновения ОМЛ у детей:
Общий клинический анализ крови
Пациенту назначат анализ крови, называемый общим клиническим анализом крови. При этом берут образец крови и исследуют его характеристики:
Биохимический анализ крови
В образце крови измеряют количество определенных веществ, выделяемых в кровь органами и тканями организма. Отклонение от нормы (в большую или меньшую сторону) может быть признаком заболевания.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови.
Для подтверждения диагноза рака и точного определения типа рака проводят такие исследования, как пункция и биопсия костного мозга. Многим детям это процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющее.medicine.
Пункция костного мозга: с помощью тонкой полой иглы врачи возьмут образец костного мозга из тазовой кости. Морфолог изучит образец костного мозга под микроскопом, чтобы обнаружить признаки рака.
Биопсия костного мозга: врачи извлекут небольшой фрагмент костной ткани для определения степени распространенияракав костном мозге. Обычно биопсия проводится непосредственно до или сразу после пункции.
Как выполняют пункцию/биопсию костного мозга?
Для диагностики лейкоза требуется провести исследование костного мозга.
После подтверждения диагноза врачи проведут дополнительные анализы, чтобы точно определить вид лейкоза. Используют такие исследования:
Такими анализами являются иммуногистохимическое исследование и проточная цитометрия.
Одним из таких исследований является FISH-анализ (флуоресцентная гибридизация in situ). В ходе этого анализа изучаются гены или хромосомы в клетках и тканях. Фрагменты ДНК, содержащие флуоресцентный краситель, изготавливают в лаборатории и добавляют в клетки или ткани на предметном стекле. Когда эти фрагменты ДНК прикрепляются к определенным генам или областям хромосом на предметном стекле, они становятся различимы.
Чтобы определить распространение опухоли, используют такие исследования:
Рентгеновское излучение — это тип пучка энергии, который способен проходить сквозь тело и, попадая на пленку, создавать изображение областей внутри тела на экране компьютера или специальной пленке. Рентгенографию грудной клетки проводят для того, чтобы определить, есть ли новообразование в грудной клетке.
Лечение острого миелоидного лейкоза
График лечения
Неделя 1
Диагностическое обследование, подготовка к лечению
Врачи собирают информацию для выбора методов лечения.
Перед началом лечения
Пациенту устанавливают тоннельный центральный катетер илидругоеустройство центрального венозного доступа для химиотерапии, введения жидкостей и взятия образцов крови.
4–6 недель
Фаза индукции
Целью этой фазыявляетсяуничтожениелейкозных клеток в крови и костном мозге и перевод заболевания в ремиссию.
Поскольку пациенты с ОМЛ уязвимы для инфекции, им также назначают поддерживающую терапию антибиотиками.
В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС).
Во многих детских медицинских центрах используются высокочувствительные тесты для измерения минимальной остаточной болезни (МОБ). Положительная МОБ указывает на более высокий риск рецидива и необходимость применения более интенсивной терапии.
4–6 месяцев
Консолидация/интенсификация/постиндукция
Фаза консолидации начинается после наступления у пациента ремиссии. Ее целью является уничтожение любых опухолевых клеток, которые могут остаться после предыдущих фаз.
Она включает 2–4 цикла химиотерапии.
На этой стадии некоторым пациентам может проводиться трансплантация гемопоэтических клеток. Если пациенту провели трансплантацию, он останется в стационаре на несколько недель. В школу ребенок сможет вернуться, скорее всего, только через год.
График последующего наблюдения
Год 1
Пациенту могут назначать проверки каждые 4 месяца.
Во время проверок проводятся такие обследования:
Год 2
Частота визитов для последующего наблюдения может быть снижена до одного раза в 6 месяцев.
Годы 3–5
Частота визитов для последующего наблюдения может быть снижена до одного раза в год.
Целью индукционной терапии является уничтожение опухолевых клеток в крови и костном мозге и перевод заболевания в ремиссию. Поскольку пациенты с ОМЛ уязвимы для инфекций, им также назначают поддерживающую терапию антибиотиками. В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг ( интратекально ).
Индукционная терапия обычно включает в себя комбинацию таких препаратов, как цитарабин и антрациклиновый препарат, чаще всего даунорубицина, в сочетании с этопозидом и/или тиогуанином.
Целью этой фазы является уничтожение любых оставшихся опухолевых клеток, которые могут растии вызывать рецидив рака. В онкологических центрах есть возможность выполнять тесты, которые позволяют обнаружить одну клетку ОМЛ среди 1000 нормальных клеток. У детей, у которых обнаруживается более 1 клетки на 1000 после завершения фазы индукции, риск рецидива наиболее высок.
Фаза консолидации начинается после наступления у пациента ремиссии. Она включает 2–4 цикла химиотерапии и длится от 4 до 6 месяцев. В ходе такой терапии применяются некоторые лекарственные препараты, используемые при индукции, а также введение не кросс-резистентных препаратов и обычно высоких доз цитарабина.
Трансплантация гемопоэтических клеток
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток ) может быть рекомендована детям с высоким риском рецидива или с резистентностью ОМЛ к лечению. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация костного мозга.
Пациенту с ОМЛ могут назначить аллогенную трансплантацию.
При такой трансплантации костного мозга дети получают гемопоэтические клетки, вырабатывающие кровяные тельца, от здорового донора. Для этого необходимо найти подходящего донора. До получения донорских клеток необходимо уничтожить собственные клетки крови в костном мозге пациента, для чего применяется химиотерапия и — в некоторых случаях — облучение. Во время трансплантации пациенту внутривенно вводятся здоровые донорские клетки. В случае успеха эти новые донорские клетки будут расти и замещать клетки крови и костного мозга пациента. В результате в костном мозге пациента должны начать вырабатываться здоровые клетки крови.
Прогноз при лечении острого миелоидного лейкоза
5-летняя выживаемость для детей с ОМЛ составляет около 70%.
Примерно у 90% детей с ОМЛ после первоначального лечения отсутствуют раковые клетки в крови. Примерно у 30% детей с ОМЛ происходит рецидив илизаболеваниеоказывается устойчивым к лечению (рефрактерным).
Отдаленные последствия острого миелоидного лейкоза
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
Цель современных исследований острого миелоидного лейкоза
Текущие исследования направлены на разработку более эффективных методов лечения форм рака, не реагирующих на первоначальную терапию, новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым тканям, и эффективных методов лечения с меньшим количеством побочных эффектов.
—
Дата изменения: июнь 2018 г.
Химиотерапия
Химиотерапия — это лечение рака с помощью мощных лекарственных препаратов. Они уничтожают злокачественные клетки или останавливают их рост.
Подробнее о химиотерапии
Лейкоз
Лейкоз — это рак крови и костного мозга. Он является наиболее распространенным онкологическим заболеванием у детей и подростков.