острый лимфобластный лейкоз прогноз жизни у детей
Острый лимфобластный лейкоз прогноз жизни у детей
Индукция и консолидация ремиссии при острой лейкемии. Существует риск смертельного исхода в первые несколько недель индукционной терапии. Этот риск можно свести к минимуму поддерживающими мероприятиями в процессе проведения химиотерапии или перед ее началом. Необходимо корректировать анемию.
Если почки увеличены или повышается уровень креатинина, то сильно возрастает риск возникновения синдрома лизиса опухоли. Необходимо принять меры для предотвращения и лечения этих осложнений. В более тяжелых случаях, таких как В-клеточная ОЛЛ и ОМЛ, может оказаться необходимой терапия, направленная на поддержание уровня тромбоцитов.
Инфекции необходимо выявлять на ранних стадиях и принимать решительные меры (см. также острая лейкемия у взрослых, поддерживающая терапия). Обычно гематологическая и клиническая ремиссия при ОЛЛ достигается использованием винкристина, преднизолона и L-аспарагиназы. В период индукции необходимы усиленная гидратация, аллопуринол и лекарства, понижающие кислотность мочи.
При таких мероприятиях обычно до 95% пациентов достигает состояния ремиссии в течение трех недель. У детей с В-клеточной ОЛЛ и в случае других плохих прогнозов эти стандартные приемы терапии не дают эффекта. Необходимы более интенсивные процедуры с использованием циклофосфамида, цитозинарабинозида, антрациклинов и метотрексата.
При ОМЛ ремиссия индуцируется цитозином и даунорбуцином. Новейшими исследованиями была дана оценка использованию дополнительных препаратов, таких как тиогуанин и этопозид. Миелосупрессия намного более выражена при использовании этих препаратов и необходима привычная поддерживающая терапия.
Полной или частичной ремиссии при ОЛЛ достигают интенсификацией лечения с использованием аспарагиназы, антрациклина (даунорбуцина, доксорбуцина), цитозинарабинозида и циклофосфамида. Метотрексат в высоких дозах увеличивает продолжительность ремиссии. Эти лекарства являются миелосупрессорами, но на данной стадии костный мозг восстанавливается вслед за гибелью большинства популяций лейкемических клеток.
Интенсификация при ОМЛ ставит большую проблему в лечении. Результат стандартной интенсивной химиотерапии улучшается в тех случаях, когда удачно проведена аллогенная трансплантация. Для многих детей трудно подобрать доноров, остается единственная возможность использовать подходящего неродственного донора для пациентов с высоким риском рецидива после достигнутой ремиссии, в таких случаях как моносомия 7 или аутологичная ТКМ (обычно назначаемая после нескольких циклов интенсивной стандартной терапии). В настоящее время эти различные подходы изучаются.
Поддерживающая терапия при детской лимфобластиой лейкемии
Продолжительность «поддерживающей» химиотерапии не может быть установлена. При более интенсивных мероприятиях индукции и консолидации представляется возможным снижение длительности поддерживающей терапии. Широко используют лекарства, такие как 6-меркаптопурин и метотрексат, часто в сочетании с винкристином и преднизолоном. В случаях плохих прогнозов используют более жесткие режимы, например лучевую терапию.
В конце курса лечения берут биопсию яичников (если профилактическое облучение не применяли) для определения латентного заболевания. Рецидивы, в некоторых случаях возникающие через год после лечения, прекращаются. Тиогуанин не используют при поддерживающей терапии, поскольку его длительное применение повышает риск возникновения спленомегалии и портальной гипертензии из-за закупорки протоков печени (без цирроза).
Профилактика заболеваний центральной нервной системы
Важность профилактики нарушений со стороны ЦНС была продемонстрирована в начале 1970-х годов. До этого времени инфильтрация мозговых оболочек лейкемическими клетками являлась причиной возникающих рецидивов в половине всех случаев. Лимфобласты проникают в мозговые оболочки диффузно и распространяются до оболочек спинного мозга и черепно-мозговых нервов.
Профилактика в значительной мере уменьшает частоту рецидивов со стороны нервной системы. В настоящее время обычный режим включает в себя черепное облучение (18 Гр в 8-10 фракциях в течение 2 недель) и интратекальное введение метотрексата (10 мг/см2 4 раза в период облучения). Однако отдаленные последствия облучения ЦНС заставляют искать способы избежать профилактического облучения.
Результаты непросто интерпретировать. Кажется, что для «типичного риска» (WBC ниже 50 х 109/л) интратекальное введение метотрексата является адекватной профилактической мерой, а облучение ЦНС необходимо в случаях повышенного риска. Непонятно, как дополнительные лекарства (такие как цитозинарабинозид) способствуют улучшению состояния.
В случае установленных поражений ЦНС (которые сейчас возникают в 5-10% случаев) применяют интратекальное введение метотрексата дважды в неделю вместе с черепным облучением в более высоких дозах (24 Гр в течение 2-3 недель) и вместе (или с последующим) облучением спинного мозга. В постоянном контроле состояния ЦНС, однако, нет необходимости. Пациентам, которые устойчивы к метотрексату, необходимо интратекальное введение цитозинарабинозида.
Профилактика и лечение тестикулярных нарушений
Рецидив заболеваний яичек происходит часто. Это одна из причин худшего прогноза для мальчиков при ОЛЛ. Частота тестикулярных рецидивов может быть снижена в режимах, использующих высокую дозу метотрексата. Это происходит у 25% мальчиков пубертатного возраста, но менее распространено у более взрослых детей. Рецидив клинически может проявляться не всегда видимой первичной припухлостью, которая позднее иногда затвердевает.
Возникает обычно в обоих яичках, тестикулярная биопсия выявляет претубулярную лейкемическую инфильтрацию. В лечении применяют облучение яичек обычно в дозах порядка 24 Гр в течение 2-3 недель. Необходимость профилактического облучения до сих пор не выяснена.
Лечение рецидивов острой лейкемии у ребенка
Если рецидив у детей возникает при поддерживающей терапии или через год после прекращения лечения, прогноз плохой и необходима ТКМ. Поздние рецидивы купируются с помощью режимов интенсивной терапии и достигаемые ремиссии достаточно устойчивы, хотя и не в каждом случае, однако необходимость ТКМ может рассматриваться и для этой группы больных.
Аллогенная ТКМ применялась в попытках улучшить результаты у детей с плохим прогнозом при ОЛЛ. Эта процедура не имеет достоверно показанного преимущества в выживании в сравнении с химиотерапией рецидива в группе стандартного риска при ОЛЛ.
Следующие клинические ситуации рассматривают как показания к применению аллогенной ТКМ: вторая или третья ремиссия, особенно если рецидив возник во время проведения поддерживающей терапии; случаи плохого прогноза, такие как t(4;11), острая недифференцируемая лейкемия (AUL), t(8;14) В-клеточная ОЛЛ и Ph’-положительная ОЛЛ. Такие дети могут иметь преимущества перед теми, кому ТКМ назначают после первой ремиссии.
Результаты ТКМ при первой ремиссии в группе высокого риска обнадеживают. В 55% случаев отмечают период трех лет жизни без рецидивов. В группе стандартного риска при второй ремиссии — в 65% случаев фиксируют 5-летний период жизни без рецидивов. Результаты в значительной мере зависят от факторов, используемых при отборе пациентов.
Аутологичная ТКМ или трансплантация стволовых клеток имеет, в целом, меньший успех, чем аллогенная, возможно потому, что костный мозг оказывается инфицированным, а также, потому, что некоторые высокодозовые режимы не включают в себя тотальное облучение тела (ТО). Новые лечебные режимы, включающие в себя комбинацию химиотерапии и ТО, могут дать улучшение результатов ТКМ. При аллогенной ТКМ смертность выше, чем при аутологичной, частично потому, что происходит отторжение трансплантата.
Если, несмотря на профилактику, возникают рецидивы со стороны ЦНС, можно вызвать ремиссию интратекальным введением метотрексата или краниоспинальным облучением. Метотрексат можно вводить через резервуар Оммая или Рикхама, который позволяет непосредственно доставлять лекарство в церебрально-вентрикулярную систему. Систематические рецидивы неизбежны, поэтому в дальнейшем обычно требуется систематическая терапия.
Рецидив ОМЛ является серьезным событием. При традиционной реиндукционной химиотерапии только 20% детей остается живыми в течение двух лет, поэтому предприняты попытки интенсификации процедур индукции ремиссии после первого рецидива с использованием аллогенной и аутологичной трансплантации. Представляется возможным, что хотя бы каждый третий ребенок с рецидивом ОМЛ мог быть излечен этим методом.
Прогноз острой лейкемии у ребенка
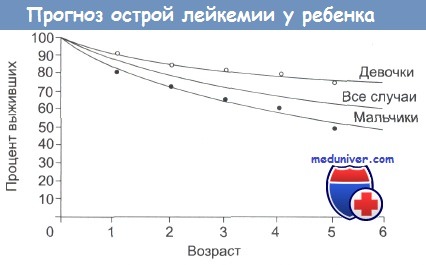
Важные прогностические признаки представлены в таблице ниже. Выживаемость среди девочек выше, чем среди мальчиков. Последствия лечения продолжают рассматриваться. Они включают в себя неврологические осложнения после облучения ЦНС и позвоночника, которые приводят к рассмотрению целесообразности уменьшения дозы облучения и использования в случаях небольшого риска.
Осложнение в виде опухоли мозга, индуцированное облучением ЦНС, наиболее распространено у детей, проявляющих полиморфизм по ферменту, детоксицирующему меркаптопурин (тиопуринметилтрансфераза), что делает их в большей степени подверженными острой токсичности и развитию вторичной ОМЛ. Эти соображения являются основными для введения адаптированных к риску стратегий лечения, которые включают известные прогностические факторы, но превносят быстрый результат и минимальные остаточные проявления болезни. Использование технологии микрозондирования может сделать возможным дальнейшее улучшение в решении задач лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лимфолейкоз
Лимфолейкоз – это злокачественное заболевание, при котором костный мозг вырабатывает большое количество незрелых, неспособных выполнять свои функции лимфоцитов. Лимфоциты являются разновидностью лейкоцитов и отвечают за иммунитет. Злокачественные лейкоциты не справляются с защитной функцией, при этом подавляют образование нормальных клеток крови и нарушают работу других органов.
Существует много разновидностей этого заболевания. Лимфолейкозы делят в зависимости от скорости развития патологического процесса, степени зрелости лимфоцитов, типа поврежденных лимфоцитов (Т- и В-лимфоциты). Однако чаще всего выделяют 2 основных типа: острый лимфобластный лейкоз и хронический лимфоцитарный лейкоз.
Лечение лейкозов обычно комплексное. На данный момент существует несколько вариантов терапии, и каждый год появляются новые, все более эффективные методы лечения лимфолейкозов. Прогноз при остром лимфолейкозе благоприятный – 95 % пациентов полностью излечиваются. Прогноз при хроническом лимфолейкозе зависит от скорости развития заболевания и сопутствующих патологий, он неуклонно прогрессирует, однако соответствующее лечение часто приводит к ремиссии и значительному улучшению состояния пациента.
Острый лимфолейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, хронический лимфолейкоз, хронический лимфоцитарный лейкоз.
Pediatric acute lymphoblastic leukemia, childhood acute lymphoblastic leukemia, acute lymphocytic leukemia, ALL, chronic lymphocytic leukemia, CLL.
Острый лимфобластный лейкоз развивается достаточно быстро – обычно в течение нескольких недель. Симптомами его являются:
Хронический лимфоцитарный лейкоз обычно никак не проявляется на начальной стадии. Он развивается годами, и постепенно возникают следующие симптомы:
Общая информация о заболевании
Лимфоциты – это разновидность лейкоцитов. Как и все остальные клетки крови, лимфоциты образуются из единой стволовой клетки, которая находится в костном мозге и дает начало лимфоидной и миелоидной стволовым клеткам. От лимфоидной стволовой клетки происходят лимфоциты, от миелоидной – другие виды лейкоцитов, эритроциты и тромбоциты.
Для того чтобы из лимфоидной стволовой клетки развились зрелые Т- и В-лимфоциты, она должна пройти через ряд последовательных делений. Сначала из лимфоидной стволовой клетки образуются лимфобласты, которые затем дают начало 2 типам клеток – предшественникам Т-лимфоцитов и предшественникам В-лимфоцитов. В процессе деления клетки становятся все более зрелыми и специализированными. Последние этапы созревания лимфоцитов проходят уже не в костном мозге, а в лимфоидных органах: тимусе, лимфатических узлах и селезенке. В результате формируются зрелые Т- и В-лимфоциты.
Лимфоциты, по сути, – клетки иммунитета. Это значит, что они участвуют в распознавании и уничтожении чужеродных тел (вирусов, бактерий) или патологически измененных тканей собственного организма (например, клеток опухоли). Т- и В- лимфоциты делают это по-разному. В-лимфоциты борются с чужеродными клетками (антигенами) с помощью иммуноглобулинов – белков, которые связывают антигены и запускают процесс их разрушения специальными белками. Т-лимфоциты распознают антигены, разрушают их самостоятельно или при взаимодействии с другими клетками крови, активируют выработку иммуноглобулинов В-лимфоцитами.
При лимфолейкозе нарушается формирование лимфоцитов. Появляется большое количество незрелых клеток, которые не способны выполнять свою работу. Это приводит к серьезным сбоям иммунитета. Человек становится более подвержен таким инфекционным заболеваниям, как туберкулез, кандидоз. Могут возникать серьезные осложнения от плановых прививок. Часто появляются так называемые аутоиммунные реакции – то есть иммунитет борется с нормальными клетками организма, например эритроцитами. В результате возникает анемия.
Злокачественные лимфоциты проникают в лимфатические узлы и селезенку, вызывая их увеличение, могут повреждать печень, легкие, головной мозг, кости.
При остром лимфолейкозе в костном мозге преобладают лимфобласты. Они очень быстро делятся, вытесняют из костного мозга и крови другие клетки, активно заселяют лимфатические узлы, селезенку. Чаще всего встречаются острые В-клеточные лейкозы, при которых образуется большое количество незрелых В-лимфоцитов. Острый В-клеточный лейкоз – самый распространенный вид лейкозов среди детей.
При хроническом лимфолейкозе в крови находят более зрелые формы лимфоцитов, которые способны некоторое время выполнять свои функции. Этот тип лейкоза характерен для людей старше 50-55 лет.
Кто в группе риска?
При остром лимфолейкозе в группе риска:
При хроническом лимфолейкозе в группе риска:
При хроническом лимфолейкозе лимфобласты обычно отсутствуют в крови. Характерным признаком хронического лейкоза является обнаружение в мазке крови клеток (или теней) Боткина – Гумпрехта. Они представляют собой остатки разрушенных лимфоцитов. Тени Боткина – Гумпрехта отсутствуют в жидкой крови и образуются в процессе приготовления мазка. Их количество определяет интенсивность разрушения лимфоцитов в крови.
При остром лимфобластном лейкозе прогноз благоприятный, особенно у детей. Большинство пациентов полностью излечиваются. Прогноз хронического лимфолейкоза зависит от скорости прогрессирования болезни и чувствительности к химиотерапии. Средняя продолжительность жизни пациентов с хроническим лимфолейкозом составляет 3-5 лет.
Специфической профилактики лимфолейкозов нет. Необходимо своевременно проходить профилактические осмотры, в ходе которых нередко выявляют заболевания крови.
Рекомендуемые анализы
Острый лимфобластный лейкоз
Острым лимфобластным лейкозом (общепринятая аббревиатура — ОЛЛ) называют злокачественное заболевание крови и костного мозга, при котором кроветворный орган неконтролируемо продуцирует незрелые (бластные) лимфоциты. Это приводит к резкому ухудшению состояния больного, повышает риск кровотечений и восприимчивость к инфекциям. Наиболее часто болезнь поражает детей в возрасте от года до шести лет, причём у мальчиков она встречается чаще, чем у девочек. Взрослые страдают от ОЛЛ на порядок реже детей, причём самые высокие показатели заболеваемости — у пожилых людей старше 60 лет.
По типу поражённых лимфоцитов клинические случаи подразделяются на:
Острый лимфобластный лейкоз В-типа наиболее часто поражает маленьких детей и людей старшей возрастной группы. Основную группу риска ОЛЛ Т-типа составляют подростки 14-15 лет.
Симптомы
Первые признаки заболевания развиваются с увеличением в составе крови незрелых лимфоцитов:
По мере распространения лейкозных клеток развиваются симптомы острого лимфоцитарного лейкоза, свидетельствующие о поражении других органов:
Могут встречаться и другие проявления болезни, в зависимости от локализации повреждений.
Причины и факторы риска
Онкогематологи связывают появление злокачественных клонов, дающих начало острому лимфобластному лейкозу, с рядом провоцирующих факторов.
У детей болезнь может развиваться, если мать испытывала воздействие одного или нескольких перечисленных факторов во время беременности.
Стадии
Различают следующие стадии заболевания.
Диагностика
Поскольку заболевание развивается очень быстро, то при обращении к онкологу или онкогематологу симптомы острого лимфоидного лейкоза у него уже, как правило, ярко выражены. Однако для подтверждения диагноза и для определения методов лечения необходимы лабораторные анализы, а также проведение инструментальных исследований:
Лечение
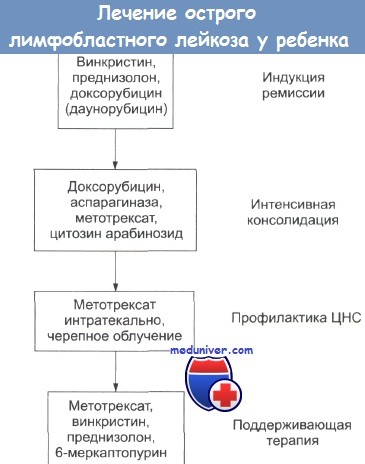
Как правило, схема лечения острого лимфобластного лейкоза включает три основных этапа.
Индукция. Продолжительность составляет несколько недель. Интенсивная химиотерапия направлена на уничтожение злокачественных лимфоцитов. К окончанию этапа в костном мозге должно быть не более 5% незрелых клеток.
На всех этапах лечение сопровождается приёмом антимикробных средств, переливаниями тромбоцитной массы и крови. Периодически проводится дезинтоксикация организма, чтобы очистить кровь от продуктов распада лейкозных клеток.
Прогнозы
При остром лимфобластном лейкозе прогноз благоприятен для 80-90% детей. У взрослых шансы на полное излечение достигают 40-45%, причём с возрастом они понижаются. Существенное влияние на успех лечения оказывает уровень бластных лимфоцитов в крови пациента на момент начала лечения, наличие у него хромосомных аномалий, а также распространение болезни в тканях головного мозга.
Профилактика
На сегодняшний день не существует специальных профилактических мер для безусловного предупреждения острого лимфобластного лейкоза. Общие рекомендации заключаются в поддержании здорового образа жизни, исключении курения, минимизации контактов с канцерогенными соединениями.
Реабилитация
Восстановление после химиотерапии ничем не отличается от аналогичных мер при остром нелимфобластном лейкозе и включает:
Важно, чтобы пациент выполнял все рекомендации онкогематолога.
Диагностика и лечение острого лимфобластного лейкоза в Москве
Квалифицированная диагностика острого лимфобластного лейкоза проводится в московской клинике Института ядерной медицины. Современное лечебно-диагностическое оборудование и высокая квалификация врачей-онкологов позволяют использовать для лечения онкозаболеваний передовые методы мировой практики с максимально высокой результативностью.
Вопросы и ответы
Какова продолжительность жизни при остром лимфобластном лейкозе?
При отсутствии лечения больной с ОЛЛ может прожить не более нескольких месяцев. Современные методики позволяют добиться полного выздоровления для 90% детей. У взрослых результативность терапии менее высока, однако у каждого пациента есть шансы, и необходимо их полностью использовать.
Нужна ли пересадка костного мозга при остром лимфобластном лейкозе?
Трансплантация костного мозга проводится только после наступления ремиссии при наличии показаний — при плохом ответе на индукционную терапию или из-за быстрого наступления рецидива. Как правило, у детей необходимости в пересадке не возникает. Костный мозг может быть взят у родственного либо у неродственного донора.
Можно ли вылечить острый лимфобластный лейкоз после рецидива?
Лечение при рецидиве заболевания зависит от локализации поражения — находится ли источник в костном мозге или вне его — например, в центральной нервной системе. Кроме того, имеет значение срок его развития — ранний либо поздний. Наиболее высоки шансы на успех при позднем рецидиве.
Острый лимфобластный лейкоз у детей. Клинические рекомендации.
Острый лимфобластный лейкоз у детей
Оглавление
Ключевые слова
Список сокращений
ВОЗ – Всемирная Организация Здравоохранения
Г-КСФ – гнулоцитарный колониестимулирующий фактор
д.м.н. – доктор медицинских наук
КТ – компьютерная томография
МОБ – минимальная остаточная болезнь
МРТ – магнитно-резонансная томография
ОЛЛ – острый лимфобластный лейкоз
СОЛ – синдром острого лизиса опухоли
ТГСК – трансплантация гемопоэтических стволовых клеток
УЗИ – ультразвуковое исследование
ЦНС – центральная нервная система
ЧМН – черепно-мозговые нервы
Ph+-ОЛЛ – острый лимфобластный лейкоз с наличием Филадельфийской хромосомы – t(9;22)/BCR-ABL
Термины и определения
Рецидив – это появление морфологически выявляемых бластных клеток после периода, в течение которого идентифицировать опухолевые клетки доступными методами не представлялось возможным.
Костномозговой рецидив – обнаружение в костном мозге 25% и более лимфобластов, без одновременного поражения ЦНС и/или другого экстрамедулярного поражения после констатации ремиссии.
ЦНС-рецидив (нейрорецидив) – появление лимфобластов в ликворе при цитологическом исследовании, а также неврологическая симптоматика, не связанная с другими заболеваниями и повреждениями. При внутричерепном образовании на КТ/МРТ и при отсутствии бластных клеток в ликворе, крови и костном мозге, для диагностики изолированного рецидива ЦНС необходимо получить гистологическое подтверждение или провести однофотонную эмиссионную КТ головного мозга. В костном мозге число бластных клеток должно составлять менее 5%.
Комбинированные рецидивы: сочетание двух и более поражений различной локализации. При комбинированных рецидивах костный мозг считается пораженным при наличии 5% и более лимфобластов.
Рефрактерность – отсутствие полной ремиссии в сроки, определенные протоколом терапии.
Ph-позитивный ОЛЛ– ОЛЛ с наличием транслокации (9;22)(q34;q11) – t(9;22) или BCR-ABL.
Минимальная остаточная болезнь (МОБ; minimal residual disease – MRD) – наличие остаточных лейкемических клеток у пациента в ремиссии, не выявляемых рутинными морфологическими методами.
1. Краткая информация
1.1 Определение
Острый лимфобластный лейкоз (ОЛЛ) – это злокачественное заболевание системы кроветворения, состоящее в появлении опухолевого клона из клеток линий лимфоидной дифференцировки, составляющего не менее 25% от других ядерных клеточных элементов, и в своем естественном течении неизбежно приводящее к фатальному исходу 4.
1.2 Этиология и патогенез
Точные причины развития ОЛЛ не установлены. Рассматривается возможная роль различных предрасполагающих факторов (генетических, вирусных, радиация, химическое и физическое воздействие и др.), однако их точное влияние на развитие ОЛЛ на сегодняшний день не установлено.
По современным представлениям в основе патогенеза ОЛЛ лежит мутация стволовой клетки, которая приводит к потере способности к нормальной клеточной дифференцировке и нарушениям в процессах пролиферации и апоптоза. Мутантный клон достаточно быстро вытесняет нормальные гемопоэтические клетки, замещая собой весь гемопоэз. Вытеснение нормальных гемопоэтических клеток и замещение их опухолевыми клетками, неспособными к созреванию, закономерно приводит к уменьшению в периферической крови зрелых клеток с развитием анемии, гранулоцитопении, лимфопении и тромбоцитопении, что проявляется соответствующей клинической картиной. Опухолевые клетки могут покидать костный мозг и инфильтрировать различные органы и ткани (селезенку, печень, лимфоузлы, тимус, центральную нервную систему (ЦНС), кожу и др.) 4.
1.3 Эпидемиология
ОЛЛ составляет около 25 % от всех злокачественных опухолей у больных в возрасте до 18 лет и является самым частым онкологическим заболеванием детского возраста. Заболеваемость составляет около 4 на 100 000 детского населения. Пик заболеваемости ОЛЛ у детей приходится на дошкольный возраст (2 – 5 лет при медиане 4,7 года). Несколько чаще болеют мальчики – соотношение 1,6:1 для В-линейного и 4:1 для Т-линейного ОЛЛ [2,3,5]
1.4 Кодирование по МКБ-10
С91.0 – острый лимфобластный лейкоз
1.5 Классификация
Классификация ОЛЛ у детей согласно ВОЗ является общепринятой 7:
2. Диагностика
2.1 Жалобы и анамнез
Клинические симптомы ОЛЛ у детей обусловлены степенью инфильтрации костного мозга лимфобластами и экстрамедуллярным распространением процесса. Пациенты с ОЛЛ могут предъявлять жалобы на слабость, лихорадку, недомогание, боли в костях и/или суставах, кровоточивость со слизистых оболочек (носовые, десневые, желудочно-кишечные и др. кровотечения), геморрагический синдром на коже, бледность. Распространение бластных клеток в лимфатические узлы и паренхиматозные органы приводит к лимфаденопатии, увеличению печени и селезенки, проявляющихся болями в животе, расширению средостения с возможным развитием синдрома сдавления, увеличению яичек у мальчиков. Проявлениями нейролейкемии могут быть симптомы поражения черепно-мозговых нервов, общемозговые, менингеальные симптомы 1.
Сбор анамнеза при ОЛЛ подразумевает тщательный расспрос о текущей или проводимой ранее лекарственной терапии, сопутствующих системных заболеваниях и хронической патологии, наличии онкологических заболеваний у родственников. Обязателен сбор эпидемиологического анамнеза семьи: условия проживания, санитарно-гигиенический уровень окружения, наличие хронических инфекционных заболеваний у близких родственников. Очень важно уточнить, откуда поступил больной: из дома или из других лечебных учреждений. Если больной в последнее время лечился в других больницах, обязательно нужно выяснить все детали терапии, в особенности противоинфекционной терапии, а также наличие или отсутствие различных лечебно-диагностических манипуляций, таких как катетеризация, наркоз, интубация, ИВЛ.
2.2 Физикальное обследование
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела, а также детальную оценку состояния всех органов и систем и неврологического статуса. Особое внимание следует обратить на документирование проявлений основного заболевания (описание всех групп увеличенных лимфоузлов с размерами, размеры печени и селезенки (указываются в сантиметрах ниже края реберной дуги по среднеключичной линии), размеры яичек у мальчиков, наличие/отсутствие лейкемидов на коже) и выявление возможных очагов инфекции. 1.
2.3 Лабораторная диагностика
Верификация диагноза проводится с помощью цитологического и цитохимического исследования мазков костного мозга и периферической крови, мультипараметрической проточной цитофлюорометрии клеток костного мозга и цитогенетического и молекулярно-генетического анализа опухолевых лимфобластов 3. Диагностический период не должен занимать более 2-х суток.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: данные общего анализа крови позволяют судить о выраженности тромбоцитопении и анемии, и необходимости проведения заместительной терапии компонентами крови. Общее количество лейкоцитов и наличие бластных клеток в периферической крови необходимо для последующего стадирования, определения группы риска и назначения адекватной терапии 2.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз ОЛЛ ставится на основании обнаружения в пунктате костного мозга более 25% лейкемических клеток, для которых морфологически и цитохимически доказан один из вариантов лимфоидной дифференцировки. При этом в бластных клетках (по данным цитохимического исследования) отсутствует активность миелопероксидазы и неспецифической эстеразы, как ключевых маркёров нелимфоидных клеток-предшественников 1.
Костный мозг аспирируется из 3-х – 4-х анатомических точек. Для пункций используются передние и задние гребни крыльев подвздошных костей.
Морфологическая классификация ОЛЛ согласно группе ФАБ (Франко-Америко-Британская кооперативная Группа) на основании размеров, строения ядра, наличия включений и других признаков подразделяет лимфобласты на группы L1, L2 и L3. В настоящее время острый лейкоз со зрелым В-фенотипом (L3) относится к группе неходжкинских лимфом, и его диагностика и лечение должны проводиться согласно соответствующим клиническим рекомендациями 3.
Цитохимическое исследование опухолевых клеток является важным для дифференциальной диагностики с другими вариантами лейкемии. Обязательным является проведение двух цитохимических реакций – реакции на миелопероксидазу и реакции на неспецифическую эстеразу 4.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Мультипараметрическая проточная цитометрия, проводимая, с целью точного определения иммунофенотипа лейкемического клона занимает центральное место в диагностике ОЛЛ, являясь очень важным и обязательным методом для диагностики различных вариантов ОЛЛ, для стратификации на группы риска и для последующего определения минимальной резидуальной болезни (МОБ) 4. Различные иммунофенотипические варианты болезни представлены в таблице 1.
Таблица 1 – Иммунофенотипическая классификация ОЛЛ по EGIL (Европейская группа иммунодиагностики лейкозов), 1995 [8]
В-линейный острый лимфобластный лейкоз
CD19 + и/или CD79a + и/или СD22cyt +
Экспрессия не менее двух из трех пан-В-клеточных маркеров
Нет экспрессии других маркеров
Цитоплазматические цепи каппа + или лямбда +
Т-линейный острый лимфобластный лейкоз
CD2 + и/или CD5 + и/или CD8 +
Кортикальный Т-ОЛЛ (TIII)
Гамма/дельта + Т-ОЛЛ (б)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Цитогенетическое исследование лейкемических клеток должно включать в себя кариотипирование и исследование методом флуоресцентной in situ гибридизации (FISH) для выявления характерных перестроек. В настоящее время следующие транслокации однозначно имеют клиническое значение – t(9;22)(q34;q11) или BCR-ABL; t(4;11)(q21;q23) и t(12;21)(p13;q22) или TEL/AML1 [3-6, 9-12].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Исследование ликвора обязательно для подтверждения/исключения диагноза поражения ЦНС (нейролейкемии), что необходимо для точного определения группы риска и назначения адекватной терапии.
В результате анализа ликвора возможны следующие варианты:
Диагностическая люмбальная пункция должна проводиться только опытным врачом под общей анестезией с целью снижения риска травматичности и механического заноса бластных клеток периферической крови в ЦНС. Точная диагностика инициального поражения ЦНС возможна только путем приготовления цитопрепарата первичного ликвора на цитоцентрифуге. Оседание клеток ликвора на стекло естественным путём требует больше времени, что неизбежно приводит к деформации клеток, появлению артефактов и неправильной интерпретации данных [3, 4].
2.4 Инструментальная диагностика
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз опухолевой массы в переднем средостении ставится по прямому и правому боковому рентгеновским снимкам грудной клетки 3. Прямой и правый боковой рентгеновские снимки грудной клетки должны быть сделаны одновременно и до начала лечения.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: В случае выявления опухолевой массы в переднем средостении при рентгенографии грудной клетки необходимо провести КТ органов грудной полости с оценкой точных размеров опухолевой массы 1. По окончании индукционной терапии КТ проводится повторно для оценки степени уменьшения опухолевой массы в средостении.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Проведение УЗИ необходимо для оценки наличия поражения и размеров инфильтрированных паренхиматозных органов и лимфатических узлов брюшной полости, яичек, органов малого таза 3.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз инициального поражения яичек устанавливается на основании клинических данных и УЗИ. Биопсия яичка при подозрении на инициальное поражение не показана. Инициальное поражение яичек не влияет на стратификацию и выбор терапии; односторонняя или двухсторонняя орхиэктомия не предусмотрена 2.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Проведение КТ/МРТ головного мозга показано (при наличии неврологической симптоматики обязательно) для исключения/подтверждения инициального поражения ЦНС 2.
2.5 Иная диагностика
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Осмотр невролога показан всем пациентам с ОЛЛ на этапе инициальной диагностики для выявления/исключения признаков нейролейкемии – поражение ЧМН, очаговая симптоматика 2.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Осмотр офтальмолога с обязательным осмотром глазного дна показан всем пациентам с ОЛЛ на этапе инициальной диагностики для выявления/исключения лейкемической инфильтрации 3.
Учитывая необходимость проведения химиотерапии, пациентам с ОЛЛ помимо обязательных исследований, необходимых для установления диагноза, определения степени распространенности процесса и назначения адекватной терапии, на этапе первичной диагностики показано также проведение различных исследований, направленных на определение состояния различных органов и систем (профилактика развития токсических осложнений). Они включают в себя:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Учитывая необходимость проведения ПХТ, на начальном этапе очень важно определить функциональное состояние различных органов и систем с целью профилактики развития возможных токсических осложнений, т.к. в процессе терапии используются препараты, обладающие гепато-, нефро- и панкреатотоксическим действием. Особенно важно в первые дни терапии контролировать функцию почек (мочевина, креатинин, электролиты), т.к. возможно развитие синдрома острого лизиса опухоли (СОЛ). Степень риска развития СОЛ зависит от инициальной массы опухоли, состояния пациента на момент начала химиотерапии и индивидуальных особенностей метаболизма. Биохимический анализ крови с определением основных ключевых показателей обязательно выполняется до начала терапии; в дальнейшем кратность исследований определяется состоянием пациента и протоколом терапии [2-4, 14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Определение инициального состояния системы гемостаза необходимо всем пациентам с ОЛЛ, т.к. в процессе лечения используются препараты, обладающие прокоагулянтными свойствами (аспарагиназа, глюкокортикостероиды) [2-4, 14]. В процессе терапии исследование гемостаза проводится регулярно (сроки регламентируются протоколом терапии).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Определение инициального состояния сердечно-сосудистой системы необходимо всем пациентам с ОЛЛ, т.к. в процессе лечения используются препараты с выраженным кардиотоксическим действием (антрациклины). В процессе терапии ЭКГ и Эхо-КГ должны повторяться перед каждым введением антрациклинов [2-4, 14].
3. Лечение
3.1 Консервативное лечение
Лечение острого лимфобластного лейкоза осуществляется при помощи комбинаций цитостатических препаратов, вводимых р/о, в/в, в/м и интратекально при строгом соблюдении дозы, длительности и времени введения согласно выбранному терапевтическому протоколу [1-6, 9, 10]. Кроме того, для ряда пациентов в предусмотренных протоколом случаях проводится облучение центральной нервной системы [13, 15, 16]. Терапия должна быть начата как можно раньше, однако для начала терапии необходимо быть полностью уверенным в диагнозе и установить объем поражения 3. Для проведения эффективного лечения необходима адекватная сопроводительная и заместительная терапия [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Лечение должно осуществляется только в соответствии с одним из специально разработанных терапевтических протоколов, подробно регламентирующему дозы и комбинации химиопрепаратов, сроки введения, детали обследования и тактику проведения цитостатической и сопроводительной терапии [1-6, 10, 17, 18]. Дозы, сроки и длительность введения химиопрепаратов должны быть в строгом соответствии с выбранным терапевтическим протоколом. Замена препаратов, пропуски введения, изменение дозы, длительности или очередности введения препаратов не допускаются.
В России проводится лечение по протоколам группы BFM (ALL-BFM-95 или ALL-BFM-2000) или группы Москва-Берлин (ALL-MB-2002 или ALL-MB-2008), имеющим сравнимую эффективность [9, 18-22].
До начала терапии пациенты разделяются на группы риска – подгруппы пациентов с более низким и более высоким риском развития рецидивов заболевания, которое проводится на основании прогностических факторов, определенных при диагностике [1-6, 10-12, 18]. Различные терапевтические протоколы имеют несколько отличающиеся друг от друга критерии, определяющие группы риска, согласно которым пациенты получают различные варианты лечения, однако, в основном, больных разделяют на три группы риска: стандартный, промежуточный и высокий.
Современное лечение ОЛЛ состоит из нескольких основных фаз: индукция ремиссии с помощью 4 и более агентов, вводимых в течение 4-6 недель, мультиагентная консолидация («закрепление») ремиссии и поддерживающая терапия, как правило, антиметаболитами в течение 2-3 лет [1, 4, 6, 19, 21, 23]. Основные элементы и возможные используемые химиопрепараты представлены в таблице 2:
Таблица 2. Фазы терапии ОЛЛ и используемые химиопрепараты.
Фаза терапии
Набор химиопрепаратов
преднизолон или дексаметазон, винкристин, даунорубицин, аспарагиназа, циклофосфамид, цитарабин, 6-меркаптопурин.
6-меркаптопурин, метотрексат, аспарагиназа
дексаметазон, аспарагиназа, доксорубицин, винкристин, циатрабин
Имеются убедительные доказательства увеличения эффективности терапии при использовании как минимум 4-компонентной индукционной терапии (глюкокортикостероид, винкристин, антрациклины и аспарагиназа) [1, 9, 10, 12, 18].
Индукция ремиссии у пациентов с ОЛЛ должна проводиться в стационарных условиях. При лечении больного с ОЛЛ необходимо быть готовыми к развитию тяжелых осложнений, требующих безотлагательной интенсивной терапии.
Оценка эффективности терапии проводится на 8, 15 день и по окончании индукции. На 8 день оценивается количество бластных клеток в периферической крови после циторедуктивной профазы. На 15 день – количество бластных клеток в костном мозге. По окончании индукционной терапии оценивается достижение ремиссии – количество бластных клеток в костном мозге, наличие/сохранение экстрамедуллярных очагов. Ликвор оценивается каждый раз при проведении люмбальной пункции. Пациенты, не достигшие ремиссии после индукционной терапии, переводятся в группу высокого риска [1-6, 11].
Пациенты, достигшие ремиссии после индукционной терапии, далее получают консолидирующую терапию в зависимости от выбранного терапевтического протокола. Терапия консолидации при отсутствии осложнений может проводиться в условиях стационарного одного дня. Если терапевтический протокол предусматривает использование высоких доз метотрексата (протоколы BFM), они должны проводиться в условиях круглосуточного стационара. Консолидирующая терапия, как правило, состоит из нескольких фаз (протоколы МВ: фазы S1, S2, S3; протоколы BFM – фаза II протокола I, протокол М, II протокол). Перед началом каждого этапа обязательно исследование общего анализа крови, биохимического анализа крови. Площадь поверхности тела для расчета доз лекарственных препаратов пересчитывается заново перед началом каждой фазы консолидирующей терапии. Условия начала отдельных этапов консолидации прописываются в каждом терапевтическом протоколе и могут несколько отличаться. Обязательным является сохранение клинико-гематологической ремиссии, отсутствие признаков инфекции и отсутствие цитопении в периферической крови [1-4, 6, 14, 19, 21, 23].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Обязательным компонентом в лечении ОЛЛ является профилактика и лечение нейролейкемии. Основными методами профилактики и лечения нейролейкемии являются интратекальное введение химиопрепаратов (метотрексат, цитарабин, преднизолон) в возрастных дозировках и краниальное облучение в ранние сроки от начала лечения. Краниальное облучение имеет непосредственные и отдаленные побочные эффекты, поэтому в современных протоколах оно используется только для небольшой четко выделенной подгруппы пациентов промежуточного/высокого риска [1, 9,13, 15, 16, 24].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Поддерживающая терапия проводится до достижения общей длительности терапии 2 года. Поддерживающая терапия состоит из ежедневного перорального приема 6-меркаптопурина с еженедельным введением метотрексата (в/м или р/о в зависимости от терапевтического протокола) [1-4, 6, 9, 10, 20, 27]. Обязательным условием адекватного проведения поддерживающей терапии является своевременная коррекция дозировки 6-меркаптопурина и метотрексата в зависимости от количества лейкоцитов. Задачей является такая юстировка доз, прежде всего 6-меркаптопурина, чтобы лейкоциты стабильно держались в пределах от 2 000 до 3 000/мкл, не допуская как развития аплазии, так и увеличения лейкоцитов выше 3 000-3 500/мкл.
Протоколы серии Москва-Берлин предусматривают также проведение реиндукций (дексаметазон + винкристин), каждые 6 недель поддерживающей терапии. На первых трех реиндукциях проводятся интратекальные введения 3-х химиопрепаратов. Больным, которым проводилось краниальное облучение, интратекально вводятся только 2 препарата – метотрексат не вводится 20.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Пациенты, определенные в группу высокого риска, по завершении индукционной терапии, получают интенсивную высокодозную полихимиотерапию, представляющую собой короткие последовательные курсы интенсивной ПХТ – «блоки». В зависимости от наличия показаний, совместимого донора и достижения ремиссии, пациентам проводится трансплантация гемопоэтических стволовых клеток (ТГСК) в максимально ранние сроки [1-4, 6, 10, 20, 21, 23].
Терапия пациентов группы высокого риска проводится только в условиях круглосуточного стационара. Перед началом каждого блока высокодозной химиотерапии обязательно исследование общего анализа крови, биохимического анализа крови, исследование функции почек (клиренс по эндогенному креатинину), регистрация ЭКГ. Площадь поверхности тела для расчета доз лекарственных препаратов пересчитывается заново перед началом каждого блока. Оценка статуса ремиссии проводится перед началом каждого блока химиотерапии.
Терапия должна начинаться как можно быстрее, что особенно важно для первых трех терапевтических элементов. Временные промежутки между элементами определяются выходом из аплазии, общим состоянием пациента и объективно регистрируемой органной токсичностью. Минимальный промежуток между началом двух последовательных терапевтических элементов составляет 21 день. Редукция доз не предусмотрена. В случае необходимости сроки введения конкретного препарата сдвигаются или он отменяется. Терапевтический элемент не должен прерываться.
Для адекватного выполнения терапевтического протокола необходимо строгое соблюдение принципов сопроводительной терапии, которые подробно описаны в каждом терапевтическом протоколе и зависят от применяемой химиотерапии. Однако, существуют «общие» рекомендации, которые включают в себя следующее [14]:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Наличие центрального венозного катетера, обеспечивающего возможность мониторинга ЦВД, частых заборов крови и высокую скорость введения жидкостей является абсолютно необходимым на начальных этапах терапии и у пациентов группы высокого риска, получающих интенсивную высокодозную химиотерапию.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Синдром острого лизиса опухоли (СОЛ) – это комплекс метаболических расстройств в результате массивного распада опухолевых клеток и высвобождения в плазму и периферические ткани внутриклеточного содержимого и метаболитов. В основе патофизиологии и клинической картины СОЛ лежат нарушения метаболизма и экскреции калия, кальция, фосфатов и мочевой кислоты. Наиболее часто СОЛ развивается в течение первых 4-х дней после начала ПХТ, однако, описаны случаи и более позднего, до седьмого дня, дебюта синдрома. Степень риска развития СОЛ зависит от инициальной массы опухоли, состояния пациента на момент начала химиотерапии и индивидуальных особенностей метаболизма [14].
Учитывая более низкую растворимость мочевой кислоты в кислой среде, необходимо обеспечить поддержание нейтрального или слабощелочного рН мочи: NaHCO3 60 ммоль на литр инфузии (60 мл 7,5% раствора соды, либо 100-120 мл 4% раствора соды) добавить к постоянной инфузии (или 100-200 ммоль/м 2 /сутки параллельной инфузией). Регулирование необходимого объёма NaHCO3 соответственно pH мочи.
Всем пациентам в первые дни терапии (5-8 дней) показано назначение аллопуринола в дозе 10 мг/кг в сутки в 2-3 приема (предельно допустимая суточная доза – 500 мг/сутки) [14].
При наличии большой массы лейкемических клеток и/или выраженной органомегалии первая доза глюкокортикостероидов для профилактики СОЛ должна составлять 1 /10 – 1 /6 от суточной дозы.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Ко-тримоксазол (Сульфаметоксазол + Триметоприм) 3 раза в неделю в один прием в дозе 5 мг/кг по триметоприму или 20 мг/кг по сульфаметоксазолу per os. (кроме периодов проведения высокодозного метотрексата) [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Лихорадкой у больного с нейтропенией (нейтрофилы 38,5 0 С или несколько подъемов (3 – 4 раза в сутки) до 38 0 С. Принимая во внимание высокий риск фатального исхода у больного с инфекцией, лихорадку у такого пациента с нейтропенией, развившую в ходе миелосупрессивной полихимиотерапии, следует расценивать как наличие инфекции, что требует немедленного начала эмпирической антибактериальной терапии и проведения обследования с целью уточнения характера инфекции.
При выборе стартовой комбинации антибиотиков необходимо учитывать результаты повторных бактериологических исследований в данной клинике у других пациентов; длительность текущей нейтропении, предшествующий курс химиотерапии; инфекционный анамнез больного, предшествующие курсы антибиотиков и их эффективность; наличие клинической симптоматики [14].
Эффективность стартовой антибактериальной терапии положено оценивать через 24-36 часов для того, чтобы судить о её достаточности, однако всегда необходим повторный с интервалами 8-12 часов детальный осмотр такого больного с оценкой стабильности гемодинамики и степени интоксикации, появления новых инфекционных очагов.
Антибактериальная терапия продолжается до разрешения нейтропении.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Имеются данные международных исследований о том, что необоснованное применение G-CSF может увеличивать риск рецидивов [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Во всех случаях, исключая пневмонию и дыхательную недостаточность, переливание эритромассы должно производиться при содержании гемоглобина ниже 70 г/л и гематокрите менее 0,3 или при наличии клинических симптомов анемического синдрома (сонливость, тахикардия, одышка). Доза переливаемой эритромассы – 10 мл/кг. При развитии инфекции эритромасса переливается при снижении гемоглобина ниже 100 г/л [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
3.2 Хирургическое лечение
3.4 Иное лечение
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Краниальное облучение имеет непосредственные и отдаленные побочные эффекты, поэтому в современных протоколах оно используется только для небольшой четко выделенной подгруппы пациентов промежуточного/высокого риска (в зависимости от рекомендаций выбранного терапевтического протокола). Краниальное облучение проводится по окончании консолидации, как правило, в дозе 12 Гр [1-4, 9, 13, 15-17, 24, 28].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: В зависимости от наличия показаний, совместимого донора и достижения ремиссии, пациентам группы высокого риска проводится трансплантация гемопоэтических стволовых клеток (ТГСК) в максимально ранние сроки [1-6, 9, 10, 17, 18, 20].
Проведение ТГСК показано всем больным высокого риска в 1-ой ремиссии и больным с рецидивами ОЛЛ (за исключением пациентов с поздними изолированными экстрамедуллярными рецидивами) при условии обнаружения родственного полностью совместимого (HLA-типирование высокого разрешения) донора. Поэтому всем пациентам HLA-типирование и инициация поиска донора должны проводиться сразу после стратификации пациентов в группу высокого риска.
Показаниями к ТГСК при первичном ОЛЛ у детей считаются: отсутствие ремиссии после индукционной терапии; транслокация (9;22)(q34;q11) или BCR/ABL; транслокация (4;11)(q21;q23) или MLL/AF4 [1-6, 9, 10, 17, 18, 20].
Пациентам, не достигшим ремиссии после проведения индукционной терапии, облигатно показана аллогенная ТГСК любого типа (в зависимости от доступности доноров и от технических возможностей).
4. Реабилитация
Реабилитация детей с ОЛЛ в ремиссии должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации не только ребенка, но и его семьи к нормальной жизни. Такая реабилитация требует кроме медицинской помощи обязательного участия социальных работников, педагогов и психологов. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений химиотерапевтического лечения, сопутствующей патологии, социальных и психологических проблем.
Поддерживающая терапия проводится по месту жительства под наблюдением врача-педиатра (если есть должность, то врача-гематолога). Врач-педиатр (гематолог) по месту жительства руководствуется рекомендациями, данными специалистами учреждения, проводившего лечение.
5. Профилактика и диспансерное наблюдение
Периодичность лабораторных и инструментальных исследований, осмотров специалистов в период диспансерного наблюдения [29]:
Пациент снимается с диспансерного учета при условии окончания поддерживающей терапии, наличия полной ремиссии, отсутствия сопутствующих заболеваний и по истечении 5 лет после окончания лечения [29].
6. Дополнительная информация, влияющая на течение и исход заболевания
Вакцинация [29]:
Возможность пребывания в организованном коллективе:
Возможность нагрузок и занятий спортом:
Отношение к рождению детей – Никаких ограничений нет. Риск развития ОЛЛ у потомства минимален.
Критерии оценки качества медицинской помощи
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнена пункция костного мозга (при установке диагноза)
Выполнено цитологическое исследование мазка костного мозга (подсчет формулы костного мозга) и цитохимическое исследование препарата костного мозга (при установке диагноза)
Выполнено иммунофенотипирование бластных клеток костного мозга с помощью проточной цитометрии (при установке диагноза)
Выполнено цитогенетическое исследование и/или молекулярно-генетическое исследование бластных клеток костного мозга (при установке диагноза)
Выполнена спинномозговая пункция (при установке диагноза)
Выполнено исследование спинномозговой жидкости (определение цитоза, белка, глюкозы, цитологическое исследование) (при установке диагноза)
Выполнена рентгенография органов грудной клетки (при установке диагноза)
Выполнены ультразвуковое исследование органов брюшной полости (комплексное) и ультразвуковое исследование забрюшинного пространства (при установке диагноза)
Выполнена компьютерная томография головы и/или магнитно-резонансная томография головного мозга (при установке диагноза в случае наличия неврологической симптоматики)
Выполнена повторная пункция костного мозга на 15 день индукционной терапии и не позднее 40 дня от момента начала индукционной терапии
Выполнено цитологическое исследование мазка костного мозга (подсчет формулы костного мозга) на 15 день индукционной терапии и не позднее 40 дня от момента начала индукционной терапии
Выполнена повторная рентгенография органов грудной клетки не позднее 40 дня от момента начала индукционной терапии (при наличии инициального поражения средостения)
Выполнен общий (клинический) анализ крови развернутый с подсчетом лейкоцитарной формулы не реже 1 раза в 7 дней (при поддерживающей терапии)
Выполнена коррекция доз меркаптопурина и метотрексата в зависимости от количества лейкоцитов в общем (клиническом) анализе крови развернутом не реже 1 раза в 7 дней (при поддерживающей терапии)
Выполнен анализ крови биохимический общетерапевтический (аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтранспептидаза, билирубин, общий белок, альбумин, глюкоза) не реже 1 раза в 3 месяца (при поддерживающей терапии)
Выполнена консультация врачом-гематологом в профильной медицинской организации (при наличии медицинских показаний к трансплантации костного мозга)
Список литературы
Приложение А1. Состав рабочей группы
Конфликт интересов: отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Таблица П1 – Уровни достоверности доказательств
Уровень достоверности
Источник доказательств
Проспективные рандомизированные контролируемые исследования
Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных
Как минимум одно хорошо организованное рандомизированное контролируемое исследование
Репрезентативная выборка пациентов
II (2)
Проспективные с рандомизацией или без исследования с ограниченным количеством данных
Несколько исследований с небольшим количеством пациентов
Хорошо организованное проспективное исследование когорты
Мета-анализы ограничены, но проведены на хорошем уровне
Результаты не презентативны в отношении целевой популяции
Хорошо организованные исследования «случай-контроль»
III (3)
Нерандомизированные контролируемые исследования
Исследования с недостаточным контролем
Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками
Ретроспективные или наблюдательные исследования
Серия клинических наблюдений
Противоречивые данные, не позволяющие сформировать окончательную рекомендацию
IV (4)
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные
Таблица П2 – Уровни убедительности рекомендаций
Уровень убедительности
Описание
Расшифровка
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии. Рекомендуется мониторирование побочных явлений
Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или
нет убедительных данных ни о пользе, ни о риске)
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии
Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов
Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой
Порядок обновления клинических рекомендаций – пересмотр 1 раз в 3 года.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови – предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обусловливает основные симптомы заболевания. Кроме того, эти опухолевые клетки могут накапливаться в лимфоузлах, печени, селезенке, центральной нервной системе и других органах, также вызывая появление специфических симптомов.
Острый лимфобластный лейкоз (ОЛЛ) – самый распространенный вид лейкоза у детей и подростков, на его долю приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается чаще, чем у девочек. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «лимфобластный» означает, что незрелые клетки, составляющие основу болезни, являются лимфобластами, то есть предшественниками лимфоцитов.
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения. Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка. Дефицит полноценных лейкоцитов приводит к ослаблению иммунитета, развиваются частые инфекции с высокой температурой.
Распространяясь по организму, лейкемические клетки приводят не только к изменениям в составе крови. Так как лейкозные клетки заполняют костные полости и костный мозг, то появляются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Опухолевые клетки могут скапливаться в печени, селезенке и лимфатических узлах; могут наблюдаться боли в животе. В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы – нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
При ОЛЛ возникают изменения в обычном клиническом анализе крови: могут быть понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки, может быть увеличено количество лейкоцитов. Но для окончательной диагностики необходимо получить клетки костного мозга, для этой цели необходима костномозговая пункция.
При морфологическом исследовании диагноз «острый лимфобластный лейкоз» ставится при обнаружении более 25% бластных клеток в костном мозге. Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток). Дело в том, что важно не только диагностировать ОЛЛ, но и определить конкретный вариант ОЛЛ. Это важное условие для планирования терапии.
Как только диагноз лейкоза поставлен, для планирования терапии необходимо выяснить, насколько в процесс вовлечены другие органы, кроме костного мозга. Более точную информацию дают такие методы диагностики как ультразвуковое и рентгеновское исследование, магнитно-резонансная и компьютерная томография и др.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала (люмбальная пункция).
Перед лечением (и в процессе) у ребенка проверяют, как работает сердце (ЭКГ и ЭхоКГ) и головной мозг (электроэнцефалограмма). Комплексные лабораторные исследования помогают объективно оценить состояние ребенка и обнаружить нарушения обмена веществ или функций каких-либо органов. Эти изменения обязательно учитываются во время лечения. Для возможно необходимых переливаний крови устанавливают группу крови пациента.
Центральное место в лечении ОЛЛ занимает химиотерапия. У некоторых пациентов дополнительно облучается центральная нервная система и/или проводится трансплантация стволовых клеток. Цель лечения – по возможности полностью уничтожить лейкемические клетки во всем организме. Интенсивность и продолжительность химиотерапии, необходимость лучевой терапии и трансплантации, а также прогноз зависят от типа лейкоза, различных факторов и ответа на терапию.
Химиотерапия – это лечение медикаментами (цитостатики), которые блокируют деление клеток или убивают опухолевые клетки. Для наиболее эффективного лечения применяют различные комбинации препаратов.
Современное лечение ОЛЛ основано на разделении пациентов на группы риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно и внутримышечно, в условиях больничного стационара или стационара одного дня. Поддерживающая терапия представляет собой этап наименее интенсивного лечения, пребывание в больнице при этом не требуется (за исключением периода реиндукций).
Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. У некоторых пациентов используется и облучение головы – краниальное облучение.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске, поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
В числе побочных эффектов химиотерапии можно также назвать тошноту, рвоту, выпадение волос. У каждого из цитостатиков есть свои побочные эффекты. Чаще всего они возникают временно, но иногда сопровождают весь курс лечения.
Серьезная проблема связана с возможностью аллергических реакций на химиопрепараты, вплоть до анафилактического шока – жизнеугрожающего состояния, которое характеризуется отеком, затруднением дыхания, сильным зудом и т.д. Так, сравнительно часто встречается аллергия на аспарагиназу, и может быть необходимо использование аналогов этого препарата.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений.