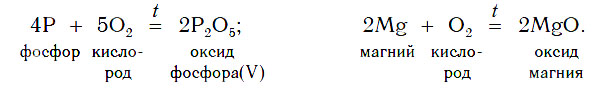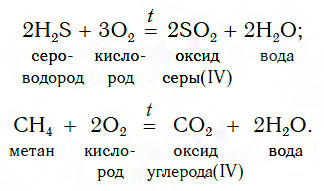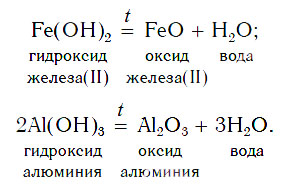оксиды в повседневной жизни человека сообщение
Значение оксидов в жизни человека
Оксиды – соединения элементов с кислородом.
Один из способов получения оксидов – реакция окисления (в частности, горения).
Содержание углекислого газа в атмосфере относительно невелико, всего 0,04—0,03%.
В воздухе, выдыхаемом человеком, углекислого газа 4%.
Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические — глюкозу, крахмал.
Просмотр содержимого документа
«Значение оксидов в жизни человека»
Значение оксидов в жизни человека
Работу выполнили Пестова Евгения и Королева Анна
Газ, необходимый растениям для фотосинтеза
Уравнение реакции фотосинтеза
6СО 2 +6Н 2 О=С 6 Н 12 О 6 +6О 2
ОКСИД ХРОМА Cr 2 O 3

Класс: 8
Презентация к уроку
Цель урока: сформировать у учащихся понятие бинарных соединений на примере оксидов.
Тип урока: урок изучения нового материала
Оборудование: коллекция горных пород: кварц, яшма, красный железняк, бурый железняк, магнитный железняк; дидактический материал (схемы: «Общая формула», «Название оксидов»), карточки-задания; компьютер, телевизор,
На ученических столах: коллекция «Известняки».
На классной доске: общая формула оксидов, формулы веществ, блоковая схема «Названия оксидов».
I. Организационный момент
II. Изучение нового материала
V. Домашнее задание
I. Организационный момент (1 мин)
Приветствие учителя. Проверка готовности класса к уроку. Психологический настрой класса. Отмечание отсутствующих.
II. Изучение нового материала (35 мин)
1. Подведение к теме урока.
Вступительное слово учителя с элементами беседы.
Добрый день ребята и уважаемые гости!
Мы продолжаем изучение соединений химических элементов. На предыдущих уроках мы познакомились с бинарными соединениями. Скажите, какие соединения называются бинарными? (соединения, которые состоят из двух элементов)
Формулы каких соединений не являются бинарными? (учитель снимает лишние формулы с доски).
Среди оставшихся формул найдите лишнюю формулу. Ответ объясните (СН4, так как в состав не входит кислород).
Что общего в оставшихся формулах?
1) Сложные вещества
2) Состоят из 2-х элементов
3) Одним из элементов является кислород (вывешивание терминов на доске)
Данные бинарные соединения относятся к классу веществ, называемых оксидами.
Тема нашего урока: «Оксиды. Важнейшие оксиды в природе и жизни человека». (Запись даты и темы урока в тетради (Слайд 1).
Сегодня мы посмотрим на оксиды глазами химика, биолога, медика, геолога, эколога. Мы обратимся к нашей периодической рубрике фотозагадок. Вы приятно удивитесь, оказывается, мы уже встречались с данными веществами, но не думали о том, что это оксиды. А ещё вы удивитесь поощрению вашей работы в конце урока.
Беседа с элементами объяснения, выполнение упражнения на доске и в тетради.
Теперь составим общую формулу для всех оксидов (на доске и в тетради):
Вернёмся к формулам оксидов.
Задание №1. (ученик у доски)
Определите степени окисления каждого элемента в формулах соединений:
Молодцы! С заданием справились. Можно идти дальше.
Объяснение учителя с элементами беседы. Выполнение упражнения на доске и в тетради.
Сейчас мы научимся давать названия оксидам. Названия оксидам можно дать несколькими способами (вывешивание схемы на доске, запись в тетради).
Первый способ: любой оксид называют оксидом с указанием названия элемента в родительном падеже. При этом если элемент имеет несколько степеней окисления, то это отражают в названии, ставя в скобках соответствующую римскую цифру.
Блоковая схема на доске
Название оксида =»оксид» + название элемента в родительном падеже + (степень окисления)
Какие элементы могут иметь несколько степеней окисления? (неметаллы, металлы побочных подгрупп)
Второй способ: названия оксидов зависят от числа атомов кислорода в формуле, которое указывается с помощью греческих числительных. Карточки с названиями греческих числительных вы можете увидеть у себя на столе.
Существуют и тривиальные названия оксидов.
Что вы слышали об этом оксиде? (приводит к образованию кислотных дождей)
Задание №2. (2 ученик у доски)
Дать названия оставшимся оксидам.
красный железняк (Данный оксид находится у вас на столах)
Итак, мы научились давать названия оксидам. Переходим вопросу о физических свойствах оксидов.
4. Физические свойства оксидов
Беседа с элементами объяснения. Самостоятельная работа с учебником, дополнительными источниками информации.
Физические свойства оксидов разнообразны. Среди них встречаются газы, жидкости и твёрдые вещества. (Составление схемы в тетради, Слайд 2)
— Приведите пример газообразного оксида? (углекислый газ) К какой группе оксидов мы его отнесём? (газообразные)
— Каким оксидом образована водная оболочка Земли? (водой) К какой группе оксидов мы её отнесём? (жидкие)
Среди оксидов очень много твёрдых веществ. Некоторые из них представлены у нас в лаборатории, например, оксид меди (II), алюминия, свинца (II). Многие твёрдые оксиды встречаются в природе в виде горных пород. У вас на столах находятся образцы природных оксидов. Аккуратно пододвиньте ящик с горными породами к себе. Соблюдая правила охраны труда, не трогайте их руками.
-Какие горные породы вы видите? (кварц, яшма, красный железняк, бурый железняк, магнитный железняк)
Познакомимся поближе с представителями каждой группы оксидов.
Сейчас каждый ряд получает формулу своего оксида.
1 ряд 2 ряд 3 ряд H2O CO2 Fe2O3
в) Физические свойства (агрегатное состояние, цвет, растворимость в воде)
г) Нахождение в природе
Для составления визитной карточки оксида используйте информацию, расположенную у вас на столах (Приложение 1). Проверка (Слайд 4-7).
Какой из этих оксидов является самым главным важным для нас в окружающем мире? (Вода)
Познакомимся с другими представителями оксидов.
Этот оксид стал важной причиной всемирного потепления климата, используется растениями в процессе фотосинтеза (углекислый газ).
Этот газ очень коварен, так как совершенно не имеет запаха. Образуется везде, где есть горение, даже в духовке при недостатке кислорода. О его присутствии нельзя узнать, пока не почувствуешь недомогание, а для отравления достаточно небольшого его количества (угарный газ).
IV. Закрепление (4 мин)
Выполнение самостоятельной работы. Взаимопроверка.
3. Степень окисления хлора в Cl2O7 равна +7.
5. Диоксид меди имеет формулу Cu2O.
7. Оксид углерода (IV) поддерживает горение.
1. Оксиды состоят из двух элементов.
5. Монооксид магния имеет формулу MgO.
7. Оксид углерода (II) используют для приготовления сухого льда.
Обменяйтесь листочками. Проверим ваши ответы. Правильные ответы высвечиваются на слайде (Слайд 17,18).
V. Заключение (4 мин)
Заключительное слово учителя.
Сегодня вы хорошо поработали.
V. Домашнее задание (1 мин)
Параграф 18 (учебник: Химия.8 класс. О.С.Габриелян.- М.: Дрофа.)
1) Составьте формулы оксидов по их названиям:
д) оксид фосфора (III);
2) Расшифруйте фразу: «Дела как сажа бела». Каким оксидом образована белая сажа? Вычислите массовые доли каждого элемента в белой саже.
Как оксиды воздействуют на природу и жизнь человека?
Оксидом является соединение, образованное двумя химическими элементами, один из которых кислород. Практически все элементы Периодической системы Менделеева Д. И. способны образовывать оксиды. Но оксиды Гелия, Неона, Аргона не получены. Наиболее известным и широко распространённым оксидом является вода. Она повсюду. Даже радуга – это результат преломления солнечных лучей в каплях воды.
Формулы оксидов
Элемент с постоянной валентностью образует один оксид. Например, у двухвалентного кальция оксид: CaO. Если у элемента переменная валентность, то он способен образовывать несколько оксидов. Примером являются окиды хрома: СrO, Сr2O3, СrO3.
Формула определяется в зависимости от валентностей составляющих элементов. Приведём пример для оксида серы.
1.Кислород двухвалентен. Сера черырёхвалентна. Пишем валентности над символами
IV II
химических элементов: SO.
2. Определяем наименьшее число, которое делится на 2 и 4. Таким числом является 4.
3. Определяем индекс возле серы: делим полученное число на значение валентности 4/4=1. Значит, индекс возле серы не пишем.
4. Этим же методом находим индекс возле кислорода: 4/2=2.
5. Получили формулу: SO2.
Интересное об оксидах
Причиной эффекта собачьей пещеры в Италии является оксид углерода СО2. Он тяжелее воздуха, поэтому получается так, что газ в пещере как раз покрывает собачью голову. Невысокие животные гибнут от удушья за несколько минут. А за счёт своего роста человек может легко пройти по ней.
В 1890 году парусное судно «Малборо» направлялось в Англию из Новой Зеландии. На борту было 23 члена экипажа и несколько пассажиров. В Англию судно не прибыло. Лишь через 23 года корабль появился вновь возле Огненной Земли. Шёл на всех парусах и оказался абсолютно не повреждённым. Оказывается, что причиной гибели людей стало извержение вулкана на острове Мартиника. Вулканические газы содержали 1,6% СО.
Появление кислот в атмосфере
Кислотные дожди появляются, когда с атмосферным кислородом и водяным паром соединяются оксиды серы и азота. Эти оксиды выбрасываются в окружающую среду металлургическими предприятиями, электростанциями, автомобильным транспортом. Полученные таким образом кислоты имеют вид дождя и разносятся ветром.
Оксид серы выбросов реагирует с водой, в результате образуется сернистая кислота:
SO2+H2O=H2SO3.
И взаимодействуя с кислородом воздуха, она частично превращается в серную кислоту:
2Н2SO3+О2=2Н2SO4.
Оксиды азота появляются в атмосфере в результате реакций азота и кислорода. Взаимодействие осуществляется при высоких температурах сгорания топлива
N2+O2=2NO
Но образуемое соединение быстро взаимодействует с кислородом:
2NO+O2=2NO2,
А полученный оксид азота реагирует с влагой из окружающей среды
2NO2+Н2О=НNO2+НNO3.
Сфера влияния кислотных дождей
Таким образом в воздухе появляются примеси кислот: серной, сернистой, азотной и азотистой. И эти примеси с осадками попадают на землю. Кислотные дожди негативно сказываются на росте растений, здоровье животных и людей.
В 1952 году непрозрачный туман охватил улицы Лондона, в результате чего погибло 4000 жителей. Частички смога раздражали дыхательные пути, а в лёгких появлялась слизь. Многие люди получили сердечные приступы с предшествующим тяжёлым кашлем. По оценкам учёных тот туман был более кислым, чем лимонный сок. Затем правительством было запрещено сжигать в городе топливо, образующее большое количество дыма. Это было сделано во избежание образования серной и азотной кислот.
Урожайность многих культур уменьшается на 3-8%, потому что листья повреждаются кислотами.
Изменяется состав воды в озёрах и ставках. В результате погибает рыба и многие виды насекомых. Исчезают птицы и животные, которые ими питаются. У улиток истончается карбонатная раковина, которая защищает их. В результате они гибнут. Также разрушаются ракушки обитателей водоёмов. Это негативно сказывается на экосистемах.
Кроме того кислотные дожди увеличивают коррозию металлов, разрушают мрамор и известняк.
После того, как был определён вред подобных дождей, в развитых странах стали устанавливать улавливатели, не пропускающие кислотные оксиды в воздух.
Основные, кислотные, амфотерные оксиды и их свойства, получение
Получение оксидов происходит с помощью различных способов. Из наиболее простых
2H2 + O2 = 2H2O
Существуют основные и кислотные оксиды. Они различаются тем, что при взаимодействии оксида с водой образуется либо кислота, либо основание. Эти реакции относят к реакциям соединения:
1. Основные оксиды и кислотные оксиды способны взаимодействовать между собой:
СаО+SO3=CaSO4
2. Основные оксиды взаимодействуют с кислотами. Образуются соответствующая соль и вода:
CaO+H2SO4=CaSO4+H2O
3. Образуются соответствующая соль и вода и при взаимодействии кислотных оксидов со щелочами:
СО2+2NaOH=Na2CO3+H2O.
В химии существуют вещества, проявляющие двойственность свойств. Это подобные двуликому Янусу амфотерные оксиды. Выступают как в качестве кислотных, так и в качестве основных оксидов. Поэтому со щелочами они проявляют особенности, характерные для кислотных оксидов, а с кислотами – основных.
Применение оксидов
Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо.
Песок, состоящий преимущественно состоит из SiO2, используют при производстве стекла.
Некоторые оксиды являются основой для красок: ZnO – белой, Fe2O3 – коричневой, Cr2O3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.
Эти соединения могут как дарить жизнь, так и разрушать её. То есть значение оксидов в жизни человека и природе является довольно существенным.
Урок 33. Получение и применение оксидов
В уроке 33 «Получение и применение оксидов» из курса «Химия для чайников» узнаем как получать оксиды различными способами, а также познакомимся с широким спектром применения оксидов во всех отраслях промышленности и быта.
Получение оксидов
1. Взаимодействие простых веществ с кислородом
Некоторые оксиды образуются в результате сжигания в кислороде (или на воздухе) соответствующих простых веществ. Так можно получить оксиды углерода(IV), серы(IV), фосфора(V), магния и других неметаллов и металлов:
2. Взаимодействие сложных веществ с кислородом
Оксиды можно получать также сжиганием в кислороде (или на воздухе) некоторых сложных веществ, например:
3. Термическое разложение нерастворимых оснований
Применение оксидов
Один из наиболее широко использующихся оксидов — вода H2O, о применении которой в быту, технике и ромышленности вы уже знаете.
Разнообразное применение находят и некоторые другие оксиды. Так, например, из оксида железа(III) Fe2O3, входящего в состав железных руд, в промышленности получают железо, а из оксида алюминия Al2O3 — алюминий. Оксид алюминия применяют также для изготовления искусственных драгоценных камней — рубина и сапфира. Мелкие кристаллы этого оксида применяются также в производстве наждачной бумаги.
Оксид углерода(IV) (углекислый газ) используют в пищевой промышленности для изготовления всех газированных напитков, для увеличения срока сохранности фруктов и овощей. Этим веществом наполняют углекислотные огнетушители. Твердый оксид углерода(IV) под названием «сухой лед» (рис. 117) применяют для хранения мороженого, для сильного охлаждения различных материалов.
Достаточно широко используется и оксид серы(IV) SO2 (сернистый газ). Он находит применение в производстве серной кислоты, для дезинфекции складских помещений, уничтожения вредных насекомых и бактерий, отбеливания бумаги.
Оксид кремния(IV) SiO2 в виде кварцевого песка используется в производстве стекла и бетона. Вместе с оксидом свинца(II) PbO он применяется для изготовления полудрагоценных камней и украшений («кристаллы Сваровски»).
Оксид кальция СaO под названием «негашеная известь» применяют при изготовлении различных строительных материалов. Оксиды некоторых других металлов находят применение в производстве красок. Так, например, Fe2O3 используют для изготовления краски коричневого, Сr2O3 — зеленого, ZnO и TiO2 — белого цветов.
Краткие выводы урока:
Надеюсь урок 33 «Получение и применение оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Оксиды. Классификация, свойства, получение, применение.

Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:

CO2 – оксид углерода (IV)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):


Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:


Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: 
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: 


Применение оксидов

Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.