ochrobactrum anthropi что это
Передача Achromobacter от пациента к пациенту и устойчивость к антибиотикам при муковисцидозе
Achromobacter – разновидность бактерий, которые являются важным источником хронических легочных инфекций у людей с муковисцидозом (МВ). В своем докладе ученые из Дании показывают доказательства передачи бактерий от пациента к пациенту и возникновение у них устойчивости к антибиотикам.
Большинство людей с МВ живут с хроническими бактериальными инфекциями в дыхательных путях из-за проблем со слизью и ее очищением. Наиболее частым возбудителем этих инфекций является синегнойная палочка.
Но недавние исследования показывают, что некоторые виды бактерий Achromobacter все чаще обнаруживаются у пациентов с МВ и связаны с устойчивостью к антибиотикам и приводят к более тяжелым заболеваниям.
Однако мало что известно о передаче этой бактерии и ее устойчивости к антибиотикам среди пациентов.
Команда под руководством исследователей из Центра геномной медицины в Копенгагене провела анализ ДНК бактерий Achromobacter, выделенных у 51 пациента с МВ. Их цель состояла в том, чтобы лучше понять, как распространяются эти патогены и насколько они устойчивы к лечению.
Перед этим исследованием все изоляты были идентифицированы как Achromobacter xylosoxidans с использованием обычных микробиологических методов.
Чтобы исследовать передачу от пациента к пациенту, результаты генома сравнивали для выявления конкретных бактерий со связанным общим предком (тот же клональный тип). Близкородственные бактерии одного вида будут иметь меньше генетических вариаций, чем более отдаленные родственные бактерии того же вида – это и может означать передачу бактерий от пациента к пациенту. В результате анализа было обнаружено 16 случаев подозрения на передачу инфекции от пациента к пациенту, которые были исследованы дополнительно.
Из 14 случаев подозрения на передачу с полной филогенетической информацией в 12 случаях подтвердили передачу от пациента к пациенту, поскольку было обнаружено, что бактерии одного пациента произошли от бактерий другого пациента.
Чтобы подтвердить это генетическое свидетельство передачи, исследователи искали частичное совпадение посещений пациентами клиники. Из 16 пар пациентов с подозрением на передачу инфекции все, кроме одной пары пациентов с микробиологическим анализом, находились в одной больничной палате в один и тот же день.
«Чем больше дней пациенты могли контактировать, тем больше была вероятность передачи, чем у пациентов без передачи», – написала команда исследователей.
В целом, 15 из 16 случаев подозрения на передачу инфекции от пациента к пациенту были подтверждены генетическим анализом и филогенетическими или эпидемиологическими данными. A. ruhlandii типа клон AX01DK01 показал большинство передач, и он был обнаружен у 13 пациентов.
Чтобы исследовать устойчивость к антибиотикам были проведены стандартные диагностические измерения профилей чувствительности к антибиотикам, они были исследованы к 21 антибиотику для 92 изолятов. У 21 пациента с единичными изолированными образцами эти бактерии были устойчивыми или частично устойчивыми в среднем к 14 антибиотикам. У 30 пациентов образцы, которые были изолированы на раннем этапе, были устойчивы в среднем к 14 антибиотикам, в то время как те, которые были собраны позже, были устойчивы к 18 антибиотикам.
Статистический анализ показал, что бактерии, изолированные позже, значительно менее восприимчивы к антибиотикам (то есть более устойчивы к ним), чем ранние и отдельные изоляты. Почти все изоляты показали устойчивость или частичную устойчивость к девяти антибиотикам; пять показали некоторую эффективность. Ни один антибиотик не оказался эффективным против всех протестированных бактерий.
«[Мы] обнаружили геномную и эпидемиологическую составляющие передачи от пациента к пациенту у всех трех видов Achromobacter и предложили новую идентификацию разновидностей генов, которую следует учитывать при оценке предполагаемых случаев передачи инфекции между пациентами», – пишут исследователи.
«Наконец, мы показали, что устойчивость к антибиотикам развивается у всех трех видов Achromobacter».
Эти результаты, добавила команда, «позволяют нам лучше понять динамику устойчивости к антибиотикам и передачу Achromobacter от пациента к пациенту с МВ, что может помочь предсказать клиническое прогрессирование инфекций, вызванных ахромобактерией, и предотвратить инфицирование».
ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ ПОЧВЕННЫХ ДИАЗОТРОФОВ ИЗ РОДОВ OCHROBACTRUM И SPHINGOBACTERIUM
Азотфиксация является важнейшим звеном в глобальном цикле азота и наряду с фиксацией углекислого газа обеспечивает продуктивность биосферы в целом [1, с. 259]. Многие природные экосистемы лимитированы по доступным соединениям азота, что придает процессу азотфиксации особое значение в круговороте биогенных элементов. Традиционно основное внимание исследователей было направлено на изучение симбиотической азотфиксации в связи с ее значимостью для сельского хозяйства [6, с. 3]. Однако за последние годы было убедительно показано, что диазотрофия широко распространена среди прокариот, и микроорганизмы, способные фиксировать молекулярный азот, присутствуют практически во всех экосистемах, не связанных с агрокультурой. Именно способность к азотфиксации дает возможность прокариотам существовать в эконишах с крайне низким содержанием азота, а также обогащать окружающую среду азотными соединениями [7, с. 41]. Несмотря на большую экологическую и практическую значимость процесса азотфиксации, до настоящего времени остаются малоизученными вопросы, связанные с оценкой биоразнообразия, а также морфолого-культуральных и физиолого-биохимических свойств свободноживущих в природных экосистемах бактерий-диазотрофов. В связи с вышеизложенным, изучение особенностей природных изолятов бактерий-азотфиксаторов, выделенных из почв экологически неблагополучных регионов Крыма, является актуальной.
Культивирование микроорганизмов проводили в термостате в темноте при температуре 30 ± 1 °С в течение 3-4 суток. Из полученных первичных культур стандартными методами выделяли чистые культуры, характеризующиеся высокой интенсивностью роста на селективных питательных средах. Для идентификации выделенных штаммов использовали метод сравнительного анализа нуклеотидной последовательности генов 16S рРНК, с помощью которого установлено, что выделенные изоляты относятся к видам S phingobacterium multivorum (штамм № 802) и Ochrobactrum anthropi (штамм № 804).
При микрокопировании мазков выявлены одиночные или расположенные в виде коротких цепочек мелкие грамотрицательные умеренно подвижные палочки с закругленными концами, проявляющие нитрогеназную и каталазную активность.
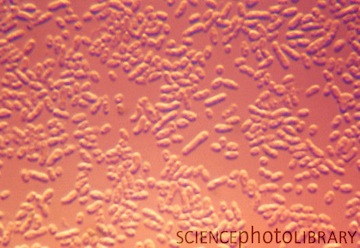
Оптимальная температура роста этих бактерий – +25-30 0 С, минимальная – +4 0 С. Для Sphingobacterium multivorum характерно умеренное образование внеклеточной слизи, а также отсутствие выраженной протеазной активности (желатин не разжижают, не выделяют сероводород). Бактерии штамма № 802 не разлагают твин 80 (полиэтилен гликоль), не гидролизуют крахмал и сахарозу; не растут в присутствии 2,5–6 % NaCl; не проявляют уреазную активность.
Рис.1. Рост колоний Ochrobactrum anthropi на поверхности МПА.
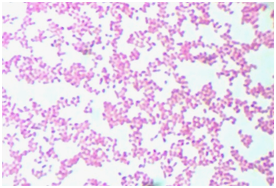
При микрокопировании мазков выявлены одиночные или расположенные в виде коротких цепочек мелкие грамотрицательные подвижные (перитрихи) палочки с закругленными концами (рис. 2). Капсула вокруг клеток не заметна.
Рис. 2. Микропрепарат Ochrobactrum anthropi, окраска по Граму (900×)
Метаболизм Ochrobactrum anthropi аэробного типа, растут бактерии в диапазоне температур от +4 до +37 0 С. При нанесении на поверхность колоний 3 % перекиси водорода наблюдалось выделение пузырьков кислорода, что указывает на выраженную каталазную активность данных микроорганизма. На питательной среде Хью-Лейфсона исследуемые бактерии окисляли D-глюкозу. При проведении биохимических тестов по утилизации углеводов установлено, что бактерии Ochrobactrum anthropi, штамм № 804 ферментировали L-(+)-арабинозу, а также утилизировали L-(+)-рамнозу, D-(+)-рафинозу, D- (+)-галактозу и сахарозу, но не разлагали D-(+)-лактозу. D-(-)-фруктозу, D-(+)-ксилозу, D-(+)-мальтозу (рис. 3).
Рис. 3. Биохимические тесты по утилизации углеводов Ochrobactrum anthropi
Бактерии Ochrobactrum anthropi, штамм № 804 окисляли только этиловый спирт, но не разлагали дульцит, D-(+)-сорбит и D-(-)-маннитол; росли в присутствии цитрата натрия и 2,5% NaCl, т.е. проявляли умеренную галофильность; осуществляли гидролиз крахмала, но не утилизировали твин 80; индол не образовывали; наличие протеолитической активности при росте в жидких питательных средах на основе горохового экстракта с добавлением пептона и тиосульфата натрия проявлялось в выделении H2S и гидролизе желатина; обладали выраженной каталазной, уреазной и нитрогеназной активностью, а также способностью к образованию нитритов.
Максимальная интенсивность роста Ochrobactrum anthropi отмечена на питательной среде Калининской с добавлением мелассы и микроэлементов (30×10 10 КОЕ), минимальная – на среде Федорова без добавления мелассы и микроэлементов (15×10 10 КОЕ).
Рис. 4. Тест на наличие уреазы у Ochrobactrum anthropi
Оба исследованных штамма не обладают фитотоксичностью (не подавляют всхожесть семян, не ингибируют развитие корней и надземных вегетативных органов растений).
В ходе проведенных экспериментов установлено, что бактерии Ochrobactrum anthropi № 804 способны разлагать 2 % глифосат (N-(фосфонометил)-глицин, C3H8NO5P) – неселективный системный гербицид, использующийся для борьбы с сорняками, особенно многолетними. Этот препарат занимает среди гербицидов первое место в мире по производству. В России он известен под торговыми названиями «Раундап», «Глисол», «Торнадо» и «Ураган» [5, с. 50]. Глифосат применяется на посевах широкого спектра сельскохозяйственных культур, в садах и парках, в водном и лесном хозяйстве, на различных стадиях роста: до всходов и после всходов сельскохозяйственных культур (в качестве гербицида) и перед сбором урожая (в качестве десиканта) [2, с. 87]. Хотя производители приводят доказательства безопасности гербицидов на основе глифосата, независимыми исследователями было показано, что этот препарат изменяет почвенную экосистему, влияя на состав и активность микрофлоры, увеличивает восприимчивость культурных растений к болезням, способствует аккумулированию тяжелых металлов в водных экосистемах, оказывая вредное воздействие на гидробионтов. При попадании в организм млекопитающих он приводит к нарушениям функций ряда органов. Глифосат, накапливаясь в почве вследствие сорбции и миграции, может сохраняться в ней в течение нескольких лет [8, с. 6].
Наличие активных ферментных систем катаболизма устойчивых и токсичных соединений неприродного происхождения (ксенобиотиков, в частности таких гербицидов, как глифосат) в сочетании с их способностью к азотфиксации является основанием для включения Ochrobactrum anthropi, штамм № 804 в состав биопрепаратов, способствующие процессам биоремедиации почв и обогащению их доступными для растений соединениями азота.
Таким образом, идентифицированные как представители видов Sphingobacterium multivorum (штамм № 802) и Ochrobactrum anthropi (штамм № 804) изоляты бактерий, выделенные из степных почв Красноперекопского района Республики Крым, обладают выраженной способностью к азотфиксации. Изучение особенностей данных штаммов позволило выявить их основные морфолого-культуральные и физиолого-биохимические свойства, отличающие исследуемых бактерий от других родственных изолятов. Особый интерес представляет собой способность штамма Ochrobactrum anthropi к биодеструкции глифосата, поскольку известны лишь немногие штаммы-деструкторы, способные минерализовать данное соединение. Общая эффективность таких штаммов не всегда высока, поэтому поиск и выделение новых штаммов-деструкторов, таких как штамм № 804 Ochrobactrum anthropi, обладающих эффективным мультиэнзимным комплексом, является актуальным направлением оптимизации биологического земледелия.
Ochrobactrum anthropi
A Microbial Biorealm page on the genus Ochrobactrum anthropi
Contents
Classification
Higher order taxa
Bacteria (Domain); Proteobacteria (Phylum); Alphaproteobacteria (Class); Rhizobiales (Order); Brucellaceae (Family); Ochrobacterium (Genus); Ochrobacterium anthropi (Species)
Species
Description and significance
O. anthropi, formerly known as Achromobacter species (CDC group Vd), is a common soil alphaproteobacteria that colonizes a wide spectrum of organisms and is being increasingly recognized as a potentially problematic opportunistic and nosocomial human pathogen.[1] Though it is extremely rare for it to affect a healthy human, there have been numerous published cases being associated with the presence of indwelling medical devices, such as central venous catheters, drainage tubes, and intraperitoneal catheters. It is also characterized by a broad spectrum of antibiotic resistance.[2]
Genome structure
The 4.8-Mb genome of O. anthropi consists of two non-identical circular chromosomes. The genome has an average C+G content of 56.22% and together comprise 4,424 protein-coding genes (
Structure and Ecology
O. anthropi is a versatile alphaproteobacterium with ability to colonize an exceptionally wide variety of habitats, from hostile environments such as polluted soil, to water, plants, nematodes, insects, animals, and humans. [5] They are rod shaped, gram negative, and motile by means of peritrichous flagella.[6] After growth on nutrient agar, the colonies are about 1 μm in diameter, non-pigmented, circular, low convex, smooth, shining, and entire. The optimum temperature for growth is between 20 and 37˚C.[6]
Metabolism
O. anthropi organisms are obligately aerobic, possessing a strictly respiratory type of metabolism with O2 as the terminal electron acceptor. They are chemoorganotrophic, using various amino acids, organic acids, and carbohydrates as carbon sources and are both oxidase and catalase positive. They also reduce both nitrate and nitrite by assimilation.[3][6]
Pathology
References
1. Patrick S. G. Chain, Dorothy M. Lang, Diego J. Comerci, Stephanie A. Malfatti, Lisa M. Vergez, Maria Shin, Rodolfo A. Ugalde, Emilio Garcia, Marcello E. Tolmasky. Genome of Ochrobactrum anthropi ATCC 49288T a Versatile Opportunistic Pathogen and Symbiont od Several Eukaryotic Hosts. Journal of Bacteriology 2011. doi: 10.1128/JB.05335-11
2. Adrian Kettaneh, Francois-Xavior Weill, Isabelle Poilane, Oliver Fran, Michel Thomas, Jean-Louis Herrmann, Laurent Hocqueloux. Septic Shock Caused by Ochrobactrum anthropi in an Otherwise Healthy Host. J. Clin Microbiol 2003. doi: 10.1128/JCM.41.3.1339-1341.2003
3. Alnor D, Frimodt-Moller N, Espersen F, Frederiksen W. Infections with the Unusual Human Pathogens Agrobacterium Species and Ochrobactrum anthropi. Clinical Infectious Diseases 1994. doi: 10.1093/clinids/18.6.914
4. Mahmood MS, Sarwari AR, Khan MA, Sophie Z, Khan E, Sami S. Infective Endocarditis and Septic Embolization with Ochrobactrum anthropi: case report and review of literature. The Journal of Infection 2000. doi: 10.1053/jinf.2000.0644
5. Sara Romano, Fabian Aujoulat, Estelle Jumas-Bilak, Anges Masnou, Jean-Luc Jeannot, Envold Falsen, Helene Marchandin, Corinne Teyssier. Multilocus Sequence Typing Supports the Hypothesis that Ochrobactrum anthropi Displays a Human-Associated Subpopulation. BMC Microbiology 2009. doi: 10.1186/1471-2180-9-267
6. B. Holmes, M. Popoff, M. Kiredjian, M. Kersters. Ochrobactrum anthropi gen. nov., sp. nov. from Human Clinical Specimens and Previously Known as Group Vd. International Journal of Systematic and Evolutionary Microbiology 2012. doi: 10.1099/00207713-38-4-406
7. Genome View Ochrobactrum anthropi ATCC 49188 chromosome 1. Gene Trek in Prokaryote Space (GTPS). DNA Data Bank of Japan.
8. Genome View Ochrobactrum anthropi ATCC 49188 chromosome 2. Gene Trek in Prokaryote Space (GTPS). DNA Data Bank of Japan.
9. Soil. Food crumbs blog.
10 Endocarditis. The Society for Cardiovascular Angiography and Interventions.
Активность антибактериальных средств in vitro
Грамотрицательные неферментирующие микроорганизмы широко распространены в окружающей среде. Одной из серьезных проблем является диагностика вызванных ими инфекций, связанная с объективными трудностями их выделения и идентификации. Второй проблемой является то, что для них характерна полирезистентность к антимикробным препаратам, включая те, которые обычно активны против Pseudomonas aeruginosa.
В данном исследовании определялась антибактериальная активность in vitro различных препаратов по отношению к 177 выделенным в клинике штаммам неферментирующих бактерий (кроме Pseudomonas aeruginosa и Acinetobacter spp.). МПК определялась методом разведений в агаре. Использовали среду Мюллера-Хинтона. Оценивали активность ампициллина, пиперациллина, пиперациллин/тазобактама, сульбактама, цефоперазона, цефоперазон/сульбактама, цефтазидима, цефепима, азтреонама, имипенема, меропенема, колистина, гентамицина, амикацина, триметоприм/сульфаметоксазола, хлорамфеникола, эритромицина, рифампицина, норфлоксацина, ципрофлоксацина и миноциклина.
У 7 изолятов: Sphingobacterium multivorum(2), Sphingobacterium spiritivorum(1), Empedobacter brevis(1), Weeksella virosa(1), Bergeyella zoohelcum(1) и Oligella urethralis (1), вместо чувствительности к цефоперазону или сульбактаму определяли чувствительность к амоксициллин/клавуланату и ампициллин/сульбактаму.
Полирезистентность к антибактериальным препаратам была характерна для таких возбудителей, как Stenotrophomonas maltophilia, Burkholderia cepacia, Chryseobacterium spp., Myroides spp., Achromobacter xylosoxidans и Ochrobactrum anthropi.
В то же время, такие микроорганизмы, как Pseudomonas stutzeri, Shewanella putrefaciens-algae, Sphingomonas paucimobilis, Pseudomonas oryzihabitans, Bergeyella zoohelcum, Weeksella virosa и Oligella urethralis часто были чувствительны к большинству из тестируемых антибиотиков.
Учитывая, что различные виды возбудителей, образующих группу грамотрицательных неферментирующих микроорганизмов, демонстрируют различные показатели антибиотикорезистентности, для выбора оптимальной схемы лечения требуется проведение микробиологического исследования с идентификацией возбудителя и выявления показателей его антибиотикорезистентности. Феномен полирезистентности, характерный для ряда возбудителей, требует активной разработки новых антибактериальных средств или поиска новых комбинаций антибиотиков, обладающих синергизмом бактерицидного действия по отношению к данным микроорганизмам.
«In vitro» activity of different antimicrobial agents on Gram-negative nonfermentative bacilli, excluding Pseudomonas aeruginosa and Acinetobacter spp. (Vay C.A., Almuzara M.N., Rodriguez C.H., Pugliese M.L., Lorenzo Barba F., Mattera J.C., Famiglietti A.M. Rev. Argent Microbiol., 2005;37(1):34-45).
Код вставки на сайт
Активность антибактериальных средств in vitro
Грамотрицательные неферментирующие микроорганизмы широко распространены в окружающей среде. Одной из серьезных проблем является диагностика вызванных ими инфекций, связанная с объективными трудностями их выделения и идентификации. Второй проблемой является то, что для них характерна полирезистентность к антимикробным препаратам, включая те, которые обычно активны против Pseudomonas aeruginosa.
В данном исследовании определялась антибактериальная активность in vitro различных препаратов по отношению к 177 выделенным в клинике штаммам неферментирующих бактерий (кроме Pseudomonas aeruginosa и Acinetobacter spp.). МПК определялась методом разведений в агаре. Использовали среду Мюллера-Хинтона. Оценивали активность ампициллина, пиперациллина, пиперациллин/тазобактама, сульбактама, цефоперазона, цефоперазон/сульбактама, цефтазидима, цефепима, азтреонама, имипенема, меропенема, колистина, гентамицина, амикацина, триметоприм/сульфаметоксазола, хлорамфеникола, эритромицина, рифампицина, норфлоксацина, ципрофлоксацина и миноциклина.
У 7 изолятов: Sphingobacterium multivorum(2), Sphingobacterium spiritivorum(1), Empedobacter brevis(1), Weeksella virosa(1), Bergeyella zoohelcum(1) и Oligella urethralis (1), вместо чувствительности к цефоперазону или сульбактаму определяли чувствительность к амоксициллин/клавуланату и ампициллин/сульбактаму.
Полирезистентность к антибактериальным препаратам была характерна для таких возбудителей, как Stenotrophomonas maltophilia, Burkholderia cepacia, Chryseobacterium spp., Myroides spp., Achromobacter xylosoxidans и Ochrobactrum anthropi.
В то же время, такие микроорганизмы, как Pseudomonas stutzeri, Shewanella putrefaciens-algae, Sphingomonas paucimobilis, Pseudomonas oryzihabitans, Bergeyella zoohelcum, Weeksella virosa и Oligella urethralis часто были чувствительны к большинству из тестируемых антибиотиков.
Учитывая, что различные виды возбудителей, образующих группу грамотрицательных неферментирующих микроорганизмов, демонстрируют различные показатели антибиотикорезистентности, для выбора оптимальной схемы лечения требуется проведение микробиологического исследования с идентификацией возбудителя и выявления показателей его антибиотикорезистентности. Феномен полирезистентности, характерный для ряда возбудителей, требует активной разработки новых антибактериальных средств или поиска новых комбинаций антибиотиков, обладающих синергизмом бактерицидного действия по отношению к данным микроорганизмам.
Проблема стерильности интубационных трубок
Улучшение результатов лечения больных в критических состояниях (КС), повышение выживаемости пациентов, обусловленные внедрением новых медицинских технологий и прежде всего, прогрессивных методов искусственной вентиляции легких (ИВЛ), в тоже время породили новые формы госпитальных инфекций в т.ч. связанных с поражением легких.
В исследованиях многочисленных авторов дан анализ всего спектра причин возникновения ВАП, но мало внимания уделено такому источнику инфекционных осложнений, как медицинский персонал. В своей работе мы хотели обратить внимание на такой путь возникновения госпитальной инфекции (ГИ), как повторное использование эндотрахеальных трубок и трахеостомических канюль. Эта проблема мало отражена в доступной литературе.
В связи с этим ЦЕЛЬЮ исследования было:
— убедиться в степени устойчивости материалов эндотрахеальных и трахеостомических трубок, длительно находящихся в просвете дыхательных путей пациентов, к проникновению нозокомиальной микрофлоры;
— оценить надежность методик обработки и обеззараживания трубок, применяемых при их повторной стерилизации.
УСЛОВИЯ выполнения работы:
ЭТАПЫ исследования:
Исследование начиналось в момент принятия решения о плановой замене эндотрахеальной/ трахеостомической трубки или смене эндотрахеальной трубки на трахеостомическую.
Перед удалением эндотрахеальной/трахеостомической трубки выполнялись:
1) посев со слизистой ротоглотки пациента (верхние дыхательные пути).
2) посев с внутренней поверхности трубки на микрофлору;
3) трубка помещалась на 12 часов в накопитель с моющим комплексом и 6% раствором перекиси водорода;
4) по окончании 12 часового интервала трубка тщательно промывалась в проточной воде с механической обработкой внутренней поверхности щеткой;
5) дезинфекция: экспозиция в растворе « Деохлор» в течении 1часа;
6) стерилизация: 6% раствором перекиси водорода в течении 6 часов;
7) промывание стерильным изотоническим раствором NaCI
8) экспозиция в камере для хранения стерильных изделий “Панимед-1“, обеспечивающей постоянную готовность к работе за счет воздействия бактерицидных УФ ламп в течение 12 часов;
9) через 12 часов трубка вынимается из камеры, с соблюдением стерильности производится измельчение дистального отдела трубки. Измельченный материал помещается в питательную среду (тиогликолевую) и направляется на микробиологическое исследование;
10) микробиологическое исследование и идентификация культуры микрофлоры.
При проведении исследований строго соблюдались требования приказов Министерства Здравоохранения Российской Федерации №408 от 12.07.1989 г и №720 от 31.07.1978 г “О мерах по борьбе с внутрибольничными инфекциями”, а так же требования отраслевого стандарта 42-21-2-85.
Исследование проведено у 32 пациентов (21 мужчина и 11 женщин), в возрасте от 1,5 до 80 лет, находившихся в отделении реанимации на пролонгированной ИВЛ. Длительность ИВЛ составила от 6 до 27 суток. По виду основной патологии больные распределились следующим образом:
тяжелая черепно-мозговая травма – 16 пациентов;
распространенный перитонит различного генеза – 7 пациентов;
острое нарушение мозгового кровообращения – 3 пациента;
тяжелая политравма – 2 пациента;
восходящая полинейропатия – 1 пациент;
гнойный менингоэнцефалит – 1 пациент;
гнойная септическая пневмония – 1 пациент;
желудочное кровотечение – 1 пациент
Анализ микробиологической картины исследований у 32 больных показал следующее: на этапах микробиологического исследования выделено суммарно 37 различных штаммов микроорганизмов.
Микробиологическое исследование материала измельченных эндотрахеальных и трахеостомических трубок, прошедших предшествующую стерилизацию выявило рост микробной флоры в 6 случаях, что соответствует 19 % от общего числа исследованных интубационных трубок, причем в одном случае обнаружена ассоциация из 3 патогенных микроорганизмов. Всего выделено 7 возбудителей:
Staphylococcus kloosi, Burkholderia cepacia, Candida albicans, Candida krusei, Enterobacter cloacae, Stenotrophomona maltophilia, Micrococcus spp, причем последний выявлен в двух случаях у различных пациентов.
Кроме того, необходимо отметить, что за время проведения работы микробиологический пейзаж в ОРИТ претерпел существенную трансформацию. К окончанию исследования начали выделяться штаммы культур которые на первом этапе не выделялись, причем идентифицировано 10 новых микроорганизмов, высевавшихся как из ротоглотки, так и из интубационных трубок. В то же время, немалая часть возбудителей, активно идентифицировавшаяся в начале исследования, к концу работы из исследуемых материалов практически не выделялась.
— Результаты нашего исследования подтвердили, что при длительном нахождении эндотрахеальной/трахеостомической трубки в дыхательных путях пациентов с тяжелой патологией, создаются благоприятные условия, приводящие к неизбежной колонизации внутреннего просвета трубки патогенной микрофлорой.
— Стандартная методика обеззараживания повторно используемых одноразовых трубок не дает ожидаемого эффекта и в 19% случаев дает рост возбудителей, эндемичных для данного отделения.
— Микрофлора, высеваемая из дыхательных путей пациента, эндотрахеальных трубок, трахеостомических канюль, в большинстве случаев (66,7%) неидентична микрофлоре выделенной с материалов после их обработки, что свидетельствует также о возможности загрязнения трубок и канюль в процессе их хранения.
— Микробиологический пейзаж отделения реанимации отличается динамизмом и требует постоянного мониторирования.
Добавить статью
Хотите поделиться информацией или может стать автором на нашем сайте? Добавляйте свои статьи и они обязательно будут опубликованы на нашем портале после проверки модератором. Самые лучшие авторы будут приняты в наш проект!