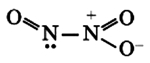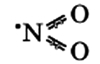no2 с чем реагирует
Оксид азота IV: получение и химические свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения
1. Оксид азота (IV) образуется при окислении оксида азота (II) кислородом или озоном:
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Химические свойства
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
При нагревании выделяется кислород:
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
В присутствии кислорода образуются только нитраты:
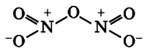
4. Оксид азота (IV) димеризуется :
Оксиды азота. Общая характеристика, химические свойства.
Важно знать, что все оксиды азота токсичны!
Более детально изучить химические свойства предлагаю при помощи таблицы, в которой собраны все необходимые реакции для сдачи ЕГЭ.
Солеобразующие оксиды азота
N2O5
с характерным острым запахом;
Хорошо растворяется в воде;
Хорошо растворяется в воде;
3) Получение в лаборатории
4) Получение в промышленности
5) Химические свойства
1) Разложение:
2) C кислотами:
3) С металлами:
4) С неметаллами:
В присутствии воды реакция идет (образование HNO3):
5) С солями:
6) С оксидами:
7) C основаниями:
2NO2 + 2KOH = KNO3 + KNO2 + H2O
1) Разложение:
2) С кислотами:
3) С металлами:
4) С неметаллами:
5) С солями:
6) С оксидами:
7) С основаниями:
1) Используется при производстве H2SO4 и HNO3;
2) Окислитель в жидком ракетном топливе;
4) Токсичен, вызывает отек легких.
1) Применение ограничено из-за взрывоопасной природы оксида азота (V);
2) Используется в качестве нитрующего агента (в органической химии).
Следующее занятие будет посвящено задачам по этой теме.
Оксид азота II: получение и химические свойства
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (II)
Оксид азота (II) NO – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
FeCl2 + NaNO3 + 2HCl → FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI → 2NO + I2 + 2H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Химические свойства
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (II) не реагирует:
Оксид азота(IV)
| Оксид азота(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(IV) |
| Химическая формула | NO2 |
| Физические свойства | |
| Состояние (ст. усл.) | бурый газ или желтоватая жидкость |
| Молярная масса | 46,0055 г/моль |
| Плотность | г. 2,0527 г/л ж. 1,491 0 г/см³ тв. 1,536 г/см³ |
| Термические свойства | |
| Температура плавления | -11,2 °C |
| Температура кипения | 21,1 °C |
| Энтальпия образования (ст. усл.) | 33,10 кДж/моль |
| Классификация | |
| Рег. номер CAS | 10102-44-0 |
Оксид азота (IV) (диоксид азота, бурый газ) NO2 — газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона. При температуре 140 °C диоксид азота состоит только из молекул NO2, он очень тёмного, почти чёрного цвета. В точке кипения NO2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2. При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера). При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Содержание
Получение
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность:
Химические свойства
Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:

Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
Жидкий NO2 применяется для получения безводных нитратов:
Применение
В производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
Физиологическое действие
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
«Лисий хвост»
«Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота на химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.
Вредное воздействие
Оксиды азота, улетучивающиеся в атмосферу, представляют серьёзную опасность для экологической ситуации, так как способны вызывать кислотные дожди, а также сами по себе являются токсичными веществами, вызывающими раздражение слизистых оболочек.
Двуокись азота воздействует в основном на дыхательные пути и легкие, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина.
В специальной литературе также указывается на то, что воздействие на организм человека диоксида азота снижает сопротивляемость к заболеваниям, вызывает кислородное голодание тканей, особенно у детей. Усиливает действие канцерогенных веществ, способствуя возникновению злокачественных новообразований.
Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом.
Оксиды азота
Азот образует несколько оксидов:
Все оксиды азота, за исключением N2O, являются ядовитыми веществами.
Оксид азота N2O (I)
Строение молекулы линейное:
Оксид азота NO(II)
Молекула имеет вид:
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре:
N2+O2=2NO.
Монооксид азота используют для получения азотной кислоты.
Оксид азота N2O3(III)
Оксид азота N2O3(III) является кислотным оксидом, в значительной степени диссоциирует и реагирует со щелочами:
N2O3 ↔ NO2+NO
N2O3+2NaOH = 2NaNO2+H2O
Оксид азота N2O3(III) взаимодействует с водой с образованием азотистой кислоты:
N2O3+H2O = 2HNO2
Азотистая кислота является слабой кислотой, и существует только в водном растворе.
Оксид азота NO2(IV)
Связи N-O располагаются под углом друг к другу, при этом они носят промежуточный «полуторный» характер, при этом имеется еще и один неспаренный электрон, как и у NO (см. выше).
При н.у. оксид азота NO2(IV) является ядовитым газом (хорошо растворимым в воде) бурого цвета, с характерным запахом.
При нагревании до 50°C неустойчивая азотистая кислота не образуется:
3NO2+H2O = 2HNO3+NO
В промышленных условиях оксид азота NO2(IV) получают путем окисления NO кислородом:
2NO+O2=2NO2
В лабораторных условиях оксид азота NO2(IV) получают окислением меди азотной кислотой (концентрированной), либо разложением нитрата свинца (меди):
Cu+4HNO3(конц) = Cu(NO3)2+2NO2↑+2H2O
2Pb(NO3)2 = 2PbO+4NO2↑+O2↑
Оксид азота NO2(IV) применяют в производстве азотной кислоты.
Оксид азота N2O5(V)
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:
2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе