naoh 3407 1 что значит
Реактивы и техника приготовления растворов
Растворы щелочей. Едкие щелочи и их растворы активно поглощают влагу и углекислоту из воздуха, поэтому приготовление из них растворов точного титра затруднено. Лучше всего такие растворы изготовлять из фиксаналов. Для этого берут пробирку с фиксаналом требуемой нормальности и мерную колбу на 1 л. В колбу вставляют стеклянную воронку с вложенным в нее стеклянным бойком, острый конец которого обращен вверх.
Когда боек будет правильно уложен в воронке, ампуле с фиксаналом дают свободно падать, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого пробивают боковое углубление ампулы и дают содержимому вытечь. Затем, не меняя положения ампулы, ее тщательно промывают хорошо прокипяченной дистиллированной водой, остуженной до температуры 35- 40°С и взятой в таком количестве, чтобы по охлаждении раствора до 20°С надо было бы добавить до метки лишь несколько капель. Титрованный раствор щелочи следует хранить в таких условиях, которые исключают возможность его соприкосновения с воздухом.
Если же фиксанала нет, титрованные растворы приготовляют из препаратов едкого натра (или едкого кали). Молекулярная масса NaOH равна 40,01. Это число одновременно является и его грамм-эквивалентом.
Для удобства расчета требуемого количества исходных веществ на приготовление 1 л титрованных растворов щелочей разной нормальности рекомендуем пользоваться данными, приведенными в таблице 31.
Таблица 31
Исходные химические вещества, г
Молекулярная масса
Грамм-эквивалент
Нормальность раствора
Вещества для
установки
титров
NaOH
40,01
40,01
40,01
Янтарная плп щавелевая кислота
56,10
56,10
56,10
28,05
11,20
То же
Чтобы приготовить 1 л 0,1 н. раствора едкого натра, отвешивают немного больше 4 г (4,3-4,5 г) препарата и растворяют в небольшом объеме дистиллированной воды (около 7 мл).
После отстаивания раствор осторожно сливают (без осадка) в литровую мерную колбу и доводят дистиллированной свежепрокипяченной водой до метки.
Приготовленный раствор хорошо перемешивают и помещают в бутыль, защищенную от попадания углекислоты. После этого устанавливают титр, т. е. точную концентрацию раствора.
Титр можно устанавливать по щавелевой или янтарной кислоте. Щавелевая кислота (СгН204-2Н20) двухосновная, и, следовательно, ее грамм эквивалент будет равен половине молекулярной. Если молекулярная масса щавелевой кислоты равна 126,05 г, то ее грамм-эквивалент будет 126,05 : 2=63,025 г.
Имеющуюся щавелевую кислоту следует один-два раза перекристаллизовать и только после этого применять для установки титра.
Перекристаллизацию проводят следующим образом: берут произвольное количество вещества, предназначенное для перекристаллизации, растворяют нагреванием, стараясь получить возможно большую концентрацию раствора или насыщенный раствор. При необходимости этот раствор фильтруют через воронку для горячего фильтрования. Фильтрат собирают в колбу Эрленмейера, фарфоровую чашку или стакан.
В зависимости от характера кристаллизации вещества насыщенный в горячем состоянии раствор охлаждают. Для быстрого охлаждения раствора при перекристаллизации кристаллизатор помещают в холодную воду, снег или лед. При медленном охлаждении раствор оставляют стоять при температуре окружающего воздуха.
Если выпали очень мелкие кристаллы, их снова растворяют, нагревая; сосуд, в котором осуществлялось растворение, сразу же обертывают в несколько слоев полотенцем, накрывают часовым стеклом и оставляют стоять в полном покое в течение 12-15 ч.
Затем кристаллы отделяют от маточного раствора, фильтруя под вакуумом (воронка Бюхнера), тщательно отжимают, промывают и подсушивают.
Приготавливая 0,1 н. раствор NaOH, необходимо иметь раствор щавелевой кислоты такой же нормальности, для этого на 1 л раствора ее нужно взять 63,025 : 10=6,3025 г. Но для установки титра такого количества раствора щавелевой кислоты много; достаточно приготовить 100 мл. Для этого на аналитических весах отвешивают около 0,63 г перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака, например 0,6223 г. Взятую навеску щавелевой кислоты растворяют в мерной колбе (на 100 мл). Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в данном случае равна не 0,1 н., а несколько меньше.
Из приготовленного раствора берут пипеткой 20 мл, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пусть на титрование пошло 22,05 мл щелочи. Как же определить ее титр и нормальность?
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0,6303 г. Следовательно, нормальность ее будет равна не точно 0,1
Чтобы вычислить нормальность щелочи, воспользуемся соотношением VN=ViNt, т. е. произведение объема на нормальность известного раствора равно произведению объема на нормальность для неизвестного раствора. Получаем: 20-0,09873 =22,05-а:, откуда
Чтобы вычислить титр или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр щелочи будет
Но этот титр не соответствует 0,1 н. раствору NaOH. Для этого прибегают к коэффициенту к, т. е. отношению практического титра к теоретическому. В данном случае он будет равен
При использовании для установки титра янтарной кислоты раствор ее приготовляют в том же порядке, что и щавелевой, исходя из следующего расчета: молекулярная масса янтарной кислоты (С4Н604) равна 118,05 г, но так как она двухосновная, то ее грамм-эквивалент 59,02 г.
Установка титра 0,1 н. раствора NaOH весовым методом. Для установки титра 0,1 н. раствора NaOH берем навеску янтарной кислоты с точностью до 0,0001 г (например, 0,1827 г). Навеску растворяем в дистиллированной воде (около 100 мл), затем добавляем 3-5 капель фенолфталеина и титруем щелочью (NaOH). Предположим, что на титрование пошло 28 мл NaOH. Вычисление титра NaOH и поправку к нему проводим следующим образом: так как грамм-эквивалент NaOH, равный 40,01 г, соответствует грамм-эквиваленту янтарной кислоты, равному 59,02 г, то, составляя пропорцию, узнаем, какому количеству NaOH соответствует содержащееся в навеске количество янтарной кислоты: 40,01-59,02
Вычисляем титр NaOH, т. е. содержание NaOH в 1 мл раствора. Оно равно: 0,1238 : 28=0,00442. Поправка к титру NaOH равна отношению титра практического к теоретическому
Проверка нормальности раствора щелочи по титрованному раствору кислоты. В три конические колбочки отмеряют бюреткой по 20-25 мл титрованного раствора кислоты (НС1 или H2S04) и титруют раствором NaOH до изменения окраски метилоранжа.
Допустим, что на титрование трех проб по 20 мл 0,1015 н. раствора НС1 затрачено в среднем 19,50 мл раствора NaOH. Нормальность щелочи будет
Растворы кислот. В большинстве случаев в лаборатории приходится иметь дело с серной, соляной и азотной кислотами. Они находятся в виде концентрированных растворов, процентное содержание которых узнаем по плотности.
При аналитических работах используем химически чистые кислоты. Чтобы приготовить раствор той или иной кислоты, количество концентрированных кислот обычно берем по объему, вычисленному по плотности.
Например, нужно приготовить 0,1 н. раствор H2S04. Это значит, что в 1 л раствора должно содержаться
Сколько же по объему нужно взять H2S04 с плотностью 1,84, чтобы, разбавив ее до 1 л, получить 0,1 н. раствор?
Кислота с плотностью 1,84 содержит 95,6% H2S04. Следовательно, на 1 л раствора ее нужно взять в граммах:
Выражая массу в объемных единицах, получим
Отмерив из бюретки точно 2,8 мл кислоты, разбавляем ее до 1 л в мерной колбе, затем, титруя щелочью, проверяем нормальность.
Например, при титровании установлено, что 1 мл 0,1 н. раствора H2S04 содержит не 0,0049 г H2S04, а 0,0051 г. Для вычисления количества воды, которое нужно добавить к 1 л кислоты, составляем пропорцию:
Следовательно, в этот раствор нужно добавить 41 мл воды. Но учитывая, что от исходного раствора было взято на титрование 20 мл, что составляет 0,02, то воды нужно брать меньше, т. е. 41-(41-0,02) =41-0,8 =40,2 мл. Это количество воды и добавляем из бюретки в колбу с раствором.
Приведенная выше работа при выполнении довольно кропотлива, поэтому можно готовить приблизительно точные растворы, вводя поправочный коэффициент, который применяют в работе при каждом титровании. При этом израсходованное число миллилитров раствора умножаем на поправочный коэффициент.
Поправочный коэффициент вычисляем по формуле
где V — объем испытуемого раствора, взятый для титрования;
kt — поправочный коэффициент раствора щелочи известной нормальности, по которому устанавливают титр вновь приготовленного раствора кислоты;
Ух— объем раствора щелочи известной нормальности, пошедший на титрование испытуемой кислоты.
Гидроксид натрия
| Гидроксид натрия | ||||||||
 | ||||||||
 | ||||||||
| Общие | ||||||||
|---|---|---|---|---|---|---|---|---|
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щелочь | |||||||
| Химическая формула | NaOH | |||||||
| Физические свойства | ||||||||
| Молярная масса | 39,997 г/моль | |||||||
| Плотность | 1,59 г/см³ | |||||||
| Термические свойства | ||||||||
| Температура плавления | 323 °C | |||||||
| Температура кипения | 1403 °C | |||||||
| Химические свойства | ||||||||
| Растворимость в воде | 108,7 г/100 мл | |||||||
| Безопасность | ||||||||
| Токсичность | Ацетат уранила-цинка | |||||||
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | желто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнен примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80°С. Этот процесс называется каустификацией; он проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твердый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия
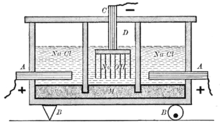
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH | 50 | 12 | 35 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Чистота водорода | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl − в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Диафрагменный метод
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подается в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую, иногда, добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из катодного пространства вытекает поток обедненного анолита, содержащего так же примеси гипохлорит- и хлорат-ионов и хлор, а из анодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щелочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щелочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка определяется высокой стоимость полимерных катионообменных мембран и их уязвимость к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щелоков самым эффективным способом является электролиз с ртутным катодом. Щелока, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (Для некоторых производств это критично. Например, в производстве искусственных волокон можно применять только высокочистый каустик.), а по сравнению с мембранным методом организация процесса при получении щелочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Na + + е = Na 0 nNa + + nHg − = Na + Hg
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щелочи с твердым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизер диафрагменного или мембранного типа.
Рынок каустической соды
Мировое производство натра едкого, 2005 год
| Производитель | Объём производства, млн.тонн | Доля в мировом производстве |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Chemical Company | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Solvay | 1.252 | 2.2 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Россия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| Другие | 27.559 | 47,87 |
| Всего: | 57,541 | 100 |
В России согласно ГОСТ 2263-79 производятся следующие марки натра едкого:
ТР — твёрдый ртутный (чешуированный);
ТД — твёрдый диафрагменный (плавленый);
РР — раствор ртутный;
РХ — раствор химический;
РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Показатели российского рынка жидкого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тыс.тонн | 2006 г. тыс.тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Стерлитамак | 239 | 249 | 20 | 20 |
| ОАО «Каустик», Волгоград | 210 | 216 | 18 | 18 |
| ОАО «Саянскхимпласт» | 129 | 111 | 11 | 9 |
| ООО «Усольехимпром» | 84 | 99 | 7 | 8 |
| ОАО «Сибур-Нефтехим» | 87 | 92 | 7 | 8 |
| ОАО «Химпром», Чебоксары | 82 | 92 | 7 | 8 |
| ВОАО «Химпром», Волгоград | 87 | 90 | 7 | 7 |
| ЗАО «Илимхимпром» | 70 | 84 | 6 | 7 |
| ОАО «КЧХК» | 81 | 79 | 7 | 6 |
| НАК «АЗОТ» | 73 | 61 | 6 | 5 |
| ОАО «Химпром», Кемерово | 42 | 44 | 4 | 4 |
| Итого: | 1184 | 1217 | 100 | 100 |
Показатели российского рынка твердого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тонн | 2006 г. тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Волгоград | 67504 | 63510 | 62 | 60 |
| ОАО «Каустик», Стерлитамак | 34105 | 34761 | 31 | 33 |
| ОАО «Сибур-Нефтехим» | 1279 | 833 | 1 | 1 |
| ВОАО «Химпром», Волгоград | 5768 | 7115 | 5 | 7 |
| Итого: | 108565 | 106219 | 100 | 100 |
Применение
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: