na2so3 с чем реагирует
Сульфит натрия
Сульфит натрия (Na 2 SO 3, натриевая соль сульфитной кислоты) — бесцветная (в виде порошка белая) кристаллическое вещество, солоноватая на вкус, консервант, пожаро- и взрывоопасен.
Химические свойства
Для сульфита натрия свойственны типичные реакции для солей:
Присоединяет воду, образуя кристаллогидрат:
Сильный восстановитель, легко окисляется кислородом в воздухе (влажном) и в водных растворах, другими окислителями:
Может также вступать в реакцию как окислитель, восстанавливаясь до Na 2 S 2 O 4 или Na 2 S:
Na 2 SO 3 + 3CO = Na 2 S + 3CO 2 (температура свыше 700 ° C).
При комнатной температуре устойчив, но разлагается при нагревании:
4Na 2 SO 3 = 2Na 2 SO 4 + 2Na 2 S (температура до 800 ° C); Na 2 SO 3 = Na 2 O + SO 2 (температура свыше 800 ° C).
Добыча
Сульфит натрия как типичную соль легко добыть многими способами, например, реакцией между оксидом натрия и сернистым газом:
В промышленности его добывают взаимодействием карбоната натрия с сернистым газом в растворе (с сернистой кислотой):
Применение и воздействие на человека
Сульфит натрия — важный продукт химической промышленности, применяется и в самой химической промышленности, и во многих других областях, в частности в металлургии, легкой промышленности, при производстве гигиенических и моющих средств. Входит в состав фотографических проявителей некоторых пестицидов. Используется также как отбеливатель, хладагент.
Является важным компонентом пищевой промышленности, используется как консервант (Е 221) при обработке фруктов (и сухофруктов), овощей, тормозит их потемнение, предотвращает образование бактерий. Также применяется как антиоксидант при производстве вин, варенья, зефира, соков. Разрешенных в странах ЕС, в Украине при условии соблюдения норм. Допустимая норма для человека — 0,7 мг / кг массы тела в сутки. Для детей употребление продуктов, содержащих обработаны сульфитом натрия, не желательно. При передозировке у человека может развиться почечная недостаточность, астма, болезни желудочно-кишечного тракта, аллергия.
Сульфит натрия
| Сульфит натрия | |
|---|---|
 | |
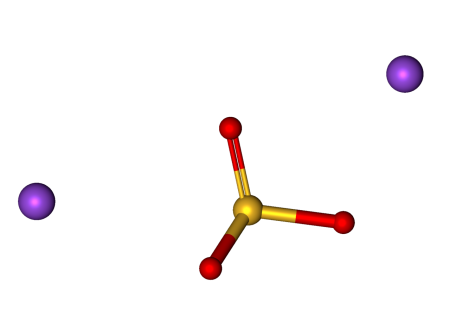 | |
| Хим. формула | Na2SO3 |
| Молярная масса | 126,037 г/моль |
| Плотность | 2,633 г/см³ |
| Т. плав. | 500 °C |
| Т. разл. | 600 °C |
| Растворимость в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) |
| ГОСТ | ГОСТ 195-77 ГОСТ 5644-75 ГОСТ 903-76 |
| Рег. номер CAS | 7757-83-7 |
| PubChem | 24437 |
| Рег. номер EINECS | 231-821-4 |
| SMILES | |
| Кодекс Алиментариус | E221 |
| RTECS | WE2150000 |
| ChEBI | 86477 |
| ChemSpider | 22845 |
| Токсичность | умеренная |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфит натрия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
Содержание
История
В фотографии впервые было использовано в 1882 году Х. Б. Беркли для пирогаллоловых проявителей с целью уменьшить пятна, возникающие на фотоматериале в процессе обработки. С 1882 года многие составы включали в себя сульфитные ионы, как правило с целями защиты проявителя от окисления, но в целом роль этих ионов была малопонятна и только спустя годы исследований удалось выявить значительный ряд функций этого соединения в составе проявляющих растворов.
Физические свойства
Химические свойства
Сульфит натрия устойчив на воздухе при комнатной температуре, но при нагревании разлагается с образованием сульфата натрия и сульфида натрия, при этом при температуре выше 800 °C разложение идет до образования оксида натрия и диоксида серы.
Гептагидрат сульфита натрия во влажном воздухе легко окисляется до сульфата натрия, для замедления окисления используют ингибиторы — гидрохинон, пирогаллол, 1,4-фенилендиамин. В сухом воздухе гептагидрат не окисляется, но частично теряет кристаллизационную воду, полностью обезвоживаясь при температуре 150—160 °C.
Водные растворы сульфита натрия имеют щелочную реакцию, при их подкислении происходит выделение диоксида серы.
Сульфит натрия является сильным восстановителем. В водных растворах находится в частично гидролизованном состоянии, легко окисляется кислородом воздуха, перманганатом калия, бихроматом калия, бромом, иодом и другими окислителями до сульфата натрия. Растворы сульфита натрия поглощают диоксид серы, образуя гидросульфит натрия, а при кипячении присоединяют серу с образованием тиосульфата натрия. В кислых растворах хлорида титана (III), двуххлористого олова и хлорида железа (II) восстанавливается до дитионита натрия или до сульфида натрия.
Фотографические свойства
Многочисленные исследования свойств сульфита натрия в составе проявляющих растворов показали, что действие этого соединения не ограничивается узкой областью снижения количества пятен на эмульсии, образующихся в процессе обработки в некоторых окрашивающих проявителях, для чего это соединение было предложено изначально. Практически сразу сульфит натрия стал использоваться в своей роли основного универсального сохраняющего вещества, что было вызвано его многоаспектным действием на фотографические составы при всех этапах проявления и хранения растворов.
Антиоксидант
Основная роль сульфита натрия в составе фотографических проявляющих растворов заключается в защите органических проявляющих веществ от окисления кислородом воздуха. При высоком значении pH раствора проявляющее вещество в отсутствии сульфита быстро окисляется, становясь фотографически неактивным. Например, гидрохинон сначала превращается в хинон, вследствие чего раствор приобретает жёлтую окраску, а затем в фотографически неактивный оксихинон, окрашивающий раствор в тёмно-коричневый цвет. Небольшое количество сульфита натрия резко замедляет этот процесс за счет того, что вместо гидрохинона с кислородом в первую очередь будет реагировать сам сульфит с образованием сульфата натрия. Присутствие же органического проявляющего вещества, в свою очередь, является ингибитором процесса окисления сульфита кислородом.
Точный механизм ингибирования окисления органических проявляющих веществ неизвестен, но предполагается, что он обусловлен связыванием сульфитом натрия окрашенных окисленных форм проявляющих веществ, которые в несвязанном состоянии катализируют дальнейшее окисление своей неокисленной формы.
Окисление гидрохинона кислородом воздуха в растворах, содержащих сульфит натрия, будет происходить уже не с образованием хинона и оксихинона, а с образованием бесцветного добезилата натрия, который также является проявляющим веществом:
Разрыв цепи полимеризации
При проявлении гидрохиноном и его производными в растворе образуются семихиноны — высокоактивные и нестабильные соединения. Они имеют тенденцию к полимеризации в гуминовые кислоты, цепи которых в типичных условиях для фотографического проявления образуются из порядка 10 молекул окисленных остатков гидрохинона и имеют тёмную окраску. Так как на стадии образования семихинона сульфит реагирует с ним, то полимеризации, как правило, не происходит, а следовательно, не будет и каталитического воздействия данных полимерных соединений на неокисленную форму проявляющего вещества. Тем не менее, для пирогаллола сульфит не способен взаимодействовать с нерастворимыми окрашенными продуктами окисления, аналогично и для слабоокрашенных продуктов окисления фенидона и L-аскорбиновой кислоты.
Обесцвечивающий агент
Сульфит натрия в описанном выше процессе связывания окрашенных форм образует бесцветные соединения, вместо сильноокрашенных, тем самым снижая нежелательные пятна и окраску результирующего изображения.
Поддержание активности проявления
Окисленные остатки проявляющего вещества в растворе, хотя и непосредственно не реагируют с галогенидом серебра в эмульсии, но изменяют pH среды и другие её показатели, что может вести либо к нарастанию скорости проявления, либо к её спаду. Лишь немногие проявляющие вещества не дают подобного эффекта. Рост активности наблюдается в проработавших растворах проявляющих веществ, имеющих активные гидроксогруппы, например у глицина-фото. Если же проявляющее вещество имеет только аминогруппы, то скорость проявления будет падать. Превращение окисленных форм в сульфонаты при реакции с сульфитом стабилизирует и поддерживает активность, тем самым позволяя избегнуть нежелательного пере- или недопроявления.
Получение
Сульфит натрия получают:
Применение
Применяют для удаления следов хлора после отбеливания тканей, для удаления серы из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих хром.
В фотографии используют как основное сохраняющее вещество в проявителях, входит в состав фиксажей и других растворов.
Безопасность
Сульфит натрия, характеристика, свойства и получение, химические реакции
Сульфит натрия, характеристика, свойства и получение, химические реакции.
Сульфит натрия – неорганическое вещество, имеет химическую формулу Na2SO3.
Краткая характеристика сульфита натрия:
Сульфит натрия – неорганическое вещество белого цвета.
Химическая формула сульфита натрия Na2SO3.
Сульфит натрия – неорганическое химическое соединение, соль сернистой кислоты и натрия.
Хорошо растворяется в воде.
Сульфит натрия образует с водой кристаллогидрат – гептагидрат Na2SO3·7H2O.
Устойчив на воздухе при комнатной температуре.
Сульфит натрия пожаро- и взрывобезопасен. Является умеренно токсичным веществом. Относится к веществам 3-го класса опасности по ГОСТ 12.1.007.
Физические свойства сульфита натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2SO3 |
| Синонимы и названия иностранном языке | sodium sulfite (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные гексагональные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м 3 | 2633 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 3 | 2,633 |
| Температура разложения, °C | 600 |
| Температура плавления, °C | 500 |
| Молярная масса, г/моль | 126,037 |
| Растворимость в воде (20 o С), г/100 г | 26,10 |
Получение сульфита натрия:
Сульфит натрия получают в результате следующих химических реакций:
В ходе реакции используется концентрированный раствор гидроксида натрия.
В ходе реакции используется концентрированный раствор карбоната натрия. Реакция протекает при комнатной температуре.
В ходе реакции используется концентрированный раствор гидроксида натрия.
Химические свойства сульфита натрия. Химические реакции сульфита натрия:
1. реакция взаимодействия сульфита натрия и кислорода :
В результате реакции образуется сульфат натрия.
2. реакция взаимодействия сульфита натрия и пероксида водорода:
В результате реакции образуются сульфат натрия и вода.
3. реакция взаимодействия сульфита натрия и сероводорода:
4. реакция взаимодействия сульфита натрия и азотной кислоты:
В результате реакции образуются сульфат натрия, оксид азота и вода. При этом в ходе реакции азотная кислота используется в виде горячего концентрированного раствора.
Аналогичным образом сульфит натрия реагирует и с другими минеральными кислотами.
5. реакция взаимодействия сульфита натрия и нитрата серебра:
В результате реакции образуются сульфит серебра и нитрит натрия.
6. реакция взаимодействия сульфита натрия и сульфата меди:
В результате реакции образуются сульфит меди и сульфат натрия.
7. реакция термического разложения сульфита натрия:
В результате реакции образуются сульфат натрия и сульфид натрия.
8. реакция термического разложения гептагидрата сульфита натрия:
Применение и использование сульфита натрия:
Сульфит натрия используется во множестве отраслей промышленности и для бытовых нужд:
– для очистки сточных вод, содержащих хром ;
– в целлюлозно-бумажной промышленности при очистке воды в качестве агента-поглотителя кислорода;
– в фотографии как основное сохраняющее вещество в проявителях, в составе фиксажей и других растворах;
– в химическом производстве как сульфирующее и сульфометилирующее вещество.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
сульфит натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфита натрия
реакции
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Оксид серы (IV)
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
4. Обработка концентрированной серной кислотой неактивных металлов.
Химические свойства оксида серы (IV)
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Карбонат натрия: способы получения и химические свойства
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду: