muscles cells к чему относится
muscle cells
Смотреть что такое «muscle cells» в других словарях:
Muscle hypertrophy — is an increase in the size of muscle cells. It differs from muscle hyperplasia, which is the formation of new muscle cells. Contents 1 Hypertrophy stimuli 1.1 Strength training 1.2 Anaerobic training … Wikipedia
Muscle fatigue — is the decline in ability of a muscle to generate force. It can be a result of vigorous exercise but abnormal fatigue may be caused by barriers to or interference with the different stages of muscle contraction. There are two main causes of… … Wikipedia
Muscle weakness — ICD 10 M62.8 ICD 9 728.87 (728.9 before 10/01/03) DiseasesDB … Wikipedia
muscle — muscleless, adj. muscly, adj. /mus euhl/, n., v., muscled, muscling, adj. n. 1. a tissue composed of cells or fibers, the contraction of which produces movement in the body. 2. an organ, composed of muscle tissue, that contracts to produce a… … Universalium
muscle disease — ▪ pathology Introduction any of the diseases and disorders that affect the human muscle system (muscle system, human). Diseases and disorders that result from direct abnormalities of the muscles are called primary muscle diseases; those… … Universalium
Muscle memory (strength training) — For the term muscle memory as related to motor learning, see Muscle memory. Muscle memory has been used to describe the observation that various muscle related tasks seem to be easier to perform after previous practice, even if the task has not… … Wikipedia
muscle cell — any contractile cell peculiar to muscle. Smooth muscle cells are elongated spindle shaped cells containing a single nucleus and longitudinally arranged myofibrils. For cardiac and skeletal muscle cells, see muscle fiber, under fiber. Called also… … Medical dictionary
muscle tissue — muscular tissue tissue specialized for contraction, which produces movement of the body and its parts; it consists of muscle fibers, muscle cells, connective tissue, and extracellular material. Called also flesh. See also muscle … Medical dictionary
Muscle — is the tissue of the body which primarily functions as a source of power. There are three types of muscle in the body. Muscle which is responsible for moving extremities and external areas of the body is called «skeletal muscle.» Heart… … Medical dictionary
Muscle spindle — Latin fusus neuromuscularis Code TH H3.11.06.0.00018 Muscle spindles are sensory receptors within the belly of a muscle, which primarily detect changes in the length of this muscle. They convey length information to the central nervous system via … Wikipedia
Muscle Cells (Myocyte)
Contents
Introduction [ edit | edit source ]
Note: This article is about skeletal myocytes.
Myocytes, sometimes called muscle fibers, form the bulk of muscle tissue. They are bound together by perimysium, a sheath of connective tissue, into bundles called fascicles, which are in turn bundled together to form muscle tissue. Myocytes contain numerous specialized cellular structures which facilitate their contraction and therefore that of the muscle as a whole.
Structure [ edit | edit source ]
Myocytes can be incredibly large
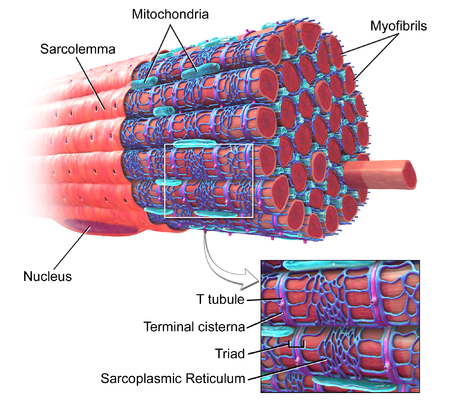
The Sarcolemma of Myocytes
Myofibril (thousands contained in a myocyte) [ edit | edit source ]
Most of the muscle cell is filled with myofibrils. [2]
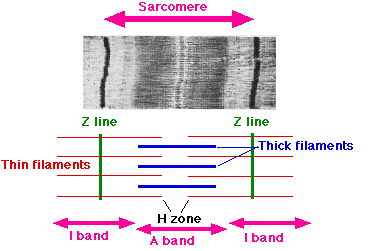
Myofibrils are contractile units (within the muscle cell) that consist of an ordered arrangement of longitudinal myofilaments (thin actin filaments and thick myosin filaments).
The characteristic ‘striations’ of skeletal muscle readily observable by light microscopy are the thin filaments (light) the thick filaments (dark).
The Z-line defines the lateral boundary of each sarcomere. [3]
Shortening or contraction of skeletal muscle fibers is a result of sarcomere shortening.
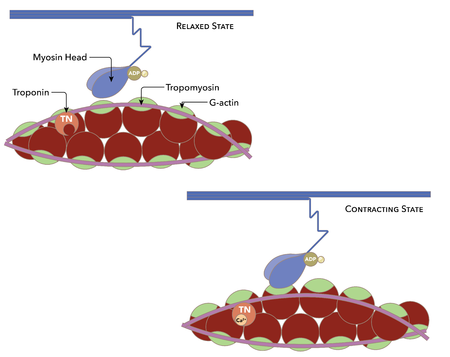
Image R: The Actin-Tropomyosin-Troponin complex. In the resting state, tropomyosin, held in place by troponin, blocks the site on actin to which myosin binds. However, in the presence of Ca++, it binds to troponin, and when troponin binds Ca++ it changes conformation, moving tropomyosin away from the myosin binding site on actin.
Sliding Filament Model of Contraction [ edit | edit source ]
The sliding filament model describes the process used by muscles to contract. It is a cycle of repetitive events that causes actin and myosin myofilaments to slide over each other, contracting the sarcomere and generating tension in the muscle.
The Muscle Contraction Process [ edit | edit source ]
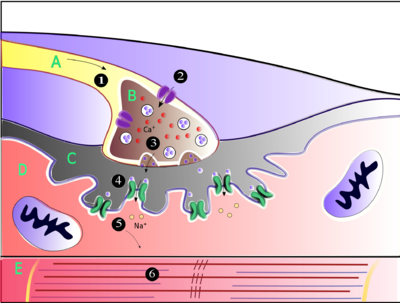
Muscles will contract or relax when they receive signals from the nervous system. The neuromuscular junction is the site of the signal exchange. The steps of this process in vertebrates occur as follows:
Image R: Labels: A: Motor Neuron Axon B: Axon Terminal C. Synaptic Cleft D. Muscle Cell
Muscle Cell Growth [ edit | edit source ]
Although muscle cells can change in size, new cells are not formed when muscles grow. Instead, structural proteins are added to muscle fibers in a process called hypertrophy, so cell diameter increases. Conversely when structural proteins are lost and muscle mass decreases atrophy is said to occur.
Cellular components of muscles can also undergo changes in response to changes in muscle use. The changes in muscle differ depending on the type of exercise undertaken.
Secretome of skeletal muscle cells [ edit | edit source ]
The secretome is the rich, complex set of molecules secreted from living cells.
Skeletal muscle is an active endocrine organ containing cells that may communicate in an auto-, para- or endocrine manner thanks to the secretion of mediators like myokines.
Myokines are defined as: cytokines and other peptides that are produced, expressed, and released by muscle fibers and exert either paracrine or endocrine effects”
Muscle Cells
Introduction
Muscle cells, commonly called myocytes, would be the cells that cosmetics muscle tissue. Cardiac and skeletal myocytes are occasionally known as muscle fibers because of their lengthy and fibrous form. Skeletal muscle cells compose the muscle cells linked to manhood and therefore are significant in locomotion. Smooth muscle cells are liable for involuntary movements, such as that of their intestines through peristalsis (contraction to propel food through the digestive tract).
Contractility is a fundamental asset of cells, and nearly all they contain the same contractile machines present in muscle cells. However, in muscle cells, a more significant percentage of these cells’ sources are given over for the purpose than in other cell types. Muscle allows complicated movements that are either voluntary–under conscious control–like turning the novel’s pages, or involuntary, like the contraction of the heart and the peristalsis in the intestine.
To know how muscle accomplishes all these several actions, you have to be aware of the physiology supporting a muscle contraction. This requires a detailed understanding of their muscle’s body. Obviously, muscle contractions will not occur without sufficient nervous stimulation or a good source of ATP, the muscles’ fuel. ATP is obtained through cellular respiration, which can be accomplished by many different metabolic pathways.
Skeletal Muscles
Skeletal muscle cells are very lengthy, in cylindrical shape, and striated. They are multi-nucleated, which means that they have more than one nucleus. This is because they are created from the combination of embryonic myoblasts. Skeletal muscle cells possess high energy requirements, so they contain many mitochondria so as to generate adequate ATP. Skeletal muscle cells, a barred muscle cell type, it makes the muscle that we use to movement and are categorized into multiple muscle tissues around the entire body, such as that of biceps.
Skeletal muscles are connected to bones close to tendons and can be as long as 30 cm, although they are usually 2 to 3 cm in length. The body of muscle cells differs from that of other body cells, and biologists have applied specific terminology to different parts of the cells. The cell membrane of a muscle cell can be referred to as the sarcolemma, and the cytoplasm is known as sarcoplasm. The sarcoplasm carries myoglobin, an oxygen storage site, and glycogen in the kind of granules from the cytosol, which provides an energy source. Sarcoplasm also includes many polyunsaturated protein structures known as myofibrils, which can be made up of myofilaments.
There are three kinds of myofilament; thick, slim, and elastic. Thick myofilaments are made from myosin, a sort of motor protein, although thin myofilaments are made from actin, yet another kind of protein used by cells for structure. Elastic myofilaments consist of an elastic kind of anchoring protein known as titin.
These myofilaments function collectively to make muscle contractions by permitting the myosin protein heads to drift across the actin filaments making a sliding activity. The fundamental unit of striated (striped) muscle is a sarcomere included of actin (mild bands) and myosin (dark circles) filaments. This structure is like the smooth endoplasmic reticulum of different kinds of cells.
Myosin partners with actin filaments, rotating a bit and then yanking the filaments across one another, such as oars propelling a ship, to create contractile force. Skeletal muscle cells also comprise two regulatory proteins, known as troponin and tropomyosin. These avoid myosin head binding site of actin from connecting with myosin. The calcium ions being discharged from the SR is the final result of a series of events at the regeneration cycle that began by means of action possible, triggering acetylcholine release (ACh) neurotransmitter.
Cardiac Muscle Cells
Cardiac muscle is barred, like skeletal muscle, since the actin and myosin are organized in sarcomeres, as in a skeletal muscle. But cardiac muscle is involuntary. Cardiac muscle cells often have a single (central) nucleus. The cells are usually branched and are closely connected by specialized junctions. The area where these cells’ ends are directly connected to some other cell is known as an intercalated disk.
Cardiomyocytes are brief and slim and quite rectangular. They are around 0.02 mm broad and 0.1 mm (millimeters) long. Cardiomyocytes contain many sarcosomes, which supply the vital energy for regeneration. Cardiomyocytes basically contain the same cell organelles as skeletal muscle cells, though they contain more sarcosomes.
Cardiomyocytes are very big and muscular, and they are connected by intercalated discs with the gap junctions for dual diffusion and communication. The disks look like dark circles between cells and therefore are an exceptional facet of cardiomyocytes. They result from adjacent myocytes’ membranes being quite close together and form a sort of paste between cells. The vital job of cardiomyocytes is to create enough contractile force for your heart to beat effectively. The contract jointly in unison, causing sufficient stress to force blood around the entire body.
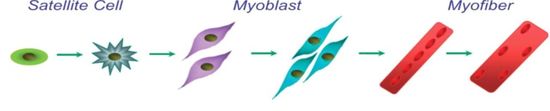
Satellite Cells
Cardiomyocytes cannot divide effectively, meaning if heart cells have been dropped, they cannot be replaced. The end result of this is that every individual cell has to work harder to produce the same output. In reaction to the human body’s higher cardiac output requirement, cardiomyocytes can develop bigger (this procedure is called hypertrophy).
If the cells cannot produce the quantity of contractile force the body needs, heart failure will happen. But satellite cells (nurse cells) are present in cardiac muscle. These are myogenic cells that behave to replace damaged muscle, even though their numbers are somewhat restricted.
Smooth Muscle Cells
These are located in the walls of the majority of blood vessels and also tubular organs such as the gut. However, it does not have a stripy look since it does not have replicating sarcomeres. Smooth muscle cells are spindle-shaped and contain one central nucleus. They vary from 10 to 600 millimeters in length and will be the smallest muscle cell form.
They are elastic and crucial in the growth of organs such as the lungs, kidneys, and vagina. The myofibrils of muscular cells are not aligned, like in the cardiac and skeletal muscular awareness, which they are not striated. Smooth muscle cells are arranged jointly in sheets, and also, this business means they can contract concurrently. They have poorly constructed sarcoplasmic reticulum and do not contain T-tubules because of the limited size of cells. However, they do contain additional ordinary cell organelles such as sarcosomes but in reduced amounts.
Function and Location
Smooth muscle cells are also responsible for involuntary contractions and also are located in the walls of arteries and hollow organs like the gastrointestinal tract, uterus, and bladder. They are also within the eye and contract, altering the form of the lens, which causes the eye to focus.
Smooth muscle cells are responsible for waves of diminution through the digestive tract, inducing food to move throughout the entire body (peristalsis). In smooth muscle cells, this can be eased by gap junctions. Gap junctions are tunnels that enable pilots to be transmitted between them, and that depolarization may spread, causing the myocytes to contract jointly in unison. Smooth muscle cells are elastic, not striated, spindle-shaped, and they have one central nucleus.
Structure
Smooth muscle cells are pivot-shaped; hold one centrally located nucleus, and deficiency striations. They are called involuntary muscles. Cardiac muscle has fibers in branches, one nucleus per cell, striations, and intercalated discs. Its contraction is not under voluntary control—the smooth muscle fibers set at branching bundles. Rather than skeletal muscle fibers, those bundles do not operate strictly parallel and arranged but include an intricate system.
Hence the cells may contract considerably more potent than striated musculature. What are more, intermediate filaments like desmin and vimentin encourage the cell arrangement. Myofibroblasts signify a distinctive sort of smooth muscle cell that also has attributes of fibrocytes. They create connective tissue proteins like elastin and collagen, for which reason they are also known as fixed (or static) connective tissue cells. Myofibroblasts are located, amongst others, at the alveolar septa of the scar and lung tissue.
Functions of Muscle Cells
Highly technical in both form and function, each muscle cell optimally performs its necessary function, though there is a version among each class’s muscle cells. Individuals classify them as either voluntary or involuntary, based on if individuals consciously control their moves.
Further categorized by appearance, muscles may appear smooth or striated, acquiring a striped appearance. Skeletal muscle cells form elongated fibers within the body. They have several nuclei within each cellphone. This contrasts with most different cells within human bodies. These cells can branch out, forming bodily connections with many surrounding cells.
A muscle cell’s capacity to contract, or enhance itself, enables motion. All contraction is dependent upon the presence of both actin and myosin. Stimulation of actin and myosin bundles induces the proteins to slip toward one another, thus shortening the fibers. The stimulation may stem out of a nerve signal, resulting from the presence of charged electrons or electrons that the brain sends out into the muscle cell.
Cardiac muscles contract at a slow but steady speed; therefore, it also takes a high amount of energy usage. Smooth muscle generally contracts quite gradually and is thought to be the most effective of the three muscle cell types. Some scientists record over 20 distinct kinds of proteins within muscles. The two significant proteins, actin, and myosin look in all three cell types. The complete arrangement of both of these proteins induces the striated appearance of visceral and skeletal muscle fibers.
Following are some essential functions of Muscle Cells:
Structure of Muscle Cells
Skeletal muscle consists of approximately Ninety percent muscle fibers & ten percent connective & fat tissues. Skeletal muscle also contains fat tissue and also, to a lesser degree, nervous and circulatory tissues. In fish, the edible part, the fillets, consists of many muscles (myomeres), which can be fitted to one another and separated by connective tissue sheaths of a couple of millimeters thick myosepta. The myosepta exhibits structural goodwill in the thoracic axis into the epidermis.
Their function is to make sure to transmit their fiber-contraction forces of a single myomere to another and into the skin and skeleton. Muscle fibers are elongated, multi-nucleated, and spindle-shaped cells of approximately 10 to 100 micrometers diameter and a span that ranges from several millimeters in fish to many centimeters in terrestrial creatures. In most types, the fiber dimensions increase with animal age and can be a significant postnatal muscle development parameter. Muscle fiber plasma membrane is referred to as the sarcolemma.
Regardless of the species, the myofibrils lined up in packages occupy almost the whole intracellular quantity of muscle fibers. Myofibrils have a diameter of about 1 mm and also consist of little subunits: the myofilaments. Thick myofilaments chiefly consist of a meeting of myosin molecules whose ATPase activity catalyzes the breakdown of adenosine triphosphate (ATP) to adenosine diphosphate (ADP) and supply the chemical energy necessary for muscle contraction.
Sarcoplasm, in other words, that the cytoplasm of muscle fibers contains several soluble proteins, such as enzymes of the glycolytic pathway and myoglobin, which carry oxygen to the mitochondria stains cells reddish. Additionally, it contains glycogen granules, representing the principal neighborhood energy book of muscle cells, along with lipid droplets.
Conclusion
A human being is a marvel and muscle cells along with million other cells make sure the human body functions properly. These are the gifts from God and there is no reason not to be grateful about these.
Что такое внеклеточный матрикс и почему его все изучают
Внеклеточный матрикс — неотъемлемая часть любой ткани.
Автор
Редакторы
Внеклеточный матрикс (ВКМ) — многокомпонентная субстанция, в которую погружены все клетки нашего организма. В последнее десятилетие интерес к внеклеточному матриксу значительно возрос. Это связано с установлением его роли в старении, клеточной дифференцировке, успешной терапии рака и лечении некоторых наследственных заболеваний. Мы подготовили цикл статей, в котором расскажем об организации внеклеточного матрикса, болезнях, связанных с его патологиями, роли ВКМ в старении и подходах к корректировке возрастных изменений.
В первой статье цикла мы рассказываем о компонентах и функциях внеклеточного матрикса, разбираемся, какую практическую пользу может принести его изучение, а также вкратце освещаем самые важные открытия в этой области, совершенные за последний год.
Редакция благодарит Татьяну Голубеву за экспертные консультации и комментарии при подготовке статьи.
Что такое внеклеточный матрикс?
Внеклеточный матрикс (ВКМ, extracellular matrix, ECM) объединяет разрозненные клетки в единый многоклеточный организм. ВКМ похож на государство, в котором живут граждане-клетки: он отвечает за благополучие клеток и управляет всеми аспектами их жизни — от питания и размножения до смерти. Для клеток ВКМ — это и квартира, и магазин, и интернет, и общественный транспорт.
ВКМ: основные игроки
Создатели ВКМ. Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, однако создавать ВКМ умеют и другие клетки: в хрящах, например, это хондроциты, а в костях — остеобласты. Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Разрушители ВКМ. Порядок в ВКМ наводят белки — разрушители его компонентов. Наиболее важные из них, металлопротеиназы, «расчищают путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
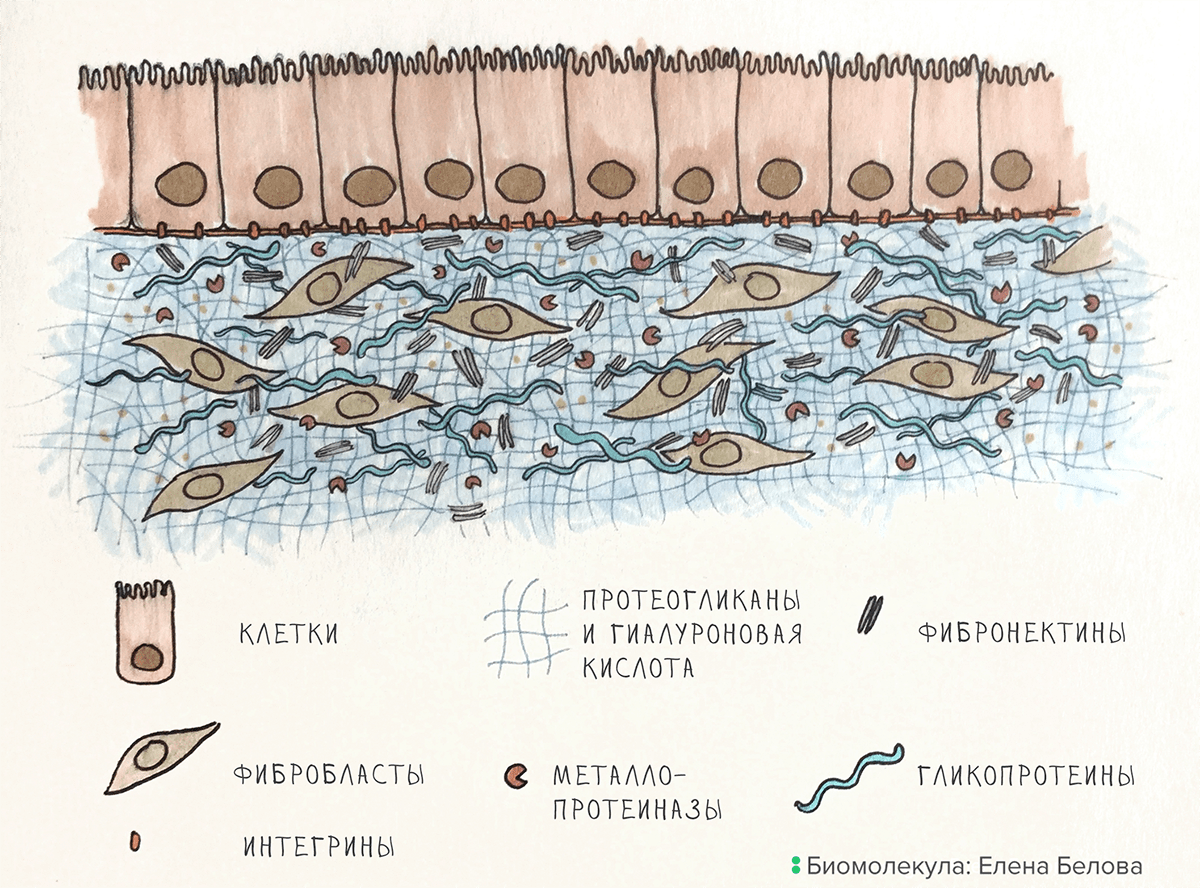
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислота и особые белки: гликопротеины и протеогликаны (рис. 1). В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой — интегрины, фибронектины, эластин, — о них мы поговорим в следующем разделе.
Тем, кто хочет узнать больше о построении и разрушении ВКМ, советуем почитать замечательный обзор на эту тему — «Кто рубит коллагеновый лес» [1].
Рисунок 1. Организация ВКМ на примере кожи. Фибробласты создают ВКМ, металлопротеиназы его разрушают. Клетки эпидермиса связаны с ВКМ при помощи интегринов.
Компоненты ВКМ
Выделяют два подкласса белков, содержащих углеводы, — протеогликаны и гликопротеины. Оба подкласса входят в состав ВКМ, однако между ними есть существенные различия.
В гликопротеинах доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот.
К гликопротеинам относятся такие важные структурные белки, как коллаген и эластин. За счет самого распространенного структурного белка в организме — коллагена — ВКМ приобретает прочность, а за счет эластина — гибкость и эластичность.
Протеогликаны — сложные белки с высокой степенью гликозилирования, часто имеющие в своем составе уроновые кислоты. В отличие от гликопротеинов, около 90–95% массы такой молекулы составляют длинные углеводные цепи регулярного строения, а на белки приходится лишь 5–10%. Такое строение обуславливает высокую молекулярную массу протеогликанов. Например, у аггрекана, белка хрящевой ткани, она может достигать 5 МДа [2]! Протеогликаны запасают воду и полезные вещества, то есть работают как «магазин», из которого клетки получают необходимые «продукты». Например, они могут фиксировать ионы кальция в очагах оссификации. Кроме того, они играют роль межтканевых прослоек и смазочного материала в суставах.
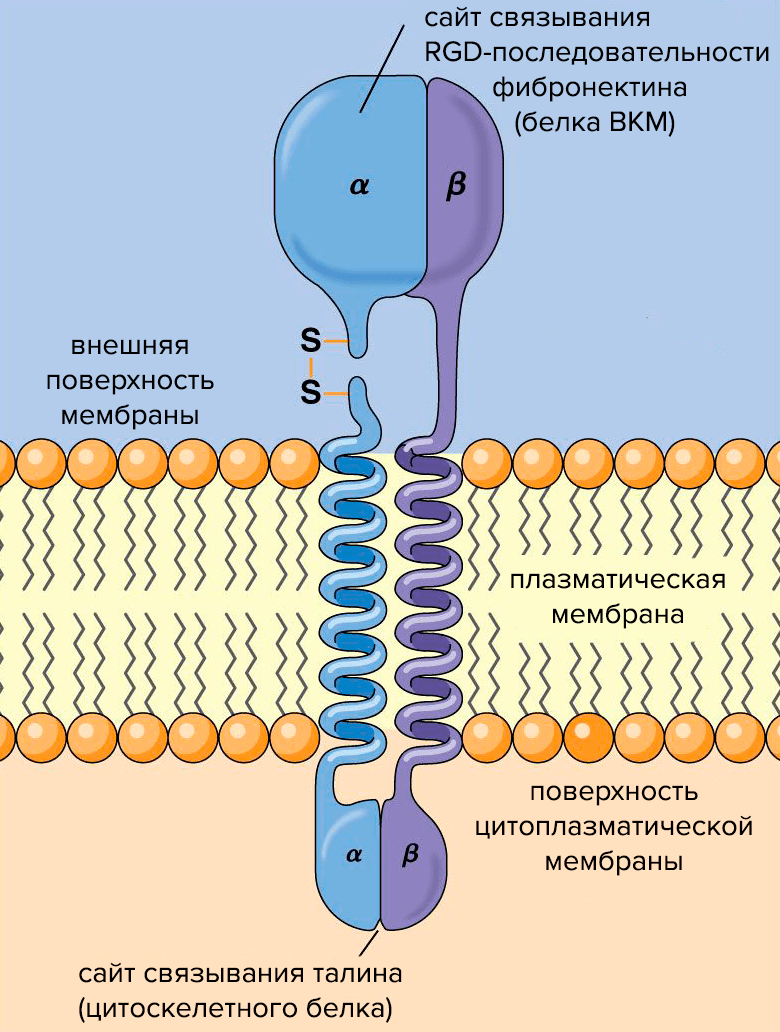
Рисунок 2. Схема строения молекулы интегрина. Субъединицы интегрина (α и β) пронизывают плазматическую мембрану, связывая клетку с внешней средой.
Интегрины — трансмембранные клеточные рецепторы, которые взаимодействуют с ВКМ и участвуют в межклеточной коммуникации. В результате этих взаимодействий в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз. То есть система интегрины—ВКМ — нечто среднее между «интернетом» и «рабочим чатом».
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы (рис. 2). Альфа-субъединицы определяют специфичность интегрина к лиганду — молекуле, способной образовывать комплекс с интегрином и таким образом воздействовать на клетку. Бета-субъединицы связаны с компонентами цитоскелета и обеспечивают передачу сигнала в клетке. О работе интегринов подробно рассказано в статье «Клетки под давлением» [3].
Интегрины улавливают химические и физические сигналы из внеклеточного матрикса и проводят их в клетку. Сигнал от интегринов передается в ядро через белки цитоскелета и сигнальные белки — так ВКМ управляет экспрессией генов и регулирует клеточную пролиферацию. При посредничестве белков цитоскелета ВКМ также управляет формой и движениями клеток.
Фибронектины — это белки клеточной адгезии. Растворимые предшественники фибронектинов синтезируюся внутри клеток и затем попадают в ВКМ. Интегрины превращают фибронектины в нерастворимые нити — компоненты внеклеточного матрикса [4]. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ [5].
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана и представляет собой полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, подобно фибронектину, дает клеткам возможность закрепляться на различных поверхностях [6]. Образно говоря, ГК выполняет задачи «интернет-провайдера» и «билета на общественный транспорт».
Почему так важно изучать внеклеточный матрикс?
Внеклеточный матрикс присутствует во всех тканях организма, поэтому сбои в его функционировании ведут к развитию болезней соединительной ткани, преждевременному старению и гибели клеток. Самый очевидный стимул для изучения ВКМ — необходимость лечения заболеваний, связанных с нарушениями структуры соединительной ткани. Таких болезней много, они могут протекать тяжело и значительно ухудшать качество жизни пациентов. Вот несколько примеров.
Мутации в генах, отвечающих за синтез структурных белков ВКМ, приводят к врожденным патологиям [7]. Поскольку соединительная ткань — основа всех систем организма, пострадать от генетических нарушений может любой орган. Такие нарушения приводят:
Преждевременное разрушение ВКМ — еще одна серьезная проблема. Здоровый внеклеточный матрикс постоянно обновляется и реструктурируется. За это отвечает семейство металлопротеиназ, белков — разрушителей ВКМ.
Металлопротеиназы — ферменты, в каталитический центр которых входят ионы металлов, в основном цинка. Отсюда и название с приставкой «металло-». Помимо каталитического центра, который отвечает за разрушение ВКМ, у металлопротеиназ есть регуляторный продомен, оберегающий фермент от преждевременной активации и ложного срабатывания.
Как именно металлопротеиназы разрушают коллаген и «отцепляют» клетки от волокон внеклеточного матрикса, рассказано в статье «Кто рубит коллагеновый лес» [1]. Сейчас же нам важно понять, что если металлопротеиназы «выходят из-под контроля», то они начинают буквально сметать всё на своем пути. Бесконтрольное разрушение ВКМ приводит к фиброзу и может вызвать рак [8] — например, рак предстательной железы [9].
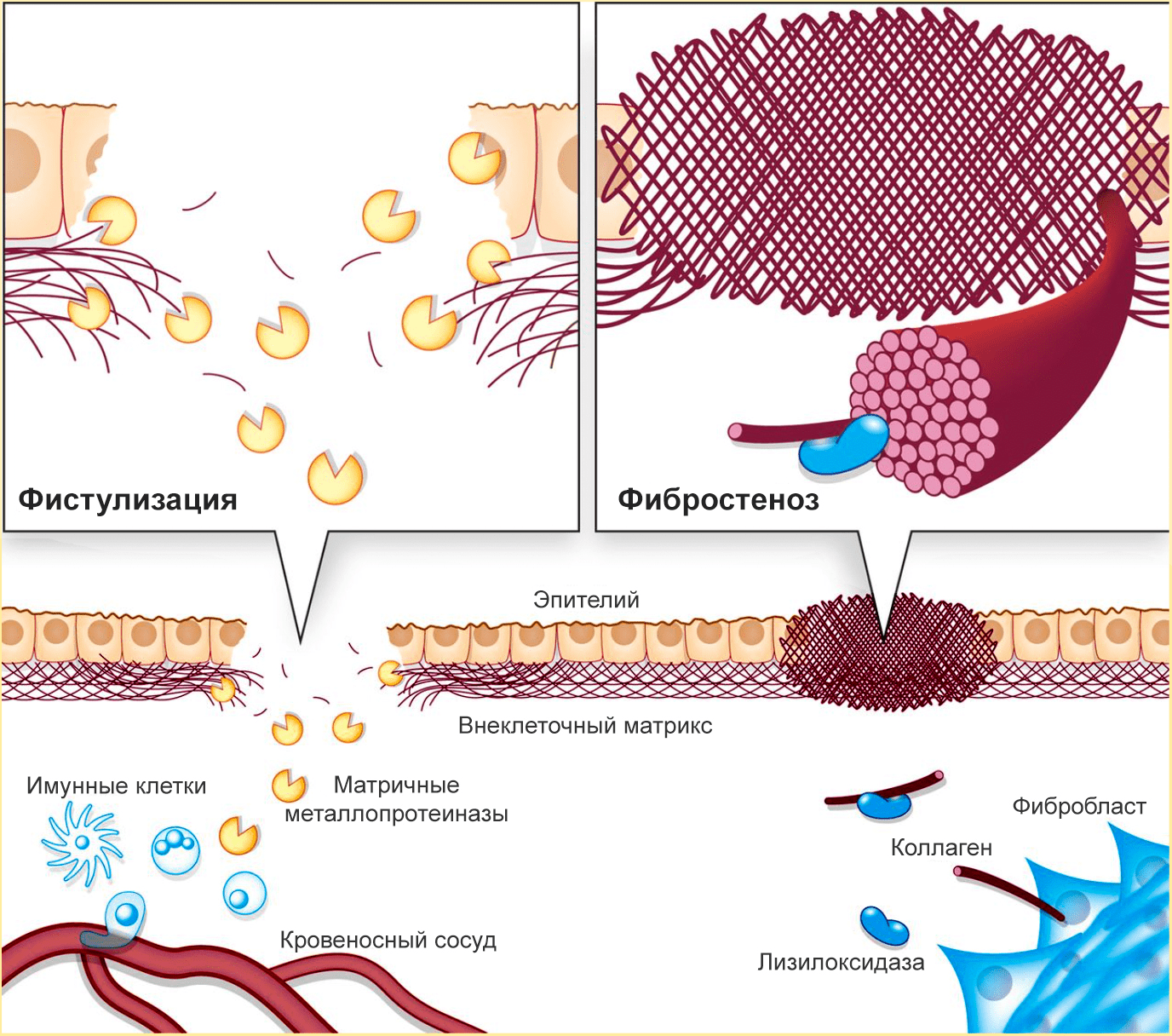
Еще одна патология, вызываемая нарушениями в процессах разрушения и формирования ВКМ, — болезнь Крона (хроническое воспаление кишечника) [10]. По мере ее развития возникает фистулизация и фибростеноз кишечника (рис. 3).
Рисунок 3. При болезни Крона происходит фистулизация и фибростеноз кишечника. Из-за избыточного разрушения ВКМ в кишечной стенке образуются отверстия, а из-за избыточного синтеза коллагена сужается просвет кишечника.
Фистулизация — образование отверстий в кишечной стенке. Этот процесс связан с неконтролируемой активностью металлопротеиназ, разрушающих коллаген слизистой оболочки кишечника. Так как целостность слизистой нарушается, иммунные клетки из кровеносных сосудов проникают в кишечную стенку — так развивается воспаление, а через некоторое время появляется отверстие в стенке кишечника.
Фибростеноз — сужение кишечника. Реагируя на повреждения, фибробласты интенсивно производят коллаген. Затем активируется лизилоксидаза — внеклеточный медьсодержащий фермент, катализирующий образование сложных поперечный связей в коллагене и эластине. Лизиолоксидаза необходима для формирования зрелых коллагеновых волокон, но при ее избытке начинаются проблемы. Этот фермент создает прочную коллагеновую сеть, «запечатывающую» поврежденные кишечные стенки, но из-за избыточной жесткости коллагеновых «печатей» фиброз только усиливается. В результате возникают воспаление и (иногда) непроходимость кишечника. Фистулизация усиливает фибростеноз: неуправляемое разрушение коллагена стимулирует его столь же неуправляемый синтез.
Избыточный синтез ВКМ часто говорит о том, что у человека рак и у этого рака плохой прогноз [11]. Кроме того, сам ВКМ может способствовать росту опухоли и распространению метастазов — это доказано для опухоли головного мозга. Особенно неприятно, что существующие методы лечения — например, лучевая терапия — способны заставить ВКМ послать клеткам сигнал, который может привести к рецидиву опухоли мозга [12].
Состав ВКМ головного мозга уникален: в нём очень много гиалуроновой кислоты и при этом гораздо меньше коллагена, фибронектина и других компонентов, характерных для ВКМ всех остальных тканей. Несмотря на важность ГК для нормальной работы тканей, в некоторых случаях она помогает проводить в клетки опухоли сигналы, делающие их более агрессивными. О том, как именно ГК «дразнит» раковые клетки, мы поговорим в разделе «Что нового мы узнали о внеклеточном матриксе за последний год?»
Лучевая терапия стимулирует работу мембранных белков HAS2, которые отвечают за синтез ГК. В результате они синтезируют больше гиалуроновой кислоты, а чем больше ГК, тем агрессивнее становятся опухолевые клетки. Получается, что лучевая терапия может стимулировать метастазирование опухоли. Таким образом, из-за особенностей ВКМ лучевая терапия помогает только на время: опухоль часто возвращается, становясь еще более опасной. Отчасти по этой причине некоторые виды опухолей мозга так плохо поддаются лечению.
Проблемы с ВКМ — важная причина старения
Первые признаки старения, которые сразу бросаются в глаза, — слабость, хрупкость костей, появление морщин и старческих пятен. Многие из этих проблем связаны с необратимыми изменениями во внеклеточном матриксе.
Одна из причин старения кожи — нарушение работы фибробластов (клеток, синтезирующих компоненты внеклеточного матрикса). При этом благополучие фибробластов зависит от состояния внеклеточного матрикса — получается замкнутый круг.
Рисунок 4. Микрофотография коллагеновых нитей в коже. а — «Целый» коллаген в молодой коже. б — Фрагментированный коллаген в стареющей коже. Стрелки указывают на старые, «разорванные» на кусочки нити коллагена.
Чтобы фибробласты хорошо себя чувствовали, им нужно цепляться за интактные, целые коллагеновые нити. Но со временем эти нити фрагментируются, и фибробластам становится не к чему крепиться, чтобы создать новый, целый коллаген (рис. 4) [13]. Если бы мы научились разрывать этот замкнутый круг, то нам, вполне возможно, больше никогда не понадобились бы антивозрастные услуги косметологов и пластических хирургов.
Старение костной ткани чаще всего связано с нарушением работы остеобластов. Эти клетки создают костный ВКМ, синтезируя коллаген и особые гликопротеины, которые участвуют в первом этапе минерализации коллагена. На втором этапе коллаген превращается в прочный внеклеточный матрикс — основу кости [14].
С течением лет старые остеобласты погибают, а новые делятся хуже и хуже. Оставшимся в живых стареющим клеткам становится всё сложнее справляться с созданием внеклеточного матрикса. Из-за этого кости у пожилых людей становятся очень хрупкими и плохо заживают после переломов.
Если бы мы могли заставить остеобласты делиться или хотя бы выяснили, как помочь им эффективнее минерализовать соединительную ткань, у пожилых людей появилась бы возмножность быстрее восстанавливаться после переломов. Такие работы уже ведутся!
В одной из подобных работ исследователи взяли коллагеновый гель, добавили к нему два неколлагеновых белка, ответственных за минерализацию коллагена (остеокальцин и остеопонтин), и создали на их основе искусственный внеклеточный матрикс. Этот исусственный ВКМ исследователи «предложили» остеобластам, полученным из стволовых клеток костного мозга. В результате активизировалось деление остеобластов, и эти остеобласты начали производить больше компонентов внеклеточного матрикса — правда, пока только в лабораторных условиях [14]. Чтобы искусственный ВКМ появился в кабинете травматолога и оказал содействие в восстановлении костей реальных пациентов, потребуется провести еще много исследований.
Что нового мы узнали о внеклеточном матриксе за последний год?
Над изучением ВКМ работают сотни исследовательских групп по всему миру, и каждый день появляется множество публикаций по этой теме. Давайте рассмотрим несколько свежих работ, чтобы получить представление о ключевых направлениях современных исследований. Вот что мы узнали о компонентах ВКМ в 2018 году.
Металлопротеиназы
Когда металлопротеиназы преждевременно разрушают эластин и коллаген легких, возникает соединительнотканное заболевание легких — эмфизема. Ученые давно стремились узнать, какой генетический компонент влияет на чрезмерную активность металлопротеиназ при этом заболевании.
Исследователи из немецкого Общества имени Макса Планка [15] связали чрезмерную активность металлопротеиназ в легких со снижением активности гена Myh10. Если этот ген «отключали» в мышиных легких, их внеклеточный матрикс формировался неправильно, разрушались межальвеолярные перегородки, с укрупнением альвеол сокращалась суммарная площадь их поверхности, а значит, должен был страдать газообмен. То есть события развивались по сценарию, типичному для человеческой эмфиземы лёгких. Кроме того, авторы работы выявили снижение экспрессии гена MYH10 в легких людей, страдающих эмфиземой.
Не исключено, что в будущем мы научимся управлять процессами, которые протекают в матриксе, используя редактирование генома и генную терапию.
Гликопротеины и металлопротеиназы
Яркий пример коварства металлопротеиназ — образование аневризм. Так, при аневризме брюшной аорты матриксные металлопротеиназы разрушают компоненты, из которых строится ВКМ этого крупного сосуда. Вскоре эта область воспаляется благодаря деятельности иммунных клеток — макрофагов. Механизмы, заставляющие металлопротеиназу разрушать аорту, долгое время оставались неизвестными.
Американским исследователям удалось выяснить, что макрофаги синтезируют нетрин-1 — белок, активирующий клетки гладких мышц сосудов [16]. Под воздействием нетрина-1 гладкомышечные клетки активируют свободные металлопротеиназы, разрушающие соединительную ткань сосуда.
Возможно, когда-нибудь мы научимся использовать иммунные клетки, чтобы управлять разрушением внеклеточного матрикса.
Интегрины и фибронектины
Южноафриканские исследователи обнаружили, что на синтез и деградацию фибронектина влияет внутриклеточный белок теплового шока Hsp90. Этот белок воздействует на фибронектин посредством рецептора LRP1 [4]. Если заблокировать этот рецептор, количество фибронектина, который накапливается во внеклеточном матриксе, уменьшается. И это очень хорошо — ведь из-за избыточного накопления фибронектина развиваются многие патологии ВКМ.
Не исключено, что если мы обнаружим подобные рецепторы в клетках разных тканей и научимся на них воздействовать, то сможем предотвращать болезни, связанные с накоплением ВКМ — например, фиброз легких.
Гиалуроновая кислота
Как компонент внеклеточного матрикса гиалуроновая кислота участвует в передаче сигнала от ВКМ в клетку и даже может превратить здоровую клетку в злокачественную [17]. Гиалуроновая кислота воздействует на клетки через рецептор CD44.
Удалось выяснить, что интенсивность сигнала, запускающего злокачественный процесс в клетке и определяющего, насколько опасна будет получившаяся раковая клетка, зависит от концентрации гиалуроновой кислоты и от ее молекулярной массы.
Гиалуроновая кислота управляет раковыми клетками, связываясь с трансмембранным белком — интегрином CD44. Активация рецептора CD44 подавляет апоптоз, из-за чего клетка становится «бессмертной», то есть раковой. Чем больше гиалуроновой кислоты, тем больше активируется рецепторов CD44 и тем, соответственно, опаснее и агрессивнее будут раковые клетки.
Если мы научимся управлять гиалуронидазами — ферментами, которые отвечают за модификацию и деградацию гиалуроновой кислоты, — мы сможем предотвращать развитие рака и появление метастазов.
Как создавать ВКМ
Когда мы усовершенствуем технологии создания искусственного ВКМ, мы сможем производить полноценные ткани и использовать их в регенеративной медицине. Работы в этом направлении ведутся уже давно, и в прошлом году удалось сделать несколько важных шагов на пути к технологии искусственного ВКМ.
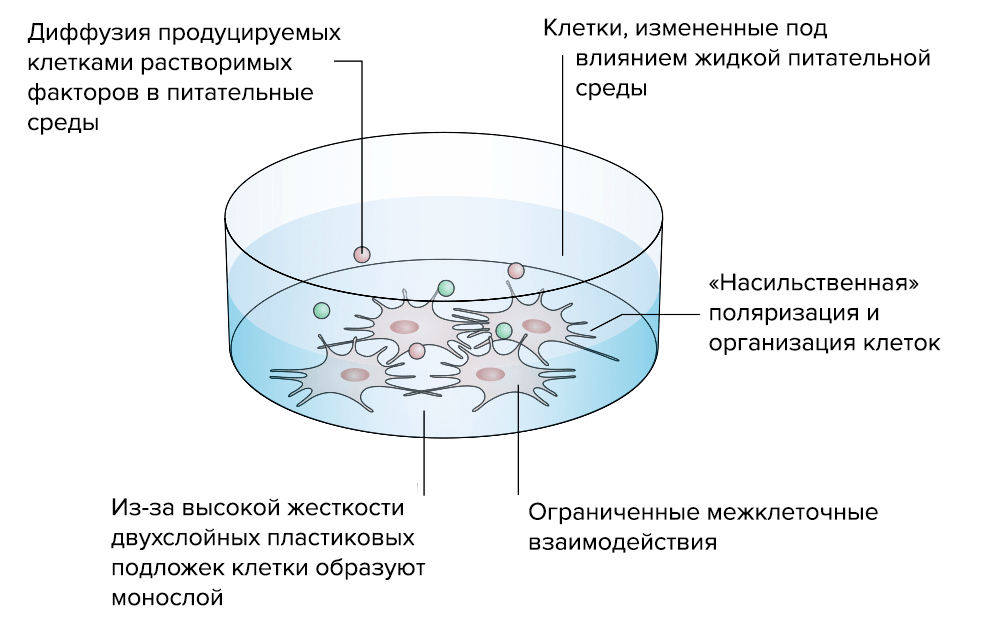
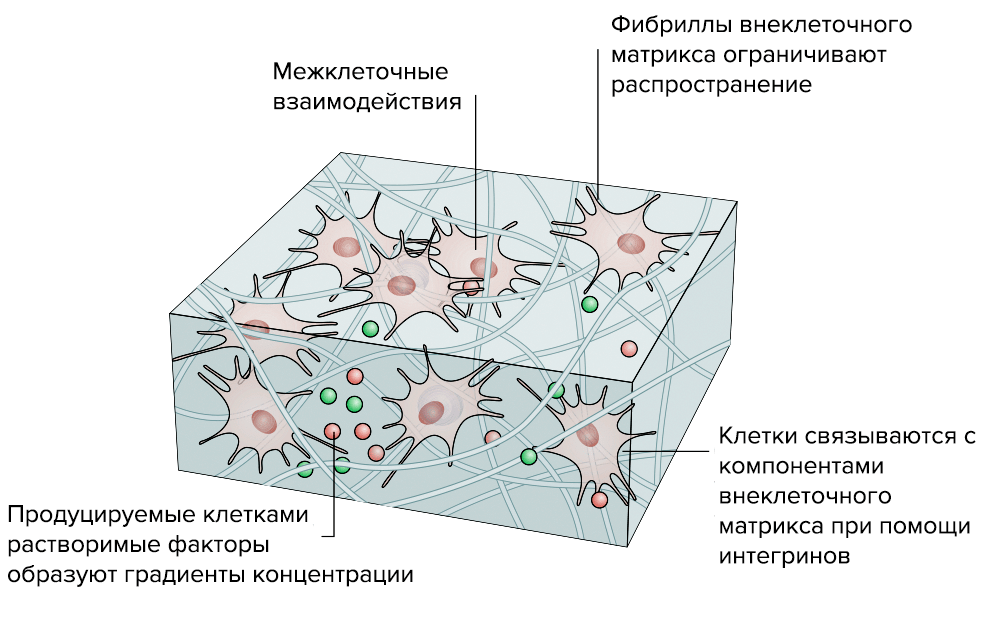
Исследователи уже научились создавать рабочие 3D-модели ВКМ (рис. 5). В отличие от традиционных 2D-моделей, которые, по сути, представляли собой клеточную культуру в чашке Петри, 3D-модели позволяют создать работающий объемный «макет» нужной нам ткани [18].
Рисунок 5а. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 2D-модель. Клетки, выращенные на двумерной пластиковой подложке, ведут себя неестественно: нарастают в один слой, из-за чего нарушается межклеточное взаимодействие.
Рисунок 5б. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 3D-модель. «Живой макет» ведет себя почти так же, как функциональная ткань: клетки растут и располагаются так, как им «нравится», поэтому у них сохраняется способность к полноценному межклеточному взаимодействию.
3D-модели можно модифицировать и дорабатывать. Уже созданы первые гидрогели — биосовместимые синтетические полимеры, способные удерживать воду. С появлением гидрогелей появилась и теоретическая возможность печатать внутренние органы.
Перед тем как первые напечатанные в лаборатории 3D-органы поступят в больницу, ученым придется решить еще множество проблем. Например, исследователям только предстоит разобраться с тем, как «подвести» к искусственным органам кровеносные сосуды. В этом тоже может помочь понимание биологии ВКМ — ведь мы уже знаем, что внеклеточный матрикс управляет в том числе и ростом сосудов [19].
Заключение
Внеклеточный матрикс — огромная тема, которую очень сложно охватить в одной статье. Ясно одно: если мы сумеем разобраться, как ВКМ функционирует и влияет на клетки, медицина сделает огромный шаг вперед.
Новые открытия в области изучения ВКМ помогут нам:
Судя по всему, ждать прорыва в изучении ВКМ осталось недолго.