митохондрии не делятся в течение жизни клетки
Митохондрии не делятся в течение жизни клетки
Все приведённые ниже признаки, кроме двух, можно использовать для описания общих свойств характерных для митохондрий и пластид. Определите два признака, «выпадающих» из общего списка, и запишите в ответ цифры, под которыми они указаны.
1) не делятся в течение жизни клетки
2) имеют собственный генетический материал
3) содержат ферменты окислительного фосфорилирования
4) имеют двойную мембрану
5) участвуют в синтезе АТФ
Общие свойства митохондрий и пластид:
1) двумембранные органоиды;
2) содержат собственную кольцевую ДНК (полуавтономные органоиды);
3) содержат мелкие рибосомы 70s;
4) способны синтезировать собственные белки;
5) синтезируют АТФ (в хлоропласте АТФ образуется в световую фазу фотосинтеза);
6) новые органоиды образуются путем деления.
(1) не делятся в течение жизни клетки – признак выпадает (митохондрии и хлоропласты делятся в течение жизни клетки);
(2) имеют собственный генетический материал (кольцевую ДНК) – общий признак митохондрий и пластид;
(3) содержат ферменты окислительного фосфорилирования – признак выпадает (относится только к митохондриям, пластиды не содержат ферменты окислительного фосфорилирования);
(4) имеют двойную мембрану – общий признак митохондрий и пластид;
(5) участвуют в синтезе АТФ – общий признак митохондрий и пластид (хлоропластов).
Митохондрии – маленькие труженики или большие начальники?
Если вы думаете, что самая важная для нас история совместной жизни начинается во время свадьбы, то это совсем не так. Самая важная история совместной жизни каждого человека началась более миллиарда лет назад, когда наши далекие одноклеточные предки вынуждены были подписать «брачный контракт» с теми, кого мы сейчас называем митохондрии (см. теория симбиогенеза).
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.
Рис. 1. Схематическое строение митохондрии
«Как белка в колесе» — динамика митохондрий
Не вся вина за метаболические нарушения лежит на нашем переедании. Метаболические нарушения связывают, в первую очередь, с неспособностью митохондрий справиться с питательными веществами. Митохондриям в клетке приходится нелегко. Мы «кормим» свои клетки то слишком много, то слишком мало, а предъявляем им «заявку» выдать энергию в виде АТФ, количество которой точно должно соответствовать нашим потребностям. Для того чтобы регулярно «выкручиваться» из этой ситуации митохондрии и правда используют некоторые «движения» — деление (fission) и слияние (fusion). Эти «митодвижения» объединяют под названием «динамика митохондрий». Баланс между делением и слиянием митохондрий — центральный механизм биоэнергетической адаптации к метаболическим потребностям клетки [2, 3].
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Итак, если в клетку какой-либо из этих тканей (кроме некоторых нейронов в мозге, об этом потом) поступает большое количество питательных веществ (поступление превышает затраты), то митохондрии находятся в разделенном (фрагментированном) состоянии. Если клетка находится в состоянии голода (поступления меньше затрат), то происходит слияние митохондрий и они находятся в соединенном состоянии. [3,4]. Так поддерживается гомеостаз клетки (рис.2).

Рис. 2 Регулирование морфологии и биоэнергетической эффективности митохондрий в ответ на избыточное или недостаточное поступление питательных веществ [из 2]
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
В чем хитрость этих движений? Если клетка находится в состоянии голода, то слияние митохондрий позволяет увеличить их биоэнергетическую эффективность (количество АТР, которое создается на молекулу питательного вещества). Если же в клетку поступает избыток питательных веществ, то их можно либо 1) запасти, либо 2)рассеять эту энергию в виде тепла. Задача митохондрий в этом случае, — рассеять больше энергии в виде тепла, запасти меньше в виде АТФ (накопление NADH и АФК приведет к окислительному стрессу). Фрагментация митохондрий позволяет им снизить биоэнергетическую эффективность, главным механизмом снижения которой считается «утечка» протонов.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).

Рис.3 Баланс энергопотребления и энерогообеспечения связан с соответствующими изменениями архитектуры митохондрий и их биоэнергетической эффективностью [из 3]
Физиологические процессы, связанные с увеличением спроса на энергию и снижением энергопоставок, (например, острый стресс, голодание и фаза G1/S) характеризуются удлинением митохондрий и дыханием, связанным с синтезом АТФ. С другой стороны, физиологические процессы, связанные с уменьшением спроса на энергию и увеличением ее поставок (высокий уровень питательных веществ, ожирение и диабет типа 2), связаны с фрагментацией митохондрий, выделением тепла или снижением функции митохондрий.
Здоровые циклы деления и слияния – залог метаболического здоровья клетки
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
Длительное ингибирование деления митохондрий (при длительном клеточном голодании) приводит к накоплению поврежденных митохондрий, которые не могут быть сегрегированы [3, 4].
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.

Рис.4 Жизненный цикл митохондрий и его регулирование доступностью питательных веществ [из 3]
Митофузины – не просто какие-то белки
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Mfn1 выполняет сходные функции, однако, вероятно, в других тканях (экспрессия Mfn2 и Mfn1 различается в разных тканях) – Mfn1 экспрессируется в большей степени в сердце, печени, поджелудочной, яичках, а Mfn2 в сердце, скелетных мышцах, мозге, бурой жировой ткани.
Таким образом митофузины являются ключевыми регуляторами динамики митохондрий. Экспрессия митофузинов различна в различных органах, они обеспечвают биоэнергетическую эффективность и механизмы адаптации к доступности питательных веществ, а также от них зависит «судьба» клетки. Не удивительно, что митохондриальные fusion белки являются потенциальными таргетами фармакологических вмешательств [2, 5].
Гипоталамус, митохондрии, метаболическая дисфункция и старение
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
Еще Дильман (Дильман В. М «Большие биологические часы») указывал на ведущую роль гипоталамуса в планомерном развитии метаболической дисфункции, приводящей к ожирению, сахарному диабету, сердечно-сосудистым, онкологическим заболеваням и старению. Согласно сформированной Дильманом теории гиперадаптоза чувствительность рецепторов гипоталамуса к сигналам, поступающим от тканей организма (лептин, инсулин и др.) постепенно планомерно снижается с возрастом. Для того, чтобы вызывать его «ответ» нужно все больше и больше того или иного гормона, — больше инсулина, больше лептина. Развивается инсулин- и лептинрезистентность, метаболические заболевания, приводящие к старению и смерти.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).
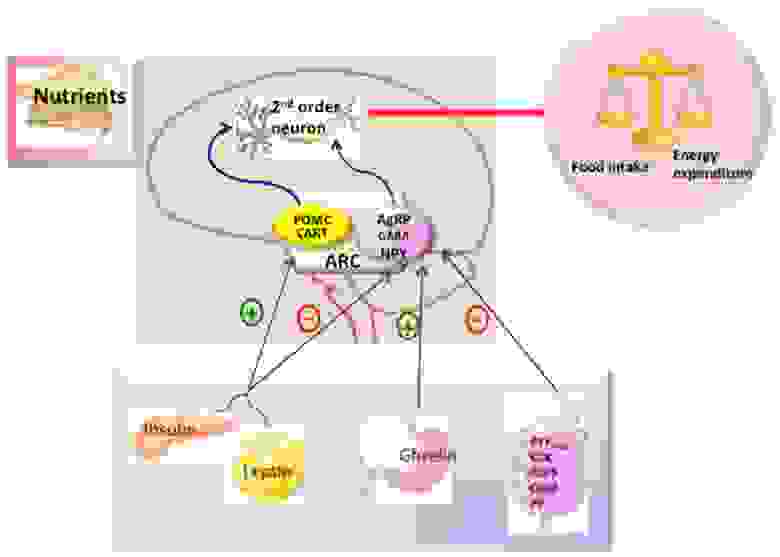
Рис. 5. Гипоталамический контроль метмболизма энергии. Мозг интегрирует метаболические сигналы (лептин, инсулин, грелин, PYY3-36) от периферических тканей, таких как поджелудочная железа, жировая ткань, желудок. В мозге специализированные нейронные сети координируют адаптивные изменения в поглощении и расходе пищи [из 5].
Так кто и как регулирует чувствительность нейронов гипоталамуса?
Изучение динамики митохондрий в тканях мозга показало, что динамика митохондрий играет существенную роль в способности нейронов гипоталамуса контролировать уровень глюкозы и гомеостаз энергии в организме [6,7,8].
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).

Рис.6. Метаболическая адаптация к стимулам окружающей среды [из 2]
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
Как повлиять на динамику митохондрий?
1. Питание и физические упражнения
Циклы питания Избыток пищи и высокожировая диета (HFD) ингибирует слияние митохондрий в клетках (в некоторых нейронах мозга механизм иной). Незавершенный цикл деления-слияния митохондрий нарушает процессы аутофагии → увеличивается внутриклеточная гетерогенность митохондрий → не происходит селективного удаления митохондрий → накапливаются митохондрии с дисфункцией.
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
От «здоровья» мембран митохондрий зависят все ключевые процессы, — аутофагия, митофагия, апоптоз, связь митохондрий с эндоплазматической сетью, динамика митохондрий. Мембраны клеточных органелл состоят из липидов и из белков. Ремоделирование этих мембран контролируется взаимодействиями между специфическими липидами и белками.
К насыщенным жирным кислотам относится пальмитиновая (С16) и стеариновая (С18). Показано, что употребление стеариновой кислоты (C18:0) стимулирует процесс слияния митохондрий. Действие ее связано с влиянием на митофузины. У мышей диетические добавки стеариновой кислоты могут частично восстанавливать митохондриальную дисфункцию, вызванную мутациями в генах Pink1 или parkin. В нейтрофилах людей, находящихся 2 дня на low-С18:0 диете, митохондрии находятся во фрагментированном состоянии (50% клеток имели фрагментированные МХ, 10 % соединенные МХ). Употребление стеариновой кислоты приводило у них к слиянию митохондрий через 3 часа [8]. Таким образом., стериновая кислота важна для поддержания циклов динамики митохондрий. Больше всего стеариновой кислоты находится в какао-бобах (31-34 %).
Фосфолипиды – основные компоненты мембран органелл. Они также регулируют динамику митохондрий, при этом их влияние различно [9].
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Для повышения эффективности доставки насыщенных жирных кислот в мембрану возможно использование переносчиков. Например, – использование насыщенного фосфатидилхолина (дипальмитофосфатидилхолин и дисероилфосфатидилхолин), который, потенциально, сможет доставить насыщенные ЖК прямо в кардиолипин [10]. Холин, как переносчик, легко проходит через цитозоль и поступает в митохондрии.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).
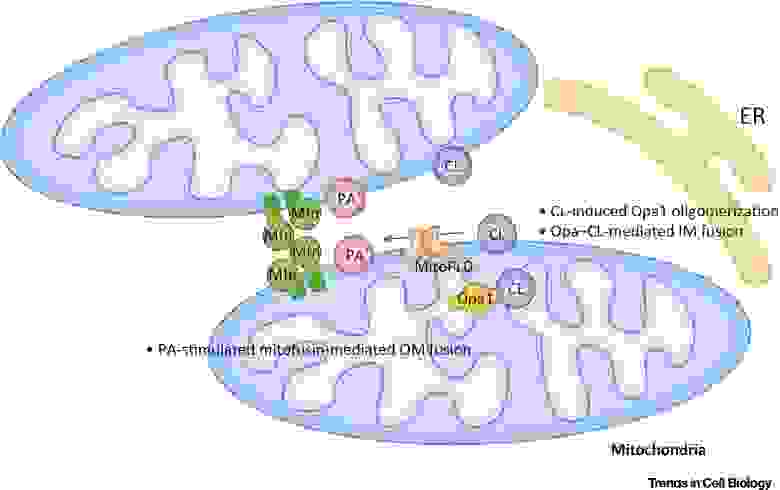
Рис.7 Регулирование слияния митохондрий фосфатидной кислотой (PA) и кардиолипином (CL) [из 9].
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Наиболее интересным является использование веществ, которые способны напрямую влиять на экспрессию митофузинов. Одним из потенциальных препаратов назван лефлюномид (leflunomide), который был одобрен FDA [5,11]. Он является индуктором экспрессии Mfn1 и Mfn2, а зарегистрирован был как препарат для лечения ревматоидного артрита.
Генная терапия митохондрий
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Ранее считалось, что образ жизни, в том числе переедание, приводит к образованию свободных радикалов, окислительному стрессу, мутациям митохондриального генома и, последовательно, нарушениям функциии митохондрий. Однако, в последнее время есть убедительные доказательства того, что мутации митохондриальной ДНК неизбежны, есть у всех (heteroplasmic DNA point mutations) и связаны с ошибками репликации, а не с оксидативными повреждениями, к которым митохондриальная ДНК довольно устойчива [12]. Уже на этапе оплодотворенной яйцеклетки часть наших митохондрий несут мутации. Со временем они делятся, мутантных митохондрий становится больше, они не могут нормально выполнять свою функцию.

Рис. 8 Клональное экспансия мутированных молекул мтДНК может приводить к митохондриальной дисфункции или может быть «спасено» компенсационным биогенезом [из 12].
Тут очень кстати можно было бы использовать редактирование генома митохондрий in vivo. Было показано, что для heteroplasmic DNA point mutations у мышей уже был достигнут значительный успех при помощи targeted zinc-finger nucleases (mtZFN) с доставкой при помощи аденовирусного вектора [13].
Перенос митохондрий
Другой многообещающий метод устранения дисфункции митохондрий – это трансплантация митохондрий. Суть этого подхода сводится к «замене» поврежденных митохондрий здоровыми экзогенными митохондриями. Впервые данный подход был использован клинически у детей с ишемией миокарда. Для трансплантации использовали аутологичные изолированные митохондрии, которые изолировали при прямой мышцы живота (делали биопсию, а затем готовили препарат), а затем вводили путем прямой инъекции [14]. Прорабатываются различные подходы введния митохондрий: прямое инъецирование изолированных митохондрий (локальное введение) и системное введение в кровоток, когда митохондрия сама «ищет» в какую клетку ей отправиться. Группы исследователей изучают возможность трансплантации митохондрий при болезни Паркинсона, ишемии печени, инсульте, митохондриальных заболеваниях [15].
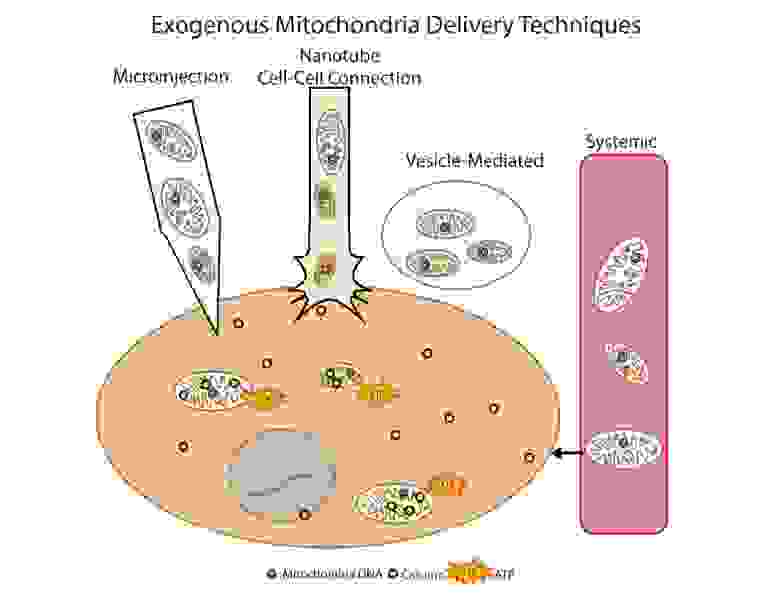
Рис.9 Способы доставки экзогенных митохондрий в клетку
Митохондрии
Человеческие клетки содержат в среднем 1500 митохондрий.Их особенно много в клетках с интенсивным метаболизмом (например, в мускулах или печени).
Митохондрии подвижны и перемещаются в цитоплазме в зависимости от потребностей клетки. Благодаря наличию собственной ДНК они размножаются и самоуничтожаются независимо от деления клетки.
Клетки не могут функционировать без митохондрий, без них жизнь не возможна.
Различный типы клеток отличаются друг от друга как по количеству и форме митохондрий, так и по количеству крист. Особенно много крист имеют митохондрии в тканях с активными окислительными процессами, например в сердечной мышце. Вариации митохондрий по форме, что зависит от их функционального состояния, могут наблюдаться и в тканях одного типа. Митохондрии — изменчивые и пластичные органеллы.
Также упомянем, что существенно упростилась сама структура митохондриальной ДНК, так как многие составные части процесса транскрипции (чтения) ДНК были утеряны, вследствие чего исчезла необходимость в особом структурировании митохондриального кода. Белки-полимеразы, осуществляющие транскрипцию (чтение) и репликацию (удвоение) митохондриальной ДНК, кодируются не в ней самой, а в ядре.
В день преобразовывается 40 кг. АТФ.Энергия в клетке может принимать различные формы. Принцип действия клеточного механизма – преобразование потенциальной энергии в энергию, которую может напрямую использовать клетка.Потенциальные виды энергии попадают в клетку через питание в виде углеводов, жиров и белковКлеточная энергия состоит из молекулы называемой АТФ: Аденозинтрифосфат. Она синтезируется в результате преобразования углеводов, жиров и белков внутри митохондрии.За день в организме взрослого человека синтезируется и распадается эквивалент 40 кг АТФ.В митохондриях локализованы следующие метаболические процессы: превращение пирувата в ацетил-КоА, катализируемое пируватдегидрогеназным комплексом: цитратный цикл; дыхательная цепь, сопряженная с синтезом АТФ (сочетание этих процессов носит название «окислительное фосфорилирование»); расщепление жирных кислот путем ;-окисления и частично цикл мочевины. Митохондрии также поставляют клетке продукты промежуточного метаболизма и действуют наряду с ЭР как депо ионов кальция, которое с помощью ионных насосов поддерживает концентрацию Са2+ в цитоплазме на постоянном низком уровне (ниже 1 мкмоль/л).
Поврежденная митохондриальная ДНК за несколько месяцев порождает более 30 подобных себе митохондрий, т.е. с теми же повреждениями.
Восстановление функций метахондрия и ограничение процессов приводящих к старению возможно при применении коэнзима Q10. В результате проведенных экспериментов было установлено замедление процессов старения и увеличение продолжительности жизни у некоторых многоклеточных организмов в результате введения добавок CoQ10.
Q10 (CoQ10) — это «свеча зажигания» человеческого организма: так же, как автомобиль не может работать без пусковой искры, организм человека не может обойтись без CoQ10. Это самый важный компонент митохондрий, вырабатывающий энергию, которая нужна клеткам для деления, перемещения, сокращения и выполнения всех прочих функций. CoQ10 также играет важную роль в выработке аденозинтрифосфата (АТФ) — энергии, которая приводит в движение все процессы в организме. Более того, CoQ10 — это очень важный антиоксидант, который защищает клетки от повреждений.
Хотя наш организм может вырабатывать CoQ10, он не всегда производит его в достаточном количестве. Поскольку мозг и сердце входят в число самых активных тканей организма, дефицит CoQ10 негативно влияет на них в наибольшей степени и может привести к серьезным проблемам с этими органами. Дефицит CoQ10 могут вызвать различные причины, в том числе плохое питание, генетические или приобретенные дефекты и, к примеру, повышенная тканевая потребность. Сердечно-сосудистые заболевания, включая высокие уровни холестерина и повышенное артериальное давление, также требуют увеличения уровня CoQ10 в тканях. Кроме того, поскольку уровни CoQ10 снижаются с возрастом, людям старше 50 лет может потребоваться больше этого вещества. Многие исследования показали, что ряд лекарственных препаратов (прежде всего гиполипидемические лекарственные средства, такие как статины) снижают уровень CoQ10.
Учитывая ключевую роль CoQ10 в митохондриальной функции и защите клеток, этот кофермент может быть полезен при наличии целого ряда проблем со здоровьем. CoQ10 может принести пользу при наличии такого широкого перечня болезней, что нет никаких сомнений в его важности как питательного вещества. CoQ10 является не только антиоксидантом общего действия, но и может помочь при наличии следующих заболеваний:
Сердечно-сосудистые заболевания: высокое кровяное давление, застойная сердечная недостаточность, кардиомиопатия, защита во время хирургических операций на сердце, высокий уровень холестерина, который лечат с помощью медикаментов, особенно статинов
Рак (для повышения иммунной функции и/или компенсации побочных эффектов химиотерапии)
Сахарный диабет
Мужское бесплодие
Болезнь Альцгеймера (профилактика)
Болезнь Паркинсона (профилактика и лечение)
Парадонтоз
Дегенерация желтого пятна
Исследования на животных и людях подтвердили полезность CoQ10 при всех вышеуказанных заболеваниях, особенно сердечно-сосудистых. В самом деле, исследования показали, что 50–75 процентов людей с различными заболеваниями сердечно-сосудистой системы страдают от дефицита CoQ10 в сердечных тканях. Устранение этого недостатка часто может приводить к драматическим результатам у пациентов с какой-либо болезнью сердца. Например, было доказано, что дефицит CoQ10 имеет место у 39 процентов пациентов с высоким артериальным давлением. Только этот вывод обуславливает необходимость приема добавок с CoQ10. Однако, как представляется, преимущества CoQ10 не ограничиваются устранением сердечно-сосудистой недостаточности.
Проведенное в 2009 году исследование, результаты которого были опубликованы в журнале Pharmacology & Therapeutics, дает основания предположить, что воздействие CoQ10 на артериальное давление становится заметным только через 4–12 недель после лечения и типичное снижение систолического и диастолического артериального давления у больных с высоким давлением является довольно скромным — в пределах 10 процентов.
Статиновые препараты, такие как Crestor, Lipitor, и Zocor, действуют путем ингибирования фермента, который необходим печени для выработки холестерина. К сожалению, они также блокируют выработку других веществ, необходимых для функционирования организма, в том числе CoQ10. Это может объяснить наиболее часто встречающиеся побочные эффекты данных препаратов, особенно усталость и мышечные боли. В одном крупном исследовании ENDOTACT, итоги которого были опубликованы в International Journal of Cardiology в 2005 году, было продемонстрировано, что статиновая терапия значительно снижает уровень CoQ10 в плазме крови, но это снижение можно предотвратить с помощью приема добавки со 150 мг CoQ10. Кроме того, добавки с CoQ10 значительно улучшают функцию выстилки кровеносных сосудов, что является одной из ключевых целей при лечении и профилактике атеросклероза.
В двойных слепых исследованиях было продемонстрировано, что прием добавок с CoQ10 был весьма полезным для некоторых пациентов с болезнью Паркинсона. У всех пациентов в этих исследованиях были три основных симптома болезни Паркинсона — тремор, ригидность и замедление движения, и диагноз заболевания был поставлен им в течение последних пяти лет.
В 2005 году исследование, опубликованное в Archives of Neurology, также показало замедление снижения функциональности у пациентов с болезнью Паркинсона, которые принимали CoQ10. После первоначальной проверки и исходных анализов крови пациенты были разделены случайным образом на четыре группы. Три группы получали CoQ10 в разных дозах (300 мг, 600 мг и 1200 мг в день) в течение 16 месяцев, в то время как четвертая группа получала плацебо. Группа, которая принимала дозу 1200 мг, показала меньшее ухудшение психических и двигательные функций и способности осуществлять повседневные действия, такие как кормление или одевание себя. Наибольший эффект был отмечен в повседневной жизни. У групп, которые получали 300 мг и 600 мг в день, инвалидность развилась в меньшей степени, чем в группе плацебо, но и результаты у членов данных групп были менее кардинальными, чем у тех, кто получал самую высокую дозировку препарата. Эти результаты показывают, что благотворного влияния CoQ10 при болезни Паркинсона можно достичь при наиболее высоких дозах приема препарата. Ни у кого из пациентов не были отмечены какие-либо существенные побочные эффекты.
Кофермент Q10 является очень безопасным. Никогда не сообщалось о серьезных побочных эффектах даже при его длительном применении. Поскольку безопасность во время беременности и лактации не была подтверждена, CoQ10 не следует использоваться в эти периоды, если только врач не установит, что клинические результаты перевешивают риски. Я обычно рекомендую принимать от 100 до 200 мг CoQ10 в день. Для наилучшего усваивания мягких желатиновых капсул их следует принимать с едой. При более высоких уровнях дозировки лучше принимать препарат разделенными дозами, а не одной дозой (лучше по 200 мг три раза в день, чем сразу все 600 мг).
