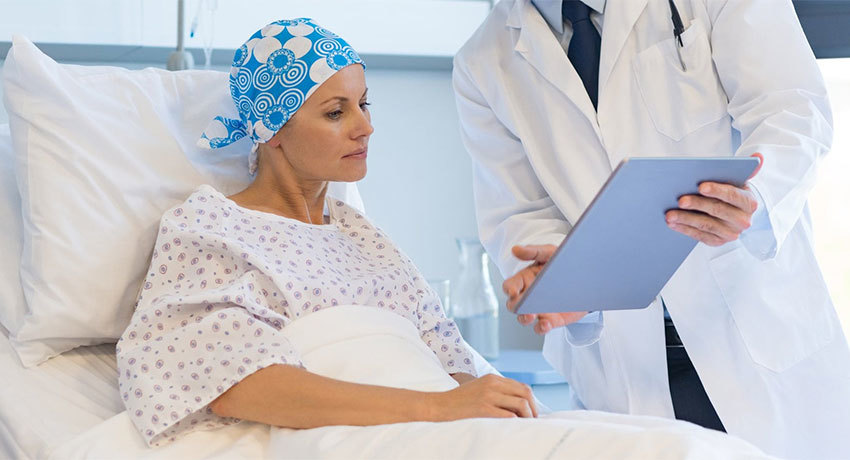
метастазы в брюшной полости прогноз срока жизни применение химиотерапии
HIPEC: гипертермическая внутрибрюшная химиотерапия
Егиев Валерий Николаевич
В половине случаев при опухолях ЖКТ и репродуктивных органов развивается перитонеальный карциноматоз: метастазы распространяются по всей поверхности брюшины – оболочки внутренних органов и стенок брюшной полости.
HIPEC (hyperthermic intraperitoneal chemotherapy) или гипертермическая внутрибрюшная химиотерапия — это не просто одно из последних достижений онкологии и самый современный метод лечения метастазов в брюшине, но и множество спасенных жизней, годы вместо отведенных месяцев.
В чем сложность лечения перитонеального карциноматоза?
Способов лечения карциноматоза до последнего времени не существовало в принципе, известные нам методики были бессильны.
Так, например, лучевая терапия вообще не применяется для лечения карциноматоза из-за риска серьезных осложнений после облучения такой большой области.
Системная химиотерапия также практически бесполезна из-за особенностей опухолевых очагов при карциноматозе.
Даже хирургическое лечение не дает нужных результатов, т.к. хирург просто не способен увидеть все метастазы на поверхности брюшины, а также не ко всем из них возможен доступ. При этом достаточно единичных раковых клеток для быстрого рецидива в течение 2-3 месяцев.
Таким образом пациент с карциноматозом признавался неизлечимым, а прогнозы по продолжительности его жизни не превышали полугода.
Сегодня благодаря гипертермической внутрибрюшной химиотерапии HIPEC нам удается увеличивать 5-летнюю выживаемость до 50%, а иногда и добиваться полного излечения пациента. Прогноз выживаемости во многом зависит от локализации опухоли, например, при раке яичников или аппендикса он несколько выше, чем при колоректальном раке.
В России гипертермическая внутрибрюшная химиотерапия HIPEC применяется пока слишком мало по причине высокой стоимости процедуры и оборудования для ее проведения, а также отсутствия врачей, освоивших ее. К сожалению, многие из них даже не слышали о HIPEC, тогда как онкологам многих других стран удается добиваться отличных результатов лечения благодаря применению этой методики.
Что такое HIPEC?
Методика HIPEC направлена на точечную борьбу с раковыми клетками в брюшной полости за счет обработки подогретым раствором из химиопрепаратов. Процедура выполняется во время циторедуктивного хирургического вмешательства.
Важнейшая задача HIPEC – уничтожить максимальное количество раковых клеток, которые могут спровоцировать рецидив. Хирург не способен удалить все очаги болезни, но грамотно проведенная гипертермическая внутрибрюшная химиотерапия обеспечит наиболее масштабное устранение онкоклеток, а значит позволит значительно увеличить продолжительность жизни и сократить число рецидивов.
Канцероматоз брюшины
Канцероматоз брюшины — вторичное злокачественное поражение оболочки, выстилающей стенки брюшной полости и покрывающей внутренние органы изнутри. Чаще всего заболевание возникает при метастазировании из первичной опухоли разной локализации: желудка, поджелудочной железы, кишечника, при раке яичника, печени и др., реже канцероматоз является первичной опухолью — мезателиомой или псевдомиксомой.
Как развивается канцероматоз
Брюшина, выстилающая изнутри брюшную полость, с разветвленной сетью сосудов является благодатной средой для образования метастазов — очагов патологии, появляющихся на поздних стадиях рака. Клетки опухоли, отрываясь от основного очага, разносятся по организму с током крови и лимфы, закрепляясь в разных местах, в том числе на брюшине, образуя метастазы. В дальнейшем раковые клетки прорастают вглубь. В зависимости от тяжести процесса различают несколько стадий канцероматоза брюшины.
Помимо метастазирования, причиной перитонеального канцероматоза может быть прорастание опухоли в полость брюшины, например, при раке желудка. Кроме того, теоретически существует риск попадания раковых клеток на брюшину при проведении операции по поводу удаления раковой опухоли.
Симптомы
Поскольку процесс в большинстве случаев является вторичным, симптомы канцероматоза брюшины определяются состоянием первичной опухоли. При опухолях желудочно-кишечного тракта основным признаком является нарушение пищеварения, боли в животе, кишечная непроходимость, при раке печени — желтуха и т.п.
Характерный признак канцероматоза брюшины — асцит, при котором в брюшной полости в большом количестве скапливается выпот. При этом живот увеличивается в объеме, скопление жидкости препятствует дыханию, появляется одышка, возможно появление признаков сердечной недостаточности. Однако нередко асцит является единственным признаком, и канцероматоз брюшины диагностируется при поступлении пациента в клинику для обследования.
Поскольку канцероматоз брюшины при раке другой локализации свидетельствует о тяжелой степени онкологического процесса, возникают симптомы, характерные для запущенной стадии рака: существенная потеря веса, вследствие интоксикации — тошнота, слабость, головная боль, у пациента повышается температура. Крупные метастазы нередко удается прощупать через брюшную стенку.
Диагностика
При планировании лечения важно определить количество и величину метастазов, площадь поражения брюшины, поэтому в диагностическую программу должно входить УЗИ. Более полную картину дает КТ или МРТ — при канцероматозе брюшины обследование позволяет оценить структуру и характер очагов.
Обязательно назначается цитологическое исследование асцитической жидкости, взятой на анализ с помощью пункции. Информативной является лапароскопия, в ходе которой берутся частицы ткани для гистологии. В качестве дополнительного метода возможно обследование на онкомаркеры — эта диагностика рекомендована для оценки прогноза канцероматоза брюшины, выявления рецидива или контроля эффективности терапии.
Лечение
Прежде всего удаляется первичная опухоль; это может быть резекция или удаление пораженных процессом органов. Также в ходе операции при канцероматозе брюшины удаляются все видимые метастатические очаги. Однако микроскопические узлы устранить невозможно, в дальнейшем они приведут к рецидиву. Чтобы исключить подобное развитие событий, назначается системная химиотерапия, в ходе которой цитостатики вводятся внутривенно. Однако такая методика имеет ряд недостатков: необходимость высокой дозы препарата для достижения эффекта, что вызовет побочные эффекты, воздействие на здоровые ткани и др.
Сегодня существует более эффективный метод лечения — интраперитонеальная химиотерапия; при канцероматозе брюшины она назначается в качестве дополнительного метода, позволяющего устранить даже микроскопические узлы. Процедура заключается во введении нагретого до 42-43°С химиопрепарата в полость брюшины. В ходе промывания оставшиеся после операции раковые клетки уничтожаются благодаря воздействию химиопрепарата в сочетании с высокой температурой. Среди преимуществ методики также следует отметить:
Внутрибрюшная химиотерапия — инновационная методика в лечении канцероматоза брюшины, благодаря которой удалось увеличить выживаемость пациентов с тяжелой стадией рака. Сегодня продолжительность жизни таких больных в среднем увеличилась на 8 лет.
Для каждого пациента, обратившегося к нам, мы подбираем тактику лечения канцероматоза брюшины только индивидуально. Мы предлагаем качественное обследование и лечение по инновационным методикам в клиниках, оснащенных современным оборудованием.
Канцероматоз брюшины: кому и зачем нужны циторедуктивная операция и HIPEC
Злокачественные опухоли могут метастазировать — распространяться на другие ткани и органы. Если первичная опухоль расположена в брюшной полости, она может распространиться по брюшине — это состояние называется перитонеальным канцероматозом. Такой вариант течения болезни значительно ухудшает прогноз — в среднем, в зависимости от вида опухоли и полученного лечения продолжительность жизни человека составляет от полугода до двух лет. Долгое время пациентам с канцероматозом брюшины могли предложить только паллиативную помощь, но появились и другие методы.
Рассказываем о циторедуктивной операции и гипертермической внутрибрюшинной химиотерапии (HIPEC), которые могут продлить жизнь людям с таким диагнозом.
Этот текст мы написали вместе с Онкоцентром «СМ-Клиника».
Что такое перитонеальный канцероматоз?
Брюшина — оболочка, выстилающая стенки брюшной полости, таза и поверхность внутренних органов — печени, матки, яичников, селезенки, кишечника. Любой патологический процесс, затрагивающий брюшную полость, может распространяться по брюшине за счет движения жидкости и клеток в этом пространстве. Например, эпителиальные опухоли яичников возникают из эпителия маточных труб, который сообщается с брюшиной. Из-за роста опухоли злокачественные клетки «отслаиваются» и могут свободно плавать в перитонеальной жидкости. Как правило, эти клетки имплантируются в область таза и другие части брюшины.
Канцероматоз выглядит как множество опухолевых узлов, покрывающих брюшину. Размер и количество узлов могут быть различными.
При каких опухолях чаще всего развивается канцероматоз брюшины?
Перитонеальный канцероматоз у женщин чаще всего развивается при раке яичников, а у мужчин — при раке толстой кишки и желудка. Например, при раке желудка опухолевые узлы на брюшине возникают у 60% пациентов.
В более редких случаях канцероматоз брюшины может быть самостоятельным заболеванием. Иногда расположение первичной опухоли установить не получается.
Какие симптомы могут указать на перитонеальный канцероматоз?
У этого состояния неспецифические признаки. Среди них:
— увеличение объема живота из-за скопления жидкости в брюшной полости — асцит
— тошнота, вздутие живота
— необъяснимая потеря веса
Злокачественный (то есть вызванный опухолью) асцит, в свою очередь, может вызывать другие симптомы, среди которых:
Перитонеальный канцероматоз может вызывать кишечную непроходимость. В этом случае продвижение содержимого желудка и кишечника через ЖКТ затруднено или отсутствует. Злокачественная кишечная непроходимость чаще встречается у пациентов с раком яичников и колоректальным раком.
Как диагностируют канцероматоз брюшины?
Заподозрить перитонеальный канцероматоз можно с помощью УЗИ, КТ и МРТ брюшной полости и малого таза.
В частности, КТ брюшной полости позволяет приблизительно оценить, насколько опухоль распространена. МРТ будет эффективнее для осмотра малого таза и позволит врачу оценить степень поражения находящихся там органов, например матки, мочевого пузыря.
Однако эти методы позволяют обнаружить только крупные очаги — опухолевые узлы до 5 мм редко отчетливо видны во время УЗИ, КТ и МРТ. Наибольшей точностью обладает лапароскопия: через прокол врач вводит в брюшную полость камеру, осматривает брюшину и, если необходимо, проводит биопсию — забирает часть опухоли на исследование.
Почему канцероматоз брюшины сложно лечить?
«Традиционные» методы лечения онкологических заболеваний — лучевая терапия, операция — не эффективны в случае с канцероматозом брюшины. Облучать такую большую область слишком опасно. Не все опухолевые очаги можно удалить хирургическим путем — метастазы могут быть очень маленького размера, незаметными для врача, или располагаться в труднодоступном месте. Оставшиеся опухолевые клетки спровоцируют рецидив заболевания.
Стандарты лечения канцероматоза брюшной полости включают системную химиотерапию, облегчение симптомов. В последние годы в списке методов появились циторедуктивная операция и HIPEC — гипертермическая внутрибрюшинная химиотерапия.
Что такое циторедуктивная операция и HIPEC?
Для этого брюшную полость пациента промывают нагретым до 42°C градусов раствором химиопрепаратов. В брюшную полость устанавливают катетеры, через которые в организм пациента попадает раствор. Такой способ введения позволяет охватить все отделы брюшной полости. Для отслеживания температуры в брюшную полость помещают датчики.
Местное, а не системное (внутривенное) применение цитостатиков позволяет увеличить дозу препаратов и при этом избежать побочных явлений. Высокая температура в сочетании высокими дозами химиотерапии усиливают противоопухолевый эффект.
Спустя примерно час–полтора раствор удаляют из брюшной полости, промывают ее физраствором и зашивают. В общей сложности такое вмешательство занимает 8–10 часов.
 |
Техник наблюдает за процессом HIPEC-терапии
Кому может подойти такой метод лечения?
Отдельные исследования и мета-анализы демонстрируют эффективность этого метода — циторедуктивная операция в сочетании с гипертермической внутрибрюшинной химиотерапией увеличивает продолжительность жизни пациентов с перитонеальным канцероматозом. Например, в этом исследовании приняли участие пациентки с III стадией эпителиального рака яичников. Авторы приходят к выводу, что добавление гипертермической внутрибрюшинной химиотерапии к циторедуктивной операции увеличивает период без прогрессирования заболевания, общую продолжительность жизни и не повышает количество побочных эффектов по сравнению с циторедуктивной операцией.
Эта лечебная опция считается оптимальным вариантом лечения пациентов с опухолями аппендикса и псевдомиксомами брюшины.
Предполагается также, что профилактическое применение HIPEC может снизить риск развития канцероматоза брюшины в будущем. Не так давно появились данные о положительных результатах профилактического применения HIPEC при раке ободочной кишки, желудка и поджелудочной железы.
Кому циторедуктивная операция и HIPEC не подходят?
Необходимость таких вмешательств определяется исходя из истории болезни, тщательного обследования и общего состояния пациента. Циторедуктивную операцию в сочетании с HIPEC могут не провести, если:
— метастазы вышли за пределы брюшины
— заболевание прогрессирует несмотря на проведенную ранее химиотерапию
— есть кишечная непроходимость, вызванная опухолью
— общее состояние пациента тяжелое
— есть высокая опухолевая нагрузка — опухолевые импланты покрывают значительную часть толстой и тонкой кишки
В целом, исследования, оценивающие эффективность метода, как правило, основаны на результатах нерандомизированных испытаний.
Безопасность процедуры пока изучается. Например, авторы этого исследования пришли к выводу, что циторедуктивная операция в сочетании с HIPEC безопасна и чаще даже безопаснее в сравнении с другими широко распространенными онкологическими процедурами, в частности, операцией Уиппла (способ лечения рака поджелудочной железы — прим. ред.). Однако и сами авторы, и их коллеги отмечают, что у исследования есть недостатки, прежде всего, касающиеся выбора пациентов. У людей с раком поджелудочной железы в большинстве случаев нет других альтернатив, кроме операции Уиппла, а пациенту с перитонеальным канцероматозом можно предложить несколько вариантов: паллиативную терапию, циторедуктивную операцию без HIPEC, — чтобы выбрать оптимальный в конкретном случае способ лечения.
Кроме того, не существует единых протоколов, регламентирующих такое лечение: во время HIPEC могут использоваться различные химиопрепараты, температура, время промывания брюшной полости.
Таким образом, окончательное решение о выборе стратегии лечения пациент и врач должны принять, взвесив все «за» и «против».
Проконсультировать по вопросам назначения циторедуктивной операции в сочетании с HIPEC смогут специалисты Онкоцентра «СМ-Клиника». Врачи Онкоцентра оказывают различные виды помощи пациентам с онкологическими заболеваниями, в том числе проводят циторедуктивные операции с последующей процедурой HIPEC.
Химиотерапия при раке с метастазами
Рак с отдаленными метастазами, как правило, соответствует четвертой стадии заболевания (стадирование зависит от типа и локализации злокачественной опухоли). Иногда обнаруживаются лишь единичные метастазы, которые, как и первичную опухоль, можно удалить хирургически. В ряде случаев это позволяет добиться ремиссии. Однако, чаще всего на момент установки диагноза метастатических очагов уже очень много. Их нельзя удалить. Для большинства пациентов при IV стадии рака основным методом лечения является терапия противоопухолевыми препаратами. Добиться ремиссии уже невозможно, но своевременное и правильное лечение может существенно замедлить прогрессирование заболевания, продлить жизнь.
В Международной клинике Медика24 применяются все виды химиопрепаратов, а также современные, в том числе инновационные, таргетные препараты, иммунопрепараты. Наши врачи подбирают оптимальные комбинации препаратов и проводят курсы лечения в соответствии с международными протоколами. Мы принимаем онкологических пациентов с любыми стадиями рака.
Цели лечения при метастатическом раке
В современной онкологии рак с метастазами рассматривается как неизлечимое хроническое заболевание. Химиопрепараты не смогут уничтожить все метастатические очаги. Но они помогают решить другие важные задачи:
Побеседуйте с лечащим врачом, спросите, с какой целью была назначена химиотерапия в вашем случае. Онкологи в международной клинике Медика24 обязательно предоставят вам подробную информацию.
Мы вам перезвоним, оставьте свой номер телефона
Противоопухолевые препараты для лечения рака с метастазами
При метастатическом раке используют разные виды противоопухолевых препаратов:
Выбирая схему терапии, врач должен учитывать такие факторы, как:
Эффективность разных комбинаций противоопухолевых препаратов при различных злокачественных опухолях была оценена в крупных клинических исследованиях. На основе этих исследований были составлены международные протоколы лечения. Эти документы регулярно обновляются с учетом актуальных данных, и ими руководствуются во всем мире.
В Международной клинике Медика24 лечение рака с метастазами проводится в соответствии с последними версиями международных протоколов.
Как проводят противоопухолевую терапию при метастазах?
После того как врач подобрал комбинацию противоопухолевых препаратов, нужно правильно определить подходящие дозы для конкретного пациента. Особенность химиопрепаратов в том, что у них очень узкий диапазон эффективности и безопасности доз. Если дозировка окажется слишком низкой, то лекарство не сможет эффективно уничтожать раковые клетки, а если слишком высокой — разовьются тяжелые побочные эффекты.
Дозы химиопрепаратов рассчитывают на килограмм массы тела или на квадратный метр площади поверхности тела. Для некоторых групп пациентов дозировки, рассчитанные такими способами, нужно дополнительно скорректировать:
Перед курсом химиотерапии пациенту назначают обследование. Необходимо провести анализы крови, проверить функцию почек, печени, системы. Это помогает правильно спланировать лечение, учесть возможные риски. Перед назначением таргетной терапии и иммунотерапии зачастую требуются генетические анализы образцов опухолевой ткани, полученных во время биопсии.
Чаще всего противоопухолевые препараты вводят в виде растворов внутривенно или принимают в виде таблеток. Лечение проводится циклами. Во время одного цикла вводят препараты, а потом делают перерыв, обычно в течение 2, 3 или 4 недель. При раке с метастазами противоопухолевую терапию проводят в течение неограниченного времени, до тех пор, пока препараты не перестанут помогать, либо пока они не начнут вызвать серьезные побочные эффекты. После этого врач подбирает другую, «запасную», комбинацию препаратов — они тоже прописаны в протоколах лечения.
Помимо системного введения химиопрепаратов, в некоторых случаях может быть применена местная химиотерапия. Лекарственные средства можно вводить:
Как контролируют эффективность химиотерапии?
Обычно, чтобы оценить эффективность химиотерапии при раке с метастазами, нужно провести 2–3 цикла. После этого назначают контрольное обследование, которое может включать инструментальные методы диагностики, анализы на онкомаркеры, другие лабораторные исследования.
Чтобы описать, как опухоль реагирует на лечение, используют специальные термины:
Если на фоне химиотерапии наблюдается частичный ответ или стабилизация заболевания, это говорит о том, что лечение эффективно, и его можно продолжить. Прогрессирование свидетельствует о том, что препараты не помогают, нужно подбирать другие.
Побочные эффекты химиотерапии
Химиопрепараты в первую очередь поражают злокачественные клетки, но под их атаку попадают и нормальные ткани, в которых активно происходит деление клеток. этого могут возникать различные побочные эффекты. Чтобы свести риск их развития к минимуму, в первую очередь врач еще до начала терапии должен тщательно оценить состояние пациента, возможные риски, правильно подобрать комбинации препаратов и их дозы. Пациенту дают рекомендации по поводу образа жизни, питания, рассказывают, при каких симптомах нужно немедленно обратиться к врачу.
Важно регулярно контролировать лабораторные показатели в процессе лечения, чтобы вовремя выявить анемию, снижение уровня тромбоцитов, ослабление иммунитета и другие нарушения. Предотвратить побочные эффекты и существенно их уменьшить помогает поддерживающая терапия.
Мы вам перезвоним, оставьте свой номер телефона
Во власти опухоли: почему метастазы так сложно остановить?
Метастазы в цельном мозге мыши, обработанном по специальной методике. Красный — MDA-231-D клетки, экспрессирующие mCherry; зеленый — сосуды, помеченные антителами к α-SMA, альфа-актинам гладких мышц [1].
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Когда в организме случилось несчастье, и из 100 триллионов нормальных клеток хоть одна переродилась в раковую и не была уничтожена, срабатывает спусковой крючок, и запускается рост опухоли. Постепенно она приспосабливает к себе окружающие клетки, а также оказывает значительное влияние на весь организм. С развитием заболевания некоторые раковые клетки покидают опухоль и формируют метастазы — вторичные очаги опухолевого роста. Зачастую своевременное удаление первичной опухоли и послеоперационная терапия не способны вызвать ремиссию. Оказывается, что первичная опухоль способна «обучать» микроокружение в очагах развития будущих метастазов уже на ранних этапах своего роста. Кроме того, метастазные раковые клетки перепрограммируют экспрессию своих генов так, чтобы лучше прижиться в новом месте обитания. Знание того, как предотвратить эти процессы, а не только рост первичной опухоли, поможет спасти до 90% людей, умирающих от основных видов рака.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Революция в понимании природы метастазирования
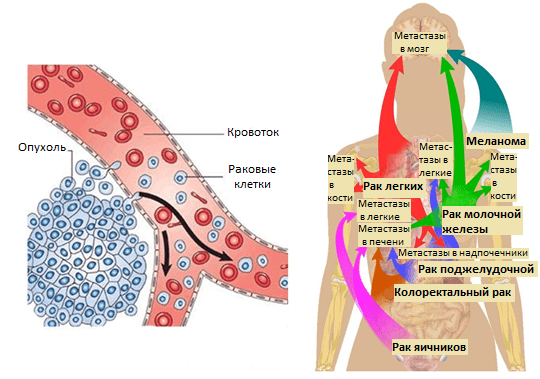
Усилия многих онкологов на протяжении последних десятилетий были направлены на установление деталей возникновения и развития рака — механизмов зарождения опухоли и регуляции ее активного роста, формирования благоприятного микроокружения из клеток стромы [2]. Эти знания несомненно привели к разработке новых подходов в терапии онкозаболеваний. Со временем стало понятно, что основная угроза рака заключена в способности к распространению по организму. Так, некоторые раковые клетки первичной опухоли (то есть развившейся изначально) отделяются от нее за счет эпителиально-мезенхимального перехода или других механизмов [3] и, попадая в кровоток или лимфоток, по маленьким капиллярам путешествуют в главные магистрали сосудистой системы. Они покидают ее за счет задержки в узких капиллярах органов, адгезии к их эндотелиальной стенке и выхода из просвета сосуда в строму органа (рис. 1). Лишь небольшой процент раковых клеток, покинувших первичную опухоль, преуспевает в этом процессе и выживает в новой среде. Эти клетки формируют будущие очаги роста опухоли в новых органах — метастазы.
Рисунок 1. Метастазирование и пути рассеивания раковых клеток.
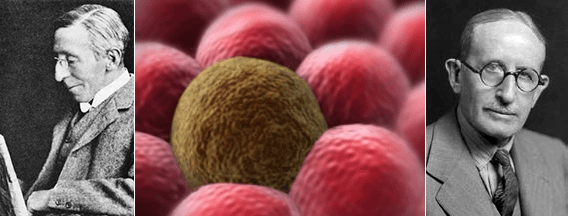
Процесс рассеивания раковых клеток по организму, названный метастазированием (от древнегреч. «менять, переносить»: meta — «через» + histanai — «устанавливать»), впервые описал еще в 1889 году Стивен Педжет [4], но механизм его развития оставался загадкой для ученого сообщества долгое время (рис. 2).
Рисунок 2. Основоположники учений о метастазировании: английский хирург Стивен Педжет (слева) и американский патолог Джеймс Юинг (справа).
Педжет провел аналогию такого распространения раковых клеток с прорастанием семян. Они тоже выживают и делятся на плодотворной «почве» — в подходящем микроокружении. В те времена невозможно было найти этому экспериментального подтверждения, и долго преобладала совсем иная теория — Джеймса Юинга (рис. 2). Он утверждал, что основную роль в распределении метастазов по организму играет динамика кровотока и устройство сосудистой системы.
Наконец в 1970-е годы в ходе нескольких экспериментов по инъекции радиоактивно меченных раковых клеток мышам Исаак Фидлер смог доказать, что результат метастазирования также зависит от природы раковых клеток. В этом случае клетки меланомы развивали метастазы только в легких, но не в печени, в сосудах которой они также задерживались, но позже не выживали [5].
Позднее было установлено еще больше фактов, подтверждающих, что раковые клетки разной природы метастазируют преимущественно в определенные органы и иногда даже в заданной последовательности. Например, клетки рака молочной железы — сначала в кости, печень, лимфатические узлы, легкие, а потом уже в мозг; клетки рака желудочно-кишечного тракта и яичников — в печень и легкие; рака простаты — в основном, в кости (рис. 1). Явление специфичного распределения метастазов по организму назвали органотропией метастазирования. Чаще всего метастазы встречаются в легких, печени и костях.
Несмотря на активные исследования, в онкологии все еще остается много вопросов без ответа. Отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? Как метастазам удается выжить после удаления первичной опухоли и проведенной химиотерапии?
Генетическая и эпигенетическая гетерогенность при метастазировании
Генетическая информация лежит в основе программирования поведения клетки. Перерождение нормальных клеток организма в раковые (злокачественная трансформация) обусловлено мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Помимо таких выгодных для опухолевых клеток мутаций, также происходят мутации в генах-пассажирах, то есть тех, что изначально не имеют влияния на рост опухоли. С каждым поколением, новым клоном внутри опухоли, накапливаются эти генетические изменения, и некоторые клоны преуспевают больше остальных, что стало основой для формирования представления об эволюции внутри опухоли. Одна из предложенных гипотез, почему некоторые клетки опухоли приобретают способность к метастазированию, основана на схожем со злокачественной трансформацией принципе. По всей видимости, у них тоже накапливаются мутации в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения она так и не нашла, ученые сходятся во мнении, что большинство клеток первичной опухоли способны метастазировать. А вот что происходит позже с геномами метастазных клеток?
В результате сравнения геномов клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов (в печени, легких, дальних лимфатических узлах) было установлено, что геномы метастазов продолжают эволюционировать в своих очагах роста независимо от первичной опухоли [6]. Интересно, что паттерн мутаций схож между метастазами в одном органе, но различен между метастазами в разных органах. Это означает, что раковые клетки на самом глубоком уровне адаптируются к новому микроокружению в зависимости от занятой ими ниши. Изучение генетических изменений при метастазировании рака поджелудочной железы выявило наличие разных субклонов (новых поколений клона), которые формируют метастазы. Однако различия между ними оказались не больше, чем между двумя случайно взятыми клетками одного организма [7].
Интересно, что обнаружили как минимум один ген, FBXW7, мутации в котором противодействуют метастазированию [8]. Происходит это за счет усиления провоспалительной реакции, пролиферации и активности T-лимфоцитов, которые стимулируют формирование адаптивного иммунитета к опухолевым клеткам. Таким образом, мутации в гене FBXW7 противодействуют опухолевой иммунносупрессии. Ее проявления, такие как уменьшение количества лимфатических сосудов и эффекторных T-лимфоцитов в первичной опухоли, связаны с лицензированием метастазирования [8].
Следующую ступень в регуляции экспрессии генов после непосредственных изменений в ДНК (мутаций, вариаций числа копий и т.д.) занимают эпигенетические изменения (метилирование гистонов, ДНК и др.) (рис. 3). По своей природе они более пластичны, более переменчивы по сравнению с генетическими изменениями и подвластны влиянию клеточной сигнализации, которая подстраивается под воздействие внешних факторов. Оказалось, что эпигенетический код значительно отличается в клетках метастазов по сравнению с первичной опухолью. При раке поджелудочной железы потеря большого количества меток неактивного хроматина (гетерохроматина) — метилирования гистонов (H3K9, H4K20) — и ослабление метилирования ДНК связаны с метастазированием. Эти модификации в раковых клетках переводят участки гетерохроматина в активное состояние, доступное для транскрипционных факторов, и в результате усиливают экспрессию генов онкогенеза, таких как регуляторы мезенхимального фенотипа, KRAS-сигнализации и метаболизма [9].
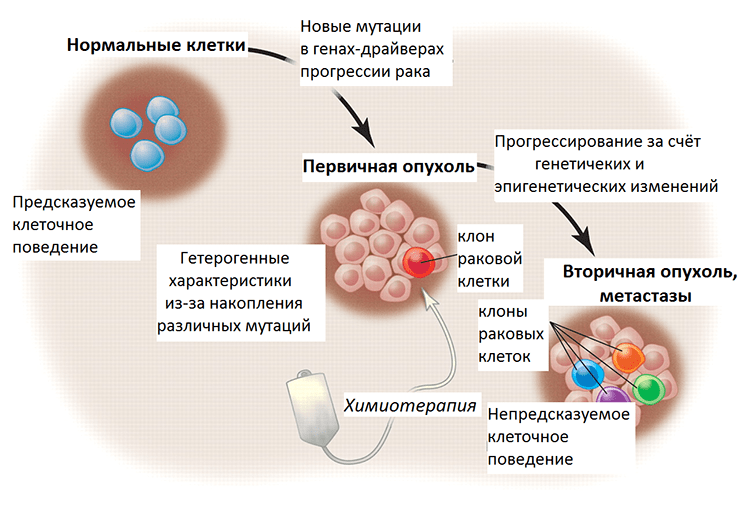
Рисунок 3. Злокачественная трансформация и прогрессирование рака в перспективе генетических и эпигенетических изменений. Нормальные клетки ткани имеют предсказуемое поведение — темпы пролиферации, срок жизни, характер взаимодействия с другими клетками. При злокачественной трансформации накапливаются мутации, и постепенно опухоль становится генетически гетерогенной (состоит из нескольких клонов, поколений раковых клеток). Химиотерапия уничтожает некоторые клоны, тогда как другие, с выгодными в новых условиях мутациями, выживают и создают новых клонов. Их поведение уже непредсказуемо, так как генетические и эпигенетические изменения этих раковых клеток привели к приобретению ими новых свойств.
Метаболическая пластичность при метастазировании
Эпигенетическая регуляция является одним из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области с недостаточным снабжением кислородом (гипоксией), так как до них не доходят кровеносные сосуды. Это вызывает в раковых клетках активацию гена фактора, индуцируемого гипоксией (HIF-1α). Происходит это за счет эпигенетического освобождения, деметилирования промотора гена, который становится доступным для транскрипционных факторов. Усиленное образование и активность белка HIF-1α, в свою очередь, регулирует экспрессию генов множества метаболических ферментов и транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток и поддерживает их потребности.
Клеточный метаболизм разделен на процессы расщепления с выделением энергии (катаболизм) и образования соединений с использованием энергии (анаболизм). Энергетический обмен клетки протекает за счет этапов клеточного дыхания — гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования. Раковые клетки по-своему приспосабливаются к сохранению продуктивности энергетического обмена в условиях недостатка кислорода. В первичной опухоли они, в основном, используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение глюкозы с преобразованием до лактата, выделяемого раковыми клетками, названо эффектом Варбурга. Он позволяет им выжить при гипоксии и активно пролиферировать за счет использования промежуточных соединений для биосинтеза и выделения энергии [10].
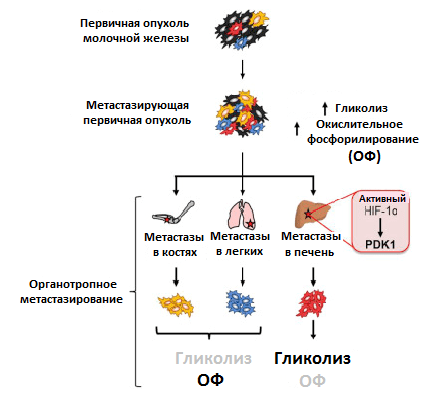
Преимущественный способ генерирования энергии у метастазов, однако, до сих пор мало изучен. Используя клетки рака молочной железы, обладающие широкой или специфической органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, активировали использование окислительного фосфорилирования, колонизировавшие печень — гликолиз. Когда раковые клетки колонизировали все вышеперечисленные очаги, они активировали сразу оба метаболических пути (рис. 4) [11]. Похоже, что такая пластичность помогает раковым клеткам освоить новые ниши для колонизации. Например, в печени гликолитический фенотип поддерживается при росте метастазов за счет активности упомянутого ранее фактора HIF-1α, а также повышенной экспрессии белка PDK1. Это фермент, который ингибирует формирование соединения ацетил-КоА. И так как его поток на развилке с гликолитическим путем в цикл трикарбоновых кислот уменьшается, усиливается образование конечного продукта гликолиза — лактата [12].
Рисунок 4. Различия в метаболизме первичной опухоли и метастазов в разных органах. Условные обозначения: ОФ — окислительное фосфорилирование; HIF-1α — индуцируемый гипоксией фактор 1; PDK1 — пируватдегидрогеназный комплекс 1.
Почему же для метастазов в одном органе выгоднее использовать преимущественно один вид метаболизма, чем другой? Ответ на этот вопрос и роль различных факторов в регуляции метаболической пластичности раковых клеток еще только предстоит узнать.
Понятие о преметастазных нишах
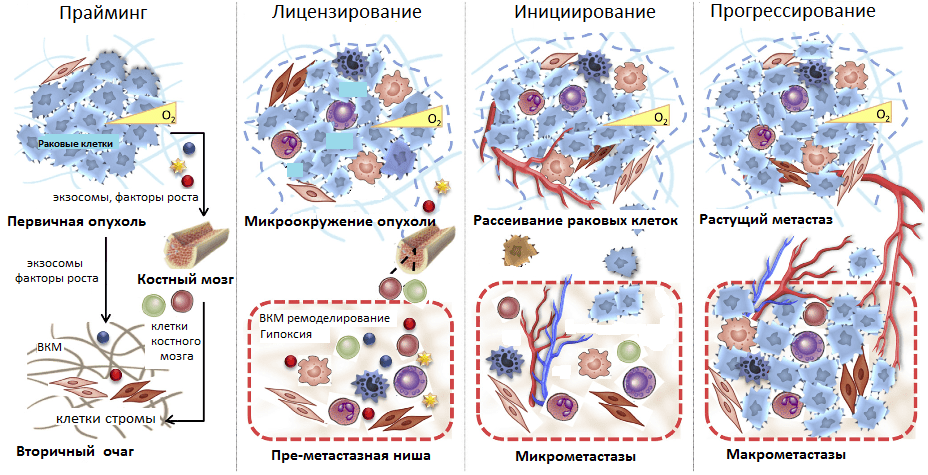
И все же метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей — освоением совершенно незнакомого места обитания. Эксперименты группы Дэвида Лидена в 2005 году впервые показали, что первичная опухоль за счет продуцируемых факторов стимулирует формирование так называемых преметастазных ниш в различных органах. Ученые показали, что раковые клетки первичной опухоли за счет стимулирования рецептора фактора роста сосудов (VEGFR-1) на миелоидных клетках-предшественниках активируют их распространение из костного мозга в известные очаги развития метастазов [13]. Кроме того, в этих очагах запускается избыточная экспрессия фибробластами одного из компонентов внеклеточного матрикса (ВКМ) — фибронектина. Миелоидные клетки-предшественники, имея рецепторы клеточной адгезии (интегрины) к этому белку, активно «ловятся на удочку» и заселяют преметастазные ниши. Они секретируют воспалительные цитокины, факторы роста и проангиогенные факторы, стимулирующие формирование сосудов. Это способствует ремоделированию стромы и колонизации ее метастазами (рис. 5) [13].
Рисунок 5. Стадии развития метастазов. Прайминг, или обучение, будущего вторичного очага роста первичной опухолью; лицензирование — иммуносупрессия первичной опухоли, создание благоприятного микроокружения в преметастазных нишах; инициирование — начало метастазирования и освоения преметастазной ниши; прогрессирование — рост метастазов во вторичном очаге.
Таким образом, в текущем представлении формирование метастазов происходит в несколько стадий. Начиная с раннего роста первичной опухоли происходит прайминг — обучение будущих ниш развития метастазов с помощью выделения различных факторов раковыми клетками, привлечения клеток из костного мозга. Затем клетки стромы первичной опухоли и преметастазных ниш (фибробласты, клетки миелоидного ряда, T-лимфоциты) формируют благоприятное микроокружение, лицензируя дальнейшее расселение метастазов. Фаза инициирования метастазирования заключается в росте сосудов, ангиогенезе, по которым метастазные клетки покидают первичную опухоль и приходят в преметастазные ниши. Прогрессирование — это финальный этап перехода микрометастазов в макрометастазы — вторичные сформированные опухоли. Он может занять от нескольких месяцев до нескольких лет (рис. 5).
Гетерогенность в механизмах формирования преметастазных ниш
Хотя для большинства органов характерна эта общая схема, существуют некоторые особенности в зависимости от места (органа) формирования ниши. Например, преметастазная ниша в печени и легких также формируется за счет привлечения нейтрофилов. Известно, что они могут помогать метастазирующим клеткам при интеграции в новую нишу за счет секретирования протеаз, цитокинов и непосредственного контакта с раковыми клетками при выходе из капилляров. Другой пример — клетки рака поджелудочной железы. Они выделяют экзосомы — липидные везикулы, которые переносят макрофаг-ингибирующий фактор (MIF). Их поглощают клетки Купфера в печени, и это запускает цепочку обучения ниши. Клетки Купфера синтезируют трансформирующий фактор роста β (TGF-β), клетки Ито активируются им и запускают перестраивание ВКМ, затем привлекая к нему макрофагов [15]. Их роль в микроокружении опухоли подробнее рассмотрена в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [16].
Метастазы в костях — одни из самых коварных, и их преметастазная ниша по-своему особенна. Например, оказалось, что при раке молочной железы только раковые клетки без рецепторов к эстрогену метастазируют в кости. Такие клетки первичной опухоли активно выделяют фермент лизилоксидазу. В костях он вызывает образование взрослых остеокластов и за счет этого стимулирует резорбцию кости. [17]. Именно эти «емкости» внутри кости метастазы занимают позднее. Другая и, пожалуй, основная функция лизилоксидазы — формирование поперечных связей между коллагеновыми волокнами ВКМ — также связана с образованием преметастазных ниш, но в легких. Преобразование коллагеновых волокон привлекает миелоидные клетки, а те позднее разрушают коллагеновые сети и дают путь раковым клеткам при заселении ткани легкого [18].
При некоторых типах рака, таких как меланома, для успешного метастазирования в лимфатические узлы и органы необходимо формирование новых лимфатических сосудов в их преметастазной нише. Недавно ученые установили, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, и медиатором его запуска является фактор роста мидкин, секретируемый клетками меланомы в составе экзосом или в свободном виде [19].
Безусловно, механизмы формирования преметастазных ниш в комплексе позволяют лучше понять развитие рака и не перестают удивлять своей сложностью.
Причины органотропии
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропному метастазированию, но как раковые клетки, которые могут метастазировать сразу в несколько органов, выбирают только один из них?
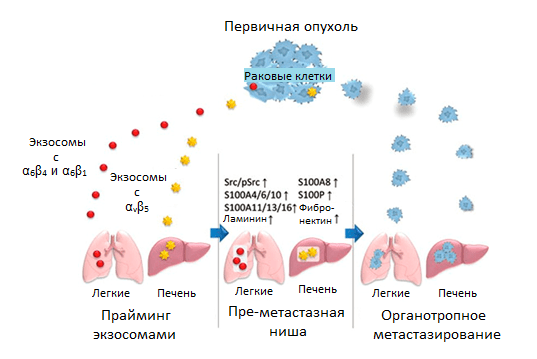
Ключевой механизм, известный на данный момент, основан на обучении будущих очагов рассеивания метастазов с помощью специфичных к ним экзосом. Эти везикулы, ранее описанные в статье «Экзосома — механизм координации и взаимопомощи клеток организма» [20], представляют собой структуры с рецепторами на своей поверхности и генетическим и секретируемым материалом внутри. Ученые провели интересный эксперимент — выделили экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и пр.) и, внедрив их в кровоток мышей с отличным типом опухоли, показали, что с их помощью возможно перепрограммировать распределение метастазов по органам. Это обусловлено тем, что экзосомы разных типов рака преимущественно содержат на своей поверхности основные рецепторы адгезии, интегрины, специфичные к определенному белку ВКМ (к ламинину — α6β4 и α6β1; к фибронектину — αvβ5 и т.д.).
Именно они адресуют доставку экзосом в определенный орган, который преимущественно имеет этот специфический ВКМ-белок в составе стромы. Сливаясь с мембранами клеток стромы того или иного органа, экзосомы доставляют содержимое и запускают свою программу: в фибробластах легких — через экспрессию одних генов S100, в клетках Купфера в печени — через экспрессию других. Активность этих генов стимулирует клеточную сигнализацию и воспалительные реакции, которые занимаются обучением преметастазной ниши (рис. 6) [21].
Рисунок 6. Регуляция органотропного метастазирования с помощью прайминга преметастазной ниши экзосомами со специфическими рецепторами интегринами. Условные обозначения: α6β4 и α6β1 — гетеродимеры интегринового рецептора; Src/pSrc — пропорция неактивной/активной форм киназы.
Перспективы в терапии метастазирования
Подведем итог: описанные здесь механизмы, очевидно, усложняют картину течения онкозаболеваний и развития тактик их лечения. Важно подчеркнуть, что гетерогенность первичной опухоли и метастазов по ряду рассмотренных здесь признаков (генетическая, метаболическая, нишевая) дает понимание того, что следует использовать комбинированное и таргетное лечение на разных стадиях течения болезни. Как подтверждение тому — результаты одного из последних исследований, проведенных на материалах пациента с рецидивами между курсами длительной иммунотерапии. Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны [22] и, следовательно, первичная, вторичные и т.д. опухоли по-разному отвечали на лечение.
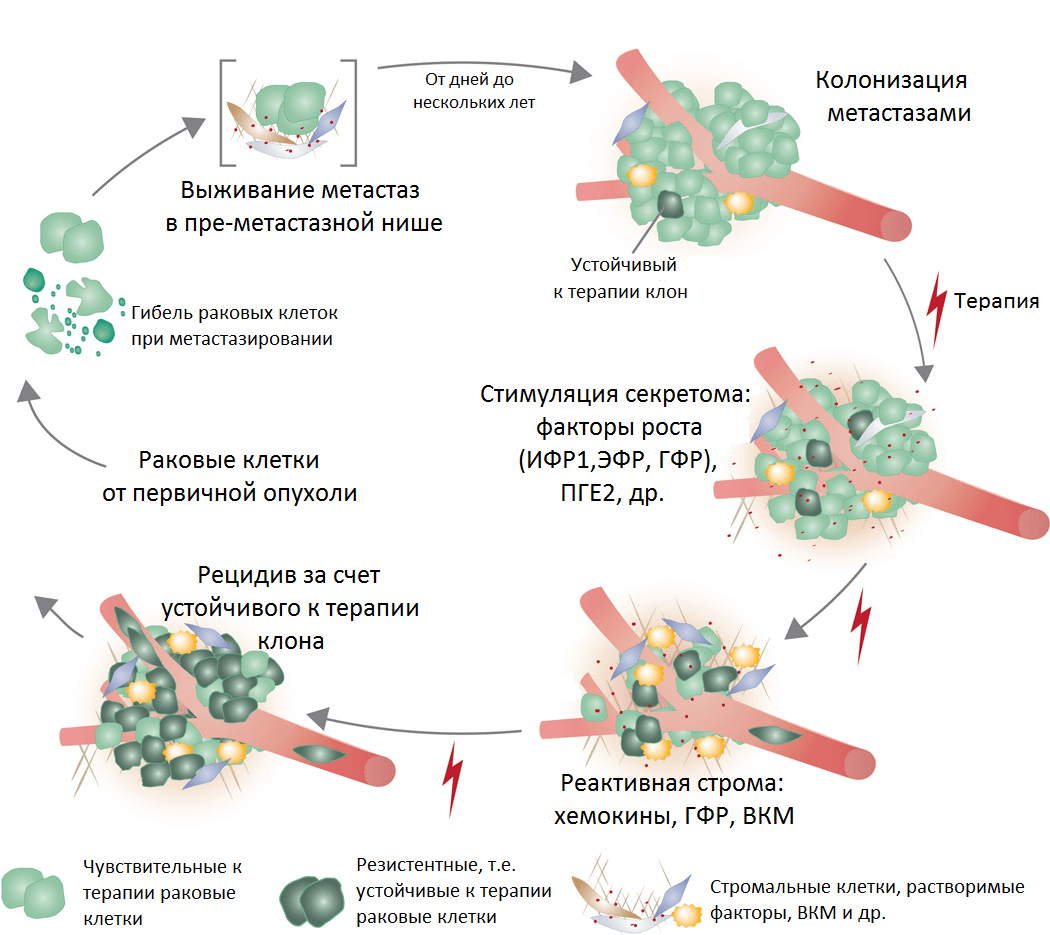
Мы также знаем, что после химиотерапии зачастую выживают субклоны раковых клеток с полезными в новой среде мутациями. Под стрессом воздействия цитостатиков субклоны раковых клеток активируют секрецию факторов роста и запускают клеточную сигнализацию, препятствующую гибели (рис. 7). Кроме того, их выживанию помогает поддержка клеток стромы, заодно изменяющих свое поведение на «оборонительное» под эффектом терапии.
Рисунок 7. Реакция метастазов на терапию, образование резистентности и развитие рецидива. Условные обозначения: ИФР1 — инсулиноподобный фактор роста; ЭФР — эпидермальный фактор роста; ГФР — фактор роста гепатоцитов; ПГЕ2 — простагландин 2; ВКМ — внеклеточный матрикс.
Обнаружение преметастазных ниш и понимание их устройства предложили по-новому взглянуть на развитие подходов в терапии. Если бы стало возможным предотвратить формирование преметастазных ниш, то с большой вероятностью было бы остановлено метастазирование, а значит, и возможность ремиссии. Будем и дальше следить за прорывами в этой области.