Фиброзные очаги в легких что это такое чем опасны
Фиброз легких – симптомы, лечение фиброза после пневмонии
Фиброз легких — патологическое состояние, обусловленное замещением функциональной легочной ткани соединительнотканными элементами (рубцом). Формирующаяся плотная жесткая ткань не участвует в газообмене и нарушает работу органов. Пациенты в первую очередь жалуются на одышку. Это осложнение инфекционно-воспалительного процесса или самостоятельное заболевание, называемое фиброзирующим альвеолитом.
Диагностика проводится с помощью инструментальных и лабораторных процедур. Полное восстановление измененных тканей невозможно, но есть консервативные методы лечения.
Причины возникновения
Механизм формирования фиброзных очагов в легких обусловлен повреждением функциональной ткани под воздействием внутренних или внешних факторов. Фиброзное утолщение вокруг альвеол затрудняет газообмен и нарушает функции органа. Разнообразные токсины, вирусы, бактериальные клетки, медикаменты и методы лечения повреждают легочную ткань с последующим образованием рубца.
Для осуществления газообмена в альвеолы должен попадать воздух из окружающей среды. Вместе с необходимым организму кислородом в легкие проникают загрязняющие вещества, способные повредить альвеолы и вызвать воспаление. Это волокна асбеста, пыль, табачный дым, выхлопные газы и другие вещества. Хроническое загрязнение — фактор риска формирования рубца и нарушения дыхательной функции.
На фоне лечения
У некоторых пациентов на фоне проведения лучевой терапии по поводу рака легких или молочной железы признаки фиброза легочной ткани появляются через несколько месяцев или даже лет после проведения лечения. Тяжесть состояния зависит от области воздействия радиационного излучения, дополнительного применения химиотерапии и основной патологии. Лучевое воздействие зачастую вызывает обширное необратимое повреждение органа в качестве осложнения, поэтому врачи тщательно подбирают дозы и регулярно обследуют пациентов.
Вызывающие фиброз легких препараты:
Вероятность развития болезни на фоне медикаментозной терапии также зависит от дозировок и особенностей активного компонента.
Первичные заболевания
Фиброз легочной ткани — распространенное осложнение коронавирусной пневмонии. COVID-19 характеризуется проникновением вирусов в органы дыхания и возникновением выраженного воспалительного процесса. Определенная степень фиброза диагностируется у большинства пациентов по результатам компьютерной томографии. Также фиброз может быть осложнением полимиозита, системного заболевания соединительной ткани, системной красной волчанки, саркоидоза, склеродермии, пневмонии любой формы и ревматоидного артрита.
Фиброзирующий альвеолит, или идиопатический легочный фиброз, — первичное заболевание легких неизвестной этиологии, сопровождающееся замещением тканей рубцом. Патология постепенно прогрессирует по мере разрастания фиброзных участков и ухудшения газообмена. Пациенты жалуются на кашель, одышку и другие симптомы. Наследственность и неблагоприятные внешние воздействия относят к основным этиологическим факторам.
Факторы риска
Существуют следующие формы предрасположенности к развитию болезни:
При обнаружении такой болезни врачи изучают анамнез больного для обнаружения перечисленных факторов.
Симптомы фиброза легких
Одышка — главное проявление значительного замещения альвеол соединительнотканными компонентами. Нарушается процесс газообмена, из-за чего в крови снижается уровень кислорода. При идиопатической форме патологии одышка постепенно нарастает. Недуг усиливается во время физических и психоэмоциональных нагрузок.
Течение фиброза и тяжесть состояния могут значительно отличаться от пациента к пациенту. У некоторых людей развивается тяжелая форма патологии, негативно влияющая на качество и продолжительность жизни. Идиопатическая форма фиброза может прогрессировать несколько месяцев или лет. Реже наблюдается стремительное ухудшение симптоматики с появлением сильной одышки.
Диагностика
Для проведения обследования необходимо обратиться к пульмонологу. Врач изучает анамнез пациента и проводит аускультацию легких для обнаружения признаков патологии. Обнаружение факторов риска в анамнезе важно для последующей постановки диагноза. Главная задача — определить причину фиброза и оценить тяжесть состояния.
Инструментальные и лабораторные исследования:
Лечение фиброза после пневмонии
Восстановить утраченные альвеолы не получится, но грамотно подобранное консервативное лечение нормализует деятельность органов и устранит симптомы патологии. Схема лечения подбирается с учетом возраста, причины фиброза, клинического течения болезни и выраженности изменений. В качестве медикаментозной терапии пациентам назначают противовоспалительные и антифиброзные средства совместно с бронхолитиками и иммунодепрессантами. Если есть признаки инфекции, назначают препараты для устранения бактерий, вирусов или других возбудителей инфекции.
Кислородная терапия и физиотерапевтические процедуры благоприятно влияют на функцию легких. Пациенту требуется длительная реабилитация. Если консервативное лечение не помогает, а работа органов стремительно ухудшается, необходима трансплантация легких.
Диссеминация в легких
Под диссеминированными процессами в легких понимается довольно обширная группа заболеваний и патологических состояний (более 100, известных современной медицине), при которых в дыхательном органе диагностируют множественные воспалительные очаги и(или) фиброзные изменения, расположенные, как правило хаотично и с обеих сторон. Патологические изменения могут затрагивать практически все легочные сегменты, а могут быть сконцентрированы только в определенных местах, например, вокруг бронхов, в периферических отделах легких и т.д.
Первично диссеминированные заболевания легких выявляются по результатам аппаратных медицинских обследований (КТ, рентген). На посрезовой компьютерной томографии легких (МСКТ) в высоком разрешении очаги диссеминации и фиброза визуализируются лучше всего. Врач-рентгенолог может оценить объем поврежденной легочной ткани, выявить фиброзные тяжи (соединительнотканные спайки и рубцы), скопление жидкости и(или) гноя в альвеолярных пузырьках, сопутствующие патологии дыхательных путей, артерий, лимфатической системы.
В этой статье мы подробнее расскажем о легочной диссеминации и заболеваниях, при которых этот симптом наблюдается.
Что такое диссеминация в легких?
Диссеминация представляет собой множественные патологические очаги (уплотнения) диаметром 1-10 мм. На КТ-сканах они выглядят как светлые пятна, в то время как в норме легочная ткань визуализируется практически однородным темным цветом. Очаги могут быть абсолютно разными по размеру, форме (эллипсообразные, с неровными краями) и морфологии. Нередко вокруг очагов обнаруживается перифокальное воспаление. Они могут сливаться и в таком случае напоминают инфильтративные процессы при пневмонии. Диссеминация также проявляется в виде очаговых микро повреждений с кровью и отеками.
При диссеминирующих процессах в легких дыхательный орган частично (в зависимости от объема поражения) перестает выполнять свою главную функцию — дыхание и транспортировка кислорода к другим органом, в частности к сердцу и головному мозгу. При тотальном диссеминированном поражении легких пациент может погибнуть.
Симптомы легочной диссеминации
Как и большинство легочных заболеваний, диссеминированное поражение легких не обладает специфическими симптомами, по которым было бы точно поставить диагноз. При диссеминации пациентов могут беспокоить стандартные респираторные симптомы:
Причины легочной диссеминации
При обнаружении диссеминации в легких, важно точно установить причину и выявить специфику патологического процесса. Причинами патологических процессов, в зависимости от формы, плотности и характера распространения очагов могут быть:
Отметим, что к одним только возбудителям инфекционно-воспалительных заболеваний легких, которые могут вызвать диссеминированное поражение легких, относится обширная группа вирусов, бактерий и грибков (mycobacterium tuberculosis, SARS-CoV-2, сoccidioides immitis) и др. Иногда выявить точную причину диффузных воспалительных очагов и фиброза не представляется возможным. Если заболевание обладает признаками, сходными с туберкулезом или пневмонией, или имеется выраженный фиброз, но даже после медицинских обследований причина остается не ясна, то такие патологические изменения называют «идиопатическими», а тактика лечения подбирается индивидуально на основании полученных данных и анамнеза пациента.
Поэтому диссеминированные заболевания легких считаются довольно сложными в диагностике. КТ легких значительно информативнее обычной рентгенографии, однако даже этот метод изолированно от лабораторных анализов, не позволяет получить достаточно сведений для назначения терапии. Если у пульмонолога или врача-рентгенолога есть подозрения на злокачественный процесс, пациенту может быть рекомендована биопсия.
Для каких заболеваний характерен симптом легочной диссеминации?
Рассмотрим наиболее распространенные заболевания, которые могут проявляться диссеминированным патологическим процессом в легких.
Туберкулез
Туберкулез легкий представляет собой довольно распространенное, опасное и тяжелое заболевание. Его возбудителем являются бактерии — палочки Коха, которые легко передаются контактным и воздушно-капельным путем, могут годами жить в уличной пыли и даже в легких человека, не вызывая никаких симптомов.
Болезнь проявляется тогда, когда иммунная система человека не может самостоятельно сдержать активную фазу и рост микобактерий mycobacterium tuberculosis. Бактериальное поражение легких при туберкулезе обычно визуализируется как множественные воспалительные очаги — гранулемы.
В центре туберкулезных гранулем расположены очаги некроза. Вокруг них формируются уплотнения — легочные альвеолы заполняются жидким субстратом, в котором содержатся сами бактерии клетки эпителия и плазмы, мертвые лимфоциты, крупные клетки Лангханса, макрофаги.
На начальных стадиях туберкулез прогрессирует практически бессимптомно, со временем пациент начинает отмечать слабость, ухудшение общего самочувствия, кашель и изменение дыхания.
При этом на аускультации редко отмечается что-то подозрительное. Анализ мокроты не показывает микобактерии. Диагностика туберкулеза возможна по результатам рентгенографического обследования и кожной туберкулиновой пробы.
Гранулематозы и диффузно расположенные «матовые стекла» на КТ не являются специфическим признаком туберкулеза. Первые обнаруживаются и при саркоидозе, а вторые — при пневмониях и других заболеваниях.
Для лечения туберкулеза пациенту назначается курс антибактериальной терапии. Важно предотвратить фиброз (рубцевание легких), поскольку такие изменения могут носить необратимый характер.
Пневмокониоз
Пневмокониозы – это диссеминированное поражение легких, причиной которого является вдыхание строительной или промышленной пыли. Чаще всего патологические процессы протекают с выраженным развитием первичного диффузного фиброза, при котором легочные альвеолы «склеиваются», поскольку в них разрастается соединительная ткань.
Пневмокониоз тоже носит гранулематозный характер. На КТ-сканах отчетливо видны множественные узелковые уплотнения разной плотности. Такие уплотнения следует проверять на предмет того, является ли процесс доброкачественным, нет ли онкологической угрозы.
Пневмокониоз относится к так называемым «профессиональным» заболеванием. Чаще всего от него страдают:
Силикоз — распространенное и тяжелое заболевание легких, при котором диагностируют множественный диффузный фиброз и узелковые уплотнения. В результате у больного существенно сокращается функциональный объем легких. Возникает из-за продолжительного вдыхания пыли со свободным диоксидом кремния (содержится в кварцевом песке и окружающем воздухе). Поэтому в группе риска находятся пескоструйщики, работники соответствующих (абразивоструйных) предприятий, жители «песчаных» регионов.
Асбестоз — хроническое заболевание легких, при котором также манифестируется множественный легочный фиброз. Возникает из-за вдыхания асбестовой пыли или волокон асбеста. В группе риска находятся работники асбестодобывающих и асбестоперерабатывающих предприятий.
Пневмонии и осложнения пневмоний
Пневмонии – группа воспалительных заболеваний легких. На фоне этого заболевания у пациента могут возникнуть более опасные осложнения, для которых также характерна диссеминация: острый респираторный синдром (ОРДС), интерстициальное поражение легких, симптом «булыжной мостовой», «сотовое легкое», отек легких, фиброз и др.
При пневмонии со множественными диффузно расположенными локусами поражения существенно снижается жизненная емкость легких, поскольку воспалительные очаги и инфильтраты крупные, альвеолы заполнены жидким экссудатом, а не воздухом.
Пневмония с диссеминацией может быть следствием кандидоза легких, пневмокониоза и других заболеваний. Необходимо точно установить причину патологических изменений. Иногда необходимо также исключить злокачественный процесс (по результатам лабораторной диагностики).
Саркоидоз
Саркоидоз легких – это онкологическое заболевание. Его основными признаками на КТ являются диссеминация и медиастинальная лимфаденопатия. Диссеминация на сканах выражена не так ярко как при прогрессирующем туберкулезе, однако определенное сходство есть. Диагностику затрудняет легочный фиброз. Вместе с дессиминированнным поражением дыхательного органа присутствуют васкулиты, периваскулиты, перибронхит.
Множественные очаги (от 2 мм до 1 см) часто расположены вдоль бронхососудистых пучков, междольковых щелей, костальной плевры, в междольковых перегородках (перилимфатический тип диссеминации). При саркоидозе гранулематоз часто (около 35% случаев) обнаруживают не только в легких, но и в бронхах. При этом их слизистая оболочка может быть не изменена – на поражение бронхов при саркоидозе указывают отек, гиперемия, участки утолщения эпителия.
На ранних сроках саркоидоз развивается бессимптомно, на более поздних пациента начинают беспокоить непродуктивный кашель, проблемы с дыханием (без явных причин), дискомфорт и жжение в области спины, в тяжесть в груди.
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
Если вы оставили заявку после 22:00, мы перезвоним вам после 8:00.
Легочный фиброз, ассоциированный с COVID-19
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Анализ научных публикаций по результатам исследований, проведенных в период пандемии COVID-19, свидетельствует о вероятном риске фиброзирования легочной ткани или прогрессирования уже имеющегося интерстициального заболевания с развитием фиброза легких у пациентов, инфицированных вирусом SARS-CoV-2. Фиброзный гистологический паттерн выявлялся примерно в 22% случаев COVID-19, начиная с 3-й недели заболевания. Молекулярная основа прогрессирования легочного фиброза после заражения вирусом SARS-CoV-2 остается неясной, но считается многофакторной, включающей прямые вирусные эффекты, иммунную дисрегуляцию, цитокиновый шторм и усиленный окислительный стресс. Требует ответа вопрос, почему у определенной части пациентов происходит переход к неконтролируемой клеточной пролиферации с накоплением фибробластов и миофибробластов, чрезмерным отложением коллагена и внеклеточного матрикса, что приводит к прогрессирующему фиброзу легких, более тяжелому течению заболевания и повышает риск тяжелых осложнений и смертности. Регламентированного терапевтического подхода к лечению легочного фиброза, ассоциированного с новой коронавирусной инфекцией, не существует. Наряду с одобренными для лечения идиопатического легочного фиброза антифибротиками нинтеданибом и пирфенидоном исследуются новые средства предупреждения процесса фиброзирования. Важным направлением исследований является поиск биомаркеров для ранней идентификации пациентов с высоким риском тяжелого течения COVID-19, отягощенного развитием интерстициального фиброзного поражения легких.
Ключевые слова: легочный фиброз, COVID-19, SARS-CoV-2, пневмония, ангиотензинпревращающий фермент 2, иммунная дисрегуляция, антифибротики.
Для цитирования: Кузубова Н.А., Титова О.Н., Лебедева Е.С., Волчкова Е.В. Легочный фиброз, ассоциированный с COVID-19. РМЖ. Медицинское обозрение. 2021;5(7):492-496. DOI: 10.32364/2587-6821-2021-5-7-492-496.
1 I.P. Pavlov First St. Petersburg State Medical University, Saint-Petersburg, Russian Federation
2 Saint-Petersburg State Pediatric Medical University, Saint Petersburg, Russian Federation
An analysis of scientific publications based on the study results conducted during the COVID-19 pandemic indicates a possible risk of pulmonary fibrosis or progression of existing interstitial lung disease with the pulmonary fibrosis development in patients with the SARS-CoV-2 virus. A fibrous histological pattern was detected in about 22% of COVID-19 cases, starting from the third week of the disease. The molecular basis of the pulmonary fibrosis progression after infection with the SARS-CoV-2 virus remains unclear, but it is considered multifactorial, including direct viral effects, immune dysregulation, cytokine storm and increased oxidative stress. The question needs to be answered why a certain part of patients undergo a transition to uncontrolled cell proliferation with the accumulation of fibroblasts and myofibroblasts, excessive deposition of collagen and extracellular matrix, which leads to progressive pulmonary fibrosis, a more severe disease course and increases the risk of severe complications and mortality. There is no regulated therapeutic approach to the treatment of pulmonary fibrosis associated with a new coronavirus infection. Along with the approved antifibrotics for the treatment of idiopathic pulmonary fibrosis, nintedanib and pirfenidone, new means of preventing the fibrosis process are being investigated. An important research area is a search for biomarkers for early identification of patients with a high risk of severe COVID-19, burdened by the development of interstitial fibrotic lung lesions.
Keywords: pulmonary fibrosis, COVID-19, SARS-CoV-2, pneumonia, angiotensin-converting enzyme 2, immune dysregulation, antif ibrotics.
For citation: Kuzubova N.A., Titova O.N., Lebedeva E.S., Volchkova E.V. Pulmonary fibrosis associated with COVID-19. Russian Medical Inquiry. 2021;5(7):492–496 (in Russ.). DOI: 10.32364/2587-6821-2021-5-7-492-496.
Введение
Результаты исследований, проведенных в период пандемии COVID-19, свидетельствуют о вероятном риске генерализации имеющегося интерстициального заболевания легких с развитием интерстициального легочного фиброза у пациентов, инфицированных вирусом SARS-CoV-2 [1, 2]. Учитывая, что примерно у 30% выживших после тяжелого острого респираторного синдрома 2003 г. и ближневосточного респираторного синдрома наблюдались стойкие рентгенологические и физиологические нарушения, соответствующие фиброзной болезни легких, следует ожидать, что последствия COVID-19 могут включать формирование у большой когорты лиц легочного фиброза и стойких, потенциально прогрессирующих физиологических нарушений [3]. Для установления истинной распространенности постковидного легочного фиброза потребуются долгосрочные последующие исследования.
Гистопатология SARS-CoV-2-пневмонии
Основным проявлением пневмонии при COVID-19 признано считать диффузное альвеолярное повреждение [3–6]. По результатам гистологического исследования аутопсийного материала в 43% случаев диффузное альвеолярное повреждение характеризовалось фиброзным паттерном [5]. Пациенты с фиброзным паттерном повреждения альвеол имели более длительную продолжительность болезни и госпитализации по сравнению с пациентами с острым альвеолярным повреждением и дольше нуждались в искусственной вентиляции легких (ИВЛ) [5]. Анализ состояния пациентов, перенесших тяжелую пневмонию при COVID-19, выявил высокую частоту фиброзных нарушений функции легких в ранний период выздоровления [6]. На основании анализа образцов легких больных COVID-19 были определены 3 основных гистологических варианта повреждения легочной ткани: эпителиальные изменения с диффузным альвеолярным повреждением (85%), сосудистый паттерн с поражением микрососудов (59%) и фиброзный паттерн с интерстициальным фиброзом (22%) [7]. По данным S.B. Polak et al. [7], гистологическая картина повреждения легочной ткани, характерная для интерстициального фиброза, выявлялась примерно с 3-й недели заболевания COVID-19 и не была связана с использованием ИВЛ. Эпителиальные и сосудистые паттерны могут присутствовать на всех стадиях симптоматического COVID-19, тогда как фиброзный паттерн (гиперплазия фибробластов, фиброз, отложение коллагена в перегородках, микрокистозное сотовое легкое) проявляется примерно с 3-й недели заболевания.
Патогенетические механизмы SARS-CoV-2-индуцированного легочного фиброза
Молекулярная основа прогрессирования легочного фиброза после заражения вирусом SARS-CoV-2 пока остается неясной, но считается многофакторной, включающей прямые вирусные эффекты, иммунную дисрегуляцию, цитокиновый шторм и усиленный окислительный стресс [8, 9]. С помощью методов биоинформационного анализа было установлено, что связывание вируса SARS-CoV-2 с рецепторами ангиотензинпревращающего фермента 2 (АПФ-2), которых особенно много в легочной ткани, приводит активации экспресии мРНК факторов роста, инициирующих процессы фиброзирования, таких как трансформирующий фактор роста b1 (Transforming growth factor β1, TGF-β1), фактор роста соединительной ткани (connective tissue growth factor, CTGF), фибронектин 1 [10]. Предполагается, что развитию фиброза легких у пациентов с COVID-19 может способствовать дисбаланс в ренин-ангиотензиновой системе [11]. В результате высокоаффинного связывания SARS-CoV-2 с рецептором АПФ-2 снижается экспрессия АПФ-2 и повышается уровень ангиотензина 2, который играет ключевую роль в процессах аберрантного заживления повреждений и формирования легочного фиброза. Эти процессы включают выработку провоспалительных цитокинов, таких как интерлейкин (interleukin, IL) 6 (IL-6) и IL-8, выработку активных форм кислорода инфицированными клетками альвеолярного эпителия и активацию TGF-β1, которая, в свою очередь, приводит к пролиферации, миграции и дифференцировке фибробластов в миофибробласты с последующим отложением в интерстиции коллагена и фибронектина [11].
Высвобождение матриксных металлопротеиназ во время воспалительной фазы острого респираторного дистресс-синдрома (ОРДС) вызывает повреждение легочного эпителия и сосудистого эндотелия и неконтролируемую фибропролиферацию. Важную роль в формировании легочного фиброза играют канонические профибротические пути, регулируемые TGF-β1, а сосудистая дисфункция является ключевым компонентом перехода от ОРДС к фиброзу, в котором участвуют сосудистый эндотелиальный фактор роста (Vascular endothelial growth factor) и цитокины, такие как IL-6 и фактор некроза опухоли-α (tumor necrosis factor-α, TNF-α) [2]. На основании наблюдений, указывающих на то, что местом повреждения при инфицировании вирусом SARS-CoV-2 являются клетки альвеолярного эпителия, а не эндотелиоциты, высказывается предположение, что механизм легочного фиброза при COVID-19 отличается от механизма идиопатического легочного фиброза и других фиброзных заболеваний легких [2].
У пациентов с COVID-19 значительно повышены сывороточные уровни хемоаттрактантного белка моноцитов-1 (monocyte chemoattractant protein 1, MCP-1), TGF-β1, TNF-α, факторов роста фибробластов (fibroblast growth factors), тромбоцитарного фактора роста (Platelet-derived growth factor), IL-6 и IL-1β [12–14]. Везикулярные эндотелиальные клетки II типа являются одним из основных источников этих фиброгенных факторов, которые стимулируют гиперпролиферацию фолликулярных клеток типа II, рекрутируют фибробласты в фиброзные локусы, индуцируют активацию и дифференцировку фибробластов в миофибробласты. Миофибробласты ответственны за избыточное накопление экстрацеллюлярного матрикса в базальных мембранах и интерстициальной легочной ткани, что в итоге приводит к потере альвеолярной функции, особенно газообмена между альвеолами и капиллярами. В ремоделировании альвеолярной ткани, инфицированной SARS-CoV-2, важная роль может принадлежать фибробластам [15]. Вирус SARS-CoV-2 способен инфицировать альвеолярные фибробласты, отличающиеся высокой экспрессией рецептора АПФ-2, что может вызвать чрезмерное разрастание фибробластов и внеклеточного матрикса, отложение патологического коллагена, которое будет облегчать проникновение вируса в глубокие слои легочной паренхимы [15]. Фибробласты могут трансинфицировать иммунные клетки и способствовать возникновению у пациентов виремии.
Ятрогенными факторами развития легочного фиброза у пациентов, выживших после тяжелой пневмонии при COVID-19, являются токсичность кислорода и повреждение легких, вызванное ИВЛ [8]. Постковидный фиброз чаще развивается у пациентов с изначально обширным двусторонним вовлечением легких, которые нуждаются в кислородной поддержке и ИВЛ, часто в течение продолжительного времени. Длительное воздействие высоких концентраций кислорода приводит к повышенной выработке свободных радикалов, которые могут повредить легочный эпителий. Механический стресс, сопутствующий ИВЛ, также может провоцировать повреждение легких и способствовать развитию легочного фиброза [16].
Возможности лечения SARS-CoV-2-ассоциированного легочного фиброза
Основной причиной легочного фиброза считается хроническое воспаление, сопряженное с повреждением альвеолярного эпителия и активацией фибробластов. Респираторные вирусные инфекции могут выступать в качестве триггеров инициации процесса фиброзирования легочной ткани или кофакторов, усугубляющих существующий фиброз легких. В настоящее время нет полностью документированного терапевтического подхода к лечению поствоспалительного легочного фиброза, ассоциированного с новой коронавирусной инфекцией.
Исследователи рассматривают использование не только хорошо известных лекарственных средств, таких как одобренные для терапии идиопатического легочного фиброза ингибитор тирозинкиназы нинтеданиб или пирфенидон с неопределенным механизмом действия [17], но и другие варианты. Антифиброзная терапия может иметь значение в предотвращении тяжелого течения COVID-19 у пациентов с интерстициальными заболеваниями легких и в предотвращении формирования легочного фиброза после индуцированной вирусом SARS-CoV-2 пневмонии [3]. Антифибротические препараты не устраняют иммунную дисрегуляцию, вызванную инфекцией SARS-CoV-2, и вряд ли предотвратят протромботические осложнения этого сложного патологического процесса [3]. Скорее всего, антифибротическая терапия будет включена в комбинированные схемы, как только будут определены эффективные противовоспалительные методы лечения, что в итоге должно ослабить фиброзные последствия [3, 18].
Существует несколько сообщений о том, что применение спиронолактона, антагониста минералокортикоидного рецептора, позволяет предотвращать развитие фиброза [2, 19]. Гормон коры надпочечников альдостерон является физиологическим активатором минералокортикоидного рецептора и частично отвечает за увеличение оборота внеклеточного матрикса, что наблюдается при легочном фиброзе, и действует преимущественно на эпителий легких. Пока нет результатов исследований, в которых были бы представлены положительные эффекты антагониста минералокортикоидных рецепторов при поствирусном фиброзе легких, но его можно рассматривать как потенциальное средство предупреждения этого серьезного постковидного осложнения [2].
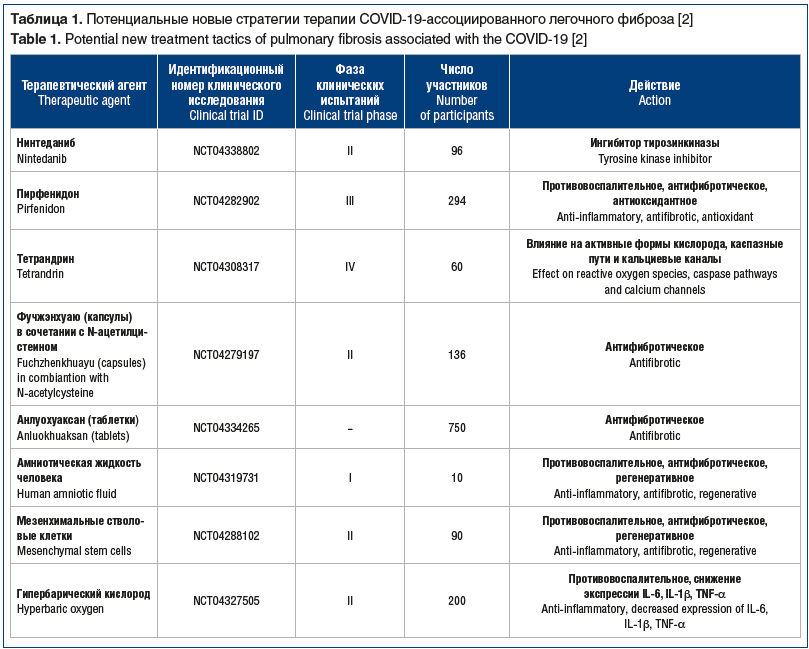
В таблице 1 представлены разрабатываемые в настоящее время новые подходы к предупреждению развития постковидного легочного фиброза [2]. Определенные надежды возлагаются на препарат под кодовым названием OATD-01, который ингибирует хитотриозидазу 1, проявляет противовоспалительную активность и тормозит развитие легочного фиброза. В настоящее время проводятся исследования с целью определить, имели ли пациенты, умершие от COVID-19, повышенную экспрессию хитотриозидазы 1 в легочной ткани. Другое изучаемое вещество, тетрандрин, является алкалоидом с разнонаправленным механизмом действия, влияющим на активные формы кислорода, кальциевые каналы и каспазные пути, который показал свою эффективность при лечении воспаления и рака легких. Антифибротические свойства формулы Фучжэнхуаю (Fuzheng Huayu), содержащей 6 китайских трав, и Анлуохуаксана (Anluohuaxian) были установлены при лечении фиброза печени, и в настоящее время проходят испытания их эффективности у пациентов с COVID-19. Другие предлагаемые варианты лечения предполагают введение мезенхимальных стволовых клеток или очищенной амниотической жидкости человека, которые известны своими противовоспалительными, антифибротическими и регенеративными свойствами.
Многие пациенты с тяжелым течением COVID-19 могут получать антиинтерлейкиновую терапию. Если ингибирование IL-1β (что вероятно) может предотвратить развитие фиброза после COVID-19, то роль ингибирования IL-6 менее ясна. Экспериментальное исследование с блеомициновой моделью легочного фиброза показало, что ингибирование IL-6 как на ранней, так и на поздней стадии повреждения легких способствует формированию фиброза. в долгосрочной перспективе [20]. Эффекты антиинтерлейкиновой терапии можно считать потенциально полезными, но полностью они неизвестны, и существует вероятность, что они могут привести к ухудшению легочного фиброза [2].
Возможные биомаркеры прогрессирования COVID-19
В настоящее время нет надежных клинических или лабораторных показателей, позволяющих на ранних стадиях COVID-19 выявлять субпопуляцию пациентов с риском прогрессирования заболевания до тяжелых и смертельных форм с возможным развитием интерстициального легочного фиброза [21–23]. Результаты недавнего исследования показывают, что у пациентов с пневмонией, вызванной вирусом SARS-CoV-2, у которых развилась тяжелая дыхательная недостаточность, отмечались гипервоспалительные реакции с признаками либо иммунной дисрегуляции, либо синдрома активации макрофагов. У большинства пациентов преобладала иммунная дисрегуляция, характеризующаяся низкой экспрессией человеческого лейкоцитарного антигена (HLA-DR) на моноцитах CD14, выраженным истощением лимфоцитов CD4 и CD19 и естественных клеток-киллеров. Развитию иммунной дисрегуляции могла способствовать гиперактивация циркулирующих моноцитов, продуцирующих большое количество IL-6 и TNF-α. Все пациенты с тяжелой формой SARS-CoV-2-пневмонии имели либо иммунную дисрегуляцию, либо синдром активации макрофагов, что специфически отличало их от пациентов, страдающих бактериальной или H1N1-ассоциированной пневмонией [24].
На основе ретроспективного анализа образцов крови пациентов с тяжелым течением COVID-19 и математического моделирования исследователи из г. Ухань (Китай) выделили 3 показателя для прогнозирования исхода COVID-19: лактатдегидрогеназу (ЛДГ), С-реактивный белок и количество лимфоцитов [25]. Для тяжелобольных пациентов с COVID-19 значительное повышение содержания ЛДГ является важным маркером повреждения легочной ткани и указывает на увеличение активности патологического процесса [26]. Повышение содержания С-реактивного белка, маркера плохого прогноза при тяжелой вирусной инфекции, отражает стойкое состояние воспаления. Лимфопения является общим признаком у пациентов с COVID-19 и может быть критическим фактором, связанным с тяжестью заболевания и прогнозом неблагоприятных осложнений в будущем. Особенно страдает от воздействия нового коронавируса популяция Т-лимфоцитов: значительно уменьшается количество хелперных и супрессорных Т-клеток, а также вспомогательных Т-клеток памяти и регуляторных Т-клеток, особенно в тяжелых случаях [22]. В литературе описаны биомаркеры фиброгенеза, определяемые в бронхоальвеолярной жидкости через 24 ч после начала развития ОРДС, которые коррелируют с показателем смертности [23]. К ним относятся N-концевой пропептид коллагена III типа, С-концевой пропептид коллагена I типа, TGF-β и альвеолярные фибробласты [27].
В настоящее время нет ясного понимания молекулярной основы тяжелых симптомов и последствий COVID-19, что диктует необходимость исследований для выявления клеточных и молекулярных биомаркеров, которые могли бы обеспечить раннюю идентификацию лиц с высоким риском тяжелого течения заболевания, отягощенного развитием интерстициального фиброзного поражения легочной ткани [28].
Заключение
Накопленные в мире за период пандемии COVID-19 исследования и наблюдения свидетельствуют о гетерогенной природе новой коронавирусной инфекции с неизвестным клеточно-молекулярным патогенетическим механизмом. Остается неясным, почему у выживших после тяжелой SARS-Cov-2-пневмонии и связанного с ней ОРДС часто наблюдается почти полное восстановление легочной функции, а у определенной части пациентов происходит переход к неконтролируемой клеточной пролиферации с накоплением фибробластов и миофибробластов, чрезмерным отложением коллагена и других компонентов внеклеточного матрикса, что приводит к прогрессирующему фиброзу легких, более тяжелому течению заболевания и повышает риск тяжелых осложнений и смертности. Легочный фиброз может стать причиной смертности у большого числа пациентов с COVID-19, и в то же время значительная часть переболевших будет испытывать долгосрочные нарушения функции легких и рентгенологические аномалии, связанные с остаточным легочным фиброзом. Чтобы установить истинную распространенность постковидного фиброза легких и определить, представляют ли собой структурные нарушения легочной ткани необратимые фиброзные изменения, потребуются длительное наблюдение и дополнительные исследования с анализом отдаленных результатов. На сегодняшний день нет полного понимания патофизиологии и молекулярной природы тяжелого течения COVID-19, поэтому необходимы исследования для выявления биомаркеров, которые могли бы обеспечить раннюю идентификацию пациентов с высоким риском прогрессирования легочного фиброза для назначения доступной антифибротической терапии.
Сведения об авторах:
Кузубова Наталия Анатольевна — д.м.н., заместитель директора по научной работе НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6-8; ORCID iD 0000-0002-1166-9717.
Титова Ольга Николаевна — профессор, д.м.н., директор НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6-8; ORCID iD 0000-0003-4678-3904.
Лебедева Елена Сергеевна — к.б.н., ведущий научный сотрудник НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6-8; ORCID iD 0000-0001-6887-0166.
Волчкова Елизавета Владимировна — аспирант кафедры анестезиологии, реаниматологии и неотложной педиатрии факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0001-6712-5121.
Контактная информация: Кузубова Наталия Анатольевна, e-mail: kuzubova@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 09.07.2021.
Поступила после рецензирования 03.08.2021.
Принята в печать 26.08.2021.
Natalia A. Kuzubova — Dr. Sc. (Med.), Deputy Director of Science, I.P. Pavlov First St. Petersburg State Medical University; 6-8, Lev Tolstoy str., Saint-Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1166-9717.
Olga N. Titova — Professor, Dr. Sc. (Med.), Director of the I.P. Pavlov First St. Petersburg State Medical University; 6-8, Lev Tolstoy str., Saint-Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904.
Elena S. Lebedeva — C. Sc. (Bio.), Leading Researcher, I.P. Pavlov First St. Petersburg State Medical University; 6-8, Lev Tolstoy str., Saint-Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-6887-0166.
Elizaveta V. Volchkova — postgraduate student of the Department of Anesthesiology, Resuscitation and Emergency Pediatrics of the Faculty of Postgraduate and Additional Professional Education of the Ministry of Health of the Russian Federation; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0001-6712-5121.
Contact information: Natalia A. Kuzubova e-mail: kuzubova@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Только для зарегистрированных пользователей