Фето фетальный синдром при многоплодной беременности что
Фето фетальный синдром при многоплодной беременности что
Частота сопутствующих ВПС в этой группе детей значительно превышает среднюю в популяции, составляя около 7%. Особенно высока выявляемость пороков среди близнецов-реципиентов (12%); наиболее частым из них является легочный стеноз (4,8—9,6%).
Естественное течение синдрома фето-фетальной трансфузии.
До 90% беременностей заканчиваются преждевременными родами. В 25% случаев один из близнецов (чаще донор) погибает внутриутробно. Еще 10% умирают вскоре после рождения. Более половины родившихся детей нуждаются в искусственной вентиляции легких. У 13% имеются внутрижелудочковые кровоизлияния III—IV степени или перивентрикулярная лейкомаляция. У близнецов-доноров в 10% случаев развивается почечная недостаточность, приводящая к смерти около 60% из них.
Среди выживших детей высок процент поражений центральной нервной системы (задержка речи и умственного развития, детский церебральный паралич).
Выраженная гипертрофия миокарда в выводном отделе правого желудочка может приводить к снижению потока крови через желудочек и легкие, что сопровождается нарушением их развития и прогрессированием легочного стеноза вплоть до атрезии клапана.
Клиническая симптоматика синдрома фето-фетальной трансфузии.
У новорожденного, перенесшего синдром фето-фетальной трансфузии в качестве донора, можно отметить бледность, тахикардию, нарушения периферической циркуляции. Тяжесть состояния близнеца-реципиента в большинстве случаев бывает обусловлена полицитемией, гипербилирубинемией, сердечной недостаточностью. Разница в массе тела между новорожденными превышает 15%. При внутриутробной гибели одного из близнецов у выжившего ребенка высока опасность развития ДВС-синдрома и почечной недостаточности.
У новорожденных с синдромом фето-фетальной трансфузии нередко выявляется артериальная гипертензия. Причиной этого у бывших доноров может быть активация ренин-ангиотензиновой системы в ответ на хроническую гипово-лемию. Причиной гипертензии у реципиентов может быть повышение в плазме уровня эндотелина-1 — потенциального сосудосуживающего вещества. Так как увеличенный уровень ренина может передаваться от донора к реципиенту, это вносит дополнительный вклад в дисфункцию сердечно-сосудистой системы у последнего.
Лечение синдрома фето-фетальной трансфузии.
Основная терапия проводится во внутриутробном периоде. В качестве вариантов лечения используют периодический декомпрессионный амниоцентез, создание сообщения между оболочками, лазерную фотокоагуляцию плацентарных анастомозов, перевод беременности в моноплодную. Это позволяет повысить выживаемость для отдельных плодов до 65—90%.
При лечении близнецов-доноров используют 10% раствор глюкозы, эритроцитарную массу и препараты железа. Близнецам-реципиентам показаны заменные переливания свежезамороженной плазмы для снижения гематокрита.
Артериальная гипертензия новорожденных и легочный стеноз лечатся по соответствующим принципам.
— Вернуться в оглавление раздела «Кардиология.»
Ультразвуковые и допплерографические критерии диагностики вариантов фето-фетальной трансфузии и селективной задержки роста одного из монозиготных близнецов
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
Хронический ФФТС необходимо дифференцировать с другими патологическими состояниями монозиготной многоплодной беременности, встречающимися реже: острой межблизнецовой трансфузией (ОМТ) и селективной задержкой роста (CЗР) одного из плодов. Несмотря на ряд схожих клинических проявлений, эти состояния имеют прогноз, отличный от прогноза при хроническом тяжелом ФФТС, требуют иной терапевтической тактики.
Хроническая форма ФФТС проявляется с середины II триместра гестации, имеет тяжелое течение, сопряжена с резко выраженным гемодинамическим дисбалансом между циркуляторными системами плодовблизнецов [9]. Клинически в течении хронического ФФТС различают 5 стадий (таблица). Критериями, на основании которых дифференцируется клиническая стадия синдрома, являются ультразвуковые и допплерографические изменения [10].
| Ультразвуковые критерии | Клиническая стадия ФФТС | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| Полиолигогидрамнион | + | + | + | + | + |
| Мочевой пузырь донора | + | — | — | — | — |
| Патологические допплерограммы | — | — | + | + | + |
| Водянка реципиента | — | — | — | + | + |
| Внутриутробная гибель плода (плодов) | — | — | — | — | + |
Селективная задержка роста одного из близнецов (дискордантный рост монозиготных близнецов) характеризуется отставанием роста одного из плодов [15]. При этом межблизнецовая трансфузия незначительна либо отсутствует, патогенез нарушений связан преимущественно с проявлениями плацентарной дисфункции, либо функциональной патологией плода. Терапевтическая тактика в большинстве таких случаев выжидательноконсервативная [16]. При остром нарушении плацентарно-плодового кровообращения возможна антенатальная гибель одного из плодов-близнецов. В подобном случае показана фетоскопическая лазерная коагуляция его пуповины. При наличии соответствующего гестационного срока и адекватной перинатальной тактике прогноз для жизни и здоровья второго плода может быть благоприятным.
Очевидной представляется невозможность клинической диагностики ФФТС на антенатальном этапе без применения серийных ультразвуковых и допплерографических исследований.
Целью работы явилось выявление последовательности ультразвуковых и допплерографических изменений на разных стадиях некорригированного хронического ФФТС, при острой межблизнецовой трансфузии и селективной задержке роста одного из монозиготных близнецов.
Материалы и методы
Проведен сравнительный анализ перинатальных исходов, а также результатов патоморфологических исследований последов.
Результаты и обсуждение
У двух из 3 женщин с хроническим ФФТС имелись указания на наличие в анамнезе пороков развития плода, перинатальных потерь и преждевременных родов. Средний возраст женщин составил 27,8±0,8 лет.
На рис. 1-12 представлены ультразвуковые и допплерографические признаки разных клинических стадий тяжелой формы хронического прогрессирующего ФФТС.
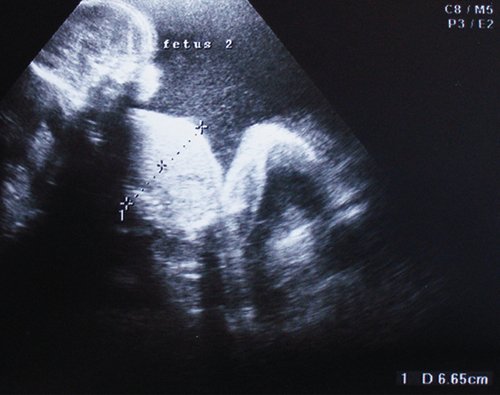
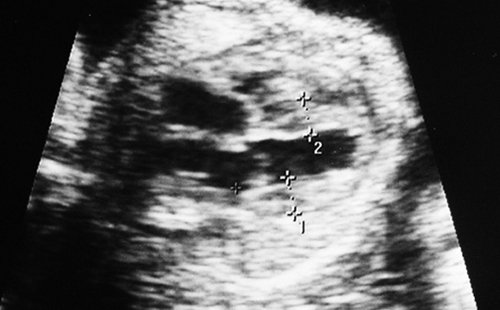
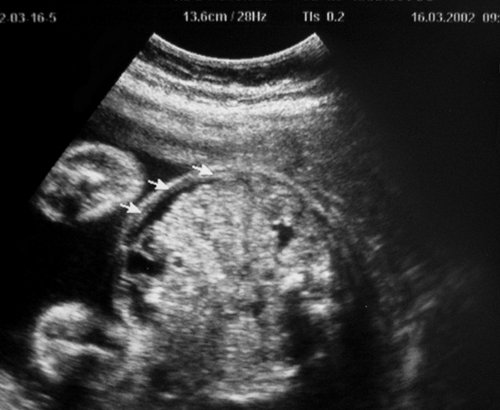
Рис. 1. Двуплодная монохориальная беременность, гестационный срок 25 нед. Выраженно дискордантный рост плодов: поперечное сечение туловища плода-донора (слева), аксиальное сечение головы плода-реципиента (справа). Отставание фетометрических показателей меньшего плода более чем на 3 SD.
Рис. 3. Плод-реципиент, имеющий нормальные для срока гестации размеры.
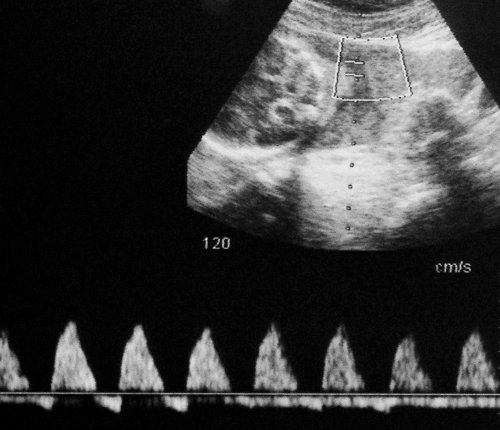
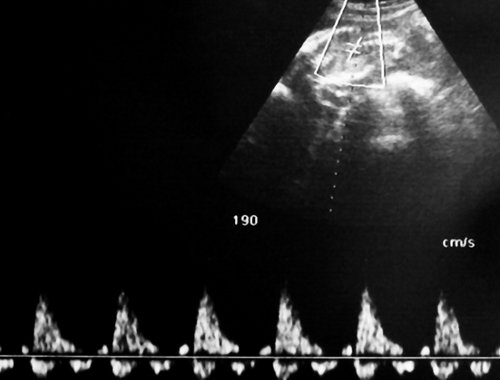
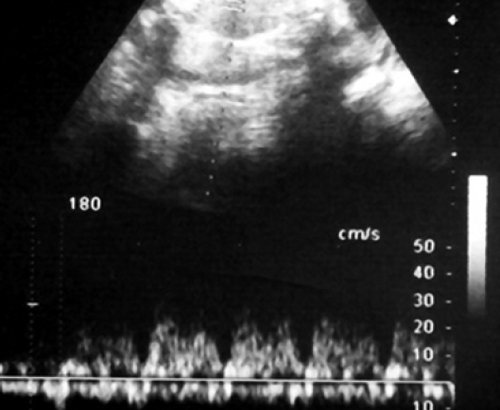
Рис. 5. Длительно регистрируемый постоянный нулевой диастолический кровоток, эпизоды реверсного диастолического кровотока в пуповинных артериях плода-донора. III стадия фето-фетального трансфузионного синдрома.
Рис. 6. Длительно регистрируемый нулевой диастолический кровоток в аорте близнеца-донора. Отсутствует визуализация мочевого пузыря плода.
Рис. 7. Реверсный диастолический кровоток в торакальной аорте близнеца-донора. В условиях фето-фетальной трансфузии спектры, характерные для терминальной фетальной гемодинамики, могут регистрироваться до нескольких недель.
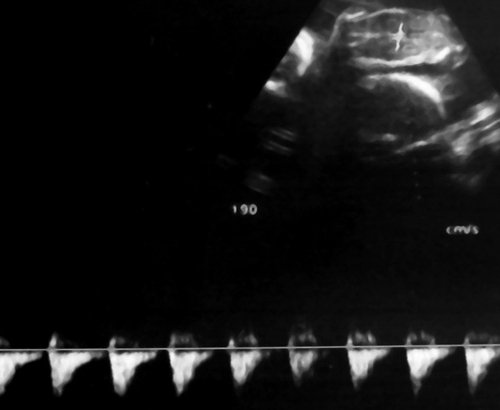
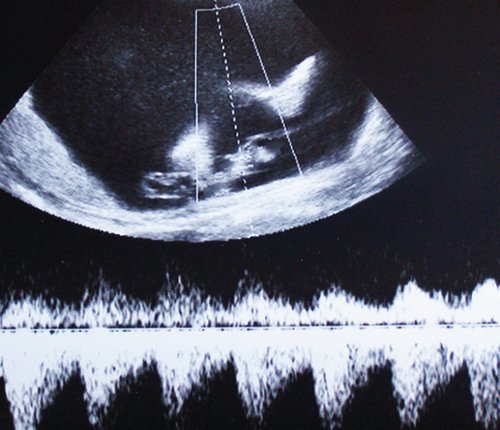
Рис. 8. Нормальная спектральная допплерограмма пуповинных артерий плода-реципиента сохраняется даже на фоне его терминального состояния, вплоть до внутриутробной гибели; выраженный полигидрамнион.
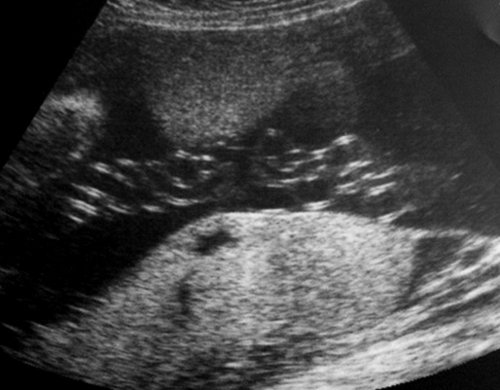
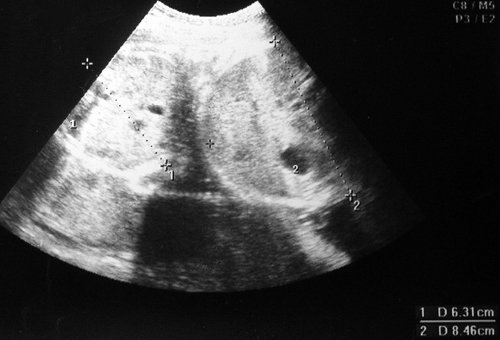
Рис. 9. Гипертрофическая компенсаторная кардиомегалия плода-реципиента (гестационный срок 26-27 нед): площадь сечения сердца занимает около 1/2 площади поперечного сечения грудной клетки, толщина миокарда желудочков и межжелудочковой перегородки сердца плода 6,5 и 6,8 мм соответственно.
Рис. 10. Пуповина плода-реципиента с признаками многократного «скручивания». Изменения зарегистрированы одновременно с допплерографическими признаками повышения резистентности венозного протока (см. рис. 11).
Рис. 12. Признаки развития сердечной недостаточности плода-реципиента вследствие гемодинамической перегрузки, начальный асцит (стрелки). IV, предтерминальная, стадия тяжелого хронического фето-фетального трансфузионного синдрома. Внутриутробная гибель обоих плодов наступила менее чем через 24 ч.
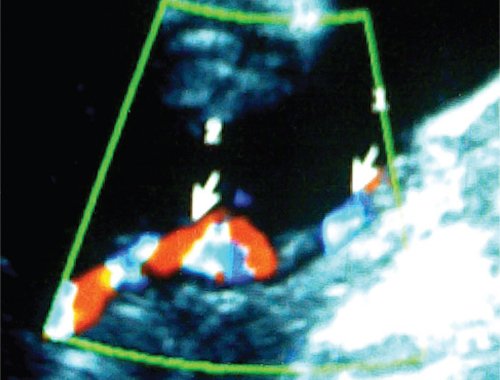
Межблизнецовые внутриплацентарные анастомозы были не единственным проявлением особенностей пуповинных сосудов. Для всех плодов при тяжелом хроническом ФФТС были характерны различные внеплацентарные изменения морфологии пуповин, выявленные антенатально в разных сочетаниях с помощью УЗИ: различная толщина пуповин близнецов за счет гипоплазии пуповинных сосудов меньшего плода, а также его гиповолемии; аномальное количество сосудов; децентрированное (краевое) отхождение пуповинных сосудов от плаценты; оболочечный ход сосудов пуповины; внеплацентарные межпуповинные анастомозы; многократно перекрученная, чрезмерно извитая пуповина большего плода; отсутствие спирального хода сосудов пуповины меньшего плода.
Патогномоничными для III клинической стадии тяжелой формы хронического ФФТС были гемодинамические изменения фетальных и пуповинных сосудов, регистрируемые с помощью спектральной допплерографии.
В то же время для пуповинных артерий плода-реципиента были характерны нормальные показатели кровотока, без повышения индексов сосудистой резистентности, регистрируемые вплоть до развития декомпенсированной трансфузии и гибели плодов. Особенностью плодовой гемодинамики близнеца-реципиента являлось нарастание объемной перегрузки с развитием застойной сердечной недостаточности, имевшей допплерографические проявления в виде повышения резистентности кровотока в субдиафрагмальных венозных сосудах плода прежде всего в венозном протоке. Ультразвуковым критерием позднего периода III клинической стадии ФФТС была регистрация допплерограммы венозного протока плода-реципиента с повышением систолодиастолического отношения (S/D) более 3,5. Таким образом, при тяжелом хроническом ФФТС именно патологические венозные допплерограммы реципиента свидетельствуют о скором развитии предтерминального состояния, что необходимо принимать во внимание при выработке акушерской тактики.
Вслед за регистрацией патологического спектра кровотока в венозном протоке быстро появлялись ультразвуковые признаки застойной сердечной недостаточности плода-реципиента: асцит, гидроторакс, гидроперикард либо анасарка, что отражало развитие IV клинической стадии тяжелого хронического ФФТС. Эта стадия в 2 случаях имела небольшую продолжительность (1-2 дня) и завершилась регистрацией внутриутробной гибели обоих пар плодов в 27 +4 и 28 +2 нед гестации; вес близнецов при рождении составил 690 и 1140 г и 810 и 1280 г, соответственно. В третьем случае при регистрации нарушений венозной гемодинамики реципиента было проведено оперативное родоразрешение в 30 +1 нед (вес при рождении составил 780 и 1630 г, меньший плод погиб интранатально, у большего плода имели место тяжелый интранатальный дистресс, полицитемия и неонатальные осложнения, связанные с недоношенностью).
Морфологическое исследование последа во всех случаях выявило наличие различных форм внутриплацентарных сосудистых анастомозов (артерио-артериальных, васкулярных цепей, артериовенозных, вено-венозных и сочетанных форм), а также внеплацентарных пуповинных аномалий.
В качестве иллюстрации синдрома острой межблизнецовой трансфузии и селективной задержки роста одного из плодов приводим клинические наблюдения.
Рис. 13. Беременность 31 нед. Монохориальная моноамниотическая двойня. Острая межблизнецовая трансфузия. Выраженное острое многоводие.
Рис. 14. Беременность 35-36 нед. Дискордантный рост монозиготных близнецов. Поперечные сечения туловищ плодов, имеющие разные диаметры и окружности. Допплерографически регистрировались признаки повышения резистентности в пуповинных артериях обоих плодов, венозная фетальная гемодинамика без изменений.
Выводы
В современной акушерской клинике сонография имеет безусловный приоритет как в первичной диагностике фето-фетального трансфузионного синдрома, так и в определении его клинической стадии, оценке гемодинамики фетоплацентарных систем плодов, их функционального состояния, прогнозировании перинатального исхода, дифференциальном диагнозе с другими вариантами осложнений монохориального многоплодия. Адекватный диагноз является необходимым условием выработки индивидуальной терапевтической тактики и cпособствует улучшению перинатальных результатов.
Литература
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Фето фетальный синдром при многоплодной беременности что
Фетофетальный трансфузионный синдром является крайне тяжелым осложнением монохориальной многоплодной беременности и встречается примерно в 10–15 % случаев. Причины его возникновения до конца не изучены, предполагают, что ФФТС связан с нарушением формирования плаценты, поздним разделением плодов, негативным влиянием внешних повреждающих факторов и дефицитом кровотока в матке беременной. ФФТС вызывает отклонения в развитии сердечно-сосудистой системы как во внутриутробном, так и в постнатальном периоде. Патологии, возникающие при этом, оказывают влияние на организм в целом и без своевременной диагностики и правильно подобранного метода лечения оказываются летальными до 100 % случаев.
Цель работы: анализ литературы, посвященной современным представлениям о влияния ФФТС на развитие сердечно-сосудистой системы монохориальной двойни во внутриутробном периоде. Раскрытие роли кардиоваскулярных нарушений в возникновении патологий организма в целом в постнатальном периоде.
Начиная со второй половины прошлого века в сфере научного исследования акушерства и гинекологии особое внимание уделялось закономерности повышенного риска развития сердечно-сосудистых патологий у монохориальных двоен в пре- и постнатальном периоде. Постепенно изучение данной проблемы привело ученых к выводу о существовании определенных процессов во внутриутробном периоде, которые нарушают поступление необходимых для развития сердечно-сосудистой системы веществ у близнецов. Такие процессы названы фетофетальным трансфузионным синдромом (ФФТС), который был впервые описан в конце XIX в. немецким гинекологом Фридрихом Шацом [1]. ФФТС является следствием развития глубоких анастомозов в сосудистой сети плаценты, в результате чего кровотоки плодов могут соединяться, вызывая диспропорцию в объёмах [2]. Таким образом, возникает нарушение в системе кровообращения двойни так, что один плод – «донор» испытывает недостаток пластических веществ и кислорода, а другой плод – «реципиент» подвержен действию избыточно поступающего объема крови. Этот процесс происходит из-за соединения сосудов плода и образования артериовенозного шунта. Выделяют два вида таких шунтов: поверхностные, которые находятся на основании стенки хориона – артерио-артериальные (АА) и вено-венозные (ВВ), и глубокие, расположенные в толще плаценты. Глубокие анастомозы обеспечивают поступление артериальной крови одного плода в венозную систему другого, образуя артериовенозные шунты (АВ) [2]. Существуют 5 степеней тяжести ФФТС, основанных на диаметре, количестве, направлении тока крови анастомозов и выраженности компенсаторных реакций двойни. Несмотря на то, что анастомозы между плодами имеются при всех монохориальных двойнях, ФФТС обычно формируется при диамниотических двойнях. Это связано с тем, что при моноамниотических беременностях больше двунаправленных поверхностных анастомозов, чем при диамниотических.
Основные особенности влияния ФФТС на организм человека могут быть изучены в результате сравнения протекания гестационного периода и родов беременных одним плодом и двойней, а также частоты постнатальных нарушений у детей. Согласно статистическим данным, частота преждевременных родов при одноплодной беременности составляет около 7 %, а при двуплодной – 49 %. Также масса тела при рождении, независимо от гестационного срока, будет 20 секунд. При этом существует вероятность перехода данного состояния в синдром внезапной детской смерти в постнатальном периоде [19].
Также у ребенка, который испытывал снижение ОЦК, после рождения возникают церебральные нарушения, связанные с рядом причин. Во-первых, с образованием кист белого вещества, формирующихся в результате длительной гипоксии и осложненной беременности, которыми могут стать арахноидальные кисты. Эти новообразования начинают оказывать давление на мозговые оболочки, что приводит к увеличению ликворопродукции. Следствием является увеличение внутричерепного давления и гидроцефалия, которые проявляются головной болью, срыгиванием, рвотой, потерей аппетита, вялостью, беспокойным сном, судорогами, гипотонусом и гипертонусом конечностей, неспособностью координировать движения, также возможны нарушения зрения и слуха. Во-вторых, церебральные патологии связаны с нарушением выделительной функции почек, что ведет к накоплению остаточных продуктов белкового обмена, оказывающих токсическое действие на головной мозг. Самые тяжелые поражения нервной системы могут проявляться такими аномалиями строения мозга, как агенезия борозд, агирия, недоразвитие серого вещества в больших полушариях головного мозга, полимикрогирия, гетеротопия [24]. По данным различных научных деятелей неврологические и нервно-психические расстройства встречаются среди 18–26 % выживших при ФФТС [25]. Таким образом, ФФТС оказывает значительное воздействие на организмы близнецов и в постнатальном периоде.
Заключение
ФФТС действительно вызывает отклонения сердечно-сосудистой системы как во внутриутробном, так и в постнатальном периоде. Патологии, возникающие при этом, оказывают влияние на организм в целом [26]. Поэтому необходимо проводить раннюю диагностику беременных с монохориальной двойней для выявления признаков нарушений и своевременного контроля над развитием ФФТС. В качестве рекомендаций для диагностики можно выделить следующие критерии УЗИ: наличие монохориальности (может быть определена с 4-й недели при использовании трансвагинального датчика) и максимального свободного кармана околоплодных вод одного плода менее 2,0 см и более 8,0 см второго плода [7]. С помощью классификации стадий ФФТС по Quintero и данных критериев возможно сравнивать различные способы лечения и прогнозировать выживаемость после врачебных вмешательств. При этом до установления типа хориальности все двуплодные беременности следует относить к группе риска ФФТС. Выбор тактики лечения ФФТС зависит от гестационного срока, анатомических особенностей матери, места прикрепления плаценты, возможности проведения фетоскопии, технического обеспечения. Консервативная терапия признана неэффективной, используются только хирургические методы: фетоскопическая коагуляция анастомозов плаценты, фетоскопическая лазерная коагуляция пуповины, амниоредукция или серийный амниодренаж, септостомия или прерывание беременности [2, 18, 27].
Фето фетальный синдром при многоплодной беременности что
Московский областной НИИ акушерства и гинекологии
ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава РФ, Москва, Россия
Современные аспекты диагностики и коррекции фето-фетального трансфузионного синдрома при многоплодной монохориальной беременности
Журнал: Российский вестник акушера-гинеколога. 2020;20(3): 11-17
Логутова Л. С., Шилкина П. С. Современные аспекты диагностики и коррекции фето-фетального трансфузионного синдрома при многоплодной монохориальной беременности. Российский вестник акушера-гинеколога. 2020;20(3):11-17.
Logutova L S, Shilkina P S. Modern aspects of the diagnosis and correction of feto-fetal transfusion syndrome in multifetal monochorial pregnancy. Russian Bulletin of Obstetrician-Gynecologist. 2020;20(3):11-17.
https://doi.org/10.17116/rosakush20202003111
Московский областной НИИ акушерства и гинекологии
В представленном обзоре литературы обсуждается проблема перинатальной смертности, связанная с развитием фето-фетального трансфузионного синдрома (ФФТС) при многоплодной монохориальной беременности. Несмотря на большие терапевтические успехи, достигнутые в течение последних 15 лет, ФФТС приводит к перинатальным потерям и высокому уровню заболеваемости новорожденных в 56—100% наблюдений многоплодной монохориальной беременности. В статье рассмотрены наиболее современные подходы к диагностике этого осложнения, а также актуальные методы лечения беременных с диагностированным ФФТС. Для коррекции ФФТС применяются фетоскопическая лазерная коагуляция анастомозов плаценты, амниоредукция, селективная редукция одного плода из двойни или прерывание беременности. В обзоре сравниваются данные методы лечения в зависимости от стадии ФФТС и различных факторов, влияющих на выбор терапевтической тактики.
Московский областной НИИ акушерства и гинекологии
ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава РФ, Москва, Россия
Введение
За последние годы во всем мире возросла частота многоплодной беременности (МБ) с 1,6 до 35,40%. Она составляет примерно 3% в структуре рождения и 14% в структуре перинатальной смертности, в связи с чем МБ становится крайне актуальной проблемой современного акушерства во всем мире. Рост частоты МБ обусловлен широким внедрением в практику здравоохранения эффективных методик лечения пациенток с бесплодием, а также применением вспомогательных репродуктивных технологий [1—8].
МБ, особенно после экстракорпорального оплодотворения и при наличии осложненного акушерско-гинекологического анамнеза, ассоциируется со значительным числом осложнений, сопровождающих ее с раннего гестационного срока. Именно это определяет повышенный уровень антенатальных и перинатальных потерь. Наиболее значимыми из них являются невынашивание в разные сроки гестации, преждевременные роды, а также увеличение вероятности возникновения преэклампсии, анемии, тромбозов, гестационного сахарного диабета, послеродового кровотечения, рождения детей с малой массой тела, неврологическими осложнениями и антенатальная гибель плодов [3, 7]. Даже при современном развитии медицины перинатальная смертность при многоплодии более чем в 6 раз превышает таковую при одноплодной беременности, частота внутриутробной гибели плода выше в 4 раза, а неонатальной — в 6 раз [2, 9]. По мнению большинства исследователей, основной причиной перинатальных потерь при многоплодии является глубокая недоношенность (и, соответственно, низкие показатели массы и длины тела при рождении), причем недоношенность среди других причин занимает первое место [2, 7, 10, 11].
Следующей причиной перинатальной заболеваемости и смертности при многоплодии, как правило, является плацентарная недостаточность (задержка внутриутробного развития плодов) [12, 13]. Особое значение имеет также тип плацентации, являющийся фактором, который существенно влияет на перинатальную заболеваемость и смертность. Примерно 80% плацент при МБ имеют дихориальный тип, 20% — монохориальный. Монохориальная плацента — единственная структура, которая в 90—95% случаев содержит сосудистые анастомозы между плацентарными системами кровообращения двух плодов, что может быть основой таких серьезных осложнений МБ, как синдром фето-фетальной трансфузии. По данным большинства авторов, фето-фетальный трансфузионный синдром (ФФТС) наблюдается в общей структуре многоплодия у 15—35% беременных [14—17].
Определение фето-фетального трансфузионного синдрома
Фето-фетальный трансфузионный синдром, или Twin-to-Twin Transfusion Syndrome (TTTS) — тяжелое осложнение многоплодной монохориальный беременности, связанное с наличием трансплацентарных сосудистых коммуникаций и циркуляторным дисбалансом между внутриплацентарными сосудистыми руслами плодов-близнецов [18]. При наличии больших васкулярных аномалий в плаценте между плодами формируются гемодинамические отношения плод—донор и плод—реципиент с диспропорцией объемов циркулирующей крови (ОЦК). Вследствие несбалансированной гемотрансфузии у плода-донора развиваются гиповолемия и анемия на фоне задержки роста. Критическое снижение ОЦК сопровождается прогрессирующей олиго- и анурией, выраженным маловодием, что препятствует нормальному созреванию легочной ткани, и высокой вероятностью антенатальной гибели плода [19]. У плода-реципиента в результате циркуляторной диспропорции резко возрастает ОЦК, развивается полицитемия, формируется гипертрофическая кардиомегалия. На фоне гемодинамической декомпенсации развивается застойная сердечная недостаточность. Увеличение почечного кровотока и повышение продукции мочи приводят к росту объема амниотической жидкости как фактора повышенного риска преждевременного разрыва плодного пузыря и индукции преждевременных родов [20].
Хотя анастомозы и, как следствие этого, сброс крови между плодами имеются при всех монохориальных двойнях, ФФТС обычно развивается только при диамниотических монохориальных двойнях. Это, вероятно, связано с тем, что при моноамниотических беременностях больше двунаправленных поверхностных анастомозов, чем при диамниотических [12].
Актуальность проблемы фето-фетального трансфузионного синдрома в современной медицине
Несмотря на большие терапевтические успехи, достигнутые в течение последних 15 лет, ФФТС сопровождается высокой перинатальной смертностью и заболеваемостью, число случаев которых составляет от 56 до 100% и зависит от гестационного срока и тяжести гемодинамических нарушений [5, 18, 21]. Формирование васкулярных анастомозов при монохориальном многоплодии встречается в 85—100% наблюдений [19, 22]. По данным L. Lewi и соавт. [23], синдром фето-фетальной гемотрансфузии является одной из наиболее частых причин потерь при монохориальной беременности, особенно в сроке до 24 нед беременности. Развитие ФФТС до 26 нед гестации связано с крайне высоким риском перинатальной смерти [24]. Во многих наблюдениях беременность заканчивается либо выкидышем, либо преждевременными родами вследствие полигидрамниона и растяжения матки или внутриутробной гибелью плода, связанной с тяжелыми сердечно-сосудистыми нарушениями. Распространенность ФФТС составляет 1 случай из 2000 беременностей [7].
По данным ретроспективного анализа, проведенного на базе Уральского научно-исследовательского института охраны материнства и младенчества Минздрава России, в Екатеринбурге в 2016 г., в группе женщин с монохориальной многоплодной беременностью, родоразрешенных в сроке предполагаемых родов, частота развития ФФТС была чрезвычайно высокой. У 29 (76,3%) беременных из 38 наблюдавшихся с монохориальной двойней были зарегистрированы признаки ФФТС. Среди монохориальных многоплодных беременностей, закончившихся в более поздние сроки, число наблюдений ФФТС значительно меньше — 26,2% (55 из 210 случаев) [14].
Особенности ведения беременности, осложненной фето-фетальным трансфузионным синдромом. Диагностика
Как показали данные исследований, проведенных в Московском областном научно-исследовательском институте акушерства и гинекологии (МОНИИАГ) [9, 15], наблюдение за пациентками со спонтанно наступившей многоплодной беременностью проводится по алгоритму, в основе которого лежит определение хориальности, т.е. числа хорионов (плацент). Ранняя диагностика числа хорионов и амнионов позволяет предвидеть возможные осложнения и провести своевременную профилактику с целью снижения числа неблагоприятных исходов, связанных с монохориальной беременностью. Оптимальный срок для определения хориальности при ультразвуковом исследовании — 11—14 нед, так как после 15 нед беременности возможности диагностики снижаются [3, 4]. Согласно практическим рекомендациям ISUOG (The International Society of Ultrasound in Obstetrics & Gynecology/Международное общество специалистов в области ультразвуковой диагностики в акушерстве и гинекологии) хориальность должна быть определена в сроки между 11-й неделей и 13-й неделей 6 днями беременности, ориентирами должны служить толщина мембраны в месте присоединения амниотической оболочки к плаценте и выявление Т-признака или λ-признака (лямбда-признак), а также выявление количества плацентарных масс, визуализируемых во время ультразвукового исследования [5]. При невозможности однозначного определения типа хориальности, беременность рекомендовано вести как монохориальную, пока не будет подтверждено обратное [25]. Начиная с 16 нед беременности, показано проведение ультразвукового исследования каждые 2 нед. Необходимо оценивать максимальный и минимальный карманы околоплодных вод, размеры мочевого пузыря у плодов и динамику их роста. Воротниковый отек при монохориальной двойне является не столько признаком хромосомных аномалий у плодов, сколько ранним прогностическим признаком развития тяжелого синдрома фето-фетальной гемотрансфузии. Еженедельное ультразвуковое исследование показано при подозрении на формирование ФФТС, первым признаком которого будет дисбаланс околоплодных вод. Начиная с 20-й недели беременности, в качестве скрининга синдрома анемии—полицитемии должна проводиться оценка максимальной систолической скорости в средней мозговой артерии плодов [3, 5, 26, 27].
При подтверждении диагноза ФФТС выполнение допплерометрии и цервикометрии позволяет уточнить стадию и принять решение о выборе адекватных лечебных вмешательств. Ультразвуковые признаки, указывающие на высокий риск развития ФФТС, включают дискордантность величин толщины воротникового пространства, наличие патологического кровотока в венозном протоке в сочетании с разницей в размерах плодов более 25% [26].
Стадия ФФТС определяется в соответствии с классификацией R. Quintero и соавт. [21, 28]:
Стадия I: полигидрамнион реципиента в сочетании с олиго/ангидрамнионом у донора; мочевой пузырь плода-донора определяется;
Стадия II: мочевой пузырь донора не визуализируется при 60-минутном ультразвуковом исследовании, состояние кровотока в артерии пуповины и/или венозном протоке некритическое;
Стадия III: критическое нарушение гемодинамики по данным допплерометрии (отсутствие или реверсный диастолический кровоток в артерии пуповины, реверсный кровоток в венозном протоке или пульсирующий в вене пуповины) у плода донора и/или плода-реципиента;
Стадия IV: водянка у плода-реципиента;
Стадия V: гибель одного или обоих плодов.
Несмотря на то что стадии, предложенные R. Quintero и соавт. не всегда точно предсказывают исход беременности или хронологическую эволюцию ФФСТ, они являются основной системой классификации ФФТС [5].
Монохориальная МБ, предрасположенная к риску плацента-ассоциированных сосудистых осложнений, требует более частого наблюдения, и в сроке 32—34 нед беременности следует выработать тактику дальнейшего ведения таких пациенток или выбрать метод родоразрешения с целью предупреждения гибели плодов [3].
Современные подходы к лечению фето-фетального трансфузионного синдрома
Ни в одной другой специальности клиническая ситуация не изменяется с такой быстротой, как в акушерстве, когда тактика ведения пациенток может в мгновение стать противоположной. Для лечения ФФТС применяются фетоскопическая лазерная коагуляция анастомозов плаценты, амниоредукция, селективная редукция одного плода из двойни или прерывание беременности. Наиболее эффективным методом лечения данного синдрома в настоящее время остается фетоскопическая лазерная коагуляция анастомозов, при которой устраняется причина появления трансфузии. Другой способ лечения — амниоцентез — убирает лишь следствие заболевания. Факторами, влияющими на выбор тактики, являются степень оснащенности медицинского учреждения, опыт персонала, срок беременности, стадия ФФТС, длина шейки матки, а также технические возможности, ограничивающие проведение фетоскопии (локализация плаценты, места прикрепления пуповин и особенности анатомии матери) [3, 5, 25, 29—31].
По мнению большинства авторов, при выжидательной тактике перинатальная смертность при ФФТС достигает 95% и согласно их точке зрения такая тактика не является рациональным подходом к лечению данной патологии в современном акушерстве [26, 32, 33]. Несмотря на это, в настоящее время во многих акушерских центрах мира стадия I по Quintero ведется консервативно. Но при этом нужно учитывать, что, если выбрано консервативное ведение, то такие симптомы, как нарастание многоводия, дискомфорт матери, укорочение длины шейки матки, должны рассматриваться как критерии, сигнализирующие о необходимости перехода к лечению с помощью фетоскопической лазерной аблации [5].
Фетоскопическая лазерная коагуляция
В процессе изучения методов лечения ФФТС врачами многих стран мира техника хирургического вмешательства претерпевала различные модификации. Вначале в хирургический процесс вовлекались все сосуды, пересекающие амниотическую мембрану [34, 35]. Учитывая, что в таком случае затрагиваются также сосуды, не соединяющие системы циркуляции обоих плодов и не участвующие в развитии ФФТС, R. Quintero и соавт. разработали методику селективной лазерной коагуляции. При этом подходе коагулируются только связанные друг с другом сосуды, которые анатомически могут не иметь отношения к амниотической перегородке [21, 36]. Согласно протоколу клиничес-ких рекомендаций по многоплодной беременности 2018 г. [25] имеются различия в технике выполнения операции, вмешательство выполняют с различной степенью селективности. Тактика L. Salomon (от одного края плаценты до другого) характеризуется коагуляцией не только анастомозов, но и плацентарного экватора между ними; в идеале плацента после аблации должна стать «дихориальной», что позволяет значительно снизить риск не только рецидива ФФТС, но и возникновения синдрома анемии—полицитемии [5, 25].
Исходы операций во многом зависят от опыта оперирующих врачей. Недостаточный опыт ведет к тому, что анастомозы остаются незамеченными, и в результате развивается рецидив ФФТС до рождения. Так, по данным E. Lopriore и соавт. [37], в 32% случаев после лазерной коагуляции были обнаружены пропущенные анастомозы. При этом в 44% это привело к развитию анемии, полицитемии. В Международном учебном центре микроинвазивной фетальной хирургии (Prenatal International GmbH, Германия) применение 1,0—1,2-миллиметровой оптики и уменьшение диаметра троакара с 3,8—4,3 мм (13 F, 11,27 мм 2 ) до 2,3 мм (7F, 2,65 мм 2 ) привело к значительному улучшению исходов для новорожденных. Выживаемость после лазерной коагуляции минимум одного ребенка выросла с 94,9 до 100% и для двух плодов с 74,3 до 90% (n=70) [38].
После внутриутробного вмешательства пациентке проводят лечение, направленное на пролонгирование беременности, в условиях стационара под контролем сонографических и лабораторных показателей. Выбор препаратов, дозировка и продолжительность терапии подбираются индивидуально, согласно существующим протоколам — микронизированный прогестерон, гексопреналин-селективные β2-адреномиметики, атозибан, противовоспалительные препараты для местного применения. Эффективность терапии оценивают через 14 дней после операции по нормализации количества околоплодных вод, визуализации мочевого пузыря плода-донора. Общепринятой практикой является проведение ультразвукового исследования раз в неделю в течение первых 2 нед после проведенной терапии с последующим снижением частоты осмотров до одного раза в 2 нед после разрешения клинической симптоматики [5, 25].
По данным одного из исследований, при сравнении близнецов от беременностей с проведенной внутриутробной селективной лазерной фотокоагуляцией (СЛФК) сосудистых анастомозов плаценты и без таковой были выявлены существенные различия. Число родившихся доноров, потребовавших гемотрансфузию в первые сутки жизни в группе без проведенной внутриутробно СЛФК сосудистых анастомозов плаценты, составило 33% при том, что в группе с проведенной внутриутробно коррекцией этот показатель гораздо ниже — 5%. Среди новорожденных-реципиентов проведения коррекции полицитемии путем операции частичной обменной трансфузии в группе с проведенной внутриутробно СЛФК сосудистых анастомозов плаценты нуждались 1% пациентов, тогда как в группе без проведенной внутриутробно коррекции ФФТС — 24% [7, 24].
В публикации Общества медицины матери и плода (SMFM), посвященной ФФТС, было отмечено, что «фетоскопическая лазерная коагуляция анастомозов плаценты считается большинством экспертов всего мира наилучшим подходом к терапии II, III и IV стадий ФФТС при сроке гестации с 16-й по 26-ю неделю» [21, 29, 39].
Амниоредукция
Несмотря на впечатляющие успехи в применении лазерной коагуляции, в современной научной литературе вновь возрос интерес к применению серийных амниоредукций в ранние стадии ФФТС. Серийная амниоредукция заключается в повторном выполнении трансабдоминального амниодренажа с целью уменьшения количества околоплодных вод плода-реципиента и пролонгирования беременности. Это связано с тем, что при I стадии была отмечена высокая частота случаев отсутствия прогрессирования заболевания, что возродило интерес к более консервативному методу лечения — амниоредукции [25, 40].
На базе Родильного дома №17 в Санкт-Петербурге в 2017 г. было подробно изучено клиническое наблюдение успешного применения однократной амниоредукции, приведшей к регрессу ФФТС, однако осложнившееся развитием в родах синдрома анемии — полицитемии. Данное наблюдение наглядно демонстрирует возможность эффективной коррекции ранней стадии фето-фетального синдрома с помощью амниоредукции. Врачам удалось пролонгировать беременность на 4 нед и 6 дней, обеспечив достижение плодами большей морфофункциональной зрелости и массы тела при рождении более 2000 г у обоих плодов. Это наблюдение подтверждает современную концепцию о том, что ранние стадии ФФТС в III триместре беременности в отсутствие прогрессирования не требуют срочного родоразрешения.
Кроме того, серийная трансабдоминальная амниоредукция является терапией второй линии в отсутствие возможности выполнения СФЛК в связи со срокои беременности более 26 нед, а также при рецидиве синдрома после фетоскопической лазерной коагуляции анастомозов плаценты и в отсутствие технической возможности выполнить лазерную коагуляцию [5, 25, 26].
По данным двух контролируемых нерандомизированных исследований, в которых сравнивались серийные амниоцентезы и селективная лазерная фотокоагуляция анастомозов плаценты, частота выживания хотя бы одного плода составила 79% [41] и 83,1% [39]. Сравнение данных этих исследований показало, что выживаемость в группе амниоредукции составила 64,4% (78/121) по сравнению с 81,5% (137/168) в группе лазерной терапии (p=0,001) [29]. Анализ отдаленных исходов развития нервной системы у новорожденных детей после лечения ФФТС методом амниоредукции показал, что частота развития церебрального паралича составляла 5,8—22,5%, задержки психомоторного развития — 7,5—22,5% [23, 37, 38, 42].
Другие методы лечения фето-фетального трансфузионного синдрома
Ситуация при монохориальной двуплодной беременности значительно отличается от дихориальной беременности, поскольку внутриутробная гибель плода (ВГП), отстающего в росте, резко увеличивает риск гибели, а также заболеваемость второго близнеца. Если ВГП во II триместре после 24-й недели беременности нельзя избежать, и она ожидается по результатам допплеросонографии, перед врачом возникает дилемма — индуцировать преждевременные роды с весьма сомнительным прогнозом для обоих близнецов или выбрать выжидательную тактику с риском 26% летальности и повышенной заболеваемости для здорового близнеца. В некоторых клиниках выполняют избирательное устранение плода посредством лазерной коагуляции места прикрепления пуповины с помощью биполярных щипцов или радиоаблации пупочных сосудов, что может привести к улучшению неонатального исхода для здорового близнеца [30].
Селективную элиминацию плода (остановка сердечной деятельности) рекомендовано применять при наличии аномалий развития одного из плодов, сочетания ФФТС с селективной задержкой роста одного из плодов при дискордантности более 40% (до 22 нед беременности), при IV стадии ФФТС в отсутствие технической возможности выполнения лазерной коагуляции. Проводят окклюзию пуповины путем коагуляции сосудов одного из плодов фетоскопическим или пункционным доступом, применяя интрафетальную лазерную или радиочастотную аблацию. Это означает, что один из плодов приносится в жертву в надежде предотвратить гибель другого плода или развитие у него повреждения головного мозга. В некоторых редких случаях родители принимают решение прервать всю беременность [5, 25, 43].
В настоящее время нет единой научно обоснованной точки зрения в отношении сроков планового родоразрешения при ФФТС без проведения лазерной коагуляции анастомозов плаценты. По данным разных авторов, этот срок варьирует от 32 до 37 нед и в каждом случае выбирается в зависимости от акушерской ситуации индивидуально [40].
В любом случае многоплодной монохориальной беременности к вопросу выбора тактики ведения, пути и времени родоразрешения следует подходить со всей серьезностью, обращая внимание на малейшие осложнения у матери и плодов [3].
Заключение
Таким образом, многоплодная монохориальная беременность по-прежнему является одной из самых сложных и неоднозначных патологий в акушерстве и неонатологии. Ежедневно врачи всего мира прикладывают огромные усилия к пониманию этиологии и патогенеза, обусловливающих возникновение фето-фетального трансфузионного синдрома при многоплодной беременности. Ведутся исследования и предлагаются новые методики диагностики и лечения ФФТС. В настоящее время развитие медицинской техники, современных методов пренатальной диагностики и использование минимально инвазивных интрафетальных методов коррекции ФФТС позволяют сохранить беременность, жизнь матери и обоих плодов, снизить уровень перинатальной смертности во всем мире.
Участие авторов:
Концепция и дизайн исследования — Л.С. Логутова;
Сбор и обработка материала — П.С. Шилкина;
Написание текста — П.С. Шилкина;
Редактирование — Л.С. Логутова.
Авторы заявляют об отсутствии конфликта интересов.