Фармакопея что это такое в медицине
ФАРМАКОПЕЯ
Фармакопея (греческий pharmakopoeia искусство приготовления лекарств) — сборник стандартов и положений, нормирующих требования к качеству лекарственных средств.
Первая русская государственная фармакопея на латинском языке («Pharmacopoea Rossica») вышла в свет в 1778 году. В 1798 году была издана вторая государственная русская фармакопея. В 1765 году в России издана военная фармакопея на латинском языке. После этого издавались военные фармакопеи (1779, 1782,1797,1808, 1812, 1818, 1840 годы), морская фармакопея (1869), «фармакопеи для бедных» (1807,1829, 1845, 1860 годы) и «придворные фармакопеи» (1825, 1872, 1874 годы).
В 1866 году вышла Российская фармакопея на русском языке, положившая начало порядковой нумерации российских, а затем государственных фармакопеи Советского Союза. Фармакопея 1866 году стала первым изданием; второе, третье, четвертое, пятое и шестое издания Российской фармакопеи вышли в свет соответственно в 1871, 1880, 1891, 1902 и 1910 годах.
Качественно новым этапом в развитии русских фармакопей явилось создание Государственной фармакопеи СССР, отразившее заботу Советского государства об обеспечении населения высококачественными лекарственными средствами. Первое издание Государственной фармакопеи СССР вышло в 1925 году и по преемственности с ранее издававшимися российскими фармакопеями было обозначено VII изданием.
В 1946 году вышло восьмое издание Государственной фармакопеи СССР, в 1952 году— второй (переработанный) тираж этого издания, в 1961 году— девятое, в 1968 году— десятое издание.
Государственная фармакопея СССР X издания (ГФХ) является однотомным изданием, состоящим из двух основных разделов.
Первый раздел включает частные статьи (монографии) об отдельных лекарственных средствах и групповые статьи о лекарственных формах (таблетки, настойки, экстракты, листья, травы и др.). Перечень частных статей, включаемых в фармакопею, составляется на основе Государственного реестра лекарственных средств, разрешенных к применению в медицинской практике и к промышленному производству в СССР (см. Реестр государственный).
Во втором разделе содержится описание общих физико-химических, химических и биологических методов исследования, применяемых для анализа лекарственных средств (общие реакции на подлинность, испытание на чистоту и допустимые пределы примесей, растворимость, определение прозрачности, степени мутности и окраски жидкостей. определение золы, летучих веществ, температуры плавления или кипения, плотности и др., флюорометрия, полярография, определение pH, хроматография и др., биологические методы оценки лекарственных растений, содержащих сердечные гликозиды, биологические методы оценки ряда гормональных препаратов, испытание на токсичность, пирогенность, стерильность и др., методы статистического анализа результатов биол. испытаний и др.).
В «Приложении» приведен ряд таблиц, необходимых для определения качества лекарственных средств (таблицы капель, плотностей водных растворов кислот, щелочей и др., абсолютной вязкости воды, алкоголеметрические таблицы и др.).
Приведены также таблицы высших доз ядовитых и сильнодействующих лекарственных средств для взрослых и детей, а также таблица однократных доз наиболее часто применяемых лекарственных средств для животных.
В ГФХ содержится 738 статей на индивидуальные лекарственные формы. На остальные допущенные к применению лекарственные средства утверждены фармакопейные статьи, приравненные по действию к включенным в фармакопею.
В дальнейшем после издания ГФХ утверждались новые фармакопейные статьи, являющиеся наряду с фармакопей официальными государственными документами, издаваемыми в виде отдельных статей или сборников как дополнение к действующей фармакопеи. Ведется подготовка нового (XI) издания фармакопеи.
Каждое новое издание Государственной фармакопеи СССР отражает достижения медицины, фармации, химии и других смежных наук на соответствующем этапе их развития.
Фармакопея в СССР имеет законодательный характер. Министерство здравоохранения СССР (см.) утверждает Государственную фармакопею и фармакопейные статьи на лекарственные средства, имеющие силу государственных стандартов. В соответствии с этим требования Государственной фармакопеи, предъявляемые к лекарственным средствам, являются обязательными для всех предприятий и учреждений Советского Союза, изготовляющих, хранящих, контролирующих и применяющих лекарственные средства.
В соответствии с Основами законодательства СССР и союзных республик о здравоохранении (см. Законодательство о здравоохранении) качество лекарственных средств должно соответствовать требованиям Государственной фармакопеи СССР.
Государственная фармакопея СССР принята соответствующими правовыми актами как официальная государственная в Народной Республике Болгарии и Монгольской Народной Республике.
Составление фармакопеи осуществляется под руководством Фармакопейного комитета Управления по внедрению новых лекарственных средств и медицинской техники М3 СССР (см. Фармация) при участии научно-исследовательских учреждений, кафедр фармацевтических институтов и факультетов, химико-фармацевтических предприятий.
Э. А. Бабаян, М. Д. Машковский, А. Н. Обоймакова.
Фармакопея что это такое в медицине
В настоящее время в Государственный Реестр лекарственных средств Российской Федерации внесено более 20 тысяч наименований лекарственных средств как отечественных, так и зарубежных производителей.
Согласно Федеральному закону «Об обращении лекарственных средств» N 61-ФЗ от 12 апреля 2010 г. [6]:
– «лекарственные препараты – лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности;
– «лекарственная форма – состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта».
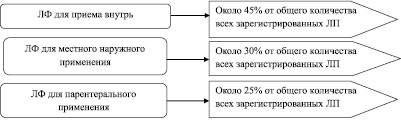
Количество лекарственных форм, в виде которых лекарственные препараты находятся в обращении на территории РФ, составляет 42 наименования. Проведенный анализ показал, что наиболее распространенной лекарственной формой являются таблетки. Число препаратов, представленных в этой лекарственной форме достигает 30 %, на долю лекарственных препаратов в виде растворов приходится 17 %, капсулированные лекарственные препараты составляют 6 %, лиофилизаты, порошки и капли – по 4 %, мази – 3 %. На долю остальных 36 лекарственных форм приходится 32 %. Распределение лекарственных форм по пути введения представлено на рисунке.
Виды лекарственных форм, в которых представлены препараты на российском фармацевтическом рынке, в зависимости от пути введения
Данные рисунка свидетельствуют о том, что наибольший процент из числа зарегистрированных лекарственных препаратов приходится на препараты в лекарственных формах для внутреннего применения (45 %), далее следуют препараты в лекарственных формах для местного и наружного применения (30 %), а затем – препараты для парентерального применения (25 %).
Для обозначения общих требований, предъявляемых к лекарственным формам, впервые в ГФ РФ включена ОФС «Лекарственные формы». В ней приведены основные термины и определения, используемые при описании производства и изготовления ЛФ, классификация ЛФ по агрегатному состоянию, по типу дисперсной системы, по пути введения и типу высвобождения.
Отнесение ЛФ к той или иной классификационной подгруппе в зависимости от ее особенностей (агрегатного состояния, технологии получения, вспомогательных веществ, способов введения) и свойств действующего вещества (источника получения фармацевтической субстанции, физико-химических свойств и др.) определяет подходы к оценке их качества.
В ОФС «Лекарственные формы» описаны общие подходы к производству/ изготовлению ЛФ. Отмечены показатели, которые являются обязательными для оценки качества лекарственного препарата независимо от ЛФ, даны указания по введению других показателей качества в зависимости от свойств ЛФ и показатели, испытание по которым проводится на стадии производственного процесса. Приведены также общие указания по упаковке, маркировке и хранению.
В ГФ РФ включены 21 ОФС на лекарственные формы. Их перечень представлен в табл. 1.
Перечень ОФС на лекарственные формы, включенные в ГФ РФ ХIII издания
Глазные лекарственные формы
Лекарственные формы для ингаляций
Лекарственные формы для парентерального применения
Из 21 ОФС на ЛФ в ГФ РФ XIII издания впервые введены: «Лекарственные формы для ингаляций», «Растворы», «Трансдермальные пластыри» и «Гранулы резано-прессованные», ОФС на 13 ЛФ были представлены в ГФ СССР Х издания [1] и ГФ СССР ХI издания (вып. 2) [2, 7].
Лекарственные средства для ингаляций – жидкие или твердые ЛФ, предназначенные для введения действующих веществ в легкие в виде паров или дисперсий твердых или жидких частиц в газовой среде с целью получения местного или системного эффекта. Одним из главных параметров эффективности ингаляции является такая величина, как депозиция, т.е. отложение препарата в дыхательных путях. Основным фактором, определяющим депозицию частиц в дыхательных путях, является размер частиц аэрозоля. Для определения количества действующего вещества, которое доходит до респираторного тракта, введен показатель «Респирабельная фракция», определяемая по включенной впервые в ГФ РФ ОФС «Аэродинамическое распределение мелкодисперсных частиц».
ЛФ для ингаляций могут быть представлены растворами, суспензиями, эмульсиями, аэрозолями, спреями и порошками. Для ЛФ для ингаляций, снабженных дозирующим устройством, определяют такой показатель, как «Однородность доставляемой дозы».
ОФС «Растворы» посвящена большой группе лекарственных препаратов, находящихся в следующих ЛФ: собственно растворы, капли, микстуры, ароматные воды, сиропы, концентраты для приготовления растворов. В ОФС приведены общие указания по особенностям технологии и стандартизации лекарственных препаратов в зависимости от ЛФ и назначения.
В отличие от пластырей медицинских, для трансдермальных пластырей, впервые описанных в ГФ РФ и предназначенных для контролируемой доставки лекарственного вещества в системный кровоток путем пассивной диффузии через неповрежденную кожу, основным показателем качества является скорость высвобождения действующего вещества или скорость подачи через полимерную мембрану в выбранную среду растворения. Этот показатель определяется по ОФС «Растворение для трансдермальных пластырей», также впервые включенной в ГФ РФ XIII издания.
Среди ЛФ, получаемых из лекарственного растительного сырья, впервые описаны гранулы резано-прессованные, предназначенные для получения водных извлечений.
Актуализированные ОФС на ЛФ, представленные ранее в действующих фармакопеях, значительно дополнены в соответствии с требованиями мировых фармакопейных стандартов.
В ОФС «Аэрозоли и спреи» особое внимание уделено требованиям к качеству, предъявляемым в зависимости от того, является ЛФ дозированной или недозированной: для недозированных аэрозолей определяют содержание действующего вещества в баллоне, процент выхода содержимого упаковки; для дозированных аэрозолей – содержание действующего вещества в дозе; количество доз в баллоне.
В ОФС «Глазные лекарственные формы», разработанной взамен ОФС ГФ Х и ГФ ХI «Капли глазные», помимо капель глазных представлены и другие ЛФ, применяемые в офтальмологической практике: жидкие и мягкие ЛФ для местного применения, твердые ЛФ для приготовления капель глазных, твердые ЛФ для инъекционного и имплантационного введения. Твердыми дозированными офтальмологическими ЛФ являются пленки глазные, состоящие из пленкообразователя и одного или нескольких лекарственных веществ, предназначенные для помещения в конъюнктивальную полость, а также имплантаты глазные, предназначенные для введения во внутренние структуры глаза на длительный период времени для оказания определенного фармакологического действия.
ОФС «Гранулы» и «Капсулы» содержат методику определения распадаемости в зависимости от вида гранул (гранулы, покрытые и непокрытые оболочкой, кишечнорастворимые и шипучие) и капсул (капсулы твердые и мягкие, кишечнорастворимые).
Важной группой ЛФ являются ЛФ для парентерального применения, что связано с быстротой их действия и высокой степенью биологической доступности. По сравнению с ОФС ГФ СССР ХI «Инъекционные лекарственные формы», в которой представлены преимущественно растворы, в ОФС «Лекарственные формы для парентерального применения» включены, помимо таких жидких ЛФ, как растворы для инъекций, также инфузионные ЛФ, концентраты, порошки и лиофилизаты, ЛФ для имплантации, в том числе, с длительным периодом высвобождения.
Для суппозиториев введен показатель «Растворение». Выполнение этого теста предполагает использование специального прибора. Для оценки качества суппозиториев на липофильной основе по этому показателю представлена отдельная ОФС.
В ОФС «Суспензии» дополнительно введены такие показатели качества как рН, размер частиц и вязкость.
Таблетки, как уже отмечалось ранее, являются наиболее востребованными среди лекарственных препаратов, имеющихся в арсенале современной медицины. Наличие или отсутствие оболочки, скорость и характер высвобождения действующего вещества, состав и способ применения таблеток определяют их классификационное деление на группы и обуславливают различие методик испытаний и предъявляемых требований.
Значительно дополнена ОФС «Эмульсии», в которой подробно описаны особенности технологии и испытания.
В ОФС «Настои и отвары», помимо особенностей технологии, описаны испытания этой ЛФ, изготавливаемой преимущественно экстемпорально. Настойки, в соответствии с современными требованиями, кроме испытаний на сухой остаток и тяжелые металлы, подвергаются испытаниям по показателям «Плотность», «Спирт этиловый», «Метанол и 2-пропанол».
ОФС «Сборы» дополнена качественными реакциями, хроматографическим и УФ-спектрофотометрическим анализом, испытаниями на однородность массы, зараженность вредителями запасов, присутствие радионуклидов, тяжелых металлов, остаточных количеств пестицидов, что очень важно для обеспечения безопасности лекарственных препаратов, получаемых из лекарственного растительного сырья.
Для сухих экстрактов предусмотрен контроль по показателю «Насыпной объем» в соответствии с требованиями включенной в ГФ ХIII статьи «Степень сыпучести порошков»; для масляных экстрактов – кислотное число, йодное, перекисное и число омыления, растворимость и показатель преломления. Определяют массу или объем содержимого упаковки и при необходимости – остаточное количество органических растворителей.
Как уже отмечалось ранее, в ГФ РФ ХIII издания включены также статьи на фармацевтико-технологические испытания лекарственных форм, многие из которых впервые введены в практику отечественного фармакопейного анализа (табл. 2).
Перечень ОФС, регламентирующих фармацевтико-технологические испытания лекарственных форм
Фармакопея
Государственная фармакопея — фармакопея, находящаяся под государственным надзором. Государственная фармакопея является документом общегосударственной законодательной силы, его требования обязательны для всех организаций данного государства, занимающихся изготовлением, хранением и применением лекарственных средств, в том числе растительного происхождения.
Содержание
История
История сборников материалов по фармации восходит к древним рукописям, среди которых известны Папирус Эдвина Смита, фармакопея Плиния Старшего, Сад Здравия Петера Шёффеля и другие.
Содержание Фармакопеи
Национальные фармакопеи
Многие страны имеют собственные фармакопеи. Всемирная организация здравоохранения издаёт Международную Фармакопею, не имеющую, однако, законодательного характера, в отличие от национальных фармакопей. В странах, не имеющих собственных фармакопей, используют международную, европейскую или другую. Многие химико-фармацевтические предприятия выпускают субстанции по требованию заказчика — в соответствии с заданным стандартом, с той или иной фармакопеей.
Россия
Составление, дополнение и переиздание Фармакопеи ранее осуществлялось фармакопейным комитетом. В настоящее время Фармакопею готовит редакционный совет, в который входят представители Минздравсоцразвития, Росздравнадзора, Росздрава, ФФОМС и ведущие российские учёные.
Соединенные Штаты Америки
Великобритания
Германия
В Германии действуют 3 Фармакопеи:
Украина
Государственная фармакопея Украины I (ГФУ) выпущена в 2001 году, четыре дополнительных тома — в 2004, 2008, 2009 и 2011 годах, соответственно. Украинская фармакопея фактически по частям воспроизводит Европейскую Фармакопею.
Белоруссия
Государственная фармакопея Республики Беларусь (ГФ РБ), гармонизирована с Европейской Фармакопеей и включает три тома:
Международная и региональная фармакопеи
Примечания
Исторические документы
Ссылки
См. также
Полезное
Смотреть что такое «Фармакопея» в других словарях:
ФАРМАКОПЕЯ — греч., от pharmakon, лекарство, и poieo, делаю. Приготовление лекарств. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. ФАРМАКОПЕЯ обязательное для аптекарей руководство к… … Словарь иностранных слов русского языка
ФАРМАКОПЕЯ — (от греческого pharmakon лекарство и poieo делаю), сборник стандартов и положений, регламентирующих требования к качеству лекарственных средств. 1 я фармакопея издана в 1498 во Флоренции. В России 1 я фармакопея (на латинском языке) вышла в 1778; … Современная энциклопедия
ФАРМАКОПЕЯ — (от греч. pharmakon лекарство и poieo делаю) сборник стандартов и положений, регламентирующих требования к качеству лекарственных средств. 1 я Фармакопея издана в 1498 во Флоренции. В России 1 я Фармакопея (на латинском языке) вышла в 1778; в… … Большой Энциклопедический словарь
Фармакопея — (от греческого pharmakon лекарство и poieo делаю), сборник стандартов и положений, регламентирующих требования к качеству лекарственных средств. 1 я фармакопея издана в 1498 во Флоренции. В России 1 я фармакопея (на латинском языке) вышла в 1778; … Иллюстрированный энциклопедический словарь
ФАРМАКОПЕЯ — (от греч. pharmakon лекарство и poieo делаю), сборник стандартов лекарственных препаратов и предписаний об изготовлении нек рых лекарственных форм. Издание первой официальной книги подобного рода относится к 9 в. (арабский Крабаддин). В России… … Большая медицинская энциклопедия
ФАРМАКОПЕЯ — ФАРМАКОПЕЯ, фармакопеи, мн. нет, жен. (от гроч. pharmakon лекарство и poieo делать) (спец.). Официальное руководство для фармацевтов, содержащее описание способов приготовления, хранения, проверки лекарств, перечень лекарственных веществ, которые … Толковый словарь Ушакова
ФАРМАКОПЕЯ — ФАРМАКОПЕЯ, и, жен. (спец.). Свод обязательных правил, к рыми руководствуются при изготовлении, проверке, хранении и назначении больным лекарственных препаратов. | прил. фармакопейный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова.… … Толковый словарь Ожегова
фармакопея — сущ., кол во синонимов: 3 • диспенсатория (2) • сборник (61) • фармакопия (1) … Словарь синонимов
Фармакопея — книга, в которой описаны сырые лекарственные вещества,известные смеси и готовые препараты, которые должны находиться в запасахаптеки, или изготовляться в последней. Обыкновенно Ф. издаетсяправительственным учреждением и имеет значение… … Энциклопедия Брокгауза и Ефрона
фармакопея — Сборник обязательных национальных или региональных стандартов и положений, нормирующих качество лекарственных средств, с указанием способов изготовления, правил отпуска по рецептам врачей, высших доз, правил хранения и т.п.; может также содержать … Справочник технического переводчика
Государственная фармакопея
Государственная фармакопея РФ (ГФ) — важный для фармацевтической отрасли нормативный документ, который содержит положения и стандарты для производимых в РФ лекарственных субстанций и препаратов. Отрасль постоянно развивается, поэтому новые методы и препараты фиксируются в новых переизданиях документа.
Работу с государственной фармакопеей в третьей главе регламентирует Федеральный закон «Об обращении лекарственных средств» от 12.04.2010 N 61-ФЗ.
Понятие о государственной фармакопее Российской Федерации
Под государственной фармакопеей понимается собрание нормативных документов (фармакопейных статей и общих фармакопейных статей), регламентирующих требования к лекарственным препаратам, субстанциям, сырью, методам контроля, лекарственным формам и так далее.
Общая фармакопейная статья — документ, который состоит из списка требований и методов контроля качества для конкретной лекарственной формы или растительного сырья; описания возможных методов анализа лекарственного средства для использования в медицинских целях; требований к индикаторам, растворам и реактивам, которые применяются для проведения анализа.
Фармакопейная статья — документ, который содержит список требований и методов контроля качества лекарственного средства для его использования в медицинских целях.
Статья может содержать информацию про оригинальные лекарственные средства. Ее разработка во время срока действия защиты исключительного права, которое подтверждено патентом, проводится при получении согласия владельца исключительных прав на это средство.
За издание фармакопеи отвечает уполномоченный федеральный орган исполнительной власти. Закон предусматривает ее переиздание не реже одного раза каждые 5 лет. В промежутке между переизданиями создаются дополнительные приложения, которые содержат общие фармакопейные статьи и/или фармакопейные статьи, получившие утверждение после переиздания последней версии.
Данные о документе, его содержании и приложениях находятся на официальном сайте в Интернете и доступны для всех.
Для чего нужна фармакопея? Значение для фармацевтической отрасли
Основная задача государственной фармакопеи заключается в обеспечении качества и соответствия отечественным и мировым стандартам лекарственных средств, которые представлены на российском фармацевтическом рынке. В статье приводится перечень свойств, показателей качества, а также методов контроля качества для конкретного вещества.
Регламент ГФ обязателен для всех организаций Российской Федерации, которые заняты в сфере обращения лекарственных средств.
История создания и развития
В 1756 году на латинском языке была выпущена самая первая российская государственная фармакопея. Целью ее создания было повышение эффективности работы военных госпиталей. Для гражданских нужд документ был издан только в 1778 году — Pharmacopoea Rossica. Она тоже была составлена на латинском языке.
На русском языке фармакопею издали в 1802 году. При этом официальное русскоязычное издание было выпущено только спустя 64 года, став своего рода стандартом для всех последующих версий.
Сегодня используется XIV издание государственной фармакопеи, которое было опубликовано 7 ноября 2018 года. Оно содержит 661 фармакопейную статью и 319 общих фармакопейных статей.
Зарубежная практика
Национальные фармакопеи есть во многих государствах, являясь обязательным стандартом, утверждённым законодательно. К самым авторитетным зарубежным источникам относится United States Pharmacopoea (Америка, выпускается с 1820 года), British Pharmacopoea (Великобритания, выпускается с 1864 года), Японская фармакопея (выпускается с 1886 года).
European Pharmacopoea (европейская фармакопея) состоит из норм, которые действуют в большинстве стран Европы. Она утверждается от имени Совета Европы. Отдельно стоит Фармакопея Евразийского экономического союза, которая утверждена Евразийской экономической комиссией в 2020 году. Свое действие она начала 1 марта 2021 года. ВОЗ выпускает собственную Международную Фармакопею. Однако важно понимать, что она носит только рекомендательный характер и не закреплена законодательно.
Если страна не имеет своей фармакопеи, она может пользоваться европейскими, международными или другими документами.
Фармакопея что это такое в медицине
В статье приведен краткий анализ зарубежных и отечественных стандартов качества лекарственных средств. Отдельные положения данной публикации могут быть хорошо известны и присутствуют в других статьях, но из песни слов не выкинешь, и этот материал, возможно, окажется полезным студентам фармацевтических и медицинских вузов, а также специалистам в области эффективности и безопасности лекарственных средств (ЛС), которые хотели бы знать, как стандартизуются ЛС и контролируется их качество.
Выделить термин «качество лекарственного средства»
К любому ЛС предъявляются три требования: эффективность, безопасность, качество. Такой подход к оценке ЛС в настоящее время принят во всем мире [8], в т.ч. и в нашей стране. Требования «эффективность» и «безопасность» относятся к медико-биологическим вопросам. Категория «качество» является чисто фармацевтической проблемой. Это необходимо понимать и не смешивать данные понятия. В частности, неверно говорить, что если ЛС обладает высокой эффективностью и обладает при этом минимальными побочными эффектами, то, следовательно, это качественное ЛС.
Конечно, надо понимать, что требования эффективности, безопасности и качества должны выполняться одновременно. Это как трехмерное изображение. Как говорил Платон, целое (в нашем случае это ЛС) есть нечто большее, чем простая сумма его частей. То есть качество косвенно влияет на эффективность и безопасность. Но в данной статье мы рассмотрим лекарственное средство только в измерении «качество».
Определить качество ЛС
Можно выделить два подхода к пониманию того, что мы называем качеством ЛС. Сразу отметим, что оба они являются правильными, и их применение отражает практический аспект – занимаемся мы стандартизацией ЛС или контролем их качества.
Первое определение, которое стоит дать: качество ЛС – это его соответствие предполагаемому использованию [7,9]. Такой подход является основой определения требований к показателям качества ЛС во всем мире. На практике это значит, что в нормативную документацию (НД) вносятся такие показатели, нормы и методы их контроля, которые зависят от того, как ЛС будет применяться. Показатели качества зависят от способа синтеза, дозировки, способа введения, лекарственной формы и т.д. Данный подход является важным и основным для специалистов, разрабатывающих НД, в которой описаны методики контроля качества ЛС. То есть это определение отражает работу по стандартизации лекарственного средства.
Другое определение качества, которое присутствует в отечественных документах, в первую очередь в Федеральном законе «Об обращении лекарственных средств» [4], кратко можно представить следующим образом: качество ЛС – это его соответствие требованиям нормативной документации. Действительно, когда НД уже разработана и утверждена и ею пользуются при контроле качества, то специалисту, проводящему этот контроль, важно именно соответствие объекта исследования требованиям в НД.
Выделить показатели качества
Стандартизация и контроль качества ЛС проводятся по трем основным направлениям:
— установление подлинности (идентификация, в зарубежной литературе по анализу ЛС – Identification);
— анализ чистоты;
— количественное определение (в зарубежной литературе по анализу ЛС – Assay).
Показатели качества ЛС вместе с методиками анализа по каждому показателю излагаются в специальной нормативной документации.
Если эта документация является государственным стандартом качества ЛС, она называется фармакопейной статьей (ФС). Установление подлинности, анализ чистоты и количественное определение составляют в данном случае суть того, что называют «фармакопейный анализ». ФС входят, в свою очередь, в сборник стандартов качества лекарственных средств, называемый «фармакопея» и публикуемый на уровне одного или нескольких государств. Требования, изложенные в фармакопее, обязательны для всех организаций, стандартизующих, изготавливающих и контролирующих лекарства на соответствующей территории.
Любая фармакопея состоит минимум из 2 основных разделов. Один из них содержит фармакопейные статьи (ФС), другой – общие фармакопейные статьи (ОФС).
ФС – стандарт качества конкретного ЛС. Это может быть как субстанция (лекарственное вещество), так и препарат (дозированное ЛС, готовое к применению). ФС, собственно, и является той НД, в которой изложены методики установления подлинности, анализа чистоты и количественного определения (какую взять навеску, в чем растворить, при какой длине волны измерить оптическую плотность, каковы допустимые пределы измеренного или рассчитанного показателя и т.д.).
ОФС содержат информацию общего характера. В них излагаются часто встречающиеся методики (чтобы каждый раз не писать их в ФС), описываются общие методы анализа – химические, физические, физико-химические (опять же, чтобы каждый раз не описывать в ФС, например, способы измерения оптической плотности растворов или принципы хроматографии), описываются общие требования к лекарственным формам и др.
Почему не по ГОСТам?
Федеральный закон от 12 апреля 2010 г. №61-ФЗ «Об обращении лекарственных средств» (с изменениями и дополнениями) – это основной документ, определяющий деятельность, связанную с оборотом лекарств на территории РФ. Мы не будем подробно останавливаться на положениях данного закона. Отметим только, что этот закон (и это очень важно) отделяет ЛС от продукции, стандартизуемой, выпускаемой и контролируемой по ГОСТам и другим нормативным документам. Такое разделение было всегда и в нашей стране, и во всех странах. Основой стандартизации и контроля качества ЛС является фармакопея.
Вышеуказанное выделение ЛС в особый вид продукции связано именно с тем, что качество ЛС зависит от предполагаемого использования, находится в тесной взаимосвязи с эффективностью и безопасностью ЛС, с путями его введения, дозировкой, лекарственной формой, патологией, при которой оно применяется. Вот поэтому документация, регламентирующая качество ЛС, является такой специфической и с самого начала становления фармакопейного анализа во всем мире потребовала своего выделения в самостоятельный вид нормативных документов.
Стандарты предприятий
Вместе с государственными ФС существуют также стандарты предприятий. И контроль качества ЛС в России (и за рубежом) в основном проводится не по ФС, включенным в фармакопею, а именно по стандартам предприятий.
В нашей стране к таковым относятся фармакопейные статьи предприятий (ФСП) для отечественных ЛС и нормативные документы (НД) для зарубежных. За исключением титульных листов и деталей оформления, ФСП и НД во многом схожи. Эти документы утверждаются в РФ в процессе процедуры государственной регистрации субстанции или препарата конкретного производителя.
Отметим небольшую терминологическую неразбериху с понятием «нормативная документация». Дело в том, что в зависимости от того, о чем идет речь, этот термин может обозначать как вообще всю документацию, регламентирующую качество ЛС (ФС, ОФС, ФСП, НД), так и конкретно НД на зарубежные ЛС. Так что важен контекст.
Фармакопеи vs стандарты предприятий
Как сосуществуют 2 стандарта качества – фармакопея и стандарт предприятия? На что следует ориентироваться при проведении контроля качества – на требования Государственной фармакопеи или соответствующей ФСП/НД?
Модель сосуществования государственного стандарта качества ЛС и стандарта предприятия не нова. Она реализуется за рубежом и в некотором похожем виде была у нас еще до введения системы ФСП/НД.
Первый вопрос: зачем нужна государственная фармакопея? Зачем в США, в Европе, в Японии разрабатывают, постоянно актуализируют фармакопеи? Ведь это требует финансирования, которое при наличии стандартов производителей может показаться холостым.
Ответ на этот вопрос очевиден. Региональные рынки насыщены воспроизведенными ЛС. Наличие большого количества дженериков требует введения единых стандартов качества – государственных ФС. Роль, которую играет ФС, это:
— унификация требований;
— обозначение минимального уровня требований.
То есть государство обозначает минимальные требования к качеству ЛС: можно сделать лучше, но хуже этого стандарта – запрещено. Требования, изложенные в ФС, устанавливаются таким образом, что их несоблюдение (несоответствие числовым нормам или сокращение количества показателей качества) оказывает негативное влияние на качество ЛС и (опосредованно) на его эффективность и безопасность.
А зачем же тогда нужны стандарты предприятий?
Во-первых, стандарт предприятия разрабатывается, когда создается вообще новое ЛС (новая молекула) и, соответственно, государственная ФС еще не существует. А когда ФС имеется, требования стандарта предприятия к качеству ЛС могут находиться на двух уровнях.
Первый (минимальный) уровень. Стандарт предприятия должен содержать не меньшее количество показателей, чем соответствующая ФС (минимальный уровень качества дженерика). Для продажи средства на территории РФ этого достаточно, только ввиду отсутствия полноценной Государственной фармакопеи регуляторы вынуждены ориентироваться на ФС из ведущих зарубежных фармакопей.
Следования такому минимальному уровню, в общем, было бы достаточно. Но проблема для России оказалась в том, что это сформировало армию ФСП/НД-клонов и, соответственно, дженериков-клонов. Было бы это неплохо, если бы этих клонов было немного и качество, эффективность и безопасность этих препаратов были эквивалентны. Ведь это именно та идея воспроизведенных ЛС, которую активно продвигает ВОЗ – доступные (и, естественно, качественные, эффективные и безопасные) дженерики. Тогда цена ЛС действительно могла бы являться основным критерием при проведении госзакупок для системы ОНЛС, при введении ограничительных мер на цены в рознице. Могла бы. Но на самом деле не может. Любой практикующий врач скажет, что имеющиеся на рынке РФ дженерики в своем большинстве неэквивалентны по эффективности. А специалисты, занятые в контроле качества, скажут (может быть, неофициально) о неэквивалентности качества, о снижении качества ниже установленных минимальных (!) фармакопейных норм.
Дженерики – это вообще отдельная тема для разговора. В ней много нюансов, тонкостей и откровенной политики, с которой можно было бы поспорить. Но факт остается фактом – следование более высоким, а не минимальным стандартам качества повышает ответственность производителя и способствует формированию цивилизованного рынка лекарств. Это и есть второй уровень.
Второй уровень. Стандарт предприятия может (и если честно, должен) содержать большее количество показателей, чем соответствующая ФС. Когда производитель идет по инновационному пути развития, когда он стремится сделать более качественную субстанцию или создать брэндированный дженерик, когда он сотрудничает с регуляторами в разработке национальных фармакопейных стандартов качества, он старается соответствовать именно этому уровню.
Следует отметить, что стандарт предприятия – это документ, являющийся собственностью предприятия, изготавливающего ЛС, и носящий конфиденциальный характер. Ведь в нем изложены конкурентные преимущества препарата. Но у нас конфиденциальность, к сожалению, реализуется по сходной цене на цифровых носителях. И это еще одна из причин, по которой немногие производители хотят вкладываться в этот второй уровень качества.
Еще раз о более высоком качестве
Часто основным критерием более высокого качества ЛС ошибочно пытаются обозначить их чистоту или пытаются сузить нормы по какому-либо показателю. В свое время академик А.П.Арзамасцев всегда говорил, что следование таким правилам не приводит к получению более качественного ЛС, и дело не в сужении установленных в ФС норм, если это не обосновано требованиями к эффективности и безопасности.
В частности, в Фармакопее США указано прямо: «Существование фармакопейных пределов или допустимых отклонений не служит основанием для утверждения, что субстанция, более близко приближающаяся по чистоте к 100%, «превышает» фармакопейное качество. Также тот факт, что средство было изготовлено с учетом более узкого интервала допустимых отклонений, чем указанные в фармакопейной статье, не повод утверждать, что препарат «превышает» фармакопейные требования».
Другими словами, нормы, заложенные в ФС по представленным в ней разделам (показателям), являются необходимыми и достаточными. И о повышении уровня качества можно говорить, если в документацию производителя вводятся другие, дополнительные показатели. Эти показатели будут определять конкурентное преимущество субстанции или препарата. То есть если производитель докажет, что контроль полиморфизма производимой им субстанции позволяет получать лекарственное вещество с показателями стабильности и растворимости, которые положительно влияют на эффективность производимого из этой субстанции препарата, то эту субстанцию можно рассматривать как более качественный продукт по сравнению с другими субстанциями, для которых полиморфизм не контролируется. И в стандарте предприятия на такую субстанцию будет присутствовать дополнительный раздел, посвященный анализу полиморфных модификаций с использованием, например, метода дифференциальной сканирующей калориметрии.
Что же касается чистоты, то это вообще больная тема. Следует отметить, что на практике были попытки сделать фармацевтические субстанции с чистотой 99,9…%. Но при коммерческом распространении таких субстанций в рамках общепринятых стандартов хранения лекарственных веществ и препаратов эти попытки терпели неудачу. Законы химического равновесия, термодинамики и кинетики вмешивались в грандиозные планы (землетрясение встало на пути Остапа). Говоря по-простому, чем меньше в субстанции содержится примесей, образующихся при хранении, тем скорее эти примеси будут накапливаться. В итоге до потребителя доходит субстанция с тем же содержанием примесей (и даже больше!), каким бы оно было без предварительной суперочистки.
Надо понимать, что требования к чистоте определяются в рамках все той же общей теории фармакопейной целесообразности – качество зависит от применения. Если примесь не влияет на эффективность и безопасность – одни требования к ее содержанию, если влияет – другие.
Основные зарубежные фармакопеи
Международная фармакопея (Ph. Int.) [10,11]
Информацию можно найти на сайте www.who.int/medicines/publications/pharmacopoeia. Издается ВОЗ с 1950 г. В настоящее время действует 4-е издание, вышедшее в 2006 г. В 2008 г. было выпущено одно дополнение к 4-му изданию.
Основная цель Международной фармакопеи – поддержание качества ЛС в развивающихся странах. То есть, если в каком-то государстве нет ресурсов для разработки собственной фармакопеи, тогда это государство может принять Международную фармакопею в качестве национальной.
Влияние Международной фармакопеи в нашей стране в настоящее время минимально. На ее стандарты специалисты мало обращают внимания и редко ссылаются в научных публикациях. Стоит отметить, что предыдущее (3-е) издание Международной фармакопеи вышло в нашей стране (еще в СССР) на русском языке. Большую роль в профессиональном переводе и выпуске русскоязычного издания сыграл академик А.П.Арзамасцев.
Европейская фармакопея (Ph. Eur.) [6]
Информацию можно найти на сайте Европейского директората по контролю лекарственных средств и здравоохранению (EDQM): http://www.edqm.eu/. Издается с 1964 г. Сейчас очередное издание выходит каждые 3 года. Обновления – каждые несколько месяцев. C 1 января 2011 г. вступило в силу 7-е издание, однако реально оно было опубликовано раньше, и с его требованиями можно было ознакомиться как в печатном виде, так и по интернету (при наличии оплаченного доступа).
Европейская фармакопея имеет классическую структуру: содержит ОФС и ФС. Но ее особенностью является то, что она не содержит ФС на препараты. В ней имеются ФС только на субстанции.
До настоящего времени отечественные регуляторы принимали стандарты Европейской фармакопеи в качестве основного ориентира, что нашло свое отражение в ГФ XII, а также в ФСП на отечественные препараты. Явно или косвенно принята на вооружение Европейская фармакопея и в ряде стран бывшего СССР.
Фармакопея США – Национальный формуляр (USP – NF) [13]
Информацию можно найти на сайте: www.usp.org. Первое издание USP вышло в 1820 г. Действующее издание: USP 33 – NF 28 Reissue (переиздание 2010 г.). С 1 мая 2011 г. вступает в силу USP 34 – NF 29, которое уже опубликовано в ноябре 2010 г. Сейчас очередное издание выходит каждый год, обновления – ежеквартально. Это наиболее динамично развивающийся фармакопейный стандарт.
Данный документ, как следует из его названия, на самом деле является сборником, включающим два разных стандарта: фармакопею и национальный формуляр. Последний определяет требования к ряду вспомогательных веществ и к другим веществам, не являющимся лекарственными. То есть Национальный формуляр США не является формулярным (ограничительным) списком ЛС, как можно было бы предположить из названия.
Фармакопея США – Национальный формуляр выпускается единственной в мире негосударственной фармакопейной организацией – Фармакопейной конвенцией США. Однако требования этого стандарта признаются на государственном уровне и определяют минимальный уровень качества, обязательный для организаций, производящих или поставляющих ЛС в США. Не будет преувеличением сказать, что Фармакопейная конвенция США является одной из самых влиятельных фармакопейных организаций в мире. Ее стандарты качества действуют не только в США и Канаде, но и принимаются на вооружение в ряде других стран, активно производящих ЛС (Индия, Китай).
Фармакопейная конвенция США является некоммерческой организацией (not for profit organization), однако ее финансовые возможности и влияние во всем мире (в т.ч. и в Европе) очень велики. Конвенция публикует ряд периодических изданий, посвященных стандартам качества ЛС, разрабатывает и продает по всему миру богатейшую коллекцию фармакопейных химических стандартных образцов, качество которых признается практически во всех странах, проводит фармакопейные образовательные курсы в США и за рубежом, предоставляет услуги по проверке пищевых добавок, ингредиентов биологически активных добавок, вспомогательных веществ. Это позволяет содержать штат, насчитывающий около 600 сотрудников, а также привлекать к своей деятельности специалистов-волонтеров не только из США, но и из других стран. Это позволяет развивать USP в полном соответствии со всеми самыми современными направлениями в области фармации. В 2010 г. Фармакопейная конвенция США предоставила Украине и Казахстану право на использование своих материалов в Фармакопеях этих стран.
Принимая во внимание процесс гармонизации фармакопейных требований, большое значение имеет выход в 2009 г. русскоязычного издания Фармакопеи США [3]. Большую роль в инициировании и проведении работы над переводом USP сыграли усилия, предпринятые академиком А.П.Арзамасцевым.
Переводное издание USP не имеет законодательного значения в РФ, однако значительное число воспроизведенных ЛС анализируется по методикам, описанным, в частности, в USP. И производители дженериков часто ориентируются на этот документ при разработке ФСП или НД. В мае 2011 г. планируется выход дополнения к ранее переведенному изданию на русском языке. Обсуждается дальнейший перевод новых изданий USP-NF.
Японская фармакопея (JP) [12]
Еще один (вместе с Европой и США) промышленно развитый регион. Соответственно – еще одна ведущая зарубежная фармакопея. Очередное издание выходит каждые 5 лет. Действующее издание – JP 15 – вышло в 2006 г., а в 2007 г. было выпущено 1-е дополнение. В нашей стране JP никогда не была особо популярна в качестве источника информации, хотя публикуется она не только на японском, но и на английском языке.
Британская фармакопея (BP) [5]
Информацию можно найти на сайте: www.pharmacopoeia.gov.uk. Не сказать о BP нельзя. Она всегда пользовалась большой популярностью у наших специалистов. Издается BP с 1864 г. Текущее издание: BP 2011. Сейчас очередное издание выходит каждый год.
Действует BP на территории Соединенного Королевства вместе с Европейской фармакопеей. ФС на субстанции в BP практически полностью повторяют соответствующие ФС из Европейской фармакопеи. ОФС по большей части также дублируют Европейскую фармакопею, хотя есть и свои собственные испытания. ФС на готовую продукцию (препараты) в BP свои собственные, поскольку, как мы уже указывали, в Европейской фармакопее соответствующие статьи отсутствуют. Если в BP какой-либо текст целиком или частично дублирует Европейскую фармакопею, это соответствующим образом помечено в BP.
В нашей стране интерес к BP, видимо, связан с тем, что она описывает требования к дозированным лекарственным формам. Эти требования часто принимают в качестве основного ориентира при рассмотрении зарубежной НД и при разработке отечественных ФСП.
Гармонизация фармакопейных требований
Мир становится все более интегральным. Субстанция, произведенная в Китае, поставляется в США для изготовления лекарственного препарата, который в свою очередь экспортируется в Европу. Поэтому для обеспечения качества, эффективности и безопасности ЛС необходимо следовать единым стандартам. Ну а производителю, естественно, важно, чтобы к нему везде применяли единые требования, что существенно снижает расходы на продвижение ЛС во всем мире.
Зачастую можно увидеть, что в Европейской фармакопее и Фармакопее США для какого-либо ЛС описаны одинаковые показатели качества, одинаковые методики анализа по этим показателям и одинаковые числовые нормы. Это отражает деятельность фармакопейных дискуссионных групп (PDG), работающих в системе ICH – Международной конференции по гармонизации требований к регистрации лекарственных средств, используемых в медицине. В работе ICH непосредственное участие принимают Всемирная организация здравоохранения и три ведущие фармакопеи – Фармакопея США, Европейская фармакопея и Японская фармакопея. Цель ICH – разработка единых требований к стандартизации, контролю качества, эффективности, безопасности, производству и регистрации лекарств. Подробную информацию и соответствующую документацию можно найти на сайте www.ich.org.
Национальная фармакопея России: зачем же нам все-таки ГФ?
В 2007 г. была утверждена и в 2008 г. вышла в свет первая часть ГФ РФ XII издания [1], которая включает в себя некоторые ОФС и некоторые ФС на субстанции. Вторая часть ГФ XII практически сверстана и готовится к публикации. Как обычно, в интернете ее уже давно предлагают к скачиванию: «студентам – пять копеек, не членам профсоюза – тридцать копеек».
Поскольку ГФ XII издана пока еще не полностью, реально по ряду показателей действует ГФ XI [2], а также утвержденные отдельно ОФС и ФС. А, может быть, у нас все еще действует ГФ X 1968 г.? Кстати, именно ГФ X до сих пор является замечательным учебным пособием по химическим методам анализа ЛС. Хотя надо понимать, что с позиций современного инструментального фармакопейного анализа это пособие уже устарело.
На последней Всероссийской конференции молодых исследователей, проходившей в Первом МГМУ им. И.М.Сеченова в январе 2011 г., после лекции по фармакопейным стандартам качества мне стали задавать довольно сложные вопросы о нынешнем состоянии российской фармакопеи. Говоря о ГФ XII, я старался быть политкорректным. Все-таки этого ребенка ждали 17 лет. Но вопросы присутствовавших специалистов были жесткими и сводились к одному: может ли ГФ XII в ее нынешнем варианте служить государственным стандартом качества ЛС?
Да, последней нашей полноценной фармакопеей была ГФ X. А потом наша страна окунулась в перманентный кризис, нарушивший планы по разработке и выпуску ГФ XI, и продолжающий ухудшать ситуацию с ГФ XII. Выход только одного издания ГФ XII растягивается на несколько лет. Это очень много и неприемлемо, т.к. современные зарубежные фармакопеи обновляются по нескольку раз в год. И это естественно. Государственная или региональная фармакопея сейчас – это не застывший на много лет стандарт, который вынуждены изучать правнуки. Изменения на фармацевтическом рынке происходят стремительно, и период переиздания стандартов качества отражает скорость реагирования на эти изменения. В адрес ГФ XII раздается много критики, с которой нельзя не согласиться. Но тем не менее выход такого документа, безусловно, очень важен для страны.
Часто предлагается вместо разработки своей собственной ГФ взять практически полностью на вооружение Европейскую фармакопею. Однако такое решение следует хорошо обдумать. Ведь дело не только в тексте ФС на отдельные ЛС и в описании общих методов анализа в ОФС. Фармакопея – это сложный документ, учитывающий специфику всего и вся.
Проблема может крыться в чем угодно. Это качество реактивов: «у них» все рассчитано на соответствующие каталоги, «у нас» можно сэкономить и купить у бедного НИИ, подрабатывающего изготовлением реагентов. «У них» – каталог фармакопейных стандартных образцов, «у нас» покупают эти стандарты, где получится. А еще оборудование, сорбенты, колонки… А еще свои подходы к поверке оборудования. И так далее. Каждый фактор по отдельности может не сыграть существенной роли. Но по совокупности возникает аддитивная ошибка, и валидированная методика из чужой фармакопеи отказывается работать.
Поэтому, кстати, часто и перенос методик из зарубежных стандартов предприятий в наши НД (хорошо, если при этом перевод на русский язык адекватный) часто заканчивается неудачей. И методику долго и уныло совместными усилиями специалистов НЦ ЭСМП и регистраторов начинают оптимизировать и подгонять. А потом, при проведении контроля качества в другой аккредитованной лаборатории, эта методика опять не работает.
Вот поэтому наши специалисты старой закалки так высоко ценят ГФ X. В 1968 г. никто и не слышал ни о какой валидации методик. Но каждая буква и цифра в этой фармакопее были именно отвалидированы, проверены неоднократно на практике в разных лабораториях. Поэтому они работают.
Вот в этом смысл разработки своего стандарта или, по крайней мере, разумной, продуманной адаптации чужого. И именно поэтому в разработке любой зарубежной фармакопеи принимают участие сотни, тысячи специалистов.
Также необходимо отметить, что чем больше на рынке дженериков, тем сильнее потребность в общем знаменателе качества – в фармакопее. И что ведь интересно: там, где национальная фармакопея более всего необходима, – в России – она до сих пор отсутствует в виде единого полноценного издания. В частности, поэтому хаос, неопределенность на рынке, выливающиеся во всеобщее раздражение и в попытки урегулировать все проблемы, акцентируя внимание на ценах на ЛС. Мы путаем причину и следствие. Рынок надо обеспечивать не лозунгами об импортозамещении, а эффективными, безопасными и качественными ЛС. И цена будет следствием. Ее нельзя назначить росчерком пера. Она зависит от вышеуказанных параметров лекарства, и доступность ЛС для пациента определяется не столько его стоимостью, сколько эффективностью работы государственного страхования.
Можете бросить в меня камень, но первоочередное применение ценовых мер низводит разработчиков ЛС до уровня обыкновенных фальсификаторов, которые могут снизить цену на поддельное ЛС, потому что не вкладываются в инновации, в рекламу, в продвижение и качество. Впрочем, это уже тема другого разговора.
1. Государственная фармакопея РФ XII., ч. 1. – М.: Изд. НЦ ЭСМП, 2008.
2. Государственная фармакопея СССР XI: Выпуски 1, 2: репринтное издание. – М.: Тимотек, 1998.
3. Фармакопея США: USP 29; Национальный формуляр: NF 24: в 2 т.: [пер. с англ.]. – М.: ГЭОТАР-Медиа, 2009.
4. Федеральный закон «Об обращении лекарственных средств» от 12 апреля 2010 г. № 61-ФЗ (с изменениями и дополнениями).
5. British Pharmacopoeia 2011.
6. European Pharmacopoeia, 7th ed.
7. ICH Harmonised Tripartite Guideline: Specifications: Test Procedures and Acceptance Criteria for New Drug Substances and New Drug Products: Chemical Substances. Q6A. – Geneva: ICH, 1999.
8. Joint Statement between The International Pharmaceutical Federation (FIP) and the International Federation of Pharmaceutical Manufacturers Associations (IFPMA): Ensuring Quality and Safety of Medicinal Products to Protect the Patient. – Geneva: FIP, IFPMA, 2002.
9. Supplementary Guidelines on Good Manufacturing Practices: Validation. – WHO Technical Report Series, No. 937, 2006.
10. The International Pharmacopoeia. 4th ed. – Geneva: WHO, 2006.
11. The International Pharmacopoeia. 4th ed., 1st suppl. – Geneva: WHO, 2008.
12. The Japanese Pharmacopoeia, 15th edition, 2006 г.
13. The United States Pharmacopeia 33 – National Formulary 28, Reissue 2010.
Автор: ДОРОФЕЕВ В.Л., проф. Первый Московский государственный медицинский университет им. И.М.Сеченова