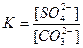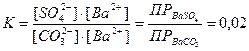Что значит растворение осадка
Образование и растворение осадков
Осадок малорастворимого электролита образуется только тогда, когда ионное произведение (ИП) превысит при данной температуре величину его произведения растворимости.
Если ИП ПР – р-р пересыщенный;
ИП 
Образование и растворение осадков находится в определенной зависимости от произведения растворимости. Чем меньше ПР для однотипных электролитов, тем быстрее и полнее образуется осадок.
Необходимо учитывать возможность образования пересыщенных растворов. Внесение затравки, потирание стенок сосуда стеклянной палочкой ускоряют выделение осадка.
Процесс растворения осадка противоположен процессу его образования. Для растворения осадка необходимо сместить равновесие в системе осадок Û насыщенный раствор. Этого можно достигнуть несколькими путями:
· добавление свежих порций растворителя, что делает раствор над осадком ненасыщенным и для восстановления равновесия часть осадка должна раствориться;
· выведение ионов из насыщенного раствора связыванием их в более прочные соединения. Это могут быть слабые электролиты, достаточно устойчивые комплексные ионы, осадки с меньшей растворимостью, чем исходный;
· переведение ионов осадка в соединения, разлагающиеся с выделением газа;
· изменение степени окисления ионов осадка, окисление или восстановление их в другие соединения, что также вызывает смещение равновесия в сторону растворения, т.к. ионы из раствора выводятся.
Растворение осадка разбавлением можно осуществлять двумя способами: одноразовым введением достаточного объема растворителя или последовательно добавлять и сливать с осадка свежие дробные порции растворителя. Второй способ дает больший эффект и обычно рекомендуется в аналитической практике. Но подходит он больше для растворения среднерастворимых соединений; так как при растворении малорастворимого электролита образуется большой объем очень разбавленного раствора, что затрудняет анализ. Таким способом промывают малорастворимые осадки от соосажденных примесей в качественном и, особенно, в количественном анализе.
Чем прочнее удается связать ионы в растворе над осадком, тем быстрее идет процесс растворения. Поэтому, чем меньше константа ионизации образующегося слабого электролита, чем меньше константа нестойкости комплексного иона и чем меньше растворимость образующегося соединения, тем легче и полнее протекает процесс растворения осадка. Проиллюстрировать приведенные способы можно следующими схемами уравнений реакций происходящих процессов: малорастворимые основания Mg(OH)2, Fe(OH)3, Al(OH)3, Mn(OH)2, Fe(OH)2, Cr(OH)3 и др. хорошо растворяются в растворах кислот, т.к. при этом ионы водорода связывают гидроксид-ионы в слабый электролит – Н2О:
Малорастворимые кислоты растворяются в растворах щелочей, процесс также идет за счет образования слабого электролита – Н2О:
Кислые соли некоторых слабых кислот растворяются не только в сильных кислотах, но и в щелочах:
Малорастворимые соли слабых кислот растворяются в сильных кислотах с образованием слабого электролита – кислоты:
Соли сильных кислот, нерастворимые в сильных кислотах, растворяются в соединениях, образующих с ионами осадка комплексные соли:
Такие соли сильных кислот, как BaSO4, CaSO4, PbSO4, SrSO4, нерастворимые в сильных кислотах и щелочах, переводят в другие малорастворимые соединения, которые, в свою очередь, растворяются в кислотах:
В этом случае, образующийся осадок AgCl затем растворяют в растворе аммиака (см. гл. VI, §5).
Сравнительно легко идет процесс растворения, если в результате реакции образующийся продукт выделяется в виде газа:
Исключение составляют малорастворимые соли слабых кислот с очень малой величиной произведения растворимости. Того ничтожно малого количества ионов, которое содержится в насыщенном растворе над осадком, недостаточно для образования слабой кислоты.
но нельзя таким образом осадить сульфиды ZnS, SnS, CdS, NiS, MnS из кислых растворов, т.к. эти соединения растворяются в кислотах.
Произведение растворимости и растворимость некоторых сульфидов
Для растворения малорастворимых сульфидов Ag, Hg, Pb, Bi, Cu, As, Sb применяют обычно окислители:
В качестве окислителя может использоваться азотная кислота:
Очень сильным окислителем является «царская водка». Рассмотрим далее детально процесс растворения сульфида ртути в «царской водке»:
3HgS↓ + 2HNO3 + 6HCl = 3HgCl2 + 3S↓ + 2NO↑ + 4H2O
Малорастворимые оксиды Al2O3, Cr2O3, Fe2O3 и др. сплавляют с гидросульфатом натрия NaHSO4, калия KHSO4 или с пиросульфатом калия K2S2O7 при t ≈ 700 o C. Остывший плав растворяют в горячей воде. Для ускорения процесса добавляют несколько капель соляной или серной кислоты.
Для растворения оксида кремния – SiO2 и силикатов, не разлагаемых кислотами, пользуются методом сплавления их с Na2CO3. Полученный плав растворяют в соляной или фтороводородной кислоте.
Растворение осадков
В ходе анализа необходимо не только получить осадок, осадив определяемый компонент в виде малорастворимого соединения, но и вновь растворить его. Для растворения осадков необходимо, чтобы произведение концентраций ПК осадка стало меньше произведения растворимости ПК
Но ведь OH-ионы можно также связывать путем введения в растворе ионов аммония, причем образунтся сравнительно мало диссоциированное соединение – гидроксид аммония:
Т.е. гидроксид магния растворяется в солях аммония. Однако NH4OH ионизирован гораздо сильнее, чем вода. Поэтому не происходит такого сильного понижения концентрации гидроксильных ионов в растворе, как при добавлении кислоты. Следовательно, растворяющее действие солей аммония значительно слабее действия кислот. В солях аммония растворяются только некоторые, наиболее растворимые основания. Наоборот, Mg(OH)2, Mn(OH)2. Fe(OH)3, Cr(OH)3, Al(OH)3 не растворяются в солях аммония и в уксусной кислоте, а растворяются в сильных минеральных кислотах. Т.е. чем меньше константа диссоциации образующегося электролита, тем легче протекает растворение осадка.
Малорастворимые кислые соли растворяются и в кислотах, и в щелочах. Например, калий обнаруживают в растворах реакцией с гидротартратом натрия. Происходит реакция и выпадает белый кристаллический осадок:
Осадок выпадает только в нейтральной или слабощелочной среде (рН 4 –7) при достаточно большой концентрации K + в растворе. И в щелочной, и в кислой среде осадок растворяется:
ZnS↓ + H + ó Zn 2+ + HS –
3. Протекание реакций комплексообразования.
В то же время менее растворимые галогениды серебра AgBr и AgI аммиак не растворяет.
Свежеосажденный фторид кальция не растворим в кислотах, но растворим в солях алюминия вследствие образования прочных фторидных комплексов:
Фторид кальция растворим также в ЭДТА вследствие образования комплексоната кальция:
CaF2↓ + H2Y 2 – ó [CaY] 2 – + 2H + + 2F –
4. Протекание реакций окисления-восстановления.
Сульфиды 4й группы не растворяются в соляной кислоте, но растворяются в кислоте-окислителе – азотной кислоте:
5. Комбинированное растворение.
Когда осадок не растворяется ни в одном из приведенных случаев, применяют комбинированное растворение, в котором сочетают несколько факторов, способствующих растворению – окисление-восстановление, образование малодиссоциирующих соединений и др.
Например, HgS не растворим в кислотах, но хорошо растворяется в смеси KI + HCl;
6. Превращение одних малорастворимых соединений в другие.
При осаждении сульфатов катионов 3й аналитической группы возникают трудности с растворением осадка, т.к. сульфат бария не растворим в кислотах. Для решения этой проблемы сульфаты бария, стронция и кальция вначале переводят в карбонаты обработкой насыщенным раствором карбоната натрия:
Карбонаты легко растворяются в кислотах. Константа равновесия этой реакции
Домножим и разделим это выражение на одну и ту же величину – равновесную концентрацию ионов бария
Из значения константы равновесия следует, что обработку карбонатом натрия следует проводить несколько раз при кипячении, удаляя каждый раз надосадочную жидкость. Это позволит сдвинуть равновесие реакции вправо.
1. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х книгах. – М.: Химия, 1990. – Кн.1.– С. 158-188.
2. Пономарев В.Д. Аналитическая химия. В 2-х частях. – М.: Высшая школа, 1982. – Ч.1. – С. 109-124.
3. Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн.1. – С. 84-101.
4. Основы аналитической химии. В 2-х книгах / Под ред. Ю.А.Золотова. – М.: Высш.шк., 2004. – Кн.1. – С. 188-204.
5. Васильев В.П. Аналитическая химия. В 2-х книгах. – М.: Дрофа, 2002. – Кн.1. – С. 252-274.
6. Алексеев В.Н. Курс качественного химического полумикроанализа. – М.:Химия, 1973. – С. 148-184.
Дата добавления: 2017-03-12 ; просмотров: 3878 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Условия растворения осадков
о садок растворяется, если гетерогенное равновесие смещается вправо, при этом насыщенный раствор переходит в ненасыщенный путем связывания одного из ионов труднорастворимого электролита в более прочные частицы:
· слабый электролит;
· менее растворимое вещество, ПР которого меньше;
· комплексный ион.
Кроме того, на растворение осадков влияет температура. С ростом температуры возрастает и величина ПР. Раствор оказывается ненасыщенным (при высокой температуре), т.е. выполняется неравенство ПР > ПК.
Пример 1. Объяснить с точки зрения теории ПР, почему гидроксид меди (I) растворяется при добавлении аммиака?
Ионы 

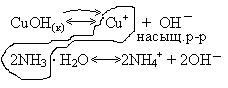 |
Схема поведения осадка:
Ионы 


Запишем уравнение реакции:
Ионы насыщенного раствора связываются в прочные комплексные соединения, гетерогенное равновесие смещается вправо. Осадок CuOH растворяется в аммиаке.
Пример 2. Будет ли гидроксид алюминия растворяться в минеральных кислотах и щелочах?
Амфотерные гидроксиды металлов, такие как 






Ионы 

Запишем уравнение реакции:

Ионы насыщенного раствора связываются в прочное комплексное соединение, гетерогенное равновесие смещается вправо. Осадок 

Схема поведения осадка:
Уравнение реакции: А1(ОН)3 + 3НС1 → А1С13 + 3Н2О.
Ионы насыщенного раствора связываются с образованием слабого электролита – воды, гетерогенное равновесие смещается вправо. Осадок А1(ОН)3 растворяется в соляной кислоте.
Пример 3. Объяснить причину растворения хлорида свинца (П) в растворе иодида калия.

PbJ2 – малорастворимое соединение. Осадок PbCl2 будет растворяться, если при этом образуется еще менее растворимый осадок, ПР которого меньше. Воспользуемся справочными данными (приложение таблица 5): 
ионы насыщенного раствора связываются с образованием малорастворимого соединения, ПР которого меньше, гетерогенное равновесие смещается вправо. Осадок PbCl2 переходит в осадок PbJ2.
Пример 4. Будет ли растворяться осадок оксалата кальция СаС2О4 а) в соляной НС1 и б) в уксусной СН3СООН кислотах?
а) Схема поведения осадка:
Ионы насыщенного раствора связываются в молекул слабого электролита щавелевой кислоты Н2С2О4, гетерогенное равновесие смещается вправо. осадок СаС2О4 растворяется в соляной кислоте.
б) Схема поведения осадка:
Осадок будет растворяться, если образуется более слабый электролит. Оценить силу электролита можно с помощью константы ионизации. Выпишем из приложения константы ионизации (таблица 3):
Уксусная кислота более слабая. Она не может вытеснить более сильную щавелевую кислоту из ее соли. Гетерогенное равновесие не нарушается, осадок СаС2О4 в уксусной кислоте не растворяется.
Растворимости. Условия образования и растворения осадков.



Растворение труднорастворимого электролита (ТРЭ) в количестве растворителя происходит до состояния насыщения.В насыщенном растворе электролит находится в динамическом равновесии с твердой фазой. Растворимость электролита определяет концентрацию ионов в насыщенном растворе электролита, значит его электропроводность. Чем меньше растворимость ТРЭ, тем он слабее.
При растворении электролита, например, соли, в раствор переходят не молекулы, а ионы. В этом случае в насыщенном растворе равновесие устанавливается между ионами соли в кристаллической фазе и ионами, перешедшими в раствор: СаСО3 кр ↔ Ca 2+ р-р + СО3 2- р-р.
Константа равновесия этого процесса:
Любой раствор может быть насыщенным, ненасыщенным и перенасыщенным.
Насыщенным называют раствор, в котором скорость реакции растворения равна скорости реакции осаждения.
Концентрация насыщенного раствора для данного вещества при данной температуре есть величина постоянная, следовательно, в насыщенном растворе концентрации ионов данного электролита являются константами.
Перенасыщенными называют растворы, которые содержат осадок.
Насыщенные растворы трудно растворимых электролитов характеризуется величиной, называемой произведением растворимости.
Добавление в раствор одноимённых ионов труднорастворимого электролита способствует выпадению в осадок иона противоположного знака
[Pb 2+ ] 
Условием образования осадка является превышение произведения концентраций ионов (ПК) малорастворимого электролита над его произведением растворимости, т.е.ПК > ПР.
Что значит растворение осадка
5.1.3. Растворимость осадков в кислотах
На растворимость осадков, являющихся солями слабых кислот, присутствие ионов водорода в растворе оказывает существенное влияние. При расчетах растворимости осадков в кислотах следует иметь в виду, что большинство слабых кислот являются многоосновными.
CaCO 3 
Этому равновесию соответствует константа диссоциации 
Этому равновесию соответствует константа диссоциации 
Таким образом, растворение карбоната кальция под действием сильной кислоты можно представить уравнениями
Растворимость соли складывается из равновесных концентраций всех форм карбоната:
Выразим концентрацию угольной кислоты и продуктов ее ступенчатой диссоциации с помощью констант диссоциации кислоты и произведения растворимости карбоната кальция:
Выражение под знаком квадратного корня является условным произведением растворимости ПР у (СаСО3). Величина в скобках обозначается буквой α. Для карбонат- иона она имеет вид:
α

Таким образом, растворимость карбоната кальция в присутствии сильной кислоты будет выше, чем в воде.