Что значит персистирующее течение болезни
Лечение персистирующего аллергического ринита
Динер Наталья Евгеньевна
Все врачи
Персистирующий аллергический ринит – это непрерывно протекающий процесс, он не зависит от сезона года и температуры вдыхаемого воздуха.
Заболевание встречается у 10-20% населения планеты, в основном им болеют люди молодого возраста. Наиболее неблагоприятное течение персистирующего ринита отмечается у девочек, для которых характерно раннее развитие осложнений в виде атопической бронхиальной астмы. Как правило, процесс проявляет себя в возрасте до 1 года. Помимо развития бронхиальной астмы персистирующий ринит может осложняться развитием назального полипоза, риносинусита и эпизодам апноэ во сне.
Наша цель состоит в том, чтобы найти провоцирующую заболевание причину и подобрать пациенту базисную терапию, которая обеспечит ему хорошее самочувствие и комфортное качество жизни.
Пациентов беспокоят приступы чихания, зуд в носу, горле, слезотечение, обильные слизистые выделения из носа, затруднение носового дыхания, нарушение обоняния, нарушение сна, повышенная раздражительность, снижение работоспособности. Хроническая заложенность носа нередко приводит к развитию воспалительного процесса в околоносовых пазухах, в этом случае пациенты жалуются на головные боли и длительную субфебрильную температуру, а также воспаления на слизистой оболочке евстахиевой трубы, что способствует развитию воспаления среднего уха и снижению слуха. Постоянное стекание выделений на заднюю стенку глотки вызывает раздражение слизистой оболочки дыхательных путей и появление сухого кашля.
Диагноз ставится на основании характерных клинико-анамнестических данных, полученных в ходе опроса и осмотра пациента аллергологом и оториноларингологом, который проводит дифференциальную диагностику с неаллергическими ринитами (инфекционным, вазомоторным, круглогодичным неаллергическим). Врачи Ильинской больницы применяют только достоверные и эффективные методы диагностики, признанные в Европе и США и прошедшие проверку с помощью специальных контролируемых клинических исследований в развитых странах мира. В распоряжении наших специалистов имеются все виды лабораторной и инструментальной диагностики. Пациенту назначаются лабораторные (общеклинический анализ крови, анализ секрета из полости носа) и инструментальные исследования (компьютерная томография околоносовых пазух, эндоскопическое исследование полости носа), проводится обязательное аллергологическое обследование – определение в сыворотке крови специфических иммуноглобулинов Е (IgE), которые вырабатываются на конкретные аллергены (бытовые, грибковые, профессиональные). Аллерголог оценивает результаты исследований и делает заключение с формированием индивидуальных рекомендаций по лечению.
При круглогодичном аллергическом рините необходимы как медикаментозное лечение, так и мероприятия, направленные на устранение контакта с провоцирующими аллергенами. В качестве медикаментозной терапии врач может назначить применение антигистаминных средств, кромонов, интраназальных глюкокортикостероидов, деконгестантов. В числе профилактических мер пациенту будет рекомендовано избавиться от ковровых покрытий, использовать очистители воздуха и пылесосы, оснащенные микрофильтрами, поддерживать рекомендованный уровень влажности в жилом помещении. В случае выявления причинно-значимого аллергена, возможно проведение аллерген-специфической иммунотерапии (АСИТ).
Аллерген-специфическая иммунотерапия является патогенетическим методом лечения персистирующего аллергического ринита, и обладает профилактическим эффектом после завершения лечебных курсов. Цель АСИТ – это выработка специфических иммуноглобулинов класса G (IgG), блокирующих специфические иммуноглобулины класса Е (IgE), которые вырабатываются в результате воздействия аллергена и обусловливают механизм развития аллергического воспаления. Метод позволяет добиться длительной ремиссии заболевания, и сохраняет трудоспособность пациента. Перед проведением АСИТ необходимо получить подтверждение роли конкретных аллергенов в развитии заболевания. Врач выбирает способ введения аллергена следуя строго отработанным протоколам для проведения специфической иммунотерапии. Приоритет отдается препаратам с оральным путем введения (в виде капель или таблеток). Проведение АСИТ возможно начиная с 5 летнего возраста. Узнать больше.
Фибрилляция предсердий: причины, симптомы, лечение
Фибрилляция предсердий (ФП) – синоним более применимого в странах СНГ термина «Мерцательная аритмия».
Фибрилляция предсердий является наиболее распространенным нарушением сердечного ритма. ФП не связана с высоким риском внезапной смерти, поэтому ее не относят к фатальным нарушениям ритма, как, например, желудочковые аритмии.
Фибрилляция предсердий
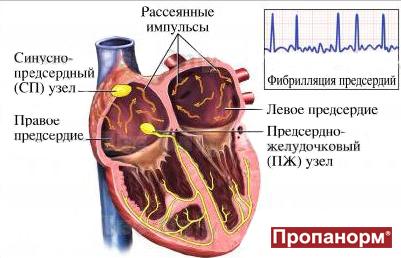
Один из самых распространенных видов наджелудочковых тахиаритмий – фибрилляция предсердий (ФП). Фибрилляцией называют быстрое нерегулярное сокращение предсердий, при этом частота их сокращений превышает 350 в минуту. Появление ФП характеризуется нерегулярным сокращением желудочков. На долю ФП приходится более 80 % всех пароксизмальных суправентрикулярных тахиаритмий. Фибрилляция предсердий возможна у пациентов всех возрастных категорий, однако у больных пожилого возраста распространенность синдрома увеличивается, что связано с учащением органической патологии сердца.
Причины развития и факторы риска
Возрастные органические изменения. С возрастом структура миокарда предсердий претерпевает изменения. Развитие мелкоочагового кардиосклероза предсердий может стать причиной фибрилляции в пожилом возрасте.
Классификация фибрилляции предсердий
По продолжительности клинических проявлений. Различают следующие формы ФП:
Типы мерцательной аритмии (МА)
Термин «мерцательная аритмия» может обозначать два следующих вида суправентрикулярной тахиаритмии.
Фибрилляция (мерцание предсердий). В норме электрический импульс возникает в синусовом узле (в стенке правого предсердия), распространяется по миокарду предсердий и желудочков, вызывая их последовательное сокращение и выброс крови. При ФП электрический импульс распространяется хаотично, заставляя предсердия «мерцать», когда волокна миокарда сокращаются несогласованно и очень быстро. В результате хаотичной передачи возбуждения на желудочки, они сокращаются неритмично и, как правило, недостаточно эффективно.
Трепетание предсердий. В этом случае сокращение волокон миокарда происходит в более медленном темпе (200–400 уд./мин.). В отличие от ФП, при трепетании предсердия все-таки сокращаются. Как правило, за счет периода рефрактерности атриовентрикулярного узла на желудочки передается не каждый электрический импульс, поэтому они сокращаются не в столь быстром темпе. Однако, как и при фибрилляции, при трепетании насосная функция сердца нарушается, а миокард испытывает дополнительную нагрузку.
Осложнения мерцательной аритмии
По последним данным, пациенты с мерцательной аритмией попадают в группу риска не только по развитию тромбоэмболического инсульта, но и инфаркта миокарда. Механизмы поражения таковы: при фибрилляции предсердий невозможно полноценное сокращение предсердий, поэтому кровь в них застаивается и в пристеночном пространстве предсердий образуются тромбы. Если такой тромб с током крови попадает в аорту и в менее крупные артерии, то возникает тромбоэмболия артерии, питающей какой-либо орган: головной мозг, сердце, почки, кишечник, нижние конечности. Прекращение кровоснабжения вызывает инфаркт (некроз) участка этого органа. Инфаркт мозга называется ишемическим инсультом. Наиболее часто встречаются осложнения:
Медикаментозная терапия
Выделяют следующие направления лекарственной терапии фибрилляции предсердий: кардиоверсия (восстановление нормального синусового ритма), профилактика повторных пароксизмов (эпизодов) наджелудочковых аритмий, контроль нормальной частоты сокращений желудочков сердца. Также важная цель медикаментозного лечения при МА – предотвращение осложнений – различных тромбоэмболий. Лекарственная терапия ведется по четырем направлениям.
Лечение антиаритмиками. Применяется, если принято решение о попытке медикаментозной кардиоверсии (восстановления ритма с помощью лекарств). Препараты выбора – пропафенон, амиодарон.
Пропафенон – один из наиболее эффективных и безопасных лекарственных препаратов, который используется для лечения наджелудочковых и желудочковых нарушений сердечного ритма. Действие пропафенона начинается через 1 ч после приема внутрь, максимальная концентрация в плазме крови достигается через 2–3 ч и длится 8–12 ч.
Контроль ЧСС. В случае невозможности восстановить нормальный ритм необходимо привести мерцательную аритмию в нормоформу. Для этой цели применяют бета-адреноблокаторы, антагонисты кальция недигидропиридинового ряда (группы верапамила), сердечные гликозиды и др.
Бета-адреноблокаторы. Препараты выбора для контроля работы сердца (частоты и силы сокращений) и артериального давления. Группа блокирует бета-адренергические рецепторы в миокарде, вызывая выраженный антиаритмический (урежение ЧСС), а также гипотензивный (снижение АД) эффект. Доказано, что бета-блокаторы статистически увеличивают продолжительность жизни при сердечной недостаточности. Среди противопоказаний к приему – бронхиальная астма (так как блокировка бета 2-рецепторов в бронхах вызывает бронхоспазм).
Антикоагулянтная терапия. Для снижения риска тромбообразования при персистирующей и хронической формах ФП обязательно назначают препараты, разжижающие кровь. Назначают антикоагулянты прямого (гепарин, фраксипарин, фондапаринукс и пр.) и непрямого (варфарин) действия. Существуют схемы приема непрямых (варфарин) и так называемых новых антикоагулянтов – антагонистов факторов свертывания крови (прадакса, ксарелто). Лечение варфарином сопровождается обязательным контролем показателей свертываемости и, при необходимости, тщательной коррекцией дозировки препарата.
Метаболическая терапия. К метаболическим препаратам относятся лекарственные средства, улучшающие питание и обменные процессы в сердечной мышце. Эти препараты якобы оказывают кардиопротективное действие, защищая миокард от воздействия ишемии. Метаболическая терапия при МА считается дополнительным и необязательным лечением. По последним данным, эффективность многих препаратов сравнима с плацебо. К таким лекарственным средствам относятся:
Диагностика и лечение любого вида аритмии требует немалого клинического опыта, а во многих случаях – высокотехнологичного аппаратного оснащения. При фибрилляции и трепетании предсердий главная задача врача – по возможности устранить причину, приведшую к развитию патологии, сохранить функцию сердца и предотвратить осложнения.
Симптомы ФП
В зависимости от формы аритмии (постоянная или приступообразная) и восприимчивости больного клиническая картина ФП варьирует от отсутствия симптомов до наличия признаков сердечной недостаточности. Больные могут жаловаться на:
Фибрилляция предсердий и трепетание предсердий может сопровождаться учащенным мочеиспусканием, вызванным повышенной выработкой натрийуретического пептида. Приступы, длящиеся несколько часов или суток и не проходящие самостоятельно, требуют медицинского вмешательства.
Патогенез и общая клиническая картина
Основное проявление фибрилляции предсердий – аритмичный пульс. При высокой частоте сердечных сокращений в момент приступа ФП может возникнуть дефицит пульса, когда число сердечных сокращений превышает частоту пульса.
Причины ФП и факторы риска
Заболевания различного генеза
Наиболее часто ФП возникает у пациентов с заболеваниями сердечно-сосудистой системы – артериальной гипертензией, ИБС, хронической сердечной недостаточностью, пороками сердца – врожденными и приобретенными, воспалительными процессами (перикардит, миокардит), опухоли сердца. Среди острых и хронических заболеваний, не связанных с патологией сердца, но влияющих на возникновение фибрилляции предсердий, выделяют нарушения функций щитовидной железы, сахарный диабет, хроническую обструктивную болезнь легких, синдром сонного апноэ, болезни почек и др.
Возрастные изменения
Фибрилляцию предсердий называют «аритмией дедушек», так как заболеваемость этой аритмией резко увеличивается с возрастом. Развитию данного нарушения сердечного ритма могут способствовать электрические и структурные изменения предсердий,. Однако специалисты отмечают, что мерцательная аритмия может возникнуть у молодых людей, не имеющих патологии сердца: до 45 % случаев пароксизмальной и до 25 % случаев персистирующей фибрилляции.
Другие факторы риска
Фибрилляция предсердий может развиваться на фоне употребления алкоголя, после удара электрического тока и операций на открытом сердце. Пароксизмы могут спровоцировать такие факторы, как физическая нагрузка, стрессовые состояния, жаркая погода, обильное питье. В редких случаях имеется наследственная предрасположенность возникновения ФП.
Методы диагностики
Сначала требуется определить индивидуальный риск инсульта:
Определение риска инсульта при первичной * (если инсультов ранее не было) профилактике (J Am Coll Cardiol 2001;38:1266i-1xx).