Что значит патогенный ген
Генетика и онкология: главные вопросы
Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
Генетика: основные понятия и диагностика
Специализация: генетика, гинекология
Основные понятия
Геном – совокупность наследственного материала, заключенного в клетке организма [1]. Геном содержит биологическую информацию, необходимую для построения организма и поддержания его функций.
Первоначальный смысл этого термина указывал на то, что понятие генома, в отличие от генотипа, является генетической характеристикой вида в целом, а не отдельной особи. С развитием молекулярной генетики значение данного термина изменилось, и сегодня под «геномом» понимают совокупность наследственного материала конкретного представителя вида.
Большинство геномов, в том числе геномы человека и геномы всех остальных клеточных форм жизни, построены из ДНК*. Практически у всех эукариотических организмов все гены организованы в более крупные макромолекулярные комплексы – хромосомы.
У человека наследственный материал соматической клетки представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре, а также клетка обладает множеством копий митохондриальной ДНК. 22 аутосомы, половые хромосомы Х и Y, митохондриальная ДНК человека содержат вместе примерно 3,1 млрд пар оснований [1].
В настоящее время в молекулярной биологии установлено, что гены – это участки ДНК, несущие какую-либо целостную информацию о строении одной молекулы белка или одной молекулы РНК. Эти и другие функциональные молекулы определяют развитие, рост и функционирование организма.
Изначально термин «ген» появился как теоретическая дискретная единица передачи наследственной информации. История биологии помнит споры о том, какие молекулы могут являться носителями наследственной информации. Большинство исследователей считали, что такими носителями могут быть только белки, так как их строение из 20 аминокислот позволяет создать больше вариантов, чем ДНК, состоящая всего из четырех видов
нуклеотидов. Позже было экспериментально доказано, что именно ДНК включает в себя наследственную информацию, что было выражено в виде центральной догмы молекулярной биологии.
Мономеры, составляющие каждую из цепей ДНК, представляют собой сложные органические соединения, включающие в себя азотистые основания: аденин (А), тимин (Т), цитозин (Ц), гуанин (Г), пятиатомный сахар (пентозу) – дезоксирибозу, а также остаток фосфорной кислоты. Эти соединения носят название нуклеотидов (Рис. 1).
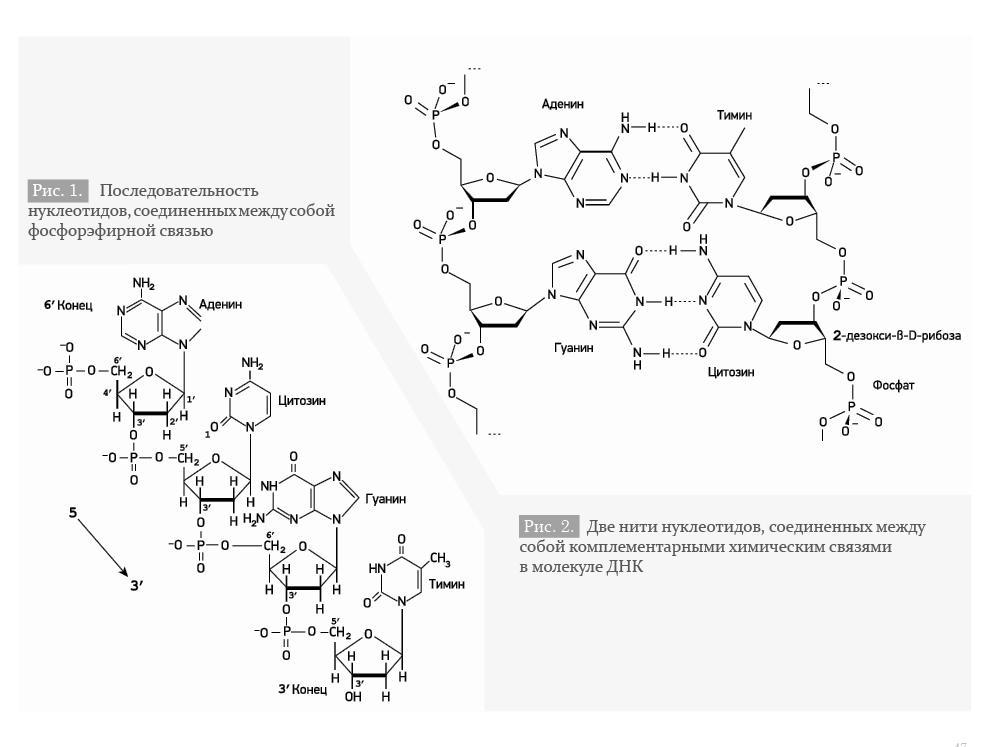
Гены могут подвергаться мутациям – случайным или целенаправленным изменениям последовательности нуклеотидов в цепи ДНК. Мутации могут приводить к изменению последовательности, а следовательно, изменению биологических характеристик белка или РНК, что, в свою очередь, может привести к их общему или локальному изменению или аномальному функционированию. Такие мутации являются патогенными, так как их результатом является заболевание, или летальными на эмбриональном уровне. Однако далеко не все изменения последовательности нуклеотидов приводят к изменению структуры белка или к существенному изменению последовательности и не являются патогенными. В частности, геном человека характеризуется такими особенностями, как однонуклеотидные полиморфизмы и вариации числа копий генов (англ. copynumbervariations), которые составляют около 1% всей ДНК человека [2].
Однонуклеотидный полиморфизм (Single nucleotide polymorphism, SNP) – отличие последовательности ДНК размером в один нуклеотид. Если две последовательности ДНК – AAGCCTA и AAGCTTA – отличаются на один нуклеотид, в таком случае говорят о существовании двух аллелей: C и T. SNP возникают в результате точечных мутаций (как правило, типа замен) и, в частности, определяют различные аллели одного гена.
Разнообразием последовательностей ДНК у людей, возможно, объясняется то, как у них происходит течение различных заболеваний, реакции в ответ на патогены, прием лекарств, вакцин и т. п. Знание об однонуклеотидном полиморфизме, вероятно, поможет в понимании фармакокинетики и фармакодинамики действия различных лекарств на человека. Этиология широкого спектра заболеваний, таких как рак, инфекционные, аутоиммунные заболевания, серповидноклеточная анемия и многие другие, включает однонуклеотидные полиморфизмы [3].
Полиморфизмы генов
Именно полиморфизмы генов в большой степени определяют индивидуальные различия в развитии тех или иных физических и психических качеств индивидума. Масштабы полиморфизмов генов у человека таковы, что между последовательностями ДНК двух людей существуют миллионы различий. Эти различия условно подразделяют на четыре основные категории: а) фенотипически не выраженные; б) вызывающие фенотипические различия; в) играющие роль в патогенезе заболевания (при полигенных болезнях); г) играющие основную роль в развитии заболевания (при моногенных болезнях).
На сегодняшний день сформированы обширные базы полиморфизмов, очень гибкие и быстро растущие.
Они постоянно обновляются за счет информации, которую поставляют в клиники и лаборатории по всему миру научные организации, в которых работает множество специалистов в области системной и молекулярной биологии, биоинформатики.
Вариантные формы некоторых генов в определенных условиях могут привести к развитию болезней. Сочетания вариантных генов предрасположенности несут в себе генетические риски множества заболеваний. Тестирование генетических предрасположенностей помогает выявить индивидуальный риск возможности заболевания и установить подверженность влиянию и воздействию негативных факторов окружающей среды.
По клиническим группам полиморфизмов различают патологии систем свертывания крови, обмена фолиевой кислоты, обмена белков костной ткани, гормонов щитовидной железы, стероидных гормонов и еще десятки других групп полиморфизмов.
В настоящее время в лаборатории CL определяются генетические полиморфизмы генов системы свертывания крови: ген F2 (20210_G>A), ген F5 (1691_G>A), ген F7 (10976_G>A), ген F13 (103_G>Т), ген FGB (455_G>A), ген ITGA 2/интегрин α-2/(807_С>Т), ген ITGВ 3/интегрин β-3/ (1565_Т>С), ген PAI-1 (675_5G>4G). Результат исследования содержит интерпретацию и описание рисков, связанных с тем или иным сочетанием. В ближайшее время планируется значительное расширение спектра определяемых полиморфизмов в CL.
Детекция результатов ПЦР проходит в режиме реального времени. Управление прибором осуществляет программное обеспечение. Программа позволяет использовать простое и интуитивное управление с использованием функции «Тест», что значительно сокращает время создания протоколов исследований. Программное обеспечение содержит приложения для количественной оценки ДНК/кДНК, анализа кривых, определения уровня экспрессии генов, исследования биоценозов и SNP-анализа, позволяет использовать функцию «дополнительных стандартов» и формировать протоколы исследования с автоматической трактовкой полученных результатов.
Научно-технический прогресс привел к одному незаменимому открытию в области молекулярной биологии – открытию метода полимеразной цепной реакции (ПЦР), который позволяет обнаружить даже небольшой фрагмент искомого генома. Полимеразная цепная реакция поначалу применялась исключительно в научных лабораториях. Однако вскоре метод нашел свое место в медицине. В 1993 году, Kary Mullis, ученому, открывшему метод ПЦР, была присуждена Нобелевская премия в области химии.
Диагностика полиморфизмов генов в медицинской лаборатории CL
Выявлять полиморфизмы сегодня позволяют методы современной молекулярно-генетической диагностики. В лаборатории CL исследования полиморфизмов проводят с 2012 года методом полимеразной цепной реакции (ПЦР), c помощью детектирующего амплификатора DtPrime производства российской компании «ДНК-Технология». Принцип ПЦР построен на методе многократного комплементарного достраивания матрицы нуклеиновой кислоты до двухцепочечной структуры, которую способен «увидеть» прибор и распознать полиморфизм. Метод ПЦР, помимо быстроты выполнения и манипулятивной простоты, является еще и весьма чувствительным и специфичным. Очень наглядно принцип метода охарактеризован в среде лабораторных работников так: «найти иглу в стоге сена, а затем построить стог из этих игл».
Для того чтобы исключить неточности, один и тот же участок гена исследуется многократно. Вся цепь ДНК разбивается на участки, затем ведется поиск участков, где прогнозируются полиморфизмы. После чего эти участки вырезаются и сопоставляются. С помощью ПЦР количество таких участков увеличивается до 10 в 36–40 степени. Каждый участок вновь прочитывается десятки раз. Только после этого можно выстроить статистически верную кривую.
Результаты и интерпретация
Информация о наличии полиморфизмов, знание их влияния на определенные виды обмена и уровень чувствительности к лекарственным препаратам позволяют оценить риск развития заболевания, предупредить его развитие и назначить верное лечение.
Важным фактом является то, что генные полиморфизмы в течение жизни не меняются и определяются один раз! Результаты не изменяются в течение жизни и не зависят от физиологического состояния организма.
Генетическое тестирование позволяет в досимптомный период выявить существующие пока только в геноме наследственные тенденции к развитию болезней и наметить пути их ранней профилактики.
Для врачей важна интерпретация результатов анализа полиморфизмов: необходимо понять, как связан тот или иной полиморфизм с вероятностью развития патологического состояния. Следует учитывать, что ни один полиморфизм не является нозологией как таковой, только ее элементом, но зачастую решающим.
Наличие полиморфизмов можно учесть при назначении лекарственных средств. Так, врач-клиницист, руководствуясь рекомендациями генетика, может изменить концентрацию или дозу препарата, который будет влиять на компонент свертывания крови. Безусловно, важны также режим, диета, физиопроцедуры, но основная роль отведена медикаментозному лечению. А это – область фармакогенетики, которая изучает реакции организма на определенные препараты согласно особенностям генома человека.
Интеграция наук
15 лет назад было заявлено, что расшифрован геном человека. Это открытие стало возможным благодаря многолетней работе ученых различных отраслей науки, уровень которой достиг тех высот, в которых информация и знания из одной области проникают в другую. Такая «интеграция наук» выводит на качественно новый уровень дальнейшее развитие биотехнологий, медицины, генетики, геномики. Каких горизонтов достигнут ученые при детальном знании генома человека, прогнозировать трудно. Можно быть готовым лишь к тому, что природа поставит перед человеком новые, не менее сложные задачи и амбициозные цели.
СОДЕРЖАНИЕ
История
Классификация
По состоянию на 2020 г. участие федеральных агентств в регулировании клинической валидности (точности) и полезности (рисков и преимуществ) генетического тестирования по-прежнему ограничено. Интерпретация и классификация вариантов особенно субъективны, поскольку лаборатории разработали свои собственные критерии до появления рекомендаций ACMG-AMP. Эта субъективность еще более проблематична, когда есть свидетельства того, что значимость вариантов со временем меняется. Из-за непоследовательности официальных руководящих принципов сообщество специалистов по геномике вынуждено бороться за эффективную категоризацию генетических вариантов.
Патогенный
Эта категория предназначена для вариантов, которые, как известно, вызывают заболевание.
Вероятно патогенный
Эта категория предназначена для вариантов, в которых есть убедительные, но не окончательные доказательства, вызывающие заболевание.
Неопределенное значение
Эта категория предназначена для вариантов с неизвестным или противоречивым клиническим значением. Дополнительные доказательства необходимы, чтобы определить, является ли вариант причиной определенного заболевания.
Вероятно, доброкачественный
Эта категория предназначена для вариантов, которые не являются причиной заболевания.
Доброкачественный
Эта категория предназначена для вариантов, которые не являются причиной заболевания. Доброкачественные варианты обычно наблюдаются раньше с более высокой частотой, и анализ in silico предсказывает доброкачественный эффект на кодируемый белок.
Ограничения классификаций
Примером варианта межгенного энхансера является тот, который связан со светлым цветом волос у северных европейцев. Вариант в энхансере гена KITLG вызывает изменение экспрессии гена только на 20%, но вызывает осветление волос.
Приложения
Количество отчетов VUS не позволяет перечислить все такие отчеты. Чтобы дать представление о некоторых приложениях в одной области, возможно, наиболее интересно сосредоточить внимание на раке груди. Помните, что это лишь часть доступной во всем мире информации об отчетах VUS, связанных с раком груди, и, как всегда, ваши результаты могут отличаться.
В исследовании, проведенном в США в 2009 году с участием более 200 женщин, получивших отчеты BRCA VUS и опрошенных в течение одного года после этого, в течение года сохранялось беспокойство по поводу результата.
Исследование результатов лечения пациентов в Нидерландах в 2012 году показало, что после генетического консультирования по поводу BRCA VUS пациенты воспринимали себя как подверженные риску рака, отличные от того, что им объяснили генетические консультанты, и что это заблуждение повлияло на решения о радикальных медицинских процедурах.
В исследовании 2015 года в Великобритании, где BRCA VUS встречаются в 10-20% тестов, 39% специалистов по раку груди, принимавших участие в исследовании, не знали, как объяснить отчет VUS пациенту без семейного анамнеза, а 71 % не были уверены в клиническом значении отчетов об испытаниях.