Что значит органическое расстройство желудка
Диагностика и лечение функциональной (неязвенной) диспепсии
Диспепсия в переводе с греческого означает «нарушенное пищеварение». В разные периоды времени в нашей стране и за рубежом в это понятие вкладывали различный смысл. Сейчас диспепсия рассматривается с позиции Международной рабочей группы по разр
Диспепсия в переводе с греческого означает «нарушенное пищеварение». В разные периоды времени в нашей стране и за рубежом в это понятие вкладывали различный смысл. Сейчас диспепсия рассматривается с позиции Международной рабочей группы по разработке диагностических критериев функциональных гастроэнтерологических заболеваний. Международные эксперты предложили определять диспепсию как симптомы, относящиеся к гастродуоденальной области, при отсутствии органических системных или метаболических заболеваний, которые могли бы объяснить эти проявления (Римские критерии III, 2006). Под функциональной (неязвенной) диспепсией (ФД) понимают симптомокомплекс, включающий боли или ощущение дискомфорта в подложечной области, тяжесть и чувство переполнения в эпигастрии после еды, вздутие живота, тошноту, рвоту, отрыжку, изжогу и другие симптомы, при которых, несмотря на тщательное обследование, не удается выявить органическое заболевание.
Эпидемиология
В США и Великобритании диспептические жалобы наблюдают у 26 и 41% населения соответственно. В России распространенность ФД достигает 30–40%. Заболевание чаще наблюдают в молодом возрасте (17–35 лет), в 1,5–2 раза чаще у женщин.
Классификация
В зависимости от клинической картины различают три варианта функциональной диспепсии:
При необходимости более детального определения ФД, с учетом ее патофизиологического механизма, Римский консенсус III выделил два новых варианта: 1) диспепсические симптомы, вызываемые приемом пищи (meal-induced dyspeptic symptoms — MDS), или индуцированные пищей диспепсические симптомы — постпрандиальный дистресс-синдром (ПДС) и 2) epigastric pain syndrome (EPS) — синдром эпигастральной боли, или эпигастральный болевой синдром (ЭБС).
Этиология и патогенез
Считается, что в развитии заболевания могут иметь значение следующие факторы:
Причиной появления основных симптомов ФД считают нарушение двигательной функции желудка и 12-перстной кишки. Преобладают следующие моторно-эвакуаторные нарушения:
Существует корреляция между симптомами и двигательными нарушениями желудка и 12-перстной кишки. Тошнота и рвота связаны с гастропарезом, чувство переполнения в эпигастрии — с нарушением чувствительности рецепторного аппарата желудка к растяжению, чувство раннего насыщения — с расстройством аккомодации желудка.
Очевидно, главное звено патогенеза ФД у большинства больных — ослабление двигательной функции желудка и 12-перстной кишки, что приводит к замедлению опорожнения желудка.
У части больных появление диспептических расстройств возможно при нормальной моторике желудка. В подобных случаях растяжение стенки желудка связано с повышенной чувствительностью механорецепторов, располагающихся в подслизистом слое, и/или с изменением тонуса проксимальной части желудка. Висцеральная гиперчувствительность возникает вследствие патологического сокращения желудка и нарушения рецепторного восприятия нормальных раздражителей, включая мышечные сокращения желудка и растяжение его воздухом и пищей.
Снижение тонуса желудка в норме связано с взаимодействием таких рефлексов, как релаксационный (поступление пищи через пищевод в желудок) и аккомодационный (растяжение желудка). Анализ таких симптомов, как боли в подложечной области, послеобеденное переполнение желудка, быстрое насыщение, тошнота, рвота, срыгивание, жжение в эпигастральной области и метеоризм, показывает, что ослабление аккомодации достоверно связано с быстрым насыщением.
При исследовании желудочной гиперчувствительности у больных с неязвенной диспепсией Klatt S. et al. установили, что средний порог чувствительности у них выше, чем у пациентов из контрольной группы, но у 50% больных с ФД порог чувствительности оставался нормальным.
Клиническая картина
При язвенноподобном варианте отмечают постоянные или периодические боли либо ощущение дискомфорта в эпигастральной области, не имеющие четкой связи с приемом пищи.
При дискинетическом варианте пациентов беспокоят чувство переполнения, тяжести в эпигастральной области после еды, вздутие живота, тошнота, рвота, чувство быстрого насыщения (табл.).
При неспецифическом варианте наблюдают сочетание различных симптомов ФД, и выделить ведущий синдром не удается.
Диагностика
Диагноз ФД правомочен лишь после исключения всех органических причин боли и дискомфорта в эпигастрии.
В России, как правило, проводится обязательное обследование больного, впервые обратившегося с этими жалобами. В США и Западной Европе предлагают два подхода: или лабораторно-инструментальное обследование больного, установление диагноза, назначение лечения, или проведение эмпирической терапии без предварительного обследования. В последнем случае диагностические процедуры назначают только при отсутствии эффекта от эмпирического лечения.
Согласно критериям Римского консенсуса III, в процессе диагностики ФД предлагается следовать пунктам, разработанным на основе доказательной медицины.
Предпочтение может быть отдано пробной терапии, поскольку ФД широко распространена, и тотальное инструментальное обследование всех обратившихся нецелесообразно.
Диагноз ФД может быть поставлен при наличии трех обязательных условий (Римские критерии):
Инструментальные и лабораторные исследования:
ФД часто приходится дифференцировать с синдромом раздраженной кишки, при котором боли чаще возникают в нижних отделах живота и обычно сопровождаются расстройствами стула (запоры, поносы или их чередование). Эти два заболевания часто сочетаются друг с другом, т. к. имеют общие патогенетические механизмы, связанные с нарушениями двигательной функции ЖКТ (эфферентное звено) и со сниженным порогом восприятия (афферентное звено).
Лечение
Терапия комплексная и включает мероприятия по нормализации образа жизни, режима и характера питания, лекарственную терапию, при необходимости — психотерапевтические методы.
По возможности устраняют физические и эмоциональные перегрузки, отрицательно влияющие на моторику ЖКТ.
Недопустимы длительные перерывы в приеме пищи, обильное употребление жирной и острой пищи, консервантов, маринадов, копченостей, кофе. Исключают курение, употребление алкоголя и газированных напитков.
Отсутствие полных представлений о патогенезе ФД делают лечение этого синдрома непростой задачей. Подходы к лечению ФД более многочисленны, чем обоснованная тактика лечения ЯБ или ГЭРБ.
Наиболее широко изучалась эффективность прокинетиков, эрадикации H. pylori и кислотосупрессивных агентов.
Прокинетики. Оказались более эффективны, чем плацебо, в 16 из 21 проведенного исследования (метоклопрамид — в 2 из 2 исследований, цизаприд — в 7 из 12 и домперидон — в 7 из 7 исследований), в целом на 40–45%.
Домперидон, метоклопрамид, цизаприд, наряду с повышением амплитуды сокращений пищевода и повышения давления в области его нижнего сфинктера, улучшают клиренс кислоты из нижнего отдела пищевода и снижают объем желудочно-пищеводного рефлюкса. Они ускоряют опорожнение желудка благодаря повышению частоты и амплитуды сокращений антрального отдела желудка, снижая время транзита и в 12-перстной кишке путем увеличения амплитуды ее сокращений. Ускорение опорожнения желудка, вызываемое прокинетиками, связано также со способностью этих препаратов синхронизировать антральные и дуоденальные сокращения.
Домперидон — это эффективный селективный антагонист дофамина. Главное действие препарата — блокада рецепторов дофамина, влияющих на моторику верхних отделов ЖКТ. Усиливая перистальтику пищевода, повышая тонус его нижнего сфинктера и регулируя моторную функцию желудка (в том числе увеличивая длительность сокращений его антрального отдела), усиливая перистальтику 12-перстной кишки, домперидон ускоряет опорожнение желудка.
Домперидон противодействует желудочной релаксации, обусловленной введением дофамина, и торможению, вызванному введением секретина; увеличивает амплитуду сокращений антрального отдела желудка, являясь причиной релаксации пилорического сфинктера. Препарат улучшает антродуоденальную координацию, под которой понимают распространение перистальтических волн из антрального отдела желудка через привратник к 12-перстной кишке.
Лечение инфекции H. pylori
В ингибирующем действии H. pylori на моторику желудка участвуют цитокины (IL-1b, IL-6, IL-8) и фактор некроза опухолей-альфа (TNF-альфа). С учетом этого антихеликобактерная терапия может приводить к нормализации желудочной моторики.
Однако полное устранение диспептических жалоб отмечается только у 20–25% пациентов с ФД. Эрадикация H. pylori, согласно результатам только 8 из 16 исследований, оказывала благоприятное влияние на симптомы пациентов с ФД. Согласно заключению Национального института здравоохранения США (1994), лечения хеликобактерной инфекции пациентов с ФД не требуется.
Однако в ряде работ показано, что частота хеликобактерной инфекции среди пациентов с неязвенной диспепсией выше, чем у здоровых лиц. Кроме того, инфицирование H. pylori может вызывать диспептические симптомы.
Другие авторы подвергают сомнению значение эрадикации H. pylori в терапии хеликобактер-ассоциированной ФД с целью устранения симптомов. Не удается выявить существенных различий в уменьшении частоты симптомов диспепсии независимо от того, получали больные антихеликобактерную терапию или нет. Имеются данные, что через год после проведенного лечения симптомы ФД у больных с успешной эрадикацией H. pylori отмечаются чаще, чем у больных, не пролеченных ранее с использованием антихеликобактерной терапии.
Среди подобных работ выделяется исследование J. Gillvary и соавт. (1997), т. к. в качестве эрадикационной схемы использовалась классическая «тройная терапия» с субцитратом коллоидного висмута, и у больных был получен хороший симптоматический ответ. Так как у некоторой части больных с ФД эрадикация H. pylori приводит к длительному улучшению самочувствия, Маастрихтский консенсус II (2000) назвал ФД в качестве показания к антихеликобактерной терапии.
Новые факты послужили причиной проведения в марте 2005 года ІІІ Совета ведущих ученых, занимающихся проблемой хеликобактерной инфекции. В результате был выработан ІІІ Маастрихтский консенсус, определяющий подходы к диагностике и уничтожению инфекции Н. рylori.
Согласно новому консенсусу, обязательному обследованию на инфицированность Н. рylori и проведению эрадикационной терапии подлежат пациенты с неисследованной ФД.
Согласно ІІ и ІІІ Маастрихтским консенсусам, «золотым стандартом» диагностики хеликобактерной инфекции и подтверждения успешности эрадикации остается дыхательный тест. Но при кровоточащих язвах, атрофическом гастрите, MALT-лимфомах, после приема ингибиторов протонной помпы (ИПП) этот метод использовать не рекомендуется, т. к. значительно растет вероятность ложных результатов. В этих случаях методом выбора является определение антител в крови. При проведении эпидемиологических исследований предпочтение отдают неинвазивным методам детекции антигенов Н. рylori в слюне и моче.
В новом консенсусе предусмотрены схемы лечения 1-й линии и резервные схемы эрадикации, а также «терапия спасения», к которой прибегают в случаях неэффективности терапии препаратами 1-й линии и резервными средствами. В качестве терапии 1-й линии предлагаются хорошо зарекомендовавшие себя две тройные схемы: ИПП + кларитромицин + амоксициллин или метронидазол. В соответствии с Маастрихтским консенсусом III трехкомпонентная антихеликобактерная терапия длительностью 14 дней повышает эффективность эрадикации на 12%. Причем кларитромицин нежелательно назначать в популяции при наличии данных о резистентности Н. рylori к этому антибиотику свыше 30%. Это же касается метронидазола и амоксициллина, хотя резистентность к последнему у Н. рylori встречается значительно реже.
В случае одновременной устойчивости Н. рylori к двум препаратам 1-й линии рекомендуется сразу начинать эрадикацию с резервной схемы, т. е. использовать резервную схему лечения в качестве первой линии.
Психотропные средства. Включают в себя антидепрессанты, блокаторы серотониновых рецепторов и обратного захвата серотонина, анксиолитики. В настоящее время нет результатов контролируемых исследований, посвященных применению этих препаратов при ФД. Надо ожидать, что эффект таких средств близок к благоприятному влиянию их на пациентов, страдающих некардиальными торакалгиями или синдромом раздраженной кишки.
Эмпирическая терапия. Если отсутствуют признаки серьезных органических заболеваний или их не было обнаружено при стандартном диагностическом обследовании, оправдано назначение так называемой эмпирической терапии.
У молодых пациентов без признаков органических заболеваний желудка для выявления хеликобактерной инфекции используют серологический тест на IgG-антитела к H. pylori или дыхательный уреазный тест. Пациентам с положительными результатами тестов следует назначить эрадикационную терапию. Если при этом диспептические симптомы проходят, дальнейшего обследования не требуется.
У пациентов, не имеющих хеликобактерной инфекции или имеющих ее, но не отреагировавших на лечение противохеликобактерными средствами, следует начать лечение Н2-блокаторами или ингибиторами протонной помпы и прокинетиками. Если эффекта нет, показаны эндоскопия и другие исследования для выбора дальнейшей тактики лечения.
Антациды. Исследования по снижению кислотности желудочного сока в лечении ФД выявили невысокую эффективность антацидов. Так, в 14 из 24 исследований было показано, что данные препараты в больших дозах вызывают улучшение самочувствия у 35–80% пациентов по сравнению с 30–60% лиц, получающих плацебо.
Антациды хорошо известны и пациентам, и врачам, доказана безопасность их использования, поэтому эта группа препаратов находит применение при ФД.
Наиболее часто используются (как по рекомендациям врачей, так и принимаются больными самостоятельно) такие антациды, как Алмагель Нео, Фосфалюгель, Рутацид, Гелусил лак, основное свойство которых — нейтрализация кислоты, выделенной обкладочными клетками слизистой оболочки. Это позволяет быстро уменьшать интенсивность болей в эпигастральной области и изжогу, у многих больных — и другие диспептические расстройства.
Препарат «Алмагель Нео» позволяет не только нейтрализовать кислое содержимое желудка, но и устранить симптомы дискомфорта, предотвратить появление метеоризма, улучшить опорожнение кишечника. Эффективность действия Алмагеля Нео обусловлена оптимальным содержанием в его составе гидроксида алюминия и гидроксида магния и наличием пеногасителя симетикона.
Кислотосупрессивные препараты. Это группа лекарственных препаратов, которую часто используют для лечения ФД. Некоторые авторы считают, что положительный результат от антагонистов Н2-рецепторов гистамина в ряде клинических испытаний получен благодаря группе больных с ГЭРБ, которые были включены в эти испытания из-за несовершенства критериев отбора.
Однако метаанализ G. Dobrilla и соавт. (1989) показал, что при использовании Н2-блокаторов терапевтический эффект на 20% превосходил эффект плацебо.
Существует мнение, что при ФД эффективной является высокая доза антагонистов Н2-рецепторов гистамина, однако для подтверждения этого необходимы серьезные исследования.
ИПП пока мало применялись при ФД. Недавно завершенное исследование с высокой статистической достоверностью показало хороший эффект омепразола при ФД, причем лучший результат был получен в группе больных с язвенноподобным вариантом по сравнению с дискинетическим. В исследовании OCAY монотерапия омепразолом оказалась эффективна в купировании симптомов диспепсии, как и эрадикационная терапия инфекции H. pylori.
Продолжаются дискуссии относительно выбора оптимального ИПП. Российская гастроэнтерологическая ассоциация рекомендует применять рабепразол. Устойчивый эффект от его приема отмечается с 1-го дня. Кроме того, нет необходимости в 2–3-дневном промежутке между назначением рабепразола и антибактериальных компонентов эрадикационной терапии, их можно применять с первых дней в комбинации. Амоксициллин и кларитромицин проявляют антибактериальный эффект по отношению к Н. рylori только при рН 5,0 и выше, поэтому назначение одновременно с этими антибиотиками других ИПП, имеющих более длительный период наступления эффекта, приводит к снижению % эрадикации Н. рylori.
Большинство экспертов считают, что достоверных различий в эффективности эрадикационной терапии в зависимости от того, какой ИПП применяется, не выявлено. В резюме «Маастрихта-III» вообще не упоминаются отдельные названия ИПП, что, видимо, отражает отсутствие среди экспертов каких-либо разногласий по этой составляющей лечения ФД.
На отечественном фармрынке присутствуют все основные ИПП: омепразол, лансопразол, пантопразол, рабепразол и эзомепразол. Омепразол чаще других используют в российской практике, что вполне оправдано с учетом количества клинических исследований, посвященных этому препарату. Отечественным генериком, по которому проводились исследования биоэквивалентности оригинальному препарату, является Гастрозол.
Мы располагаем опытом курсовой монотерапии препаратом «Омез» в дозе 20 мг 2 раза в сутки в течение 4 недель у 12 пациентов с диагнозом синдрома ФД, у 8 из которых была ФД по язвенному типу, у 2 — по дискинетическому, у 2 — по неспецифическому. Возраст пациентов колебался от 22 до 35 лет, среди них было 5 мужчин и 7 женщин. В контрольной группе (n = 10), сопоставимой по полу и возрасту с основной, применялся ранитидин в дозе 150 мг 2 раза в день.
В процессе лечения было установлено, что в группе использования Омеза значимо более быстро уменьшилась выраженность клинических симптомов, снизился уровень тревожности по шкале Тейлора, депрессии по шкале Цунга, нормализовался вегетативный индекс Кердо, снизилась выраженность болей по визуальной аналоговой шкале (ВАШ), повысилось качество жизни (КЖ) по сравнению с группой сравнения, где применялась монотерапия ранитидином.
Дифференцированная медикаментозная терапия
Резюмируя изложенное для практического врача-терапевта или семейного врача, необходимо иметь в виду следующее:
Функциональные нарушения желудочно-кишечного тракта: достижения в понимании и лечении
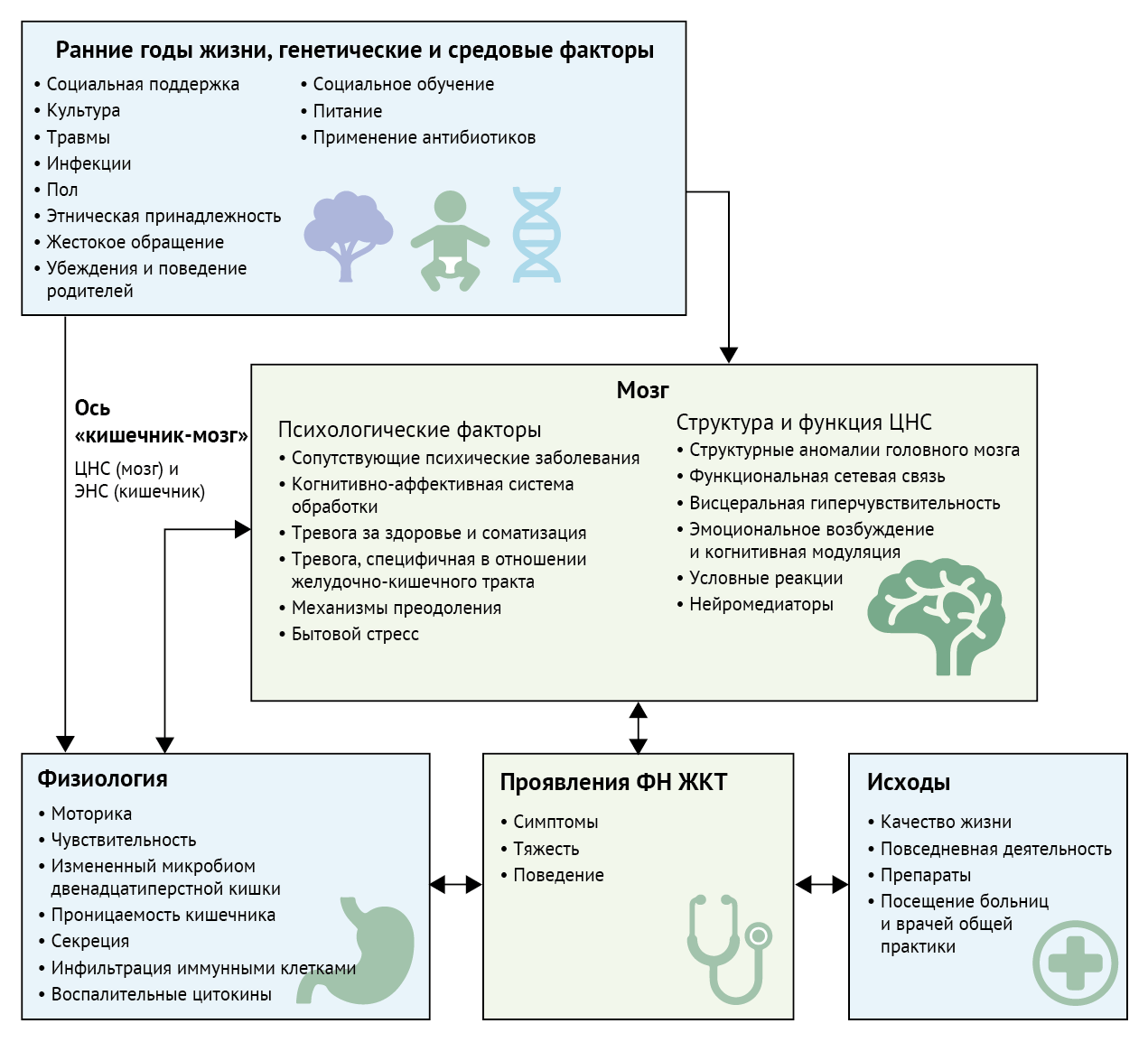
Симптомы нарушения функции желудочно-кишечного тракта встречаются очень часто, однако у многих людей они не сопровождаются какой-либо органической патологией. У большинства из этих людей будет диагностировано какое-либо функциональное желудочно-кишечное расстройство: синдром раздраженного кишечника, функциональная диспепсия или функциональный запор. Эти состояния затрагивают до 40 % людей в любой момент времени, при этом две трети из них будут иметь нестабильные хронические симптомы. Патофизиология функциональных нарушений желудочно-кишечного тракта сложна, но включает в себя двунаправленное нарушение регуляции взаимодействия кишечника и мозга (через ось «кишечник-мозг»), а также дисбиоз микробиома в кишечнике, изменение иммунной функции слизистой оболочки, висцеральную гиперчувствительность и аномальную моторику желудочно-кишечного тракта. Таким образом, эти состояния относят к нарушениям взаимодействия кишечника и мозга. Часто встречаются сопутствующие (коморбидные) психические состояния, однако неясно, предшествуют ли они симптомам или обусловлены ими. Пациенты с функциональными нарушениями желудочно-кишечного тракта могут чувствовать стигматизацию, нередко при этом диагнозе отсутствует эффективная коммуникация с врачами, и не проводится обучение. Своевременное выявление и лечение этих состояний крайне важно, поскольку они оказывают значительное влияние на систему здравоохранения и общество в целом из-за неоднократных консультаций, ненужных исследований и операций, выписки рецептурных и использования безрецептурных лекарств, а также ухудшения качества жизни и трудоспособности. Для постановки диагноза используются критерии, основанные на симптомах, при разумном применении отдельных методов обследования для некоторых пациентов. Общие принципы лечения основаны на понимании биопсихосоциальных основ состояния и включают лечение физических симптомов и (в случае наличия) сопутствующих (коморбидных) психических состояний. В будущем подходы к лечению функциональных нарушений желудочно-кишечного тракта, вероятно, станут более персонализированными, основанными не только на симптомах, но и патофизиологии и психологии в их основе.
Введение
Спектр симптомов, связанных с нарушением функции желудочно-кишечного тракта, включает боли в животе, диарею, запоры, вздутие живота, чувство переполнения в животе после приема пищи, тошноту и рвоту. Эти симптомы являются общими для широкого спектра органической патологии, включая рак органов желудочно-кишечного тракта, воспалительные заболевания кишечника, целиакию, язвенную болезнь и нарушения моторики, такие как парез желудка. Тем не менее, хорошо известно, что в случае значительного числа пациентов проведенное обследование не выявляет никаких структурных аномалий, способных объяснить наблюдаемые симптомы, которые в этом контексте часто называют функциональными. Функциональные нарушения желудочно-кишечного тракта (ФН ЖКТ), такие как синдром раздраженного кишечника (СРК), функциональная диспепсия или функциональный запор, недостаточно изучены и имеют сложную патофизиологию; при этом на них приходится не менее трети обращений в гастроэнтерологические клиники [1]. Из-за типа вовлеченной патофизиологии и стигмы, связанной с термином «функциональный», эти состояния получили новое определение — нарушения взаимодействия между кишечником и мозгом, что лучше отражает их научное обоснование [2]. Диагностику и классификацию ФН ЖКТ осуществляют с использованием стандартизированных критериев, рекомендованных Римским фондом (Rome Foundation). Современные подходы к лечению направлены на борьбу с преобладающими желудочно-кишечными и психическими симптомами, а не на выявление и устранение конкретных патофизиологических механизмов, лежащих в основе нарушения. Почти половина всего населения в любой момент времени будет иметь симптомы, удовлетворяющие критериям ФН ЖКТ [3], при этом нередко у одного человека может наблюдаться несколько таких состояний [4]. Более двух третей людей обращались к врачу за предыдущие 12 месяцев, 40 % регулярно принимали лекарства, а треть перенесли потенциально ненужную операцию на брюшной полости по поводу своих симптомов, такую как гистерэктомия или холецистэктомия [4]. Наряду с тем фактом, что лечение этих состояний обходится дорого, а сами они влияют на качество жизни в той же степени, что и органические поражения желудочно-кишечного тракта [4], это подчеркивает фундаментальное важность ФН ЖКТ как для систем здравоохранения, так и для общества. Тем не менее, исследования ФН ЖКТ не являются приоритетом для финансирования [5]. Данная статья является первой в серии из трех. В двух дополнительных статьях подробно обсуждаются два наиболее распространенных ФН ЖКТ: СРК и функциональная диспепсия.
Взгляд со стороны пациента
Диагноз ФН ЖКТ имеет значение для пациента из-за стигмы, которая его часто сопровождает. Эти расстройства не имеют структурно-органических особенностей, поэтому многие врачи считают их незначительными и негативно воспринимают пациентов с такими состояниями, часто считая их страдающими психическими расстройствами [7]. Такое отношение может нанести пациенту как физический, так и эмоциональный вред [8] и может привести к возникновению чувства стигматизации и стыда. В свою очередь, эта стигматизация может подорвать способность пациента адекватно выражать свои мысли и чувства медицинским работникам, заставляя его преуменьшать тяжесть своих симптомов и влияние, оказываемое ими на качество его жизни [8, 9]. Пациенты боятся, что их сочтут страдающими психическим расстройством, поэтому некоторые из них предпочитают страдать, избегая любых медицинских вмешательств, в конечном итоге теряя надежду на восстановление качества своей жизни или, наоборот, фактически еще более активно используя медицинские услуги в поисках ответов. Этот процесс может заставить пациентов отвергнуть диагноз из-за подозрения, что врач сдался и прекратил поиск истинной причины симптомов. Даже если пациент принимает диагноз, у него может развиться чувство обвинения самого себя за наличие состояния, которое врачи не считают реальным [10]. Половина всех пациентов с ФН ЖКТ не информируют о диагнозе даже членов своей семьи и друзей из-за страха, что их неправильно поймут или не поверят [11].
Таким образом, что можно сделать, чтобы изменить восприятие этих расстройств и этих пациентов, а также обеспечить более адекватное информирование о диагнозе и эффективную помощь? Нужно начать с врачей, осуществляющих диагностику и лечение. Разочарование многих врачей заключается в том, что ФН ЖКТ не так легко вылечить, необходим постоянный контроль за симптомами, а следовательно, частые посещения и последующее наблюдение. Этот аспект заболевания может привести к разочарованию, когда пациент сообщает об отсутствии улучшения состояния, и может способствовать выгоранию врача.
Во-первых, врачи должны знать, как поставить точный диагноз ФН ЖКТ, используя основанные на симптомах Римские критерии, и как эффективно сообщить этот диагноз пациенту, обосновав свои выводы и четко, лаконично обозначив расстройство. При постановке диагноза очень важно использование профессионального языка. Врач не должен говорить пациенту: «Мы думаем, что у вас СРК», вместо этого необходимо сформулировать диагноз так: «У вас СРК». Использование более определенных формулировок может улучшить принятие диагноза пациентом, уменьшить его опасения и обеспечить основу для соблюдения рекомендаций по лечению и режима приема лекарств, а также для положительных отношений между пациентом и лечащим врачом [12]. Во-вторых, пациенты должны быть правильно информированы о своем состоянии и принимать активное участие в процессе принятия решения о лечении. Пациенты лучше реагируют на четкую, краткую обучающую информацию с использованием изображений и диаграмм для закрепления сложных концепций, таких как ось «кишечник-мозг» или контроль «ворот боли», что не позволяет им обращаться к неквалифицированным источникам, которые могут содержать неточную информацию. Наконец, пациенты должны чувствовать и понимать, что они вправе задавать вопросы обо всем, что им неясно, честно говорить о тяжести своей болезни и ее влиянии на качество их жизни и ощущать значимость пережитого опыта. Когда все эти элементы обеспечены опытным клиницистом, и пациент, и врач могут получить положительные эмоции, эффективные результаты лечения и длительные доверительные взаимоотношения [13].
Эпидемиология
Панель 1 | Римские критерии IV пересмотра: Функциональные нарушения желудочно-кишечного тракта взрослых (нарушения взаимодействия между кишечником и мозгом) [14]
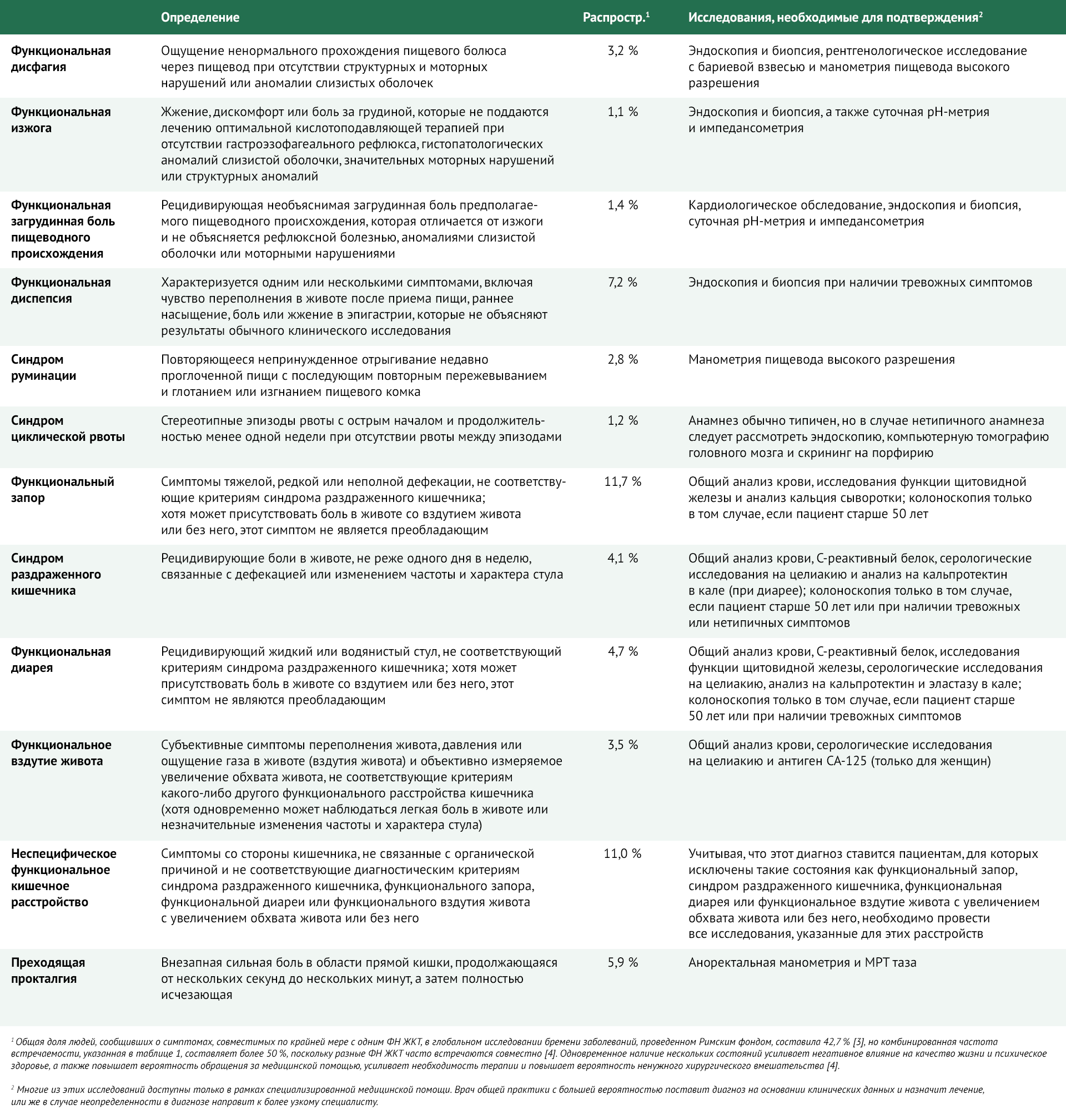
Недавний глобальный интернет-опрос 54 127 взрослых в сообществах 26 стран, проведенный Римским фондом, показал, что 23 112 человек (43 %) подходят по критериям наличия по крайней мере одного ФН ЖКТ [3]. Эти люди активнее прибегали к медицинским услугам и говорили о более низком качестве жизни, чем те, кто не соответствовал этим критериям. В одном шведском исследовании [15] с последующим наблюдением в течение 7 лет только 232 (42 %) из 547 респондентов в общей популяции не имели симптомов на протяжении всего исследования. Некоторые из наиболее распространенных ФН ЖКТ, согласно Римским критериям IV, их предполагаемая частота среди населения в целом в глобальном обследовании Римского фонда [3], а также подтверждающие исследования, необходимые для постановки этих диагнозов, описаны в таблице 1 [16–21]. СРК, функциональная диспепсия и функциональный запор относятся к числу наиболее распространенных ФН ЖКТ и являются предметом особого внимания исследователей в этой области. Однако другие расстройства, которые менее хорошо изучены и для которых не хватает доказательных методов лечения, такие как руминация и функциональная дисфагия, также встречаются чаще, чем считалось ранее.
Таблица 1 | Определения некоторых наиболее распространенных ФН ЖКТ у взрослых согласно Римским критериям IV пересмотра, распространенность этих состояний среди населения в целом и подтверждающие исследования, необходимые для постановки этих диагнозов
Женщины, как правило, страдают от ФН ЖКТ чаще, чем мужчины [22–24]. Действительно, глобальное исследование Римского фонда показало, что 49 % женщин сообщили о наличии хотя бы одного ФН ЖКТ по сравнению с 37 % мужчин [3]. Эпидемиологические исследования [25, 26] показали повышенный риск развития при ФН ЖКТ как атопических, так и аутоиммунных заболеваний. Курение также является фактором риска [27], а внекишечные симптомы, такие как усталость или другие хронические болевые синдромы, перекрываются в большей степени, чем можно было бы ожидать случайно [28, 29]. Что касается географии, то исследования постоянно показывают различия в распространенности ФН ЖКТ между странами, хотя эти состояния наблюдаются во всем мире [3, 22–24, 30, 31]. Эта вариабельность может частично объясняться различиями в методологии проведения исследований [31]. Однако она может также отражать различия в генетике, культуре, образе жизни и традициях питания, существующие между нациями [32, 33].
Патофизиология
Интегрированная модель патогенеза заболевания помогла бы объяснить все известные явления, встречающиеся при ФН ЖКТ, и, что важно, обеспечила бы новое, экспериментально проверяемое понимание их причин (рисунок 2) [27, 39]. Важно, что биопсихосоциальная модель определяет болезнь как целостную и многофакторную и подчеркивает существование тесной связи между разумом и телом, которой способствует признанный факт двунаправленной связи между мозгом и кишечником при ФН ЖКТ [34, 35, 40]. Каковы бы ни были основные причины и патогенез ФН ЖКТ, для субъективного восприятия симптомов пациентом необходима обработка болевых и других сигналов от кишечника центральной нервной системой. Это участие центральной нервной системы подтверждается объективными данными, в том числе доказательствами существования нескольких областей аномальной мозговой активности, связанной с висцеральной гиперчувствительностью, а также с тревогой и депрессией у пациентов с ФН ЖКТ [41, 42]. В данных исследованиях нельзя определить причинно-следственные связи, однако они не имеют значения, когда патофизиология понимается с точки зрения взаимодействующих систем.
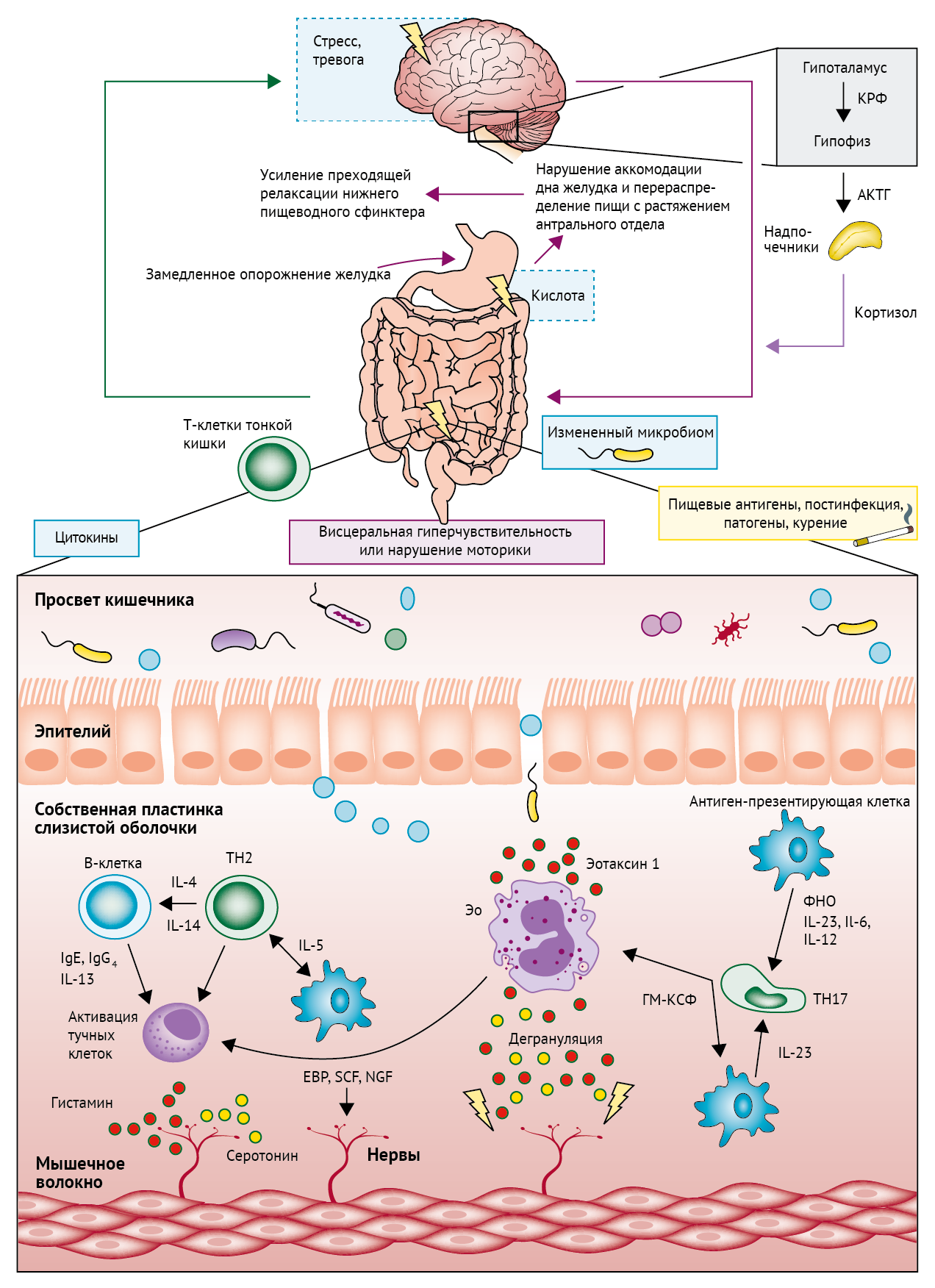
Адаптирована из работы Talley и Talley [27, 39]. Предполагается, что после первичного контакта хозяина с антигеном факторы окружающей среды вызывают активацию его иммунной системы. Презентация Т-лимфоцитам антигенов из просвета кишечника, таких как патогены или пищевые пептиды, стимулирует созревание наивных Т-лимфоцитов до Т-хелперов 2 (TH2). Высвобождение ассоциированных цитокинов (IL-4, IL-5 и IL-14) способствует активации и привлечению эозинофилов, В-лимфоцитов и тучных клеток. В дополнение к традиционному TH2-пути секреция IL-23 антиген-презентирующими клетками, такими как дендритные клетки, В-лимфоциты и макрофаги, способствует дифференцировке Т-хелперов 17 (TH-17). Продукция ГМ-КСФ Т-хелперами TH-17 дополнительно стимулирует привлечение эозинофилов. Дегрануляция тучных клеток и эозинофилов приводит к высвобождению медиаторов воспаления, которые могут повреждать кишечный барьер, а также стимулировать и повреждать нервные волокна кишечника, что приводит к висцеральной гиперчувствительности и нарушению моторики, вызывающим желудочно-кишечные симптомы. Т-клетки кишечника, α4β7, являются маркером воспаления кишечника как при функциональной диспепсии, так и при синдроме раздраженного кишечника, и их уровень коррелирует с задержкой опорожнения желудка. Моторная дисфункция двенадцатиперстной кишки также может нарушать клиренс кислоты, вызывая кишечно-желудочные рефлекторные реакции, которые нарушают аккомодацию дна желудка и усиливают преходящую релаксацию нижнего пищеводного сфинктера, что приводит к желудочно-кишечному рефлюксу. Сигнальные каскады, стимулирующие дальнейшее высвобождение цитокинов, могут привести к появлению внекишечных симптомов, таких как беспокойство и усталость. Место и степень активации иммунной системы кишечника могут определять тип возникшего нарушения (например, поражение проксимального отдела кишечника может вызывать функциональную изжогу или диспепсию, более дистальное поражение — синдром раздраженного кишечника, функциональный запор или функциональную диарею).
КРФ = кортикотропин-рилизинг фактор, АКТГ = адренокортикотропный гормон, Ig = иммуноглобулин, IL = интерлейкин, TH = Т-хелперная клетка.
Новые данные ставят под сомнение концепцию о том, что пути «кишечник-мозг» действуют одинаково у всех пациентов с ФН ЖКТ. Независимые эпидемиологические исследования [43–45] показывают, что в 50 % случаев ФН ЖКТ начинаются с психологического стресса, за которым следуют желудочно-кишечные симптомы, в то время как в других 50 % случаев сначала возникает дисфункция кишечника, а затем наступает психологический стресс. Это наблюдение привело к гипотезе о том, что у некоторых пациентов патологический процесс начинается в желудочно-кишечном тракте и в первую очередь управляется им, что впоследствии вызывает системные проявления, включая психологическую дисфункцию как неотъемлемую часть патологического процесса. Кроме того, были определены вероятные микробные причины; Helicobacter pylori является общепризнанной причиной функциональной диспепсии, поскольку у некоторых пациентов излечение заболевания занимает длительное время после успешной эрадикации инфекции [46], а после гастроэнтерита может возникать или сохраняться впервые возникший СРК и/или функциональная диспепсия [47, 48], хотя гастроэнтерит как провоцирующий фактор выявляется в анамнезе лишь в редких случаях [49, 50].
Кроме того, в поддержку важности скрытой желудочно-кишечной патологии, лежащей в основе ФН ЖКТ, в разных подгруппах пациентов было выявлено неспецифическое воспаление кишечника (характеризуется преобладанием эозинофилов с инфильтрацией тучными клетками или без нее), повышенная проницаемость кишечника, изменения микробиома и активация иммунной системы (характеризуется циркулирующими Т-клетками, происходящими из тонкой кишки, и цитокиновым ответом) [51–53]. В свою очередь, имеются данные, указывающие на то, что неспецифическое воспаление кишечника может изменять структуру и функции нейронов, вероятно, вызывая висцеральную гиперчувствительность и моторную дисфункцию желудочно-кишечного тракта [54]. Более того, рефлекторные реакции кишечника могут затем изменять функцию более проксимальных отделов ЖКТ, потенциально вызывая задержку опорожнения желудка, ухудшение аккомодации дна желудка или усиление преходящей релаксации нижнего пищеводного сфинктера, что может объяснять различные ФН ЖКТ у одного пациента [55].
Ожидается, что активация иммунной системы кишечника будет чаще наблюдаться у женщин, будет связана с риском атопических и аутоиммунных заболеваний, а также будет колебаться с течением времени, возможно, с учетом вариабельности симптомов, все из которых наблюдаются при функциональной диспепсии и СРК [27]. Большинство пациентов с СРК и функциональной диспепсией имеют симптомы, связанные с приемом пищи [56, 57]. Отдельные компоненты пищи, возможно, в некоторых случаях подвергаясь аберрантному взаимодействию с микробиомом, могут приводить к презентации антигена в верхних отделах кишечника, инициируя активацию иммунной системы [58]. В других случаях реакция на стресс, управляемая централизованно, может быть первичным процессом заболевания, изменяющим функцию кишечника через гипоталамо-гипофизарно-надпочечниковую ось, вызывая нарушение взаимодействия «мозг-кишечник» [59]. Неблагоприятные события в раннем возрасте, возможно, приводящие к эпигенетическим изменениям, могут объяснить симптомы хронического характера и висцеральную гиперчувствительность у отдельных пациентов [60]. Эта модель заболеваний кишечника, обусловленных взаимодействием кишечника и мозга, является проверяемой и имеет значение для лечения, поскольку она потенциально способна выявить патогенетические пути, которые можно будет прервать. Это можно осуществить путем исключения пищевых антигенов, специфических манипуляций с микробиомом или целенаправленной иммунотерапии. В будущем эти методы могут дать надежду на излечение, а не только лишь на симптоматическую терапию.
Диагностика
Ценность выявления других диагнозов, таких как целиакия или воспалительные заболевания кишечника, которые могут проявляться сходными симптомами, заключается в том, что для разных состояний эффективны совершенно разные методы лечения. Тем не менее, процесс дифференциальной диагностики требует хорошей клинической оценки с учетом риска, связанного с избыточным исследованием [13]. Опытные клиницисты могут определить, какие пациенты нуждаются в дальнейшем обследовании. Например, для студента колледжа, пришедшего в клинику первичной медицинской помощи с эпизодом спазмов в животе и диареей перед выпускными экзаменами, достаточно минимального обследования, или же врач может вообще не назначать обследования и только наблюдать за динамикой симптомов. И наоборот, пожилому пациенту с похожими симптомами, которые в течение нескольких месяцев усиливаются и сопровождаются потерей веса, потребуется дополнительное обследование, например колоноскопия, в т. ч. с визуализацией. Кроме того, характер обследования будет зависеть от имеющихся клинических признаков; при преобладающем болевом синдроме необходим иной набор исследований, чем при хронической диарее или рвоте.
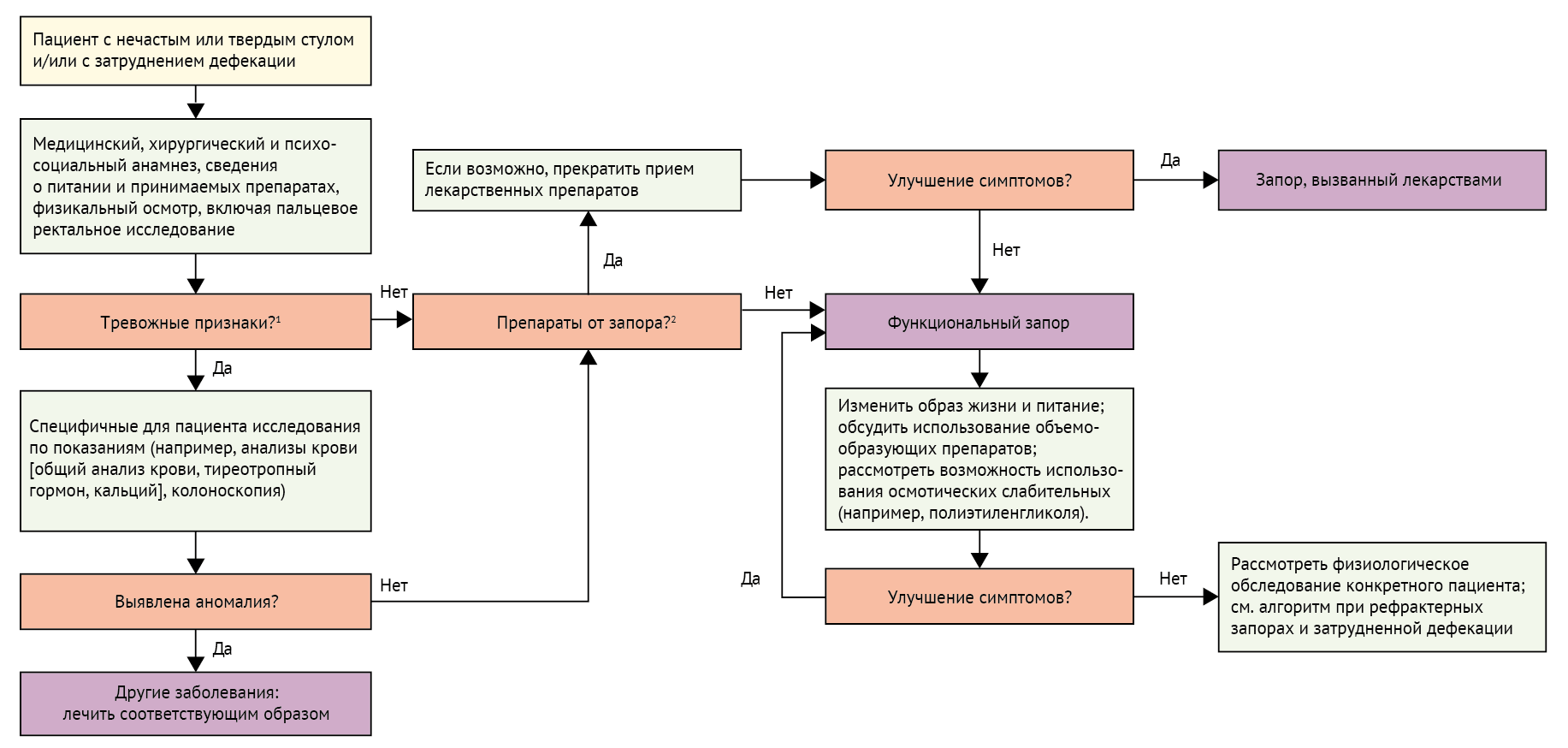
Наилучший способ провести экономически эффективное и целенаправленное диагностическое обследование — изначально учитывать конкретные клинические параметры. Факторы, которые могут привести к дополнительному обследованию, включают пожилой возраст (например, после 50 лет назначают колоноскопию), другие сопутствующие заболевания, более короткую продолжительность симптомов или ухудшение тяжести и течения болезни, отсутствие информации о предыдущих исследованиях или наличие тревожных симптомов или так называемых «красных флагов». Тревожные симптомы в определенной степени зависят от анатомической области и рассматриваемого диагноза; к ним относят потерю веса, рвоту кровью, постоянную рвоту, кровь в стуле, воспалительное заболевание кишечника или рак в семейном анамнезе, отклонения от нормы при физикальном обследовании или аномальные результаты лабораторных исследований, такие как анемия. Когда симптомы носят хронический характер, необходимость в повторном обследовании определяется появлением новых или изменением характера имеющихся клинических признаков или тревожных симптомов, а не увеличением частоты жалоб на симптомы. Одним из методов решения этих проблем является использование алгоритмов диагностики, разработанных Римским фондом [61]. В качестве примера на рисунке 3 представлен рекомендуемый алгоритм обследования пациентов с симптомами запора [61, 62].
Течение болезней и их последствия
ФН ЖКТ — это хронические заболевания. Хотя их симптомы вариабельны и часто связаны с приемом пищи [56, 57], частота жалоб на симптомы, как правило, остается неизменной с учетом того, что число людей, чьи симптомы исчезают, совпадает с числом людей, у которых развиваются новые симптомы [63–65]. Развитие впервые возникших симптомов у людей, которые симптомов ранее не имели, может указывать на двунаправленность путей «кишечник-мозг»; при этом более высокий уровень тревоги и депрессии связан с развитием СРК и функциональной диспепсии в ходе последующего наблюдения [44, 45, 66]. Тем не менее, в последующих продольных исследованиях среди пациентов, у которых симптомы сохранялись, также наблюдался переход между различными ФН ЖКТ [65, 67, 68]. Действительно, шведское исследование [15] показало, что симптомы варьировали у 40–60 % пациентов, в течение семи лет жаловавшихся на СРК, диспепсию, симптомы желудочно-пищеводного рефлюкса или незначительные симптомы, не отвечающие критериям ФН ЖКТ. Не менее часто наблюдается совпадение симптомов, так что у одного пациента с ФН ЖКТ могут наблюдаться как другие (два и более) ФН ЖКТ [69–71], так и другие необъяснимые с медицинской точки зрения состояния, такие как синдром хронической усталости [72] или фибромиалгия [73]. Распространенность тревоги и депрессии нарастает с увеличением числа одновременно присутствующих у пациента ФН ЖКТ, а также с частотой и тяжестью желудочно-кишечных симптомов [74]. Также часто встречается нарушение сна [75, 76], распространенность которого, похоже, также повышается с увеличением числа одновременно присутствующих у пациента ФН ЖКТ [75].
Тревогу вызывает тот факт, что около трети пациентов с ФН ЖКТ из-за наличия абдоминальных симптомов будут подвергаться ненужным хирургическим вмешательствам, включая холецистэктомию и гистерэктомию [4]. В одном из опросов 51 (23 %) из 223 пациентов с функциональной диспепсией сообщили о том, что перенесли хирургические операции, проведенные специально для изучения их симптомов, в том числе диагностические вмешательства [77]. Многомерный анализ с поправкой на множественные вмешивающиеся факторы, проведенный для изучения частоты хирургических операций среди пациентов с СРК, показал, что наличие СРК в три раза повышает шансы на проведение холецистэктомии, в два раза — аппендэктомии и гистерэктомии, а также на 50 % — операции на поясничном отделе позвоночника [78]. Такие вмешательства в сочетании с тем фактом, что две трети пациентов обращались к врачу в течение предыдущих 12 месяцев, и 40 % пациентов принимают лекарства от своих симптомов [4], значительно повышают и без того значительные затраты здравоохранения на лечение ФН ЖКТ [77, 79–81]. Хотя наличие функционального запора было связано с повышением риска смертности примерно на 20–30 % [82, 83], это, по-видимому, не относится к другим ФН ЖКТ. Тем не менее, частота этих состояний поражает. Пациенты говорят о негативном влиянии заболеваний на их трудоспособность, указывают на большое количество вынужденных невыходов на работу или снижение продуктивности труда ввиду болезни, а также на ухудшение способности к социализации [81]. Таким образом, мы видим существенное негативное воздействие ФН ЖКТ на качество жизни [3, 81].
Тактика ведения
Общие принципы лечения основаны на биопсихосоциальном понимании состояний [36] и связаны с нарушением регуляции оси «кишечник-мозг». ФН ЖКТ определяются любой комбинацией нарушения моторики, висцеральной гиперчувствительности, иммунной функции и изменений слизистой оболочки, микробиоты кишечника и обработки сигналов в ЦНС [20]. Таким образом, симптомы пациентов, соответствующие Римским критериям IV для ФН ЖКТ, могут быть вариабельными и находиться под влиянием различных комбинаций этих факторов. Так, например, у пациента, отвечающего критериям наличия СРК, может быть вздутие живота, связанное с неправильным перевариванием пищевых компонентов, таких как ферментируемые олигосахариды, дисахариды или моносахариды и полиолы (FODMAP), боль и диарея, связанные с висцеральной гиперчувствительностью, нарушение иммунной регуляции слизистой оболочки после бактериальной инфекции (постинфекционный СРК) или тревога и боль, вызванные центральной дисрегуляцией боли и связанные с посттравматическим стрессовым расстройством, возникшим после сексуальной или физической травмы. Поскольку клинический профиль и степень тяжести могут меняться с течением времени, проницательный врач должен определить, какие из этих факторов по отдельности или в комбинации являются целями для лечения. Есть несколько принципов, которые следует учитывать при начале лечения.
Отношения между пациентом и медицинским работником
Панель 2 | Рекомендации по установлению эффективных отношений между пациентом и медицинским работником
Профиль симптомов
Тип симптомов, их локализация и определяющие физиологические факторы будут влиять на лечение. Некоторым пациентам будет достаточно простых недорогих методов лечения, таких как слабительные или противодиарейные средства, хотя доказательная база для этих методов лечения ограничена. Метаанализы, основанные на исследованиях и базах данных, показали, что при функциональном запоре или СРК с запором эффективны такие препараты, как линаклотид * или лубипростон * (действующие как стимуляторы секреции через ионные каналы кишечника) или прокинетики, такие как прукалоприд или тегасерод (действующие через 5-HT серотониновые рецепторы) [88–90]; в случае диареи при СРК полезны рифаксимин (минимально абсорбируемый антибиотик), алосетрон * или ондансетрон (антагонисты 5-HT3 серотониновых рецепторов) или элуксадолин (агонист μ- и κ-oпиоидных рецепторов и антагонист δ-oпиоидных рецепторов) [91, 92]. Однако при сильной сопутствующей боли в животе рекомендовано лечение антидепрессантами или препаратами, направленными на ЦНС, т. н. центральными нейромодуляторами [93, 94]. Если боль локализована в прямой кишке (например, при синдроме мышцы, поднимающей задний проход) возможно лечение с помощью биологической обратной связи [19]. Клиницисту необходимо определить, какие симптомы являются доминирующими и какие методы лечения с наибольшей вероятностью приведут к улучшению.
* В России разрешение на применение не имеет — прим. перев.
Психосоциальные особенности
Ось «кишечник-мозг» является основой двунаправленной взаимосвязи, при которой желудочно-кишечные симптомы влияют на психосоциальное состояние, и наоборот. Таким образом, хроническая боль, тошнота или рвота могут привести к тревоге или депрессии в зависимости от раннего опыта, преодоления трудностей, а также влияния социума и семьи. И наоборот, психосоциальные трудности, включая сопутствующую тревожность, депрессию, серьезную утрату или сексуальную или физическую травму в анамнезе, влияют на болевой порог и моторику желудочно-кишечного тракта. Эта связь оправдывает использование поведенческих методов лечения желудочно-кишечного тракта, таких как когнитивно-поведенческая терапия или гипнотерапия [95].
Хотя сопутствующие психосоциальные заболевания могут определять необходимость поведенческой терапии для лечения желудочно-кишечного тракта, успех лечения определяется осознанием пациентом его ценности и мотивацией к участию [96]. Лучшие кандидаты на поведенческую терапию для заболеваний желудочно-кишечного тракта понимают природу расстройств взаимодействия «кишечник-мозг», открыты для изменения поведения с целью облегчения симптомов, могут установить связь между стрессом/тревогой и симптомами, а также имеют время для участия в терапии. Пациенты с тяжелой психопатологией или расстройством личности, которые плохо понимают взаимодействие кишечника и мозга, которые зациклены на лечении или же которые не могут или не хотят принимать участие в лечении, вряд ли получат пользу от терапии [95].
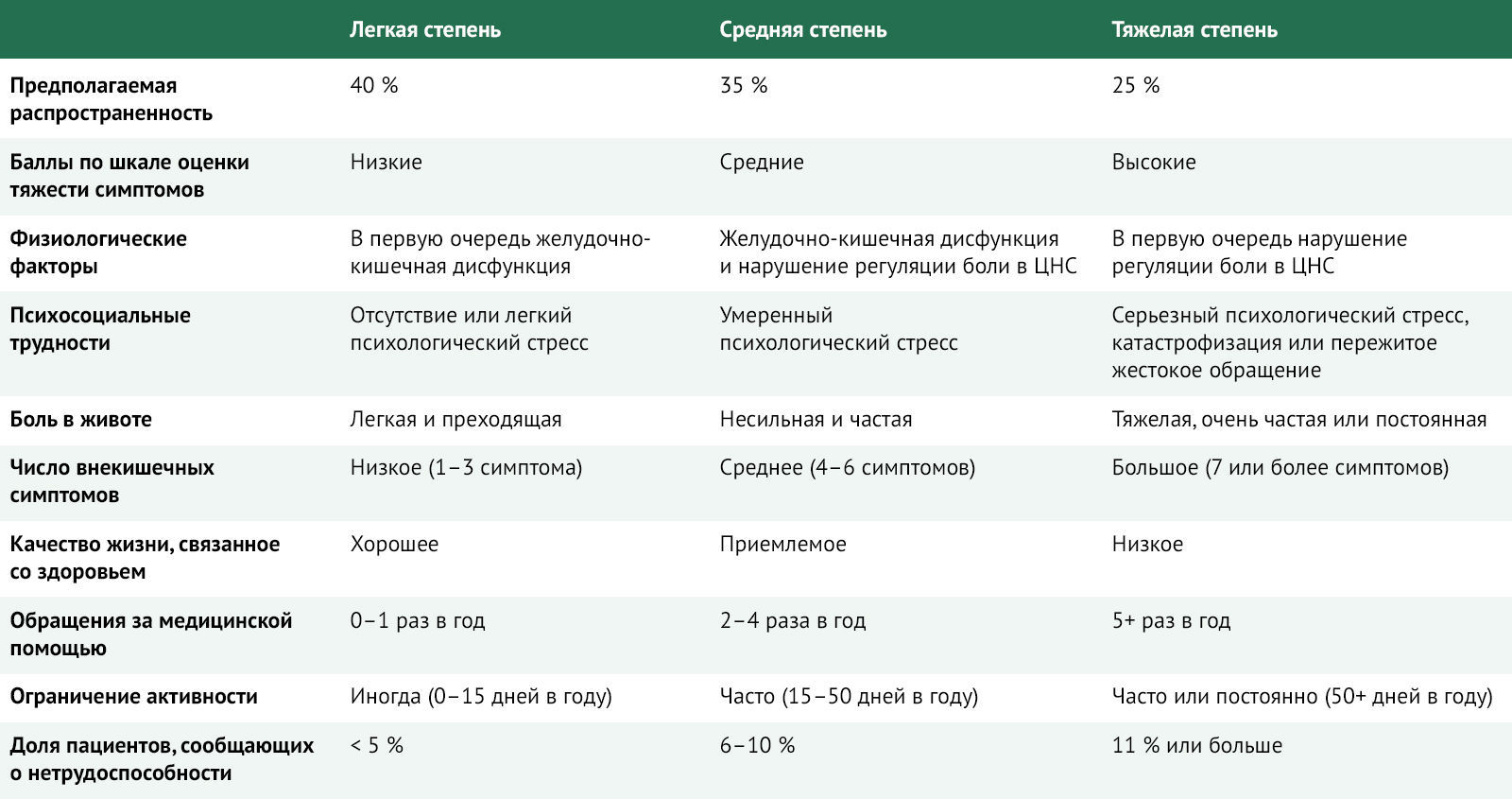
Тяжесть симптомов
Степень тяжести — это биопсихосоциальная комбинация жалоб пациента на желудочно-кишечные и внекишечные симптомы, степени боли, инвалидности, психосоциальных нарушений, восприятия болезни и связанных с болезнью поведения и изменения качества жизни [97]. Степень тяжести имеет значение при принятии решения о лечении. Например, пациент, имеющий нечастые слабо выраженные боли в животе без каких-либо других симптомов и без психологического стресса, вряд ли обратится за лечением, и даже в случае обращения его симптомы будут определены как легкие, не требующие лечения. И наоборот, пациент, страдающий сильной болью в животе, наряду с фибромиалгией и мигренью, который не может работать, находится в депрессии и часто обращается за медицинской помощью или же госпитализирован, будет считаться страдающим тяжелыми симптомами и подвергаться лечению поведенческими методами и множественными медицинскими процедурами. Авторы статьи представляют руководство, разработанное рабочей группой Римского фонда, для оказания помощи в классификации степени тяжести ФН ЖКТ (таблица 2) [97].
Таблица 2 | Клинический профиль тяжести функциональных желудочно-кишечных расстройств [20, 97].
Таким образом, лечение ФН ЖКТ требует эффективных взаимоотношений между пациентом и медицинским работником, а также мультимодального подхода, который учитывает характер симптомов, их тяжесть, наличие сопутствующих психосоциальных заболеваний и (в сочетании) их воздействие на пациента. Многомерный клинический профиль, предложенный Римским фондом, учитывает эти факторы, чтобы помочь клиницисту оказывать помощь, ориентированную на личные потребности пациента [98, 99]. Пять компонентов этого профиля включают: категориальный диагноз (симптоматические критерии); клинический модификатор (например, СРК с запором, диареей или смешанный вариант, постинфекционная этиология и чувствительность к FODMAP); влияние на пациента (слабое, умеренное и тяжелое); психосоциальный модификатор (например, диагноз психолога, история потери или травмы); а также физиологическая дисфункция и биомаркеры (при наличии). Хотя в настоящее время эта модель имеет эвристическую ценность и продвигается в клиническом образовании [99], для обеспечения доказательной поддержки необходимы дополнительные исследования.
По мере того, как новые проверяемые модели патофизиологии ФН ЖКТ развиваются и улучшают наше понимание этих состояний, будущие подходы к лечению, вероятно, станут более персонализированными, основанными не только на симптомах, но и на лежащих в их основе патофизиологии и психологии.