Что значит опухоль неоперабельна
Неоперабельная опухоль головного мозга: современные подходы к лечению
Хирургическая операция – основной метод лечения больных с доброкачественными опухолями и один из наиболее эффективных способов борьбы с абсолютным большинством злокачественных новообразований, обнаруженных на ранних стадиях. Однако если патологический очаг находится в головном мозге, он может быть признан неоперабельным даже тогда, когда «ведет себя» неагрессивно, растет медленно и выявляется своевременно.
К неоперабельным опухолям головного мозга относят новообразования, удаление которых хирургическим путем связано с угрозой для жизни пациента, высоким риском его инвалидизации или резкого прогрессирования заболевания.
В том числе, такой диагноз может быть поставлен, если:
Чем больше из вышеперечисленных особенностей присуще конкретному новообразованию, тем выше вероятность, что в диагнозе может появиться фраза «неоперабельная опухоль головного мозга», которую человек нередко воспринимает, как приговор. Эти опасения нельзя назвать беспочвенными, ведь еще несколько десятилетий назад у такого пациента действительно было мало шансов победить болезнь или, хотя бы, замедлить ее развитие.
Причины неэффективности химиотерапевтического и лучевого лечения устаревшими методами
В связи с особой организацией и функциями центральной нервной системы, эффективность облучения опухоли мозга на традиционных радиотерапевтических установках была крайне низкой, равно как и польза от приема химиопрепаратов предыдущего поколения. Происходило это потому, что:
С появлением в арсенале нейроонкологов новых технологий, оборудования и препаратов ситуация кардинальным образом изменилась.
Современные подходы к лечению больных с неоперабельными опухолями головного мозга
Решить проблему с эффективным и безопасным лучевым лечением позволило внедрение в клиническую практику радиохирургических аппаратных комплексов Гамма-нож и Кибер-нож, систем TrueBeam и Triology с инновационными линейными ускорителями, томотерапевтических установок с многолепестковыми коллиматорами, а также открытие центров протонной терапии.
Выбор наиболее подходящего метода, аппарата и схемы лечения определяется с учетом особенностей технологии, опухоли и больного.
С помощью конформной лучевой терапии на установке TrueBeam STx можно быстро и эффективно разрушать неоперабельные новообразования большого размера и сложной формы
Современные препараты и схемы лечения и щадяще. Это дает возможность свести к минимуму вероятность и тяжесть побочных эффектов химиотерапии. Кроме того, в последнее время были синтезированы лекарства, способные успешно преодолевать гематоэнцефалический барьер.
Используемая технология дает надежду значительному числу пациентов с глубокорасположенными/труднодоступными опухолями головного мозга, которым было отказано в оперативном лечении, поскольку оно имело неоправданно высокий риск повреждения жизненно важных отделов головного мозга.
При этом также снижается риск инфицирования, не требуется длительного пребывания в стационаре (1 день по сравнению с 5-10 днями после открытой операции на головном мозге), уменьшается время восстановления, практически не требуется удаления волос и почти не остается рубцов.
Профессор K.Ashkan, нейрохирург клиники Харли Стрит, одной из наиболее авторитетных онкологических клиник Великобритании, подчеркнул, что: «Технология Visualase объединяет лазерную хирургию и робототехнику с использованием принципа «замочной скважины». Точность лазерной абляции обеспечивается МРТ-контролем в реальном времени и роботизированной системой управления ROSA. Гибкий катетер диаметром 1,65 мм и неглубокий костный фиксатор обеспечивают широкий хирургический доступ. Все это позволяет безопасно лечить опухоли головного мозга в местах, которые ранее считались недоступными. Минимально инвазивный характер вмешательства позволяет быстро восстановиться после терапии с минимальной продолжительностью пребывания в больнице. Visualase будет полезен пациентам с целым рядом неврологических и нейрохирургических расстройств, особенно с эпилепсией и опухолями головного мозга».
Таким образом, сегодня шанс на выход в ремиссию с сохранением качества жизни есть даже в самых тяжелых ситуациях – в том числе и у больных, ранее считавшихся безнадежными.
Немного о терминах и ошибочных выводах
У не имеющих медицинского образования пациентов или их родственников иногда возникают сомнения в необходимости удаления опухолевого узла с помощью радиохирургической установки. Связано это с тем, что во врачебном заключении не написано (и не может быть написано) «неоперабельный рак головного мозга», а идет речь об опухоли, новообразовании, очаге неопластического роста и др. Особенно много вопросов вызывает обоснованность облучения доброкачественной опухоли.
В данном случае людей вводят в заблуждение особенности медицинской терминологии. Нужно иметь в виду, что в тканях мозга нет клеток эпителия, которые способны переродиться и дать начало истинной раковой опухоли – карциноме. То есть, рака мозга как такового не существует. Но данное обстоятельство отнюдь не означает, что обнаруженный очаг безобиден. Напротив, высокозлокачественные опухоли мозга отличаются крайне агрессивным «поведением», хотя и не относятся к раковым.
Более того, в ряде случаев доброкачественные узлы могут доставлять не менее серьезные проблемы. Например, если они нарушают кровообращение, сдавливают центры нервной и нейрогуморальной регуляции.
Прогнозы
Эффективность лечения больных с неподлежащими удалению новообразованиями мозга зависит от ряда факторов, среди которых:
Если вам требуется второе мнение для уточнения диагноза или плана лечения, отправьте нам заявку и документы для консультации, или запишитесь на очную консультацию по телефону.
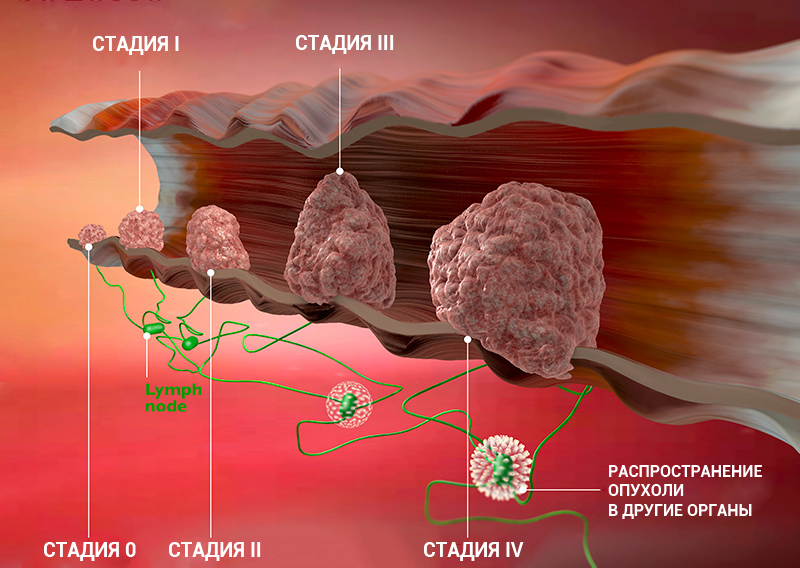
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Что значит опухоль неоперабельна
а) Терминология:
1. Сокращения:
• Немелкоклеточный рак легкого (НМРЛ)
• Мелкоклеточный рак легкого (МРЛ)
2. Определение:
• Рак легких, при котором хирургическое вмешательство не приведет к улучшению показателей выживаемости: клинические стадии IIIB и IV
б) Лучевые признаки неоперабельности рака легкого:
1. Основные особенности:
• Оптимальный диагностический ориентир:
о Стадия поражения лимфатических узлов N3 или наличие отдаленных метастазов служат поводом для отказа от проведения хирургического вмешательства
2. Рентгенография:
о Солитарный узелок ( 3 см)
о Лимфаденопатия корня легкого и средостения на противоположной стороне:
— Утолщенные паратрахеальные полосы, патологические изменения аортолегочного окна, области бифуркации трахеи, расширение средостения
о Плевральный выпот
о Метастаз в костной ткани
3. КТ:
• КТ с контрастным усилением:
о Т4: инвазия структур средостения, тел позвонков, наличие отдельных опухолевых узелков (узелка) в другой доле первично пораженного легкого
о N3: прескаленные, надключичные лимфатические узлы, лимфатические узлы средостения или корня легкого на противоположной стороне размером > 1 см по короткой оси
о M1a: наличие отдельных опухолевых узелков (узелка) в контралатеральном легком, солидных метастазов в плевре или злокачественного плеврального выпота
о M1b: Отдаленный метастаз (метастазы)
— В надпочечниках (40%), в печени (30%), костях (20%), головном мозге (10%)
о Для постановки точного диагноза необходимо проведение биопсии узелка или цитологического анализа плевральной жидкости
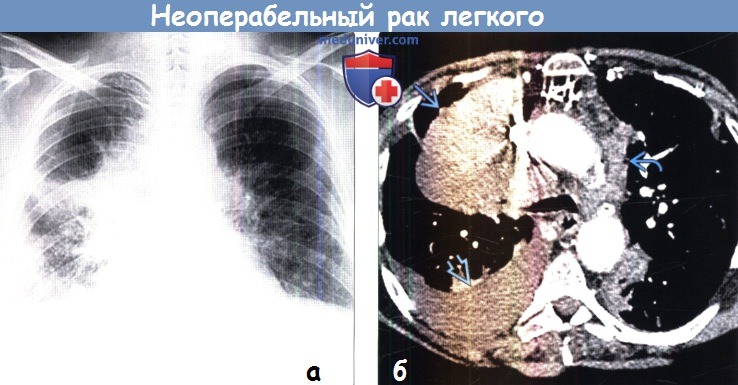
(б) У того же пациента при КТ с контрастным усилением визуализируются объемное образование с дольчатым контуром размером 12 см вблизи корня правого легкого, лимфаденопатия средостения с противоположной стороны и злокачественный плевральный выпот справа.
Также были выявлены узелки в контралатеральном легком и метастаз в головном мозге, что соответствует клинической стадии IV (Т4, N3, М1b). 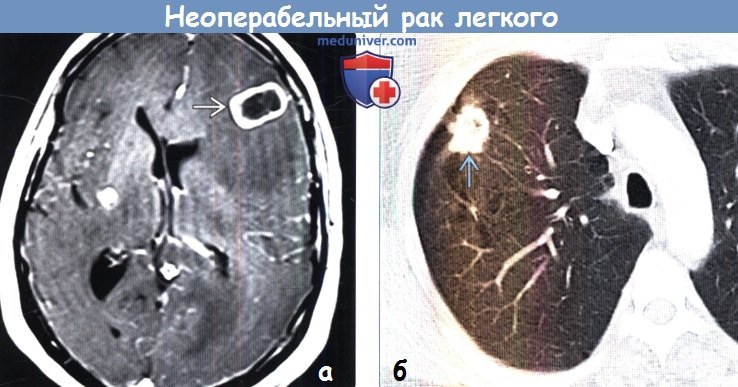
(б) У той же пациентки при КТ с контрастным усилением в верхней доле правого легкого определяется объемное образование с дольчатым контуром размером 3 см.
Был выявлен неопределенный узелок в надпочечнике (не показан), который поданным биопсии является метастазом аденокарциномы легкого. Картина соответствует стадии IV (T1b, N0, M1b).
Была проведена химиолучевая терапия, однако пациентка прожила всего два месяца. 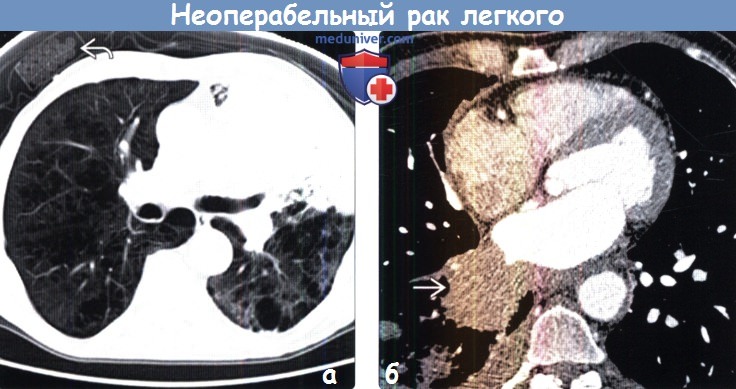
Сигареты в кармане пациента свидетельствуют о том, что он продолжает курить. При биопсии под контролем КТ был выявлен мелкоклеточный рак легкого.
(б) У мужчины 44 лет с плоскоклеточным раком при КТ сердца в нижней доле правого легкого визуализируется объемное образование, инвазирующее сердце, что соответствует нерезектабельному раку легких.
4. Методы медицинской радиологии:
• ПЭТ/КТ:
о Метод выбора для выявления метастазов за пределами грудной клетки и средостении с целью стадирования:
— 24% пациентов, которым предполагалось выполнять хирургическое вмешательство, было отказано в его проведении по результатам сканирования
— Характеризуется низкой чувствительностью при выявлении метастазов в головном мозге
о Используется для контроля эффективности терапии
5. МРТ:
• Метод выбора для выявления метастазов в головном мозге, печени и надпочечниках
о Метастазы в головном мозге: патологическое образование (образования) с кольцевидным контрастированием о Последовательности МРТ с химическим сдвигом могут использоваться для дифференцирования метастазов в надпочечниках и доброкачественных аденом:
— Отсутствие потери сигнала на Т1ВИ в противофазе указывает на наличие метастаза
— Чувствительность: 100%; специфичность: 81 %
• Используется для оценки вовлечения в опухолевый процесс миокарда, средостения, сосудов, плечевого сплетения или тел позвонков
6. Ультразвуковое исследование:
• Используется для наведения при торакоцентезе или биопсии
7. Рекомендации к проведению лучевых исследований:
• Оптимальный метод
о КТ с контрастным усилением представляет собой метод выбора для первичной оценки узелка и первичного стадирования о ПЭТ/КТ и МРТ являются оптимальными методами для выявления метастазов
в) Дифференциальный ряд заболеваний:
1. Аденокарцинома:
• Узелок, объемное образование солидное, частично солидное или с изменениями по типу «матового стекла»
• Контур спикулообразный, неровный или дольчатый
2. Плоскоклеточный рак:
• Объемное образование центральной локализации, часто с наличием полостей
3. Мелкоклеточный рак:
• Крупное объемное образование центральной локализации, инва-зирующее корень легкого и средостение и часто метастазирующее в лимфатические узлы
1. Основные особенности:
• Генетические:
о У лиц, не куривших на протяжении всей жизни, существует большая вероятность развития мутации в гене эпидермального фактора роста (EGFR):
— Высокая эффективность применения ингибиторов тирозин-киназы
2. Стадирование, определение степени дифференцировки и классификация опухолей:
• Применимо к стадированию НМРЛ, МРЛ и карциноиду бронха
3. Микроскопические особенности:
• Аденокарцинома:
о Муцинозная или немуцинозная с формированием желез; ацинарная или со стелющимся характером роста
• Плоскоклеточный рак:
о «Раковые жемчужины», межклеточные десмосомные мостики
• Мелкоклеточный рак:
о Мелкие клетки округлой формы, скудная цитоплазма, высокий уровень митотической активности


д) Клинические аспекты неоперабельного рака легкого:
1. Проявления:
• Наиболее частые признаки:
о Кашель, одышка, гемофтиз
о Рецидивирующая пневмония
о Потеря веса
• Другие признаки:
о Боль вследствие инвазии грудной стенки
о Изменение психического состояния или припадки, обусловленные метастазами в головном мозге
о Синдром верхней полой вены
о Охриплость вследствие инвазии возвратного гортанного нерва
о Синдром Панкоста: нейропатическая боль в верхней конечности, птоз, миоз, энофтальм, ангидроз
о Паранеопластические синдромы, чаще при МРЛ
• Клинический профиль:
о Курящие или курившие лица составляют >85% пациентов
2. Демографические данные:
• Пол:
о М: Ж = 2:1
е) Диагностические аспекты. Ключевые моменты диагностического заключения:
• Врач лучевой диагностики играет важную роль в выявлении потенциально не резектабельной опухоли
ж) Список литературы:
1. Betancourt-Cuellar SL et al: Pitfalls and limitations in non-small cell lung cancer staging. Semin Roentgenol. 50(3): 175-82, 2015
Редактор: Искандер Милевски. Дата публикации: 27.1.2019
Роман Комаров: «Нерезектабельных опухолей не бывает»
Роман Николаевич, можно ли поставить на поток операции сверхбольшого объёма?
Сверхсложные и сверхобъёмные операции, которые выполняют в клинике Сеченовского университета, можно отнести к условной категории «хирургия без границ». Условной потому, что в стандартах оказания медицинской помощи в РФ такие операции не предусмотрены, хотя в реальной жизни необходимость в них возникает регулярно. Очередной такой случай стал очередным поводом к разговору с руководителем кафедры факультетской хирургии N1, директором клиники факультетской хирургии им. Н.Н.Бурденко Первого МГМУ им. И.М. Сеченова доктором медицинских наук, профессором Романом Комаровым. Оттолкнувшись от конкретной клинической ситуации, мой собеседник дал прогноз на будущее: какое место в нём отведено симультанной хирургии, и может ли один универсальный специалист заменить мультидисциплинарную хирургическую команду?
Итак, в клинику Первого МГМУ поступил пятидесятилетний житель Краснодара со злокачественным новообразованием головки поджелудочной железы. Диагноз был выставлен по месту жительства полтора года назад, он оказался, можно сказать, случайной находкой: первым поводом для обращения мужчины к врачу стала внезапно развившаяся желтуха, никаких иных симптомов болезни до этого он не испытывал. За прошедшие месяцы пациент перенёс 23 курса химиотерапии, которые не привели к стабилизации процесса. Хирургическое лечение пациенту не проводилось. В нескольких онкологических центрах, куда обращался больной, формальным основанием к отказу от оперативного вмешательства называли инкурабельность опухоли: она проросла в ворота печени, желудок, поперечную и восходящую ободочные кишки, двенадцатиперстную кишку, магистральные сосуды, то есть, фактически заполнила собой верхний отдел брюшной полости.
— Около ста лет назад один из гигантов отечественной хирургии Владимир Андреевич Оппель сказал: «Да, вы вылечили больного от рака, но это стоило ему жизни». В этих словах, безусловно, заключается большой смысл: да, вы убрали опухоль, но возникли послеоперационные осложнения, которые привели к смерти больного. Однако осознание возможности такого исхода нередко подкашивает энтузиазм многих врачей. Они считают, что им предстоит «хирургическая авантюра», которая сопровождается большими рисками, прежде всего, для самого пациента после такого рода, вульгарно говоря, «бульдозерных» операций. И это их останавливает.
— Самое важное, что требуется клинике для развития такого рода хирургии – команда врачей разных специальностей, которые располагают большим опытом выполнения стандартных онкологических операций и значительным опытом реконструктивной хирургии сердца и сосудов, потому что радикальная онкология и сосудистая хирургия неразделимы. При таком подходе риск осечки минимален. Общаясь с нашими зарубежными коллегами, мы выяснили, что у них та же проблема, что и в нашей стране: есть онкологический центр, там делают классные операции, но этот центр не располагает высокоинтенсивной сердечно-сосудистой хирургией. И наоборот: если это кардиоцентр, куда поступает пациент с раком той или иной локализации, то, как правило, начинаются сложности, поскольку там нет онколога.
— Не всегда. Конечно, есть раки, которые вообще не надо оперировать. Например, мелкоклеточный рак лёгкого: гистология опухоли такая, что даже если вы выполните лобэктомию или пневмонэктомию, отдалённый результат не будет отличаться от других вариантов лечения. Но при большинстве форм злокачественных новообразований, даже при местно-распространённых опухолях, которые проросли в окружающие органы и магистральные сосуды, часть пациентов можно успешно прооперировать.
Мы действительно видели разные комбинации болезней и получили опыт разного рода симультанных операций. К примеру, недавно прооперировали пациента со злокачественной опухолью пищевода и пороком митрального клапана, оказалось, что это первый в мировой практике случай одномоментного хирургического вмешательства с таким сочетанием заболеваний. Этому человеку тоже отказали в ряде лечебных учреждений, потому что при пороке митрального клапана выполнять большую онкологическую операцию нельзя: для больного опасен наркоз, может развиться отёк лёгких на операционном столе. В подобных ситуациях хирурги и анестезиологи онкоцентров связаны по рукам риском кардиальной катастрофы у онкологического больного, и пациентам отказывают в операциях. Данная сочетанная патология действительно неприятная, но, как теперь показывает наш опыт, она не является однозначным противопоказанием к хирургическому лечению: мы успешно выполнили пациенту одномоментную экстирпацию пищевода и протезирование митрального клапана из правой торакотомии.
— Стационаров, где практикуют подобную хирургию, в России считанные единицы. Причина только в отсутствии адекватного финансировании, или у коллег нет интереса к тому, что вы называете «бульдозерными» операциями?
Беседу вела Елена БУШ, обозреватель «МГ»
Лечение неоперабельного рака поджелудочной железы
МНИОИ имени П.А. Герцена – лидер в Российской Федерации, использующий высокотехнологичный, инновационный подход в лечении неоперабельного рака поджелудочной железы методом HIFU
Эффективное ультразвуковое лечение
Пациенты из любого региона РФ
Талон на ВМП, по платным услугам
Особенности лечения рака поджелудочной железы
Уникальный орган
Поджелудочная железа является уникальным органом у человека. Её по праву можно назвать координатором пищеварения. Она находится в зоне крайне рыхлой клетчатки, и при этом обильно кровоснабжается и иннервируется, так как именно в этом месте проходят основные кровеносные магистрали, крупные нервные стволы, пути обильного лимфоттока. Если в какой-либо части поджелудочной железы возникают злокачественные клетки, они очень быстро растут и метастазируют в окружающие ткани, по ходу кровеносных и лимфатических сосудов. К сожалению, на момент выявления опухоли хирургия в лечении рака поджелудочной железы часто (почти в 80% случаев) бывает бессильной, опухоль признается неоперабельной. И тогда, в качестве метода локального лечения может быть предложен инновационный метод HIFU- терапии.
В отдельных случаях HIFU-терапия используется у пациентов с операбельными опухолями, которые по тем или иным причинам не могут перенести операцию, например, из-за состояния сердечно-сосудистой системы.
Что такое HIFU-терапия
Ключевые преимущества HIFU-терапии в лечении
злокачественных опухолей в МНИОИ имени П.А. Герцена
Область применения HIFU-терапии в онкологии
Область применения метода
| На HIFU опухоли поджелудочной железы направляются пациенты с нерезектабельными опухолями, это опухоли III и IV ст., либо с потенциально резектабельными опухолями (I и II ст) у неоперабельных по соматическому статусу больных. Как правило, лечение производится в комбинации с химиотерапевтическим лечением. В МНИОИ им. Герцена П.А. за 2016-19 г.г. пролечено свыше 100 пациентов с ЗНО поджелудочной железы. Предварительные результаты двухлетнего наблюдения вдохновляют. Признаков перфорации полого органа, острого панкреатита зарегистрировано не было. |
| HIFU выполняется при наличии гепато- или холангиокарциномы у неоперабельных больных (например при наличии сопутствующего цирроза печени или других тяжелых коморбидных состояний) При вторичных, метастатических опухолях необходимо рационально подходить к выбору этого вида лечения: очаги должны быть единичными, а не множественными, с тотальным или субтотальным поражением обеих долей печени; очаги должны быть доступны для абляции. Поэтому всегда необходима предварительная разметка на аппарате HIFU. |
| C помощью HIFU можно успешно лечить как доброкачественные опухоли, так и злокачественные опухоли молочных желез в случае неоперабельности больной по соматическому статусу или категорическом отказе пациентки от операции. Ограничением к лечению является расположение опухоли непосредственно за соском, а также прорастание опухоли в кожу. С 2012 по 2017 год было пролечено 16 пациенток с фиброаденомами и 12 пациенток с ЗНО. Пациентки с пролеченными фиброаденомами успешно наблюдаются. Продолженного роста фиброаденом не наблюдается. Пациенткам со злокачественными опухолями в разные сроки после HIFU проводилась мастэктомия, либо резекция молочной железы. Процент полной абляции ЗНО составил 60-100%. Все пациентки с ЗНО молочных желез живы, в ремиссии. Осложнений в практике МНИОИ имени П.А. Герцена не наблюдалось, косметический эффект операции оценивался пациентками как превосходный. |
| HПроводится редко, так как в преобладающем большинстве случаев такие больные оперируются. Однако в случае наличия противопоказаний к операции метод HIFU может быть эффективно использован. |
| Наибольшее распространение в мире HIFU получило именно в области лечения миомы матки. В настоящее время метод получил подтверждение европейских и американских профессиональных сообществ в качестве альтернативного хирургическому методу лечения. Показанием к лечению является симптомная миома или аденомиоз (метро-меноррагии, болевой синдром, дизурические явления, связанные с крупной миомой) и желание женщины сохранить матку. Наиболее часто к HIFU обращаются женщины с сохранной детородной функцией, желающие сохранить матку и иметь детей, а также женщины пременопаузального периода с тяжелой клинической симптоматикой миомы или аденомиоза, отказывающиеся от оперативного вмешательства. Противопоказанием для HIFU являются гиперинтенсивные при МРТ, гиперваскулярные при УЗИ узлы. В этих случаях возможен рецидив миомы. В случае рецидива лечение может повторяться. В практике МНИОИ имени П.А. Герцена с 2009 по 2014 год в группе из 110 пациенток наблюдалось два ожога кожи передней брюшной стенки 2 степени. |
| Оптимально использование специальных аппаратов с трансректальным лечебно-диагностическим модулем. В отдельных случаях (при наличии акустического доступа) лечение возможно и трансабдоминальным доступом на аппарате HIFU 2001. |
Условия проведения HIFU-терапии
Опухолевое образование при проведении ультразвукового обследования должно чётко визуализироваться, в течении сеанса пациент находится в неподвижном положении на животе в течение 30-40 минут, не допускаются к проведению сеанса больные с механической желтухой, тяжелой одышкой, периферическими отеками, большим количеством жидкости в брюшной полости, тяжёлой полиорганной недостаточностью.
Рекомендации пациентам
Для решения вопроса о лечении методом HIFU-терапии необходимо получить консультацию в поликлинике Института, после чего, возможно, будут назначены обследование или дообследование. Затем будет проведен междисциплинарный консилиум врачей, на котором будет принято решение об избранном методе лечения. Необходимо помнить, что лечение онкологических заболеваний методом HIFU-терапии выполняется по ОМС или по талонам ВМП (высокотехнологичная медицинская помощь) и финансируется из государственного бюджета.
Позвоните нам сегодня, чтобы мы смогли Вам помочь!
8 (495) 150 11 22
Госпитализация по ОМС возможна только в случае, когда пациент обследован в необходимом объёме, что должно быть подтверждено медицинским документами, и при отсутствии противопоказаний. + 7 499 165 92 52 (отдел госпитализации)
Контактная информация
+7 (495) 150-11-22
Единая справочная служба
125284, г. Москва, 2-й Боткинский пр., д.3
Прием на консультацию: c 10:00 до 14:00
Время работы: с 8:30 до 17:15 (по будням)
Часы посещения пациентов в стационаре:
с 16:00 до 20:00 (ежедневно)
Часы работы приемного отделения:
с 9:00 до 15:00