Что значит негативный в отношении злокачественности материал это интраэпителиальных поражений
Что ПАП-мазок может показать, классификация заключений, расшифровка ПАП-мазка
Проведение ежегодной диспансеризации позволяет выявить отклонения, хорошо поддающиеся коррекции. Лечение малых проблем и назначение соответствующей профилактики позволяют укрепить здоровье, обеспечить долгую и полнокровную жизнь. И.И.Гузов, к.м.н., главный врач ЦИР
Результаты ПАП-мазка могут указывать на доброкачественные изменения клеток, в том числе, инфекции, реактивные (воспалительные) изменения, атрофические изменения и злокачественные поражения.
В первую очередь оценивается качество мазка: исследуют только мазки достаточного качества.
К другим составляющим образцов относятся лейкоциты, эритроциты и другие клетки крови, слизь, флора и другие, более редкие, компоненты.
Число и тип клеток в мазке зависит от возраста и гормонального статуса женщины. Мазок должен содержать достаточное количество видимых клеток плоского эпителия, чтобы быть признанным мазком удовлетворительного качества.
В конце практически всегда указывается заключение. В разных странах используются разные цитологические классификации. Наиболее распространена классификация Bethesda (Бетезда) разных лет утверждения (The Bethesda System, TBS).
Заключение «NILM» — Negative for intraepithelial lesion or malignancy — говорит об отсутствии внутриклеточного поражения или злокачественности, то есть клетки не изменены, онкологической настороженности нет. По другой классификации это заключение звучит как «цитограмма без особенностей».
Возможные особенности цитограммы в пределах нормы — атрофический типа мазка, например, после родов или в связи с возрастными изменениями. Некоторые изменения эпителия также могут быть при беременности, при приеме гормональных контрацептивов.
Измениния, относящиеся к дисплазии, обычно появляются за несколько лет до развития инвазивного рака.
Общая классификация изменений плоского эпителия
Степени дисплазии по глубине поражения эпителия
Плоскоклеточный инвазивный рак: стадия уточняется при гистологическом исследовании после биопсии, подтверждается после операции.
Требуется дообследование и лечение, повторение анализа через несколько месяцев.
Необходимо дообследование, динамическое наблюдение, лечение.
В зависимости от степени поражения может быть рекомендовано: повторение ПАП-мазка, анализ на HPV, кольпоскопия, а по результатам и биопсия шейки матки.
Необходимо дообследование и лечение.
Изменения в железистом эпителии
Система классов — это устаревшая система классификации ПАП-мазков по Папаниколау
Также существуют классификации ВОЗ, обучающей программы европейской комиссии
Скрининг рака шейки матки
Изменения шейки матки при раке и предопухолевых состояниях часто протекают бессимптомно и обычный осмотр не всегда укажет на патологию. Скрининговые программы позволяют своевременно выявить изменения, определить причину и назначить лечение.
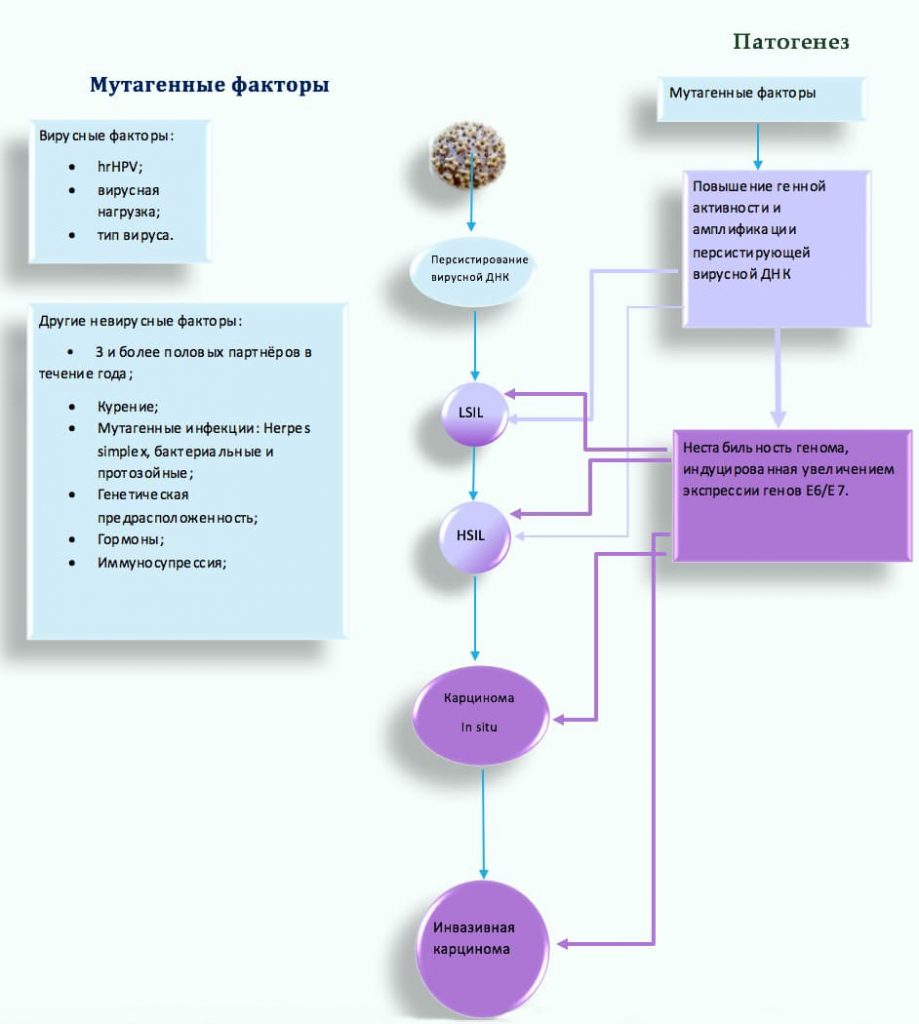
Предрасположенность к раку шейки матки определяется генетическими маркерами, но вклад в развитие патологии составляет не более 1% из всех случаев. Большое влияние оказывают внешние и внутренние факторы. Нарушения гормонального фона и питания ткани, локальное состояние иммунитета — определяют внутреннюю причину, по которой возникают предраковые изменения. Ранняя активная половая жизнь, частая смена половых партнеров и частые роды, применение гормонсодержащих контрацептивных препаратов, наличие ИППП в анамнезе являются внешними факторами риска развития рака шейки матки.
В 85% случаев рак шейки матки ассоциирован с ВПЧ.
ВПЧ и рак шейки матки
ВПЧ — ДНК-содержащий вирус. Вирус обладает родством к эпителиальным клеткам. После проникновения в клетки, вирус запускает синтез собственного генетического материала. Зараженные эпителиальные клетки начинают активно делится. Но из-за нарушений, клетки эпителия остаются незрелыми. Эпителиальный пласт не формируется должным образом. Возникает дисплазия.
В шейке матки в 90% случаев вирус может элиминироваться из организма благодаря внутренним резервам организма женщины. Но длительное нахождение вируса в клетках в 10% случаев провоцирует цервикальные интраэпителиальные неоплазии (CIN). Выделяют три гистологических класса CIN: легкой (CIN I), умеренной (CIN II) и высокой степени (CIN III), при переходе одной в другую вероятность формирования рака увеличивается. Дисплазии легкой степени (CIN I) в 90% случаев инволюционируют в нормальную ткань или остаются в неизменном виде, 10% прогрессируют в CIN II. CIN II трансформируются в CIN III в 1 случае из 10. При персистенции ВПЧ более 3-х лет на фоне дисплазии высокой степени развивается рак. Такая ситуация наблюдается у половины женщин с диагнозом инвазивный рак.
Существует около 200 видов ВПЧ, но не каждый тип способен вызвать поражения шейки матки. ВПЧ 16 и 18 типов обычно выявляются при цервикальной интраэпителиальной неоплазии CIN III и инвазивном раке, поэтому назван вирусом высокоонкогенного типа. ВПЧ 6 и 11 типа часто ассоциирован с CIN I и CIN II и обладает низким онкогенным потенциалом.
| Наличие дисплазии выявляется при проведении цитологического исследования по Папаниколау (ПАП-мазок). В ходе анализа изучаются особенности строения клеток, их морфология, расположения, после чего выдается заключение о наличии или об отсутствии атипии клеток. Для выполнения анализа материал должен быть получен с трех участков: влагалищной части шейки матки, цервикального канала и зоны трансформации. Зона трансформации — зона перехода многослойного плоского эпителия шейки матки в железистый эпителий цервикального канала. В зоне трансформации обычно начинаются предраковые изменения. |  |
Полученный материал переносится на предметное стекло и окрашивается, после чего врач-цитолог исследует образец под микроскопом. Если мазок, не содержит цилиндрический эпителий, то образец считается неинформативным и исследованию не подлежит.
Процесс забора мазка не стандартизован, поэтому могут быть получены ложноотрицательные результаты. Для того, чтобы избежать ложных ответов, нужно соблюдать правила забора образца. Ответственность лежит на медицинском персонале, результат зависит от квалификации человека.
Ответственность за правильную подготовку к исследованию лежит на пациенте. Перед сдачей мазка на цитологию женщина должна придерживаться простых правил подготовки:
В таком случае образец не будет содержать посторонних элементов, и лаборатория сможет выдать достоверное заключение.
Результат цитологического анализа
Цитологическая интепретация клеточного состава должна быть представлена лечащему врачу в клинически значимых терминах и определениях. Существует несколько цитологических классификаций. Наиболее распространенные это классификация по Папаниколау и Бетдеста.
В соответствии с классификацией Папаниколау мазки делятся на 5 типов:
Классификация Бетесда является международной. Она создана в качестве унифицированного инструмента передачи информации между врачами-цитологами и врачами-клиницистами.
В классификации Бетесда введен термин «плоскоклеточные интраэпителиальные поражения»(SIL), которые могут быть высокой и низкой степени (LSIL и HSIL соответственно). LSIL соответствует слабой дисплазии (CIN I) и папилломавирусной инфекции. HSIL объединяет умеренную (CIN II) и тяжелую дисплазии (CIN III), внутриэпителиальный рак.
Образец, в котором клетки трудно поддаются дифференцировке, и врач не может определить связаны ли изменения с дисплазией или это реактивное состояние, выводятся в класс ASC-US. При постановке такого диагноза пациентка должна находится под динамическим наблюдением.
Если врач-цитолог видит, что в эпителии присутствуют изменения доброкачественные и нет никаких настораживающих морфологических признаков, выводит в заключении NILM. NILM также обозначает норму и реактивные изменения.
Соответствия цитологических заключений: корреляция между классификацией дисплазией/карциномой in situ/, Bethesda system 2001 года и классификацией по Папаниколау.
Что значит негативный в отношении злокачественности материал это интраэпителиальных поражений
Исследование цитологических препаратов эпителия шейки матки, проводимое с использованием меченных флюоресцирующими веществами антител, которое позволяет выявить наличие и оценить степень присутствия на атипичных клетках специфичного маркера активности процессов клеточного деления.
Маркер пролиферации ki-67, оценка экспрессии онкопротеина ki-67 иммуноцитохимическим методом.
Marker Of Proliferation Ki-67, proliferation-related Ki-67 antigen, Ki-67 immunocytochemistry in liquid based cervical cytology.
Какой биоматериал можно использовать для исследования?
Аспират из полости матки.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Введение научно обоснованных программ скрининга позволило значительно снизить смертность от рака шейки матки, поэтому в настоящее время данный подход является одним из самых эффективных способов профилактики этого онкологического заболевания. Чаще всего скрининг включает в себя определение маркеров вируса папилломы человека (доказана связь рака шейки матки с ВПЧ-инфекцией) и цитологическое исследование. При этом диагностические возможности традиционного цитологического исследования весьма ограничены – по некоторым данным, его чувствительность составляет до 85%, он во многом лишен стандартизации, а достоверность результатов часто страдает по причине некачественного приготовления материала. В настоящее время золотым стандартом для диагностики патологии шейки матки считается метод жидкостной цитологии. Материал для исследования забирается цитощеткой, которая затем помещается в емкость со специальным консервирующим раствором. Он предотвращает преждевременное высыхание клеток, способствует сохранению их морфологических и молекулярно-биологических свойств, а также минимизирует содержание в образце постороннего материала (слизи, клеток периферической крови, элементов воспаления и разрушенных клеток). В дальнейшем с помощью специального оборудования изготавливается однослойный цитологический препарат, который врач-цитолог изучает под микроскопом. Характер патологических изменений, выявленных при цитологическом исследовании, оценивается в соответствии с общепринятой международной системой Bethesda – она представляет собой набор аббревиатур, используемых для обозначения цитологических заключений:
При выявлении по данным цитологического исследования интраэпителиальных изменений плоского эпителия низкой степени (LSIL), атипичных клеток плоского эпителия неясного значения (ASC-US) и атипичных клеток железистого эпителия (AGC) рекомендуется дополнительное обследование на содержание в атипичных клетках белка ki-67. Для анализа используется тот же материал, что и для жидкостной цитологии (однократное взятие биологического материала для исследования методом жидкостной цитологии позволяет проводить также и дополнительные диагностические исследования без повторных гинекологических манипуляций). Содержание белка ki-67 в атипичных клетках определяется с помощью иммуноцитохимического исследования. Для этого из взвеси клеток готовят мазки, которые затем окрашивают раствором антител, меченных флюоресцирующими метками, специфичными к ki-67. Если в опухолевой клетке присутствует искомый белок, антитела связываются с ним и при просмотре стекла под специальным микроскопом можно увидеть флюоресценцию, что будет свидетельствовать о положительном результате теста. Степень флюоресценции и процент клеток, в которых она есть, лежит в основе интерпретации результатов иммуноцитохимического анализа.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
В норме Ki‑67 определяется только в клетках нижних слоев плоского эпителия слизистой оболочки наружной части шейки матки. При дисплазии клетки, экспрессирующие Ki‑67, появляются в верхних слоях эпителия; данный маркер может экспрессироваться в значительной части клеток в очагах незрелой плоскоклеточной метаплазии.
Что может влиять на результат?
Соблюдение правильности техники взятия биологического материала для исследования.
Скрининг рака шейки матки: жидкостная цитология c ВПЧ-тестом (Roche Cobas 4800)
Цитологическое исследование мазков (соскобов) с поверхности шейки матки (наружного маточного зева) и цервикального канала на атипию
Жидкостная цитология. Исследование соскоба шейки матки и цервикального канала (окрашивание по Папаниколау)
Иммуноцитохимическое исследование соскобов шейки матки с определением белка р16
Human Papillomavirus низкого (HPV 6, 11, 44) и высокого (HPV 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) канцерогенного риска, ДНК (выявление, генотипирование и количественное определение) [реал-тайм ПЦР]
Антиген плоскоклеточной карциномы (SCCA)
Кто назначает исследование?
Диагностическая ценность иммуноцитохимического метода при ВПЧ-ассоциированных заболеваниях шейки матки. А. Р. Хачатурян, Е. К.Орехова, Г. Х. Толибова, Т. Г. Траль. Журнал акушерства и женских болезней. Выпуск 3, том LXIV, 2015. С. 47-51.
Скрининг рака шейки матки. Взгляд клинициста. Ю. Г. Паяниди, Л. Г. Комарова, В. П. Козаченко, В. В. Кузнецов, А. Ю. Кашурников, К. И. Жорданиа. Онкогинекология, №1, 2013. С. 35-41.
Sahebali S, Depuydt CE, Segers K, Vereecken AJ, Van Marck E, Bogers JJ. Ki-67 immunocytochemistry in liquid based cervical cytology: useful as an adjunctive tool? Journal of Clinical Pathology. 2003;56(9):681-686.
Цитологический скрининг рака шейки матки: вопросы терминологии
Актуальность вопроса терминологии, используемой в ходе проведения цитологического скрининга, обусловлена системным подходом к ведению пациентов и необходимостью врачей различных специальностей говорить «на одном языке» о той или иной патологии.
Цитологический скрининг РШМ берет свое начало с предложенного Г. Папаниколау цитологического исследования вагинального мазка, получившего название Пап-тест.
Трудоемкость методики окраски и высокая стоимость реактивов, используемых в оригинальной рецептуре окраски цервиковагинальных образцов по Папаниколау, привели к разработке других методик. В разных странах последователи морфологических школ используют различные методы окраски цитологических препаратов: метод Папаниколау и его модификации (Руденко, Куница, REAP); гематоксилин и эозин, азур-эозиновые смеси (по Паппенгейму, Романовскому, Лейшману, Diff-Quick). Однако применение различных способов окраски не меняет сути исследования, а может являться взаимодополняющим фактором.
В силу углубления представлений о патогенезе РШМ, установления роли вируса папилломы человека в этом процессе и для повышения чувствительности и воспроизводимости результатов скрининга в 1988 г. в Национальном институте рака США разработана и принята новая цитологическая классификация, получившая название терминологической системы Бетесда (ТБС). Классификация несколько раз пересматривалась (1991 г., 2001 г.) и нынче является наиболее широко используемой.
Основными пунктами ТБС являются:
Редакция ТБС 2001 г. предполагает 2 категории образцов: удовлетворительный и неудовлетворительный. Для классификации «удовлетворительный» образец должен содержать 8–12 тыс. хорошо визуализируемых клеток плоского эпителия в традиционном мазке и как минимум 5 тыс. клеток плоского эпителия в жидкостном препарате. К обозначению «удовлетворительный» обязательны комментарии цитолога о наличии или отсутствии элементов эндоцервикса или зоны трансформации. Последние должны быть представлены не менее 10 хорошо сохраненными эндоцервикальными или метаплазированными клетками. Отсутствие эндоцервикальных клеток отмечается цитологом, но не является критерием для классификации мазка как «неудовлетворительного», если материал из цервикального канала берется нецервикальной щеточкой у женщин в период менопаузы. В свою очередь, к категории «неудовлетворительный» относятся образцы, которые не могут быть обработаны в лаборатории, поскольку не подписаны или разбиты, а также образцы с малым количеством материала или более чем на 75% перекрытые элементами воспаления или эритроцитами.
Согласно цели скрининга — отбора пациенток для дообследования, все цервикальные образцы оценивают как:
Негативными являются образцы, в которых нет клеточных признаков неоплазии. При этом в них могут присутствовать:
Согласно представляемой классификации, неинвазивные, внутриэпителиальные патологические изменения плоского эпителия представлены поражениями низкой и высокой степени, поскольку в рамках скрининга принципиальное значение имеет установление степени риска перехода выявленных изменений в инвазивный рак, что и определяет тактику ведения пациентки. Разделение плоскоэпителиальных поражений на 2 группы вместо 3 (слабая, умеренная и тяжелая дисплазия — CIN I, CIN II, CIN III) обусловлено различным биологическим смыслом этих категорий: поражения низкой степени (LSIL) — это морфологическое проявление продуктивной вирусной инфекции, в то время как поражения высокой степени (HSIL) являются следствием трансформирующего действия вируса папилломы человека и носят молекулярно-генетические черты опухолевого процесса. Объединение в одну категорию умеренной, тяжелой дисплазии и карциномы in situ способствует повышению достоверности цитологических заключений и сведению к минимуму количества расхождений с патогистологическим исследованием, так как около 70% случаев поражения высокой степени носят полимофный, сочетанный характер. Отдельно выделены категории «атипичных клеток плоского эпителия»:
В отношении железистых поражений шейки матки цитологическое исследование имеет несколько ограниченную специфичность. Согласно ТБС, железистые поражения представлены атипичными эндоцервикальными/эндометриальными/железистыми клетками без дополнительного уточнения, атипичными эндоцервикальными/железистыми клетками с подозрением на неоплазию, эндоцервикальной аденокарциномой in situ, аденокарциномой эндоцервикальной/эндометриальной/внематочной/без дополнительного уточнения.
Позитивно зарекомендовавшая себя система ТБС, получив широкое распространение во всем мире, окончательно вытеснила из научной литературы и практического использования систему классов по Папаниколау, но не нашла применения в Украине — ни в системе последипломной подготовки врачей-цитологов, ни в практической деятельности большинства участников скрининга. Существующая нормативная база (Медична документація, форма № 215/о, затверджена наказом МОЗ України від 04.01.2001 р. № 1) ограничивает использование рассматриваемой терминологии. Это обстоятельство приводит к определенной путанице в интерпретации цитологических заключений и неадекватности ведения пациенток с патологией шейки матки. Отсутствие единой терминологической базы и критериев оценки также усложняет, а в ряде случаев делает невозможной и статистическую обработку данных, получаемых в разных учреждениях в рамках проведения скрининга.
Для устранения этих проблем представляется необходимым формирование рабочей группы, которая бы разрешила ряд связанных с этим задач, состоящих в:
Терминологическая система Бетезда(TBS-2014). Алгоритмы ведения пациенток

«В центре нашего внимания женщина, чьё предраковое поражение шейки матки должно быть диагностировано точно, быстро и полностью удалено, с тем, чтобы предотвратить развитие инвазивной карциномы и вернуть ей радость жизни».
История проблемы
«Я не мог убедить своих коллег в практичности процедуры».
Джорж Папаниколау, 1928 год.
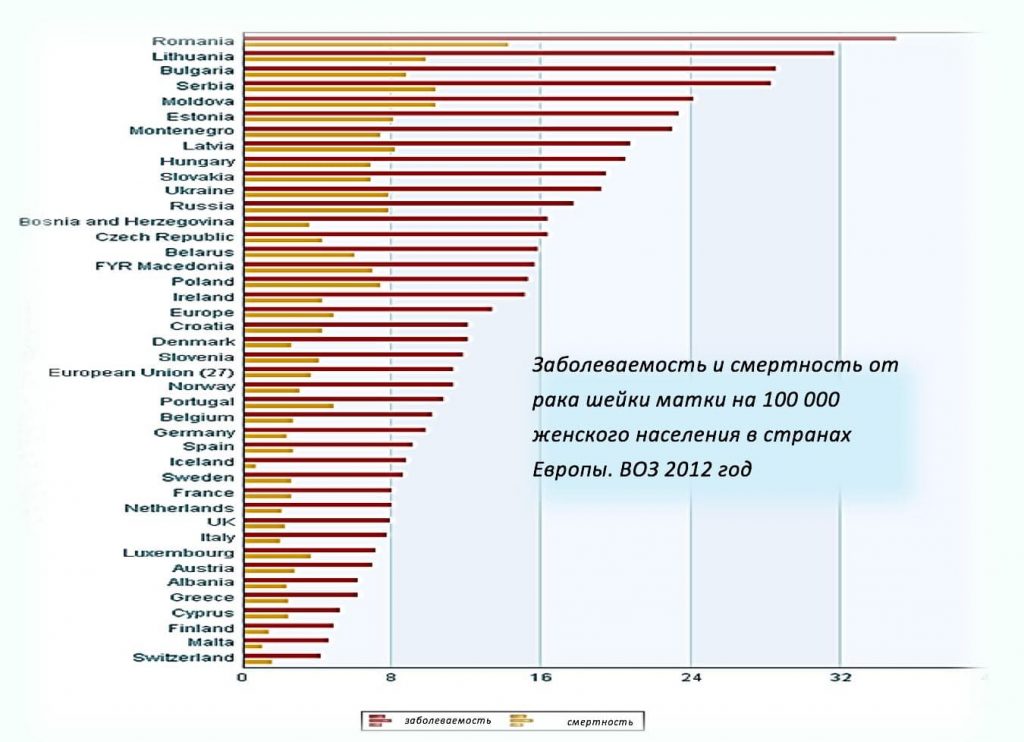
Эпидемиология рака шейки

По данным ВОЗ (2012):
Этиология

Рак шейки матки связан с персистированием ДНК вируса папилломы человека высокого риска (hrHPV). Согласно результатам мета-анализа (Li et al.2011) превалирование (hrHPV) обнаруживают в 85.9%-92.9% случаев рака. Аногенитальные типы HPV, вовлечённые в развитие карциномы и кондилом принадлежат к α-роду и подразделяются на два основных типа: hr (высокого риска) и lr (низкого риска).
lrHPV ассоциированы с кондиломами и транзиторной инфекцией. В большинстве случаев иммунная система, посредством апоптоза инфицированных клеток, элиминирует вирус lrHPV, а повреждения восстанавливаются регенерацией плоского эпителия.
hrHPV способен интегрироваться в ДНК человека и при отсутствии лечения вызывает карциномы урогенитальной и орофарингеальной области.
Частота выявления различных типов hrHPV при цервикальной карциноме в Европе
(de Sanjose et al.2010): HPV 16 – 66%, HPV 18 – 7%, HPV 33 – 6%,HPV 45 – 4%,HPV 31 – 3%.
При аденокарциномах наиболее часто выявляют: HPV 16,18,45.
Карциногенный эффект hrHPV необходимо рассматривать в контексте факторов риска, которые способствуют персистированию вируса:
Роль HPV и других факторов риска в онкогенезе
Формы существования ВПЧ в инфицированных клетках и ключевые, интегральные вирусные гены.
Ключевую роль в патогенезе играют:
P53 и Rb – белки, вовлечённые в процессы восстановления повреждённой ДНК и активации апоптоза клеток, с необратимыми структурными нарушениями генома.
Этапы развития инвазивной плоскоклеточной цервикальной карциномы
Инвазивной плоскоклеточной карциноме предшествует цервикальная интраэпителиальная неоплазия (CIN I,II,III).
CIN (I,II,III) – гистологические типы не инвазивной стадии заболевания, напрямую связанные с процессами инфицирования и интеграции ВПЧ, при которой аномальные клетки ограничены слоем эпителия.

ВПЧ16 и 33 характеризуются самым высоким риском прогрессии в CIN III.
ВПЧ 16 и 31 практически никогда не регрессируют.
Итак CIN I или LSIL – в большинстве случаев,
продуктивная или эписомальная стадия инфицирования ВПЧ.
CIN II, III или HSIL – интегративная или интросомальная стадии инфицирования ВПЧ.
Регуляция процесса деления (переход клетки из G1 в S фазу) нормальной эпителиальной клетки и при эписомальной инфекции ВПЧ
Нарушение регуляции клеточного деления при трансформирующей интросомальной инфекции ВПЧ
Избыточная экспрессия p16 высоко коррелирует с онкогенной трансформацией, вызванной персистирующим вирусом ВПЧ высокого риска (hrHPV).
В клетках эпителия, инфицированных трансформирующей hrHPV, онкопротеин вирусной ДНК E7 замыкает белок ретинобластомы, что нарушает образование комплекса pRb E2F. Это приводит к бесконтрольной пролиферации клеток эпителия, с вирусной ДНК, генетической нестабильности, гиперэкспрессии белка p16, которую выявляют при иммуноцитохимическом окрашивании жидкостных Пап-препаратов.
Таким образом, иммуноцитохимическое окрашивание на белок p16 позволяет:

А-LSIL (CIN I) – слабоположительное окрашивание.
Б-HSIL (CIN II) – умеренное окрашивание.
В-HSIL (CIS) – резко положительное окрашивание.
Г – HSIL (CIS) – резко положительное окрашивание. (И.П.Шабалова, К.Т. Касоян.2016).
Роль иммуногистохимического окрашивания на белок p16 в выработке тактики ведения пациенток по результатам гистоморфологического исследования.
А. Использование иммуногистохимического окрашивания биопсийного материала на белок p16 с целью дифференциальной диагностики HSIL от не неопластических мимикрирующих процессов, таких как незрелая плоскоклеточная метаплазия, атрофическая метаплазия и репарация.
Иммуноцитохимический тест P16/Ki67 (CINtec Plus).
В последние годы большое внимание цитологов направлено на исследование диагностической значимости одновременного определения экспрессии белков р16 и Ki-67 в цитологических препаратах для идентификации плоскоклеточного интраэпителиального поражения высокой степени (HSIL) в Pap-тесте с диагнозом ASC-US (клетки плоского эпителия с атипией неясного значения, LSIL (плоскоклеточное интраэпителиальное поражение низкой степени) и ASC-H, при которых представляется затруднительным исключить HSIL. По результатам одного из самых значительных проспективном диагностическом исследовании, в которое вошло 27 000 женщин из разных стран (PALMS- Primary, ASC-US, LSIL Marker Study), были сделаны следующие выводы о диагностической значимости теста P16/Ki67:

Взаимодействие ВПЧ с эпителиальной клеткой происходит по 2 основным сценариям:

Особенности и неоспоримые преимущества ЖЦ
Правила подготовки к проведению Пап-теста 
Наилучшее время для Пап-теста: промежуток между 5-м и 22-м днями цикла. Если Вам предстоит Пап-тест, то в за 2 дня Вы не должны:
Техника взятия материала для проведения BD SurePath Пап-теста
Цитологическое заключение составляется в течение 3-х рабочий дней с интерпретацией результатов по системе Bethesda 2014 (TBS-2014)
Этапы роботизированной пробоподготовки и клеточного обогащения SurePath
Окрашивание мазков, приготовленных по технологии BD SurePath
Технология BD SurePath предусматривает единственный метод окрашивания мазков – по Папаниколау. Это метод полихромного окрашивания клеточной суспензии. По признанию всех специалистов, он является наилучшим для гинекологических препаратов. Окраска по Папаниколау обладает целым рядом преимуществ перед другими методами, которые делают её мировым стандартом окрашивания мазков при проведении Пап-теста:
Фундаментальные принципы системы Bethesda:
Терминология цитологического заключения Пап-теста должна быть:
Основные категории
Атипия плоского эпителия
Атипия железистого эпителия
Причины последнего пересмотра TBS в 2014 году

В настоящее время TBS-2014 рекомендована во всём мире, как наиболее оптимальная терминологическая классификация патологических изменений шейки матки, которая составляет основу формирования цитологического заключения.

Более того, на основе ключевых принципов терминологической системы цервикальной патологии, позднее стали формироваться стандартизированные цитологические классификации для описания патологии иных локализаций: система Бетезда для щитовидной железы 2010 года, поджелудочной железы и Парижская система интерпретации патологии уринарного тракта 2013 года. В соответствии со «стилем Бетезда», каждая диагностическая категория в этих системах описана с ориентировочным риском развития злокачественной патологии и рекомендациями по ведению пациентов. И, самое главное, что аналогичная двухуровневая терминологическая система для плоскоклеточных поражений LSIL и HSIL, используемая цитологическами классификациями, в настоящее время рекомендована ВОЗ и ACSSP, для гистоморфологических описаний ВПЧ-ассоциированных поражений нижнего аногенитального тракта (Stoler M. Et al, 2014).
Пункты, которые содержит цитологическое заключение по системе Бетесда 2014, приведены в таблице 1.
Специфические инфекционные агенты:
Другие: клетки эндометрия (у женщин в возрасте старше 45 лет).
Атипичные клетки железистого эпителия:
Атипичные клетки железистого эпителия: эндоцервикальные клетки/железистые клетки с подозрением на неоплазию (AGC favor neoplastic);
Эндоцервикальная аденокарцинома in situ (AIS). Аденокарцинома:
Другие злокачественные новообразования (указать какие).
Дополнительные тесты (Результаты исследования).
Указание использования компьютеризированной интерпретации препарата (если применялясь).
Особенности последней редакции TBS-2014
Глава 1. Оценка адекватности образца.
Чувствительность Пап-теста в значительной степени определяется качеством взятия материала и способом приготовления цитологического препарата. Поэтому в цитологическом отчете важно указать метод исследования (традиционный или жидкостной). Для каждого из них существуют строго определённые требования к количественному составу клеточных элементов плоского эпителия, цилиндрического и метаплазированного.
Критерии адекватности по системе Бетезда
Образец считают удовлетворительным для оценки если:
При отсутствии клеток ЗТ образец может быть признан адекватным для оценки, но с обязательным указанием, что в образце не представлены клетки цилиндрического или метаплазированного эпителия, что отразится на тактике ведения пациентки.
Неудовлетворительным образец считают в следующих ситуациях:
Рекомендации при неудовлетворительном образце:
Система Бетезда: Т-зона. Цитологическое резюме:
Алгоритм ведения пациенток с цитологическим заключением NILM, нет ЗТ.
Глава 2. TBS-2014 посвящена категории неопухолевых изменений NILM (негативные в отношении интраэпителиальных поражений и злокачественности) с указанием типа:
I.Неопухолевые клеточные изменения:
II. Реактивные изменения, связанные с:
А также указывают на наличие специфических инфекционных агентов:
NILM –это категория, в которую входят все случаи без признаков внутриэпителиальной неоплазии. И это не только абсолютная норма, но и образцы с различными доброкачественными изменениями, которые возникают по ряду причин, а именно: острое и хроническое воспаление, гормональные сдвиги, беременность, кормление грудью, изменения pH, использование контрацептивов, облучение и химиотерапия в лечебных протоколах. Среди неопухолевых доброкачественных процессов, на которые необходимо акцентировать внимание, выделяют следующие:

Кератоз (без признаков атипии) – проявления защитной реакции в виде ороговения верхних слоёв эпителия, которая возникает, как правило, в ответ на хроническое воспаление, в том числе, вызываемое низкими титрами ВПЧ, при отсутствии каких-либо признаков неоплазии. Считают, что кератоз – это вторая линия защиты эпителиальных клеток, после метаплазии, которая представляет собой первую реакцию в ответ на действие повреждающего фактора. Кератоз, паракератоз, гиперкератоз и дискератоз – это описательные термины, которые в прошлом использовались непоследовательно. Потому в последней редакции для описания выявленных доброкачественных изменений используется единый термин «кератоз». После метаплазии, хроническое воздействие повреждающего фактора приводит, как правило, к образованию в клетках кератогиалиновых гранул и последующему кератозу.
Критерии гиперкератоза: безъядерные клетки плоского эпителия поверхностных слоёв, полностью сохранившие клеточные контуры, но с пустыми пространствами на месте ядра, так называемыми «ядрами-призраками». Ранними признаками наступающего гиперкератоза являются клетки поверхностного эпителия с керато-гиалиновыми гранулами.
Критерии паракератоза: миниатюрные клетки поверхностных слоёв различной формы, с оранжевой или розовой цитоплазмой и маленькими пикнотичными ядрами. Ядерно-цитоплазматическое соотношение не нарушено, ядра округлые, с ровным контуром и напоминают по форме и размерам ядра соседних клеток. При обнаружении паракератозных клеток, необходимо полностью убедиться в отсутствии признаков ядерной атипии, в противном случае, при наличии плеоморфизма ядер, гиперхромазии и увеличенного ядерно-цитоплазматического соотношения, паракератоз интерпретируют, как ASC-US или ASC-H, или SIL. Для полной уверенности в интерпретации изменений, как NILM, следует провести ко-тестирование на ДНК ВПЧ.


Трубная метаплазия – это метапластический феномен, при котором нормальные эндоцервикальные клетки замещаются эпителием фаллопиевых труб. Этот феномен часто обнаруживается в верхней части цервикального канала.
Критерии трубной метаплазии

Цилиндрические реснитчатые клетки, располагающиеся небольшими группами. Круглые или овальные ядра часто бывают гиперхромными и плеоморфными. Хроматин распределён равномерно, ядрышки, как правило не видны. Ядерно-цитоплазматическое соотношение может быть увеличенным. Наличие ресничек и терминальной полоски – это самый важный отличительный признак этих клеток.
Трубная метаплазия – это доброкачественный процесс, но его часто принимают и интерпретируют, как атипичные эндоцервикальные клетки. Это происходит из-за увеличенных гиперхромных ядер, наслаивающихся друг на друга. Следует обращать внимание на наличие ресничек и терминальной полоски – признаков, позволяющих убедиться в доброкачественном характере обнаруженных структур.
Атрофия
Атрофия – это физиологический возрастной феномен, обусловленный снижением гормональной стимуляции, которая приводит к истончению эпителиального слоя, состоящего исключительно из незрелых базально/парабазальных клеток.

Атрофия с воспалением. Характерен фон препарата: дегенеративные изменения парабазальных клеток и полиморфноядерных нейтрофилов (ЖЦ).
В сложных случаях реактивно-репаративных изменений в клетках парабазального эпителия, иммуноцитохимическое окрашивание на белок р16 позволяет установить доброкачественную природу выявленных изменений.
Изменения, связанные с беременностью
В течение беременности в цитологических препаратах отмечают изменения, которые напоминают неопластические процессы. Это объясняется изменением гормонального фона, который приводит к неполному созреванию эпителия. Доминирующим клоном клеток во время беременности являются промежуточные клетки. Они напоминают лодочку и называются навикулярными клетками. Во время беременности отмечают феномен Ариас-Стеллы. Он представляет собой доброкачественный процесс, в который вовлечены клетки железистого эпителия (эндоцервикальные и эндометриальные). Критерии феномена:


Глава 3. TBS-2014 посвящена вопросу о необходимости указания в цитологическом заключении на наличие доброкачественных эндометриальных клеток у женщин старше 45 лет.

Глава 4. Эпителиальная атипия плоского эпителия. Клетки плоского эпителия с атипией неясного значения. (ASC).
В категорию ASC входят все случаи интраэпителиальных изменений, которые по качественным и/или количественным цитоморфологическим характеристикам не возможно отнести к LSIL или HSIL. В соответствии с критериями TBS-2014, в данной категории выделяют две группы клеток с атипией:
Категория ASC-US предполагает наличие клеточных изменений, более выраженных, чем реактивные, но по качеству или количеству, недостаточных для постановки LSIL. По данным различных исследований, в 40-50% случаев обнаруживают ДНК HR-HPV, а причина остальных цитоморфологических заключений, как ASC-US – реативно-репаративные процессы, присутствие специфического инфекционного агента, применение ВМС, атрофия, инфицированность ВПЧ низкого онкогенного риска, либо остаётся неизвестной. Однако, при интерпретации выявленных изменений, используя данные анамнеза и клинического осмотра, по возможности и данные пересмотра предыдущих исследований, а также ВПЧ-тестирования, следует помнить, что в 10-20% случаев ASC-US гистоморфологическое исследование даёт заключение HSIL. Hr-HPV тестирование является основным дифференциально диагностическим подходом для тактики ведения пациенток с цитологическим заключением ASC-US (R. Nayar, David C. Wilbur.2015). Обнаружение у пациентки любого возраста hr-HPV и цитоморфологических изменений, соответствующих критериям атипии неясного значения, позволяет поставить диагноз ASC-US или LSIL. При наличии указаний в цитологическом заключении на атипичную репарацию, вызванную воспалительным процессом, повторный Пап-тест назначают не раньше, чем через 2 месяца после окончания противовоспалительного лечения (И.П. Шабалова, К.Т. Касоян, 2016).
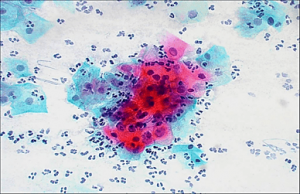
На данном слайде представлен кластер атипичных клеток, отнесённых к категории ASC-US. Клетки полиморфны по форме, размерам, ядерной гиперхромазии. Оксифильная цитоплазма клеток позволяет предположить HPV, однако классических койлоцитов в данном кластере нет.
Данная категория предполагает наличие всех убедительных цитоморфологических признаков LSIL в препарате, а также тех, которые подозрительны, но не совсем достаточны для заключения о наличии интраэпителиальных поражений высокой степени злокачественности (HSIL).
Цитоморфологические критерии:
При обнаружении резко выраженных изменений в структуре ядра (гиперхромия, высокое ядерно-цитоплазматическое соотношение, неровный контур), предпочтительным считают заключение HSIL. Цитологический диагноз ASC-H, не зависимо от результатов hr-HPV-тестирования, является показанием для проведения кольпоскопии. В практике цитологических исследований существует три основных ситуации, при которых устанавливают диагноз ASC-H:

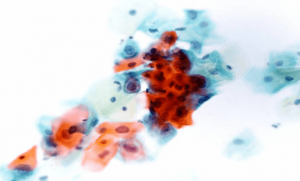
На данном слайде представлен цитологический образец ASC-H в метаплазированных клетках. Последующая биопсия установила диагноз HSIL – интраэпителиального поражения высокой степени злокачественности.
Риски для категории ASC-US/ASC-H развития HSIL в течение 5 лет.
На основании представленных рисков развития интраэпителиальных поражений высокой степени злокачественности (HSIL), специалистами ASCCP в 2012 году были разработаны алгоритмы ведения пациенток для всех категорий, в том числе и при атипии неясного значения. Основной принцип, положенный в основу всех алгоритмов при цервикальном скрининге – соответствие менеджмента риску. При этом Пап-тест специалисты рассматривают, как основную меру или эталон принятия решений.
Глава 5. Атипия плоского эпителия. LSIL/HSIL
Двухуровневая система разделения атипии плоского эпителия составляет основу терминологической системы Бетезда, которая полностью отражает биологию вирусно-эпителиальных взаимодействий. Поражения низкой степени злокачественности (LSIL) представляют собой продуктивную, транзиентную, эписомальную форму ВПЧ-обусловленных изменений плоского эпителия. Если продукты трансляции вируса (ранние и поздние гены) нарушают экспрессию крайне консервативных у млекопитающих генов (онкогенов, генов-ингибиторов опухолевого роста, генов-блокаторов апоптоза), возникает принципиально иная форма ВПЧ-ассоциированных изменений – интросомальная, интегрированная, которая морфологически проявляет себя поражениями плоского эпителия высокой степени злокачественности (HSIL). Основной целью цервикального скрининга
LSIL &CIN I & слабая дисплазия):
Продукция вируса & Транзиентная инфекция & Койлоцитарная атипия
Цитоморфологическую LSIL основу составляют инфицированные клетки с койлоцитарной атипией.
Койлоциты – клетки плоского эпителия, содержащие в ядре и цитоплазме вирусные частицы, репликация которых, приводит к характерным цитоморфологическим изменениям, свойственным койлоцитарной атипии. Они вызваны цитопатогенным действием вируса, которое приводит к некрозу ядра и цитополазмы.
Койлоцитарная атипия является одним из важнейших прямых признаков ВПЧ-инфицирования эпителия шейки матки.
Критерии:
HSIL & CIN II, CIN III, CIS & умеренная дисплазия, тяжёлая дисплазия, cr in situ. HPV E6/E7 экспрессия & риск инвазивного рака.
Терминологическая система Бетезда объединяет все типы дисплазий после категории CIN I в единую группу атипий плоского эпителия высокой степени злокачественности (HSIL), которые представляют собой интегрированную, инрососмальную форму ВПЧ-ассоциированных поражений. Принципиально важной и наиболее значимой частью цитологической практики является дифференциальная диагностика LSIL и HSIL, которая полностью опирается на чётко определённые цитоморфологические критерии. На первый план выступают все признаки незавершённого клеточного созревания.
Критерии HSIL:
Четыре наиболее частых морфологических типа HSIL
Дисплазия с ороговением: клетки с ярко выраженной атипией, с признаками ороговения цитоплазмы (оранжевые клетки при окраске по Папаниколау) располагаются в пластах, с наслаивающимися гиперхромными ядрами. Опухолевый диатез отсутствует, что отличает эту форму HSIL от инвазивного рака. Но, с другой стороны, гипер- и паракератоз-косвенные признаки ВПЧ-инфекции, могут протекать без признаков клеточной атипии, что затрудняет дифференциальную диагностику Данной формы HSIL.
Мелкие клетки с резким дискариозом: ядра атипичных клеток чуть больше, чем у лимфоцита. Клетки располагаются разрозненно или в гиперхромных пластах, в которых достаточно трудно определимы границы между ними. Цитоплазма почти не определяется т.к. ядро занимает практически 100% клеточного объёма. Дифференциальную диагностику проводят с фолликулярным цервицитом, эндометриальным клетками и незрелой метаплазией, нейроэндокринной карциномой.
HSIL в незрелых метаплазированных клетках: клетки преимущественно располагаются по одиночке, в отличие от незрелых метаплазированных клеток, образующих небольшие пласты. Как известно, ядерно-цитоплазматическое соотношение в нормальных незрелых метаплазированных клетках приближается к 50%. Дифференциальная диагностика должна опираться на признаки атипии: аномальное распределение хроматина, неровность ядерной мембраны, плеоморфность ядер в пластах, гиперхромию ядер и гранулярный хроматин. Цитоплазма плотная, с чёткими границами, вакуолизирована.
HSIL в атрофических мазках: гиперхромные парабазальные пласты клеток, лежащие на фоне воспаления и аутолиза – это общие морфологические черты HSIL и атрофии. Для дифференциальной диагностики необходимо опираться на следующие признаки: внимание должны привлекать отдельно лежащие популяции клеток с признаками дискариоза. При наличии атрофического вагинита, при котором клетки могут быть увеличены и несколько атипичны, рекомендовано проведение короткого курса местной терапии эстрогенами и последующее котестирование, включающее цитологическое исслеование и ВПЧ-тестом.


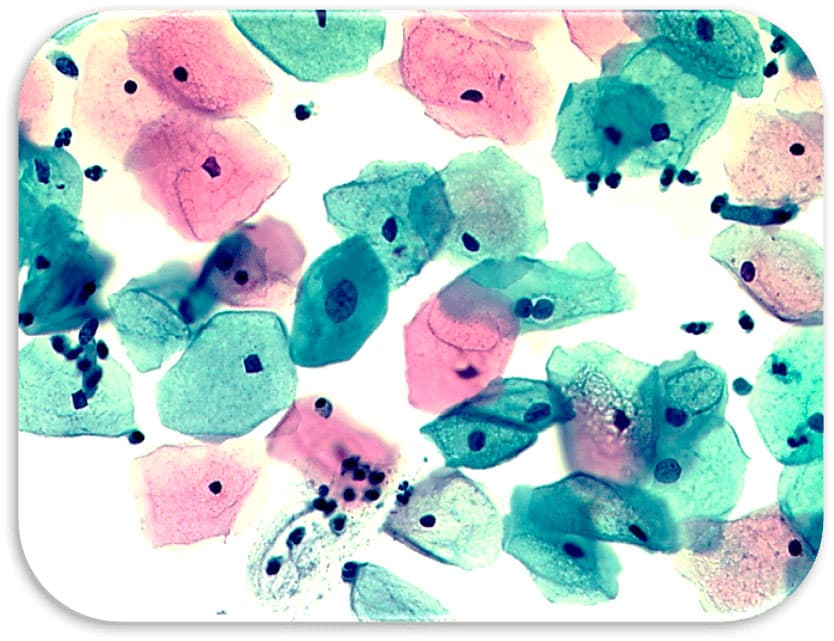
Глава 6. Атипия железистого эпителия (AGC).
Внедрение в практику Пап-теста жидкостных технологий приготовления препаратов, а также использование цитощёток Cervex-Brush Combi, захватывающих одновременно экто-эндоцервикс и зону трансформации, позволило существенно улучшить цитологическую диагностику патологии железистого эпителия, относительная доля которого в последние два десятилетия существенно возросла. (R. Nayar, David C. Wilbur.2015.).
Аденокарциномы соствляют 5-10% от всех неоплазм шейки матки. Гистологически выделяют три типа: эндоцервикальная, эндометриальная и светлоклеточная аденокарциномы. Эндоцервикальная аденокарцинома – самый распространённый и наиболее легко распознаваемый при цитологическом обследовании тип. Довольно часто она сочетается с плоскоклеточной карциномой, что свидетельствует об общности этих процессов по этиологии и патогенезу. Таким образом, наряду с плоскоклеточными неоплазмами, являются ВПЧ-ассоциированными злокачественными новообразованиями шейки матки. Достаточно долго аденокарцинома может не проявлять себя клинически, без изменений шейки матки. Цитологически выделяют три степени градации аденокарциномы, в зависимости от степени дифференцировки опухолевых клеток: высоко-, средне, и низкодифференцированная. Чем меньше дифференцировка, тем меньше злокачественные клетки напоминают нормальный эндоцервикальный эпителий.
В системе Бетезда выделена категория атипичных клеток железистого эпителия (AGC). Этот цитологический диагноз устанавливают если клеточная (ядерная) атипия превышает признаки реактивно-воспалительных изменений, но не является очевидной для постановки диагноза аденокарциномы.
| Атипия железистого эпителия: | |
| ASC-H | HPV-тест + кольпоскопия с биопсией. |
| LSIL | HPV-тест (-), повторное цитологическое обследование через 6 месяцев. |
| HSIL | HPV-тест+ кольпоскопия с биопсией. |
| Плоскоклеточная карцинома | Оперативное лечение |
| Атипия цервикальных клеток, возможно неоплазия; Эндоцервикальная аденокарцинома in situ Эндоцервикальная аденокарцинома | Кольпоскопия с конусовой радиоволновой эксцизией/гистероскопия с раздельным диагностическим выскабливанием цервикального канала и полости матки. |
| Эндометриальная аденокарцинома | Гистероскопия, раздельное диагностическое выскабливание цервикального канала и полости матки. |




Для получения профессиональной консультации обращайтесь к гинекологам нашей клиники.



















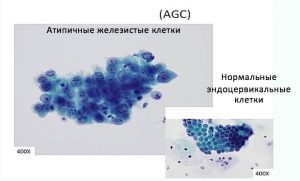 Критерии AGC:
Критерии AGC: